Урок химии на тему «Вода» (9 класс)
Автор, разработчик: Учитель Талицких М.В. МБОУ СОШ ст.Луковской им.С.Г.Астанина Моздокского р-на РСО-Алания
Предмет: Химия
(рабочая программа составлена на основе ФГОС, авторской программы по химии О.С.Габриеляна и ориентирована на использование учебника «Химия. 9 класс» Габриелян О.С. – М.: Дрофа, 2013г)
Класс: 9 класс
Тип урока:
По ведущей дидактической цели: урок изучения нового материала;
По способу организации деятельности: индивидуально-групповой;
По ведущему методу обучения: проблемно-поисковый.
Продолжительность урока: 1 урок по 40 минут.
Технология: развивающее обучение, технология критического мышления, проблемное обучение, обучение в сотрудничестве, ИКТ, здоровьесберегающие технологии.
Цели урока.
Обучающие:
Дать представление о роли воды в химии;
ознакомить учащихся со свойствами воды (физическими и химическими);
Развивающие:
Развитие познавательной активности учащихся, вырабатывать умение наблюдать, анализировать, делать выводы, объяснять ход эксперимента;
Формирование основных учебных компетенций: учебной, коммуникативной, личностной;
Развивать умения мыслить нестандартно, творчески;
Воспитательные:
Воспитывать коммуникативные качества, умение высказывать собственное мнение, сотрудничать в паре;
Ориентирование учащихся на здоровый образ жизни;
Формирование правильной самооценки учащихся;
Воспитание потребности в знаниях, повышения познавательных интересов, привитие интереса к химии.
Здоровьесберегающие технологии: следить за осанкой учащихся; проводить упражнения для снятия напряжения глаз; проветривание помещения.
Методы – см в Приложении
Основной: проблемно-поисковый
Средства обучения:
1) учебник «Химия. 9 класс» Габриелян О.С. – М.: Дрофа, 2013г
2) мультимедийный проектор, экран, компьютер, колонки, таблица химических элементов.
3) на столах учащихся –тетрадь, в которой учащиеся делают записи в течении всего урока;
Формирование УУД- см в Приложении:
Предметные:
П 1: Знать характерные свойства воды;
П 2: Иметь представление о роли воды в природе и жизни человека;
П 3: анализ и синтез информации;
Деятельность учащихся – см в Приложении
Ход урока (см. технологическую карту).
технологическую карту).
Свойства водорода — урок. Химия, 8–9 класс.
Физические свойства
Водород имеет молекулярное строение. Его молекула h3 состоит из двух атомов, соединённых ковалентной неполярной связью.
При комнатной температуре водород представляет собой бесцветный газ без запаха и вкуса. Это самое лёгкое вещество на Земле. Его плотность равна примерно \(0,9\) г/дм³. Водород в \(14,5\) раз легче воздуха.
В воде водород растворяется плохо (примерно \(2\) объёма на \(100\) объёмов воды), но может поглощаться некоторыми металлами. Например, \(1\) объём палладия может растворить до \(900\) объёмов водорода.
Температура кипения водорода низкая. Она равна \(–253\) °С. Ниже температура кипения только у гелия.
Молекулы водорода благодаря своей малой массе и размерам могут проникать сквозь стенки сосуда, в котором он содержится. Заполненный водородом шарик через некоторое время сдувается. При температуре \(300\)–\(600\) °С водород способен диффундировать сквозь стенки стеклянного или металлического сосуда.
При температуре \(300\)–\(600\) °С водород способен диффундировать сквозь стенки стеклянного или металлического сосуда.
Химические свойства
При комнатной температуре химическая активность водорода низкая. Она значительно повышается при нагревании.
1. Взаимодействие с простыми веществами-неметаллами (кроме фосфора, кремния, инертных газов).
- Водород реагирует с кислородом. При этом образуется вода:
2h3+O2=t2h3O.
Смесь водорода с кислородом или с воздухом взрывоопасна.
- При освещении или нагревании идёт реакция с хлором, и образуется хлороводород:
h3+Cl2=hν2HCl.
Подобным образом водород реагирует и с другими галогенами: фтором, бромом, иодом.
- Если водород пропускать над нагретой серой, то образуется сероводород:
h3+S=th3S.
- В присутствии катализатора при повышенном давлении водород реагирует с азотом с образованием аммиака:
N2+3h3=t,p,k2Nh4.
Обрати внимание!
В реакциях с неметаллами водород является восстановителем.
2. Взаимодействие с простыми веществами-металлами.
При нагревании водород реагирует со щелочными и щелочноземельными металлами с образованием гидридов:
2Na+h3=t2NaH,
Ca+h3=tCah3.
Обрати внимание!
В реакциях с металлами водород является окислителем.
3. Взаимодействие со сложными веществами.
- Водород способен реагировать с оксидами металлов (кроме оксидов щелочных и щелочноземельных металлов, бериллия, магния, алюминия):
WO3+3h3=tW+3h3O,
CuO+h3=tCu+h3O.
- Водород реагирует с угарным газом с образованием метилового спирта:
CO+2h3→Ch4OH.
- Водород вступает в реакции со многими органическими веществами.
| 21 мая 2020 г. | |||
Органические вещества. Углеводороды Углеводороды |
Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| Органические вещества. Кислородосодержащие соединения | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| 15 мая 2020 г. | |||
| Итоговая видеоконсультация по химии | Химия 9 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| 12 мая 2020 г. | |||
| Генетическая связь между классами неорганических соединений | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| Кислоты неорганические и органические | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
5 мая 2020 г. |
|||
| Электролиз растворов и расплавов. Применение электролиза в промышленности | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| Неметаллы | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| 29 апреля 2020 г. | |||
| Окислительно-восстановительные реакции в природе, производственных процессах и жизнедеятельности организмов | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| Свойства простых веществ – металлов главных и побочных подгрупп | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
Урок 1. Обобщение знаний. Виды химических связей и типы кристаллических решеток Обобщение знаний. Виды химических связей и типы кристаллических решеток |
Химия 9 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| Урок 2. Обобщение знаний. Электроотрицательность. Степень окисления | Химия 9 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| 6 апреля 2020 г. | |||
| Свойства, получение и применение углерода. Синтез-газ как основа современной промышленности | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| Общая характеристика элементов IVА-группы | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
Периодическая система химических элементов Д. И. Менделеева. Строение атома и вещества. И. Менделеева. Строение атома и вещества. |
Химия 9 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
Урок химии по теме «Химическое равновесие и условия его смещения». 9-й класс
Цель урока: формирование представлений
учащихся о химическом равновесии, условиях его
смещения.
Задачи:
Образовательные: дать понятия об обратимости
химических реакций, о химическом равновесии.
Формировать умение применять знания о
закономерностях смещения химического
равновесия.
Развивающие: развивать умение устанавливать
причинно-следственные связи, развивать
познавательный интерес к предмету и творческую
активность.
Воспитательные: воспитывать личные качества
учащихся: коммуникативность, самостоятельность.
Коррекционные: развивать грамотную речь,
расширять словарь учащихся, корректировать
произношение сложных химических терминов.
Реактивы: хлорид железа (III), роданид аммония,
крахмальный клейстер, йод.
Тип урока: изучение нового материала.
Ход урока
1. Организационный момент.
Приветствие.
Определение отсутствующих.
Проверка готовности учащихся к уроку.
2. Мотивация и актуализация знаний.
Начинается наш урок, эпиграф к которому звучит
так: “Ум заключается не только в знании, но и в
умении прилагать знание на деле”. (Аристотель).
Мы ещё вернёмся к этому эпиграфу, и вы сами
сможете объяснить, почему именно его я взяла,
чтобы озаглавить наш урок. А на уроке мы будем
говорить о химических реакциях.
Самое интересное в окружающем нас мире – это
то, что он очень сложно устроен, и к тому же
постоянно изменяется. Каждую секунду в нём
Каждую секунду в нём
происходит множество химических реакций,
образуется множество химических веществ.
Фронтальный опрос.
– В чём суть химических реакций?
– Каковы условия, необходимые для
возникновения химических реакций?
– Перечислите признаки химических реакций?
– Дайте определение скорости химической
реакции.
– Что является гомогенной и гетерогенной
реакциями?
– Какие реакции относят к экзотермическим, а
какие к эндотермическим?
– От каких факторов зависит скорость
химической реакции?
3. Вводная информация учителя и
формирование цели урока.
Сегодня на уроке мы познакомимся с новым
понятием “химическое равновесие”. Понятие это
имеет очень большое значение, как для химии, так и
для химической технологии. Знание о химическом
равновесии необходимы для предсказания условий,
при которых можно осуществлять химические
превращения, а так же помогут добиться
максимального выхода продукта реакции.
Итак, давайте вместе сформулируем цель нашего
занятия.
Цель урока: изучить химическое равновесие и
условия его смещения.
4. Изучение нового материала
.
Большинство химических реакций может
протекать в двух противоположных направлениях,
т.е. являются обратимыми.
Откроем учебник (Кузнецова Н.Е., Титова И.Н., Гара
Н.Н., Химия 9 класс) параграф 2. Найдите в тексте
определение, какие реакции называют обратимыми.
(Обратимыми – называются реакции, которые
протекают при данных условиях одновременно в
двух противоположных направлениях – прямом и
обратном). В уравнениях обратимых реакций
используют знак обратимости ().
Примером обратимой реакции может служить
синтез йодоводорода из водорода и йода:
h3 (г) + I2(г)
2HI(г)
Скорость прямой реакции (V1) вначале
максимальна, а скорость обратной (V2) – равняется
нулю. Концентрация реагирующих веществ с
Концентрация реагирующих веществ с
течением времени уменьшается, а концентрация
продуктов реакции увеличивается. Поэтому
скорость прямой реакции уменьшается, а скорость
обратной реакции увеличивается. В определённый
момент времени скорости прямой и обратной
реакций становятся равными (V1=V2).
Это означает, что реакция достигла состояния
равновесия.
Отметим, что понятие равновесие можно
использовать только по отношению к закрытой
системе.
Запишем определение: состояние обратимой
реакции, при котором скорость прямой реакции
равна скорости обратной реакции, называется химическим
равновесием.
Если записать реакцию, в которой наступило
равновесие, в общем виде следующим образом: aA + bB cC + dD
То равновесие можно охарактеризовать через
константу равновесия K. Эта величина показывает
соотношение между концентрациями продуктов
реакции (числитель) и исходных веществ
(знаменатель), которое устанавливается при
равновесии.
Если константа равновесия больше единицы, что
это значит? (Значит, на момент установления
равновесия большая часть исходных веществ
превратилась в продукт).
Вы часто встречались с механическим
равновесием. Приведите примеры. (Весы в состояния
равновесия, маятник).
В отличие от механического равновесия, при
котором всякое движение прекращается, при
химическом равновесии обе реакции (прямая и
обратная) продолжают идти, но скорости их равны, и
поэтому никакие изменения в системе не
происходят. Если изменение условий не
происходит, то состояние равновесия может
продолжаться бесконечно долго. По вашему мнению,
можно ли сместить химическое равновесие? Как вы
предлагаете это делать?
Химическое равновесие легко нарушить. Изменяя
определённые условия можно добиться смещения
химического равновесия. При этом скорости прямой
и обратной реакций становятся не одинаковыми.
Направление смещения равновесия определяется принципом,
который был сформулирован французским учёным Ле
Шателье: Если на равновесную систему
оказывается внешнее воздействие, то равновесие
смещается в сторону той реакции, которая
противодействует этому воздействию.
Факторы, которые могут приводить к смещению
химического равновесия:
А) Концентрация реагирующих веществ.
Б) Температура.
В) Давление.
Рассмотрим влияние этих факторов более
подробно.
Влияние концентрации реагирующих веществ.
Повышение концентрации исходных веществ
смещает равновесие в сторону прямой реакции,
понижение – в сторону обратной реакции.
Демонстрация опыта. В качестве равновесной
системы используется реакция образования
роданида железа (III) из хлорида железа (III) и
роданида аммония.
FeCI3 + 3Nh5CNS –> Fe(CNS)3 + 3Nh5CI
Признаком, указывающим на смещение равновесия
в ту или иную сторону, служит изменение
интенсивности окраски раствора, обусловленной
концентрацией роданида железа (III).
Проводим реакцию. Содержимое делим на две
части. В один стакан добавляем 10 мл. исходного 0. 1М
1М
раствора хлорида железа (III).Наблюдаем увеличение
интенсивности окраски. Вопрос к классу
“почему”? Во второй стакан добавляем 20мл.
насыщенного раствора хлорида аммония.
Анализируем, почему идёт ослабление окраски.
Влияние температуры.
При нагревании системы равновесие смещается в
сторону эндотермической реакции; при охлаждении
в сторону экзотермической реакции.
Демонстрация опыта. В две пробирки
крахмального клейстера добавляем две капли йода.
Появляется синий цвет.
Крахмал + I2 –> вещество синего цвета
При нагревании пробирки окраска исчезает.
Почему? В какую сторону смещается равновесие. При
понижении температуры (охлаждаем пробирку)
окраска проявляется. Почему? Куда смещается
равновесие.
Какой знак теплового эффекта отвечает данной
реакции?
Влияние давления.
Давление влияет на равновесие реакций, в
которых принимают участие газообразные
вещества. При увеличении давления равновесие
При увеличении давления равновесие
смещается в сторону меньшего объема, при
уменьшении давления равновесие смещается в
сторону большего объема.
Так для увеличения выхода аммиака необходимо
повышать давление в системе. Если внешнее
давление повышается, то равновесие смещается в
сторону той реакции, при которой число молекул
газа уменьшается.
N2(г) + 3h3(г)
2Nh4(г)
Если же реакция протекает без изменения числа
молекул газообразных веществ, то давление не
влияет на равновесие в данной системе.
Как вы думаете, катализатор может повлиять на
смещение химического равновесия?
Использование катализатора, приводящего к
ускорению данной обратимой реакции, никак не
влияет на состояние равновесия.
5. Закрепление нового материала
.
А сейчас мы вернёмся к эпиграфу нашего урока и
постараемся полученные знания использовать при
решении заданий.
Задание №1 (решаем, рассуждаем совместно).
Какой знак теплового эффекта, отвечающего
процессу растворения кислорода в воде?
Учитывайте тот факт, что с нагреванием
растворимость кислорода в воде снижается.
O2 + вода
водный раствор кислорода
Задание №2 (решаем совместно).
При термическом разложении карбоната кальция
может установиться равновесие. В каком
направлении оно будет смещаться при повышении
температуры?
Задание №3 (самостоятельная работа).
Используя принцип Ле Шателье, определите в
какую сторону сместится химическое равновесие
при повышении или понижении температуры,
давления, и концентрации:
N2 + O2 2NO — Q
Учащиеся решают самостоятельно, затем
осуществляют самоконтроль, опираясь на материал
слайда.
6. Подведение итогов.
Что нового и интересного вы узнали на данном
уроке?
Почему нужно знать способы смещения
химического равновесия?
В каких областях эти знания необходимы?
7.
 Рефлексия. Выставление оценок.
Рефлексия. Выставление оценок.
8. Домашнее задание.
Параграф 2, знать основные понятия, внимательно
прочитать выводы. Задача: укажите знак теплового
эффекта растворения азота в воде (при нагревании
растворимость азота в воде уменьшается).
Литература, используемая при составления
конспекта урока:
- Бердоносов С.С., Менделеева Е.А. Материалы курса
“Особенности содержания и методики
преподавания избранных тем курса химии 8-9-х
классов” – М.: Пед.университет “Первое
сентября”, 2006. - Кушнарев А.А. Экспресс – курс по неорганической
химии с примерами, задачами, реакциями. 8-9 классы
– М.: Школьная пресса, 2002. - Химия. Пособие – репетитор для поступающих в
вузы. /Под ред. Егорова – Ростов н/Д, Феникс, 2003 - Химия. Базовый уровень. Книга для учителя./ Под
ред. О.С. Габриелян и др. – М.: Дрофа, 2009.
О.С. Габриелян и др. – М.: Дрофа, 2009.
Природные ресурсы и синтетические материалы | Глава 6: Химическое изменение
Обсудите в классе термины «синтетический» и «натуральный».
Объясните, что в науке «синтетический» материал — это материал, в котором исходные вещества химически изменены для получения материала с другими характеристиками. Типичный пример — пластик. Чтобы сделать это, нефть обрабатывается и химически изменяется, чтобы в конечном итоге стать пластиком.Ряд химических реакций, которые используются для превращения природных ресурсов в синтетические продукты, называется химическим синтезом .
Чтобы сделать «натуральный» продукт, природный ресурс не подвергается химическим изменениям. Например, деревянный стул. Он более натуральный, чем синтетический, потому что его форма была изменена, но материал по-прежнему остается деревом. Стекло немного сложнее классифицировать, но его можно считать натуральным материалом. Это происходит из песка, который был расплавлен, а затем охлажден.Молекулы, из которых состоит стекло, остались такими же, как и в песке.
Это происходит из песка, который был расплавлен, а затем охлажден.Молекулы, из которых состоит стекло, остались такими же, как и в песке.
Скажите учащимся, что все продукты сделаны из природных ресурсов. «Натуральные» продукты производятся из природных ресурсов , таких как древесина и песок. «Синтетические» продукты также производятся из природных ресурсов. Например, синтетический материал пластик производится из нефти, которую выкачивают из земли. Нефть является природным ресурсом.
Спросите студентов:
- Как натуральные, так и синтетические продукты производятся из природных ресурсов.Объясните, почему это утверждение верно.
Если вы проследите, из чего что-то сделано достаточно давно, вы обнаружите, что все вещества, используемые для изготовления этого продукта, происходят из нашего мира. Первоначально они могут происходить от растений, животных или земли.
- Как определить, что что-то следует классифицировать как синтетическое?
Как синтетические, так и натуральные продукты изготавливаются из природных ресурсов, которые люди могут изменить из той формы, в которой они находились в природе.
 Но синтетические продукты перерабатываются и изменяются химически людьми для получения нового вещества с другими характеристиками.
Но синтетические продукты перерабатываются и изменяются химически людьми для получения нового вещества с другими характеристиками.
Примечание. Значение слова «синтез» в слове «фотосинтез»
Учащиеся могут быть знакомы с термином синтез от слова фотосинтез . Возможно, вы разбили слово на фото и синтез , чтобы объяснить процесс, посредством которого растения используют энергию солнца для синтеза сахара из углекислого газа и воды.При таком использовании синтез представляет собой естественный процесс, который происходит в зеленых растениях и других организмах с хлорофиллом. Но для целей этого урока термин синтез и синтетический материал используется для обозначения того, что люди используют химические процессы для создания или синтеза нового материала.
Представьте, что ученые могут синтезировать соединение, которое также можно найти в природе.
Покажите видео профессора Дейва, Заставят ли меня взорваться синтетические витамины?
Спросите студентов:
- Натуральный или синтетический витамин D, который вырабатывается нашей кожей под воздействием солнечных лучей?
Когда мы находимся на солнце и наш организм вырабатывает витамин D, этот витамин считается естественным.Но точно такое же соединение, изготовленное на фабриках, которое вы можете купить в виде витаминной таблетки, считается синтетическим. - Почему ученым может быть полезно синтезировать соединение, которое можно найти в природе?
Если по какой-то причине вы не можете получить соединение из природного источника, может быть полезно использовать синтетическую, но идентичную версию. Если добыча предмета в природе слишком дорога или чрезмерный сбор может нанести ущерб окружающей среде или разрушить среду обитания, может быть лучше синтезировать соединение.
Объясните учащимся, что хотя витамин D можно найти в природе, тот факт, что ученые создают его с помощью химических процессов, делает его синтетическим. Таким образом, можно создать синтетическое вещество, идентичное существующему в природе. Эта идея особенно важна для студентов, которые будут работать над темой синтетических лекарств в исследовательской части этого урока.
Таким образом, можно создать синтетическое вещество, идентичное существующему в природе. Эта идея особенно важна для студентов, которые будут работать над темой синтетических лекарств в исследовательской части этого урока.
Представьте исследовательский проект, который будут выполнять учащиеся, и поручите или предложите учащимся выбрать синтетический продукт для изучения.
Объясните учащимся, что они будут выполнять исследовательский проект, чтобы узнать о синтетическом продукте. Они будут читать различные онлайн-статьи, смотреть информационные видеоролики и пользоваться библиотечными ресурсами. Студенты попытаются найти ответы на следующие три наводящих вопроса:
- Какие природные ресурсы используются для производства синтетического продукта?
- Какие химические процессы используются для производства синтетического продукта?
- Каковы отрицательные и положительные последствия для общества производства и использования синтетического продукта по сравнению с производством и использованием более натурального продукта с аналогичной функцией?
Либо поручите учащимся, либо попросите их выбрать синтетический продукт, который они будут исследовать и составить отчет, из списка ниже. Решите, будут ли студенты работать в группах или индивидуально.
Решите, будут ли студенты работать в группах или индивидуально.
Синтетические продукты
- Полиэтиленовый пакет
- Пластиковая бутылка
- Одноразовый подгузник
- Синтетическое волокно/ткань (полиэстер, нейлон или вискоза)
- Кевлар
- Искусственный подсластитель
- Синтетическое топливо (Synfuel)
- Синтетический каучук
- Хлорохин (лекарство от малярии)
- Таксол (лекарство от рака)
- Физостигмин (препарат от глаукомы)
- Аспирин
Примечание. Для каждого синтетического продукта даны ссылки на онлайн-ресурсы.Этот список приведен в конце этого урока. Вы можете дать учащимся одну или несколько таких ссылок, чтобы помочь им начать исследование. Студенты могут также использовать другие ресурсы, онлайн или нет, которые они найдут. Если у вас есть учащиеся, использующие ресурсы, которые они находят самостоятельно, напомните им, чтобы они учитывали автора и цель автора в предоставленной информации.
Объясните, что на уроке в классе будет моделировать исследование, которое учащиеся будут проводить на синтетическом продукте.
Скажите учащимся, что прежде чем приступить к исследовательскому проекту, они изучат и создадут свой собственный синтетический продукт — гелевого червя. Объясните, что если бы это был настоящий желевидный червь для еды, в него были бы добавлены подсластители, витамины и фруктовые ароматизаторы. Тем не менее, цель этого урока — узнать о химическом синтезе, поэтому учащиеся сосредоточатся на химических веществах, которые участвуют в химической реакции, а не на ароматизаторе. Кроме того, поскольку это научная лаборатория, студенты не должны пробовать или есть гелевого червя.
Объясните, что вы будете предоставлять информацию о синтетическом гелевом черве, организованную вокруг трех наводящих вопросов. Типы информации, которую вы предоставляете в классе, послужат моделью того, что студенты будут искать при исследовании своего синтетического продукта.
Напомните учащимся, что вопросы следующие:
- Какие природные ресурсы используются для производства синтетического продукта?
- Какие химические процессы используются для производства синтетического продукта?
- Каково отрицательное и положительное воздействие производства и использования синтетического продукта на общество по сравнению с производством и использованием более натурального продукта с аналогичной функцией?
Расскажите о веществах, используемых для изготовления гелевого червя, и объясните, что они получены из природных ресурсов.
Вопрос 1: Какие природные ресурсы используются для производства синтетического продукта?
Скажите учащимся, что они определенным образом соединят два раствора, чтобы сделать одного гелевого червя. Ингредиентами раствора, которые вступают в химическую реакцию, являются альгинат натрия и хлорид кальция. Оба они обычно используются в пище для улучшения ее текстуры.
Альгинат натрия
Показать иллюстрацию Бурые водоросли
Из какого природного ресурса получают альгинат натрия?
Альгинат натрия производится из бурых водорослей, называемых ламинариями, которые в диком виде растут в океане.Его собирают и перерабатывают для получения альгината натрия.
Что делают с водорослями, чтобы получить альгинат натрия?
Морские водоросли нарезают и смешивают с водой, чтобы получился густой гель. Затем его разбавляют большим количеством воды и фильтруют. Смесь выпаривают и дополнительно обрабатывают для получения порошка альгината натрия.
Хлорид кальция
Показать иллюстрацию Известняк
Из какого природного ресурса получают хлорид кальция?
Хлорид кальция производится из известняка, который является обычной горной породой, которую добывают.
Что делают с известняком для получения хлорида кальция?
Известняк реагирует с соляной кислотой или хлоридом натрия, чтобы получить хлорид кальция.
Предложите учащимся сделать червя из синтетического геля, смешав растворы альгината натрия и хлорида кальция.
Дайте каждому учащемуся лист с заданиями .
Учащиеся записывают свои наблюдения и отвечают на вопросы о задании в листе задания.Разделы «Объясните это с помощью атомов и молекул» и «Возьми это» Дальнейшие разделы рабочего листа будут выполняться в классе, в группах или индивидуально, в зависимости от ваших инструкций. Посмотрите на учительскую версию листа с заданиями, чтобы найти ответы.
Вопрос 2: Какие химические процессы используются для изготовления синтетического продукта?
Всем классом учащиеся проведут следующую практическую работу, чтобы ответить на вопрос о химическом синтезе. При исследовании своего синтетического продукта студенты не будут проводить химический синтез.Вместо этого они должны выяснить в целом, как производится продукт. Цель занятия с гелевыми червями — дать учащимся пример химического синтеза.
Примечание. Напомните учащимся, что они не могут попробовать или съесть синтетического гелевого червя. Убедитесь, что учащиеся вымыли руки после выполнения этого задания.
Вопрос для изучения
Почему гель-червь, изготовленный из растворов хлорида кальция и альгината натрия, считается синтетическим продуктом?
Материалы для каждой группы
- Раствор хлорида кальция в маленькой чашке
- Раствор альгината натрия в маленькой широкой чашке
- Одна пипетка
- Бумажные полотенца
Подготовка учителей для всех групп
- Поместите ½ чайной ложки хлорида кальция в чашку.Добавьте 25 мл воды и перемешайте до растворения хлорида кальция. Поместите около ½ чайной ложки раствора хлорида кальция в небольшую чашку для каждой группы.
- Поместите ¼ чайной ложки порошка альгината натрия в пластиковую бутылку. Подойдет пустая одноразовая пластиковая бутылка для воды на 8 унций с плотно закрывающейся крышкой.

- Осторожно добавьте 50 мл воды во флакон с альгинатом натрия. Плотно закройте бутылку и энергично встряхивайте в течение примерно 30 секунд.
- Добавьте еще 50 мл воды в бутыль с раствором альгината натрия.Необязательно: добавьте одну каплю пищевого красителя. Плотно закройте флакон и снова встряхните.
- Налейте одну столовую ложку (15 мл) раствора альгината натрия из флакона в порционный или широкий пластиковый стакан для каждой группы.
Процедура для студентов
- С помощью пластиковой пипетки добавьте около 10 капель раствора хлорида кальция в центр чашки с раствором альгината натрия.
- Дотянитесь до центра раствора (куда вы положили хлорид кальция) и осторожно и медленно вытащите гелевого «червя».»
- Положите «червя» на бумажное полотенце.
Ожидаемые результаты
Учащиеся смогут вытащить из чашки длинную желеобразную нить (червяка) или каплю.
Примечание: Напомните учащимся не пробовать и не есть гелевого червя. Скажите учащимся, что они сделали синтетического гелевого червя, но настоящие гелевые черви производятся с использованием другого процесса и других ингредиентов.
Скажите учащимся, что они сделали синтетического гелевого червя, но настоящие гелевые черви производятся с использованием другого процесса и других ингредиентов.
Спросите студентов
- Какими были растворы хлорида кальция и альгината натрия, когда ваш учитель впервые дал их вам?
Раствор хлорида кальция был прозрачным и бесцветным.Это было очень похоже на воду. Раствор альгината натрия также был прозрачным и бесцветным, но казался более густым. - После того как вы добавили раствор хлорида кальция в раствор альгината натрия и начали вытягивать из центра, как растворы изменились?
Вместо того, чтобы течь как жидкость, химическая реакция заставила его выйти из чашки в виде геля. - Считаете ли вы гелевого червя синтетическим продуктом? Почему или почему нет?
Гелевый червь является синтетическим продуктом, потому что он был изменен химически и теперь имеет совсем другие свойства, чем растворы альгината натрия и хлорида кальция, которые использовались для его изготовления.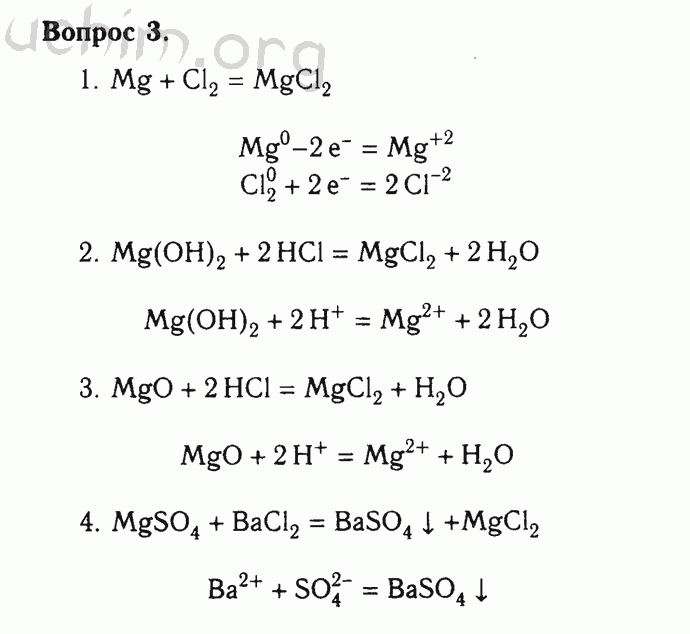
Очистка
В конце урока попросите учащихся вылить растворы хлорида кальция в канализацию с большим количеством воды или в соответствии с местными правилами. Избыток раствора альгината натрия и гель-червей следует выбрасывать вместе с классным мусором. Предложите учащимся вымыть руки после уборки.
Объясните химический процесс сшивания, который используется для изготовления синтетического гелевого червя.
Вопрос 2 (продолжение): Какие химические процессы используются для изготовления синтетического продукта?
Скажите учащимся, что в своих исследованиях они должны искать следующие подсказки о химическом процессе(ах), используемом(ых) для производства их синтетического продукта:
- Можете ли вы определить одну или несколько молекул, участвующих в производстве продукта?
- Происходят ли одна или несколько химических реакций?
- Нагреваются ли вещества?
- Вещества, находящиеся под давлением
- Используется ли спецтехника?
- Изменился ли метод за эти годы?
Объясните, что вы продолжите использовать гелевого червя в качестве примера, чтобы показать классу информацию, которую им следует искать, чтобы ответить на второй вопрос при исследовании собственного синтетического продукта.
Это объяснение касается следующего:
- Можете ли вы определить одну или несколько молекул, участвующих в производстве продукта?
- Происходят ли одна или несколько химических реакций?
Спроектируйте иллюстрацию Полимер альгината натрия.
Вот две модели молекулы альгината натрия. Одна из них представляет собой шаростержневую модель, показывающую все атомы: 6 атомов углерода (черный), 7 атомов кислорода (красный), 9 атомов водорода (белый) и 1 положительный ион натрия (фиолетовый).Другая — гораздо более простая модель, использующая форму шестиугольника почти для всей молекулы и маленький кружок для положительного иона натрия. Обратите внимание, что в обеих моделях ион натрия имеет положительный заряд, а место, где он связан с молекулой, имеет отрицательный заряд. Многие молекулы альгината натрия связаны вместе, образуя длинную молекулу, называемую полимером. Обратите внимание учащихся на то, что каждая молекула перевернута по сравнению с соседней.
Спроектировать иллюстрацию Сшивающий альгинат натрия.
Чтобы увидеть, что происходит при добавлении хлорида кальция, нам нужно использовать как минимум две полимерные цепи альгината натрия.
При смешивании раствора альгината натрия и раствора хлорида кальция положительные ионы кальция замещают положительные ионы натрия. Поскольку ионы кальция имеют два положительных заряда, ионы кальция связываются с отрицательным участком двух молекул альгината натрия и создают «поперечную связь» между двумя цепями. Многие химические реакции сшивания заставляют альгинат натрия загустевать и превращаться в гель.
Объясните, что, поскольку конечный продукт химически отличается от исходных веществ, произошел химический синтез и гель-червь представляет собой синтетический материал
Сообщите учащимся, что они, возможно, не смогут найти такой уровень детализации о химическом процессе, используемом для производства их синтетического продукта. Однако им следует попытаться найти что-нибудь о молекулах или характеристиках материалов до и после процесса, в ходе которого синтезируется их продукт.
Объясните влияние на общество производства и использования синтетического продукта по сравнению с производством и использованием более натурального продукта с аналогичной функцией.
Вопрос 3: Каково отрицательное и положительное влияние производства и использования синтетического продукта на общество по сравнению с производством и использованием более натурального продукта с аналогичной функцией?
Предложите учащимся представить, что желейных червей можно массово производить с фруктовыми ароматизаторами, витаминами и минералами для изготовления синтетических фруктовых закусок.Объясните, что вы будете использовать идею гелевого червя массового производства в качестве примера, чтобы показать классу информацию, которую им следует искать при исследовании воздействия их синтетического продукта.
Скажите учащимся, что в своих исследованиях они должны искать следующие виды экологических, социальных и экономических воздействий, возникающих в результате производства и использования их синтетического продукта. Они также должны сравнить эти последствия с последствиями производства и использования менее синтетических/более естественных альтернатив с аналогичной функцией.Учащиеся должны рассмотреть следующие вопросы:
Они также должны сравнить эти последствия с последствиями производства и использования менее синтетических/более естественных альтернатив с аналогичной функцией.Учащиеся должны рассмотреть следующие вопросы:
- Используемые природные ресурсы являются возобновляемыми или невозобновляемыми?
- На что влияет:
- Добыча, добыча или сбор природных ресурсов?
- Обработка природных ресурсов перед их использованием для производства конечного продукта?
- Производство конечного продукта?
- Каково положительное влияние на общество использования конечного продукта?
Подумайте о влиянии производства закусок из синтетических гелевых червей по сравнению с производством кусочков настоящих фруктов.
Возобновляемый или невозобновляемый?
И альгинат натрия, и хлорид кальция являются природными ресурсами. При рассмотрении наших ресурсов важно учитывать, являются ли они возобновляемыми или невозобновляемыми ресурсами. Если учащиеся не знакомы с этими терминами, познакомьте их сейчас. Объясните, что возобновляемые ресурсы пополняются в результате естественных процессов за достаточное время, чтобы удовлетворить потребность. Например, деревья являются возобновляемыми ресурсами, а нефть — нет.Обычно использование возобновляемых ресурсов имеет меньше негативных последствий, потому что ресурс можно пополнить.
Если учащиеся не знакомы с этими терминами, познакомьте их сейчас. Объясните, что возобновляемые ресурсы пополняются в результате естественных процессов за достаточное время, чтобы удовлетворить потребность. Например, деревья являются возобновляемыми ресурсами, а нефть — нет.Обычно использование возобновляемых ресурсов имеет меньше негативных последствий, потому что ресурс можно пополнить.
| Возобновляемые и невозобновляемые Природные ресурсы, используемые для приготовления каждой закуски |
|||
|---|---|---|---|
| Основной ингредиент(ы) | Природные ресурсы, используемые для изготовления каждого | Возобновляемый? Почему или почему нет? |
|
| Гелевый червь | Альгинат натрия | Бурые водоросли | Возобновляемый, потому что водоросли размножаются в течение нескольких лет. |
| Хлорид кальция | Известняк | Не восстанавливается, потому что известняк — это горная порода, на формирование которой ушли миллионы лет. | |
| Ломтики свежих фруктов | Фрукты | Фруктовое дерево, вода, и питательные вещества почвы |
Возобновляемые, потому что можно сажать новые деревья, дождь дает воду, а хорошие методы ведения сельского хозяйства могут пополнять почву питательными веществами. |
Последствия изготовления синтетической гелевой закуски для червей
- Альгинат натрия
Бурые водоросли собирают в океане в дикой природе. Это дом и пища для морских существ. Сбор бурых водорослей в океане может повлиять на другие организмы в экосистеме. Переработка морских водорослей в альгинат натрия требует энергии и приводит к образованию отходов, которые необходимо контролировать.
Сбор бурых водорослей в океане может повлиять на другие организмы в экосистеме. Переработка морских водорослей в альгинат натрия требует энергии и приводит к образованию отходов, которые необходимо контролировать. - Хлорид кальция
Придется добывать известняк.Для этого требуется оборудование, которое потребляет энергию и загрязняет окружающую среду.
При переработке известняка для производства хлорида кальция образуются отходы, которые необходимо контролировать. - Производство гелевых червей
Массовое производство гелевых червей на заводе требует оборудования и энергии. - Положительные воздействия
Людям (в основном детям) нравится их есть.
Последствия нарезки настоящих фруктов
- Выращивание и уход за фруктовыми деревьями
Подготовьте землю, используя крупногабаритную технику.Это использует энергию и увеличивает загрязнение.
Удобряйте и поливайте деревья. Некоторые удобрения могут быть загрязнителями при попадании в озера и реки. В некоторых районах воды может быть меньше, чем в других. Возможным загрязнителем может быть использование пестицидов.
В некоторых районах воды может быть меньше, чем в других. Возможным загрязнителем может быть использование пестицидов. - Сбор и нарезка фруктов
Сбор урожая вручную не загрязняет окружающую среду, но сбор урожая с помощью машин требует энергии и увеличивает загрязнение. Нарезка фруктов на кусочки размером с закуску, вероятно, будет производиться машиной, которая потребляет энергию и увеличивает загрязнение окружающей среды. - Положительные воздействия
Людям нравится есть нарезанные фрукты. Свежие фрукты содержат витамины и питательные вещества, необходимые для хорошего здоровья.
Заключение
- Настоящие фрукты, вероятно, полезнее и могут иметь меньше негативных последствий. Но если бы синтетические фруктовые закуски можно было делать с витаминами, другими питательными веществами и небольшим количеством сахара, они могли бы стать возможной альтернативой кусочкам настоящих фруктов.
Примечание:
В зависимости от того, какой синтетический продукт выбирают учащиеся, информация, которую они находят для ответов на вопросы, может различаться по степени детализации и полноте.
Предложите учащимся изучить свой синтетический продукт, используя ресурсы Интернета и библиотеки.
Направление исследований студентов
Обсудите с учащимися важность отслеживания информации, которую они находят, оценки надежности источников, которые они используют, и правильного цитирования источников. Возможно, у вас уже есть ресурсы для студентов по правильному цитированию и оценке надежности источников. Ниже мы собрали несколько образцов.
Примечание. В зависимости от того, какой синтетический продукт выбирают учащиеся, информация, которую они находят для ответов на вопросы, может различаться по степени детализации и полноте.
Изучение аспектов синтетических материалов, природных ресурсов, способов производства продуктов и влияния производства на общество может быть сложной задачей для учащихся. Студентам может быть трудно найти релевантные, надежные и понятные веб-сайты. Студентам может понадобиться существенное руководство для проведения исследований в Интернете. Мы предоставили несколько рекомендуемых веб-сайтов в качестве отправной точки для студенческих исследований. Используйте свой собственный опыт, а также опыт школьной библиотеки и медиацентра, чтобы помочь учащимся найти полезный материал.
Мы предоставили несколько рекомендуемых веб-сайтов в качестве отправной точки для студенческих исследований. Используйте свой собственный опыт, а также опыт школьной библиотеки и медиацентра, чтобы помочь учащимся найти полезный материал.
Основные цели студенческих исследований
После того, как учащиеся узнают продукт, который они будут исследовать, напомните им, чтобы они искали следующую информацию:
- Какие природные ресурсы используются для производства синтетического продукта?
- Какие химические процессы используются для изготовления синтетического продукта?
- Каково отрицательное и положительное влияние производства и использования синтетического продукта на общество по сравнению с производством и использованием более натурального продукта с аналогичной функцией?
Предложите учащимся использовать результаты своего исследования, чтобы сделать вывод о том, перевешивают ли положительные стороны отрицательные стороны. Если им потребуется дополнительная информация для принятия такого решения, попросите студентов определить, что им нужно знать.
Если им потребуется дополнительная информация для принятия такого решения, попросите студентов определить, что им нужно знать.
Примечание. Учащимся может быть сложно найти подробную и конкретную информацию о некоторых аспектах природных ресурсов, производственных процессах и влиянии их синтетических материалов и продуктов на общество. Предложите учащимся получить как можно больше информации, чтобы понять основы ресурсов, которые идут на создание продукта, общий процесс его изготовления, а также положительное и отрицательное влияние производства и использования продукта на общество.
Следующий список предназначен для того, чтобы учащиеся могли сравнить воздействие синтетического продукта на общество с более натуральным продуктом с аналогичной функцией.
Продукты с аналогичными функциями (более синтетические/более натуральные)
- Пластиковый/ бумажный пакет
- Пластиковый контейнер/ Стеклянный контейнер
- Одноразовый подгузник/ Тканевый подгузник
- Синтетическое волокно и ткань (полиэстер, нейлон или вискоза) / Хлопковое, шелковое или шерстяное волокно и ткань
- Кевлар/ Сталь
- Искусственный подсластитель/сахар
- Синтетическое топливо (Synfuel)/ нефть
- Синтетический каучук/ Натуральный каучук
- Хлорохин (лекарство от малярии)/ кора хинного дерева
- Таксол (лекарство от рака)/ Кора тиса
- Физостигмин (лекарство от глаукомы)/ Калабарские бобы
- Аспирин/ Кора ивы
Следующие веб-сайты могут помочь учащимся начать исследование своего синтетического продукта.
Пластиковые пакеты
Пластиковые бутылки
- Американский химический совет, Основы: определение и свойства полимеров
- Thomasnet.com, Производство пластиковых бутылок
- Объясните это!, Стекло
- Воздействие на окружающую среду, воздействие производства стекла на окружающую среду
- The Vermont Juice Co., стекло против пластика
- Упаковка мира, пластик против стекла — почему пластиковые контейнеры лучше
- Washington Post, Почему стеклянные банки не обязательно лучше для окружающей среды, чем пластиковые банки
- Академия питания и диетологии, Ешьте правильно, Стеклянные контейнеры против пластиковых
- Общественное вещание штата Орегон, что зеленее? Это не то, что вы ожидаете
Одноразовые подгузники
Синтетическое волокно и ткань (полиэстер, нейлон, вискоза)
- ChemMatters, нейлон
- FiberSource, краткая история производства волокон
- Объясните это, нейлон
- Science360, Изготовление ткани: профиль из нейлона
- Смитсоновский институт, Как 75 лет назад нейлоновые чулки изменили мир
- Как производятся продукты, Район
- Текстильная биржа, Процесс производства вискозы
- Объяснение химии, волокна
- Как работают вещи, почему хлопок лучше впитывает влагу, чем нейлон?
- четверт.
 нам, что такое полиэстер?
нам, что такое полиэстер? - Детали для шитья онлайн, хлопок и полиэстер
- Сравнение материалов: хлопок и полиэстер
Кевлар
Искусственный подсластитель
- ChemMatters, The Skinny о подсластителях: как они работают?
- ChemMatters, Искусственные подсластители
- Scientific American, Сахар и искусственные подсластители
- CNN, Настоящий или поддельный сахар: имеет ли значение?
- Discovery Communications, Seeker, искусственный подсластитель оставляет послевкусие в окружающей среде
- Американское химическое общество, экологические науки и технологии, Искусственный подсластитель сохраняется в окружающей среде
- Всемирный фонд дикой природы, Устойчивое сельское хозяйство — сахарный тростник
- Откройте для себя, Химия искусственных подсластителей
Синтетический каучук
Синтетическое топливо
Таксол (лекарство от рака)
Физостигмин (препарат от глаукомы)
Хлорохин (лекарство от малярии)
Кортизон (лекарство от артрита)
Аспирин
Предложите учащимся сделать рекламу, постер, короткое видео, статью или другой материал о своем синтетическом продукте.

Студенческие проекты должны ответить на следующие вопросы.
- Какие природные ресурсы используются для производства синтетического продукта?
- Какие химические процессы используются для изготовления синтетического продукта?
- Каково отрицательное и положительное влияние производства и использования синтетического продукта на общество по сравнению с производством и использованием более натурального продукта с аналогичной функцией?
Предложите учащимся использовать результаты своих исследований, чтобы сделать вывод о том, какой продукт будет лучшим выбором для общества.
Решения NCERT для науки класса 9, глава 3
Страница № 32:
Вопрос 1:
В ходе реакции 5,3 г карбоната натрия вступили в реакцию с 6 г этановой кислоты. Продуктами были 2,2 г диоксида углерода, 0,9 г воды и 8,2 г этаноата натрия. Покажите, что эти наблюдения согласуются с законом сохранения массы.
Карбонат натрия + этановая кислота → этаноат натрия + диоксид углерода + вода
Ответ:
В данной реакции карбонат натрия взаимодействует с этановой кислотой с образованием этаноата натрия, диоксида углерода и воды.
Масса карбоната натрия = 5,3 г (Дано)
Масса этановой кислоты = 6 г (Дано)
Масса этаноата натрия = 8,2 г (Дано)
Масса двуокиси углерода = 2,2 г (Дано)
Масса воды = 0,9 г (Дано)
Теперь общая масса до реакции = (5,3 + 6) г
= 11,3 г
А, общая масса после реакции = (8,2 + 2,2 + 0,9) г
= 11,3 г
∴Общая масса до реакции = Общая масса после реакции
Следовательно, данные наблюдения согласуются с законом сохранения массы.
Видеорешение для атомов и молекул (Страница: 32 , Q.No.: 1)
Решение NCERT для науки класса 9 — атомы и молекулы 32 , вопрос 1
Страница № 33:
Вопрос 2:
Водород и кислород соединяются в соотношении 1:8 по массе с образованием воды. Какая масса газообразного кислорода потребуется для полной реакции с 3 г газообразного водорода?
Какая масса газообразного кислорода потребуется для полной реакции с 3 г газообразного водорода?
Ответ:
Дано, что массовая доля водорода и кислорода в воде составляет 1:8.
Тогда масса газообразного кислорода, необходимая для полной реакции с 1 г газообразного водорода, составляет 8 г.
Следовательно, масса газообразного кислорода, необходимая для полной реакции с 3 г газообразного водорода, составляет 8 × 3 г = 24 г.
Видеорешение для атомов и молекул (Страница: 33 , Q.No.: 2)
Решение NCERT для науки 9 класса — атомы и молекулы 33, вопрос 2
Страница № 33:
Вопрос 3:
Какой постулат теории атома Дальтона является следствием закона сохранения массы?
Ответ:
Постулат атомной теории Дальтона, который является результатом закона сохранения массы:
Атомы — неделимые частицы, которые не могут ни образоваться, ни разрушиться в результате химической реакции.
Видеорешение для атомов и молекул (Страница: 33 , Q.No.: 3)
Решение NCERT для науки класса 9 — атомы и молекулы 33 , вопрос 3
Страница № 33:
Вопрос 4:
Какой постулат атомной теории Дальтона может объяснить закон определенных пропорций?
Ответ:
Постулат атомной теории Дальтона, который может объяснить закон определенной пропорции, звучит так:
Относительное количество и тип атомов в данном соединении остаются постоянными.
Видеорешение для атомов и молекул (Страница: 33 , Q.No.: 4)
Решение NCERT для науки 9 класса — атомы и молекулы 33 , вопрос 4
Страница № 35:
Вопрос 1:
Определить единицу атомной массы.
Ответ:
Единица массы, равная ровно одной двенадцатой массы одного атома углерода-12, называется одной атомной единицей массы.Пишется как «у».
Видеорешение для атомов и молекул (Страница: 35 , Q.No.: 1)
Решение NCERT для науки класса 9 — атомы и молекулы 35, вопрос 1
Страница № 35:
Вопрос 2:
Почему невозможно увидеть атом невооруженным глазом?
Ответ:
Размер атома настолько мал, что его невозможно увидеть невооруженным глазом.Кроме того, атом элемента не существует независимо.
Видеорешение для атомов и молекул (Страница: 35 , Q.No.: 2)
Решение NCERT для науки 9 класса — атомы и молекулы 35, вопрос 2
Страница № 39:
Вопрос 1:
Запишите формулы числа
.
(i) оксид натрия
(ii) хлорид алюминия
(iii) сульфид натрия
(iv) гидроксид магния
Ответ:
(i) Оксид натрия → Na 2 O
(ii) Хлорид алюминия → AlCl 3
(iii) Сульфид натрия → Na 2 S
(iv) Гидроксид магния → Mg(OH) 2
Видео Решение для атомов и молекул (Страница: 39 , Q.№: 1)
Решение NCERT для науки класса 9 — атомы и молекулы 39 , вопрос 1
Страница № 39:
Вопрос 2:
Запишите названия соединений, представленных следующими формулами:
(i) Алюминий 2 (SO 4 ) 3
(ii) CaCl 2
(iii) К 2 SO 4
(iv) КНО 3
(v) CaCO 3
Ответ:
(i) Al 2 (SO 4 ) 3 → Сульфат алюминия
(ii) CaCl 2 → Хлорид кальция
(iii) K 2 SO 4 → Сульфат калия
(iv) KNO 3 → Нитрат калия
(v) CaCO 3 → Карбонат кальция
Видео Решение для атомов и молекул (Страница: 39 , Q.
 №: 2)
№: 2)
Решение NCERT для науки класса 9 — атомы и молекулы 39 , вопрос 2
Страница № 39:
Вопрос 3:
Что означает термин «химическая формула»?
Ответ:
Химическая формула соединения означает символическое представление состава соединения.Из химической формулы соединения мы можем узнать количество и виды атомов различных элементов, составляющих соединение.
Например, из химической формулы двуокиси углерода CO 2 мы узнаем, что один атом углерода и два атома кислорода химически связаны друг с другом, образуя одну молекулу соединения, двуокиси углерода.
Видеорешение для атомов и молекул (Страница: 39 , Q.No.: 3)
Решение NCERT для науки класса 9 — атомы и молекулы 39 , вопрос 3
Страница № 39:
Вопрос 4:
Сколько атомов содержится в
(i) молекула H 2 S и
(ii) PO 4 3− ион?
Ответ:
(i) В молекуле H 2 S присутствуют три атома; два из водорода и один из серы.
(ii) В ионе PO 4 3– присутствует пять атомов; один из фосфора и четыре из кислорода.
Видеорешение для атомов и молекул (Страница: 39 , Q.No.: 4)
Решение NCERT для науки 9 класса — атомы и молекулы 39 , вопрос 4
Страница № 40:
Вопрос 1:
Рассчитайте молекулярные массы H 2 , O 2 , CL 2 , CO 2 , CH 4 , C 2 H 6 , C 2 H 4 , NH 3 , CH 3 ОН.
Ответ:
Молекулярная масса H 2 = 2 × Атомная масса H
= 2 × 1
= 2 х
Молекулярная масса O 2 = 2 × Атомная масса O
= 2 × 16
= 32 х
Молекулярная масса Cl 2 = 2 × Атомная масса Cl
= 2 × 35,5
= 71 и
Молекулярная масса CO 2 = атомная масса C + 2 × атомная масса O
= 12 + 2 × 16
= 44 х
Молекулярная масса CH 4 = атомная масса C + 4 × атомная масса H
= 12 + 4 × 1
= 16 х
Молекулярная масса C 2 H 6 = 2 × атомная масса C + 6 × атомная масса H
= 2 × 12 + 6 × 1
= 30 ед.
Молекулярная масса C 2 H 4 = 2 × атомная масса C + 4 × атомная масса H
= 2 × 12 + 4 × 1
= 28 х
Молекулярная масса NH 3 = Атомная масса N + 3 × Атомная масса H
= 14 + 3 × 1
= 17 и
Молекулярная масса CH 3 OH = атомная масса C + 4 × атомная масса H + атомная масса O
= 12 + 4 × 1 + 16
= 32 ед.
Видео Решение для атомов и молекул (Страница: 40 , Q.№: 1)
Решение NCERT для науки 9 класса — атомы и молекулы 40, вопрос 1
Страница № 40:
Вопрос 2:
Рассчитайте формулу удельных масс ZnO, Na 2 O, K 2 CO 3 , учитывая атомные массы Zn = 65 ед., Na = 23 ед., K = 39 ед., C = 12 ед. и O = 16 ед.
Ответ:
Формула единицы массы ZnO = Атомная масса Zn + Атомная масса O
= 65 + 16
= 81 и
Формула единицы массы Na 2 O = 2 × атомная масса Na + атомная масса O
= 2 × 23 + 16
= 62 х
Формула единицы массы K 2 CO 3 = 2 × атомная масса K + атомная масса C + 3 × атомная масса O
= 2 × 39 + 12 + 3 × 16
= 138 х
Видео Решение для атомов и молекул (Страница: 40 , Q.
 №: 2)
№: 2)
Решение NCERT для науки 9 класса — атомы и молекулы 40, вопрос 2
Страница № 42:
Вопрос 1:
Если один моль атомов углерода весит 12 граммов, какова масса (в граммах) 1 атома углерода?
Ответ:
Один моль атомов углерода весит 12 г (Дано)
я.е., масса 1 моля атомов углерода = 12 г
Тогда масса числа атомов углерода = 12 г
Следовательно, масса 1 атома углерода
Видеорешение для атомов и молекул (Страница: 42 , Q.No.: 1)
Решение NCERT для науки 9 класса — атомы и молекулы 42 , вопрос 1
Страница № 42:
Вопрос 2:
В чем больше атомов, в 100 граммах натрия или в 100 граммах железа (при условии, что атомная масса Na = 23 ед. , Fe = 56 ед.)?
, Fe = 56 ед.)?
Ответ:
Атомная масса Na = 23 ед. (Дано)
Тогда грамм атомной массы Na = 23 г
Итак, 23 г Na содержат = число атомов
Таким образом, 100 г Na содержит число атомов
= количество атомов
Снова атомная масса Fe = 56 u(Дано)
Тогда грамм атомной массы Fe = 56 г
Итак, 56 г железа содержат = атомов
Таким образом, 100 г Fe содержит число атомов
число атомов
Следовательно, 100 граммов натрия содержат больше атомов, чем 100 граммов железа.
Видеорешение для атомов и молекул (Страница: 42 , Q.No.: 2)
Решение NCERT для науки 9 класса — атомы и молекулы 42 , вопрос 2
Страница № 43:
Вопрос 1:
В пробе соединения кислорода и бора массой 0,24 г анализом было обнаружено, что она содержит 0,096 г бора и 0,144 г кислорода. Рассчитайте процентный состав соединения по массе.
Рассчитайте процентный состав соединения по массе.
Ответ:
Масса бора = 0,096 г (Дано)
Масса кислорода = 0,144 г (Дано)
Масса образца = 0,24 г (Дано)
Таким образом, весовая доля бора в соединении =
= 40%
А, процентное содержание кислорода по массе в соединении =
= 60%
Видео Решение для атомов и молекул (Страница: 43 , Q.№: 1)
Решение NCERT для науки 9 класса — атомы и молекулы 43 , вопрос 1
Страница № 43:
Вопрос 2:
При сгорании 3,0 г углерода в 8,00 г кислорода образуется 11,00 г двуокиси углерода. Какая масса углекислого газа образуется при сгорании 3,00 г углерода в 50,00 г кислорода? Какой закон химических соединений будет определять ваш ответ?
Ответ:
Углерод + кислородДвуокись углерода
3 г углерода реагируют с 8 г кислорода с образованием 11 г углекислого газа.
Если в 50 г кислорода сжечь 3 г углерода, то 3 г углерода прореагируют с 8 г кислорода. Оставшиеся 42 г кислорода останутся нереакционноспособными.
В этом случае также образуется только 11 г углекислого газа.
Приведенный выше ответ подчиняется закону постоянных пропорций.
Видеорешение для атомов и молекул (Страница: 43 , Q.No.: 2)
Решение NCERT для науки 9 класса — атомы и молекулы 43 , вопрос 2
Страница № 44:
Вопрос 3:
Что такое многоатомные ионы? Приведи примеры?
Ответ:
Многоатомный ион — это группа атомов, несущих заряд (положительный или отрицательный).Например, ион аммония, ион гидроксида (OH — ), ион карбоната, ион сульфата.
Видеорешение для атомов и молекул (Страница: 44 , Q.
 No.: 3)
No.: 3)
Решение NCERT для науки класса 9 — атомы и молекулы 44 , вопрос 3
Страница № 44:
Вопрос 4:
Напишите химические формулы следующих веществ:
(а) Хлорид магния
(б) Оксид кальция
(с) Нитрат меди
(г) Хлорид алюминия
(e) Карбонат кальция
Ответ:
(a) Хлорид магния → MgCl 2
(б) Оксид кальция → CaO
(c) Нитрат меди → Cu (NO 3 ) 2
(d) Хлорид алюминия → AlCl 3
(e) Карбонат кальция → CaCO 3
Видео Решение для атомов и молекул (Страница: 44 , Q.№: 4)
Решение NCERT для науки 9 класса — атомы и молекулы 44 , вопрос 4
Страница № 44:
Вопрос 5:
Назовите элементы, входящие в состав следующих соединений:
(а) Негашеная известь
(б) Бромистый водород
(с) Разрыхлитель
(г) Сульфат калия
Ответ:
|
Соединение |
Химическая формула |
Наличие элементов |
|
Негашеная известь |
СаО |
Кальций, Кислород |
|
Бромоводород |
HBr |
Водород, Бром |
|
Разрыхлитель |
NaHCO 3 |
Натрий, водород, углерод, кислород |
|
Сульфат калия |
К 2 SO 4 |
Калий, сера, кислород |
Видео Решение для атомов и молекул (Страница: 44 , Q.
 №: 5)
№: 5)
Решение NCERT для науки 9 класса — атомы и молекулы 44 , вопрос 5
Страница № 44:
Вопрос 6:
Рассчитайте молярную массу следующих веществ:
(a) Этин, C 2 H 2
(б) Молекула серы, S 8
(c) Молекула фосфора, P 4 (атомная масса фосфора = 31)
(d) Соляная кислота, HCl
(e) Азотная кислота, HNO 3
Ответ:
(a) Молярная масса этина, C 2 H 2 = 2 × 12 + 2 × 1 = 26 г
(б) Молярная масса молекулы серы, S 8 = 8 × 32 = 256 г
(c) Молярная масса молекулы фосфора, P 4 = 4 × 31 = 124 г
(d) Молярная масса соляной кислоты, HCl = 1 + 35.5 = 36,5 г
(e) Молярная масса азотной кислоты, HNO 3 = 1 + 14 + 3 × 16 = 63 г
Видеорешение для атомов и молекул (Страница: 44 , Q.
 No.: 6)
No.: 6)
Решение NCERT для науки класса 9 — атомы и молекулы 44, вопрос 6
Страница № 44:
Вопрос 7:
Какова масса—
(а) 1 моль атомов азота?
(b) 4 моля атомов алюминия (Атомная масса алюминия = 27)?
(c) 10 молей сульфита натрия (Na 2 SO 3 )?
Ответ:
а) Масса 1 моля атомов азота равна 14 г.
(b) Масса 4 молей атомов алюминия равна (4 × 27) г = 108 г
(c) Масса 10 молей сульфита натрия (Na 2 SO 3 ) равна
10 × [2 × 23 + 32 + 3 × 16] г = 10 × 126 г = 1260 г
Видеорешение для атомов и молекул (Страница: 44 , Q.No.: 7)
Решение NCERT для науки 9 класса — атомы и молекулы 44 , вопрос 7
Страница № 44:
Вопрос 8:
Преобразовать в моль.
(а) 12 г газообразного кислорода
(б) 20 г воды
(c) 22 г диоксида углерода
Ответ:
(a) 32 г газообразного кислорода = 1 моль
Затем 12 г газообразного кислорода == 0,375 моль
(б) 18 г воды = 1 моль
Затем 20 г воды == 1,11 моль (приблизительно)
(c) 44 г углекислого газа = 1 моль
Затем 22 г углекислого газа == 0,5 моль
Видео Решение для атомов и молекул (Страница: 44 , Q.№: 8)
Решение NCERT для науки 9 класса — атомы и молекулы 44 , вопрос 8
Страница № 44:
Вопрос 9:
Какова масса:
(а) 0,2 моль атомов кислорода?
(б) 0,5 моль молекул воды?
Ответ:
(а) Масса одного моля атомов кислорода = 16 г
Тогда масса 0. 2 моль атомов кислорода = 0,2 × 16 г = 3,2 г
2 моль атомов кислорода = 0,2 × 16 г = 3,2 г
(b) Масса одного моля молекулы воды = 18 г
Тогда масса 0,5 моль молекул воды = 0,5 × 18 г = 9 г
Видеорешение для атомов и молекул (Страница: 44 , Q.No.: 9)
Решение NCERT для науки класса 9 — атомы и молекулы 44 , вопрос 9
Страница № 44:
Вопрос 10:
Рассчитайте количество молекул серы (S 8 ), содержащихся в 16 г твердой серы.
Ответ:
1 моль твердой серы (S 8 ) = 8 × 32 г = 256 г
т. е. в 256 г твердой серы содержится = 6,022 × 10 23 молекул
Тогда в 16 г твердой серы содержится =
= 3,76 × 10 22 молекул (приблизительно)
Видеорешение для атомов и молекул (Страница: 44 , Q.
 No.: 10)
No.: 10)
Решение NCERT для науки 9 класса — атомы и молекулы 44 , вопрос 10
Страница № 44:
Вопрос 11:
Рассчитайте количество ионов алюминия, присутствующих в 0.051 г оксида алюминия.
( Подсказка : Масса иона равна массе атома того же элемента. Атомная масса Al = 27 u)
Ответ:
1 моль оксида алюминия (Al 2 O 3 ) = 2 × 27 + 3 × 16
= 102 г
т. е. 102 г Al 2 O 3 = 6,022 × 10 23 молекул Al 2 O 3
Тогда 0.051 г Al 2 O 3 содержит =
= 3,011 × 10 20 молекул Al 2 O 3
Количество ионов алюминия (Al 3+ ), присутствующих в одной молекуле оксида алюминия, равно 2.
Следовательно, количество ионов алюминия (Al 3+ ), присутствующих в 3,011 × 10 20 молекул (0,051 г) оксида алюминия (Al 2 O 3 ) = 2 × 3,011 × 10 4 10
9
= 6.022 × 10 20
Видеорешение для атомов и молекул (Страница: 44 , Q.No.: 11)
Решение NCERT для науки 9 класса — атомы и молекулы 44 , вопрос 11
Посмотреть решения NCERT для всех глав класса 9
Введение в химические реакции — BBC Bitesize
Типы данных
0.0.$blocks-article-row-1.1:$znytxbk-1=10.1.1.$1″> Если вы проводите расследование, вы записываете доказательства любых изменений.Доказательства, которые вы регистрируете, называются данными и могут быть количественными или качественными.
Количественные данные
Количественные данные можно подсчитывать, измерять и выражать с помощью чисел.
Количественные данные могут быть дискретными (подсчитанными) или непрерывными (измеренными).
1.$blocks-divider-blocks-grid-container-10.0.0.$blocks-article-row-1.1:$znytxbk-1=10.1.1.$5″> Например, если в результате реакции выделяется много энергии, мы можем использовать термометр и измерять повышение температуры в градусах Цельсия (C).
Качественные данные (слова)
Качественные данные описывают качества или характеристики, которые часто поддаются наблюдению.
Например, «цвет изменился с белого на синий».
0.0.$blocks-article-row-1.1:$znytxbk-1=10.1.1.$9″> Всегда нужно указывать, какой был цвет и что он изменил.
Материя в нашем окружении, Класс 9 Наука Глава 1 Примечания, Вопросы Ответы
Материя в нашем окружении Заметки для класса 9, пояснения к видео, вопрос-ответ
Материя в нашем окружении CBSE Class 9 Science Chapter 1 — Полное объяснение и Примечания к главе «Материя в нашем окружении».
На занятии рассматриваются следующие темы: Материя и ее классификация, Физическая и химическая классификация, Молекулярная теория вещества, Молекулярные структуры и свойства твердых тел, жидкостей и газов, Плазма и состояние БЭК, Температурные и температурные шкалы, Взаимное превращение состояний вещества, Испарение. .
Здесь приводится полное объяснение главы, а также все важные вопросы и ответы NCERT на книжные вопросы, также предоставленные для удобства студентов.
Класс 9 Наука
Глава 1 – Материя в нашем окружении
См. пояснение к главе 1 «Материя в нашем окружении»
пояснение к главе 1 «Материя в нашем окружении»
Материя в нашем окружении Введение
Расскажите нам о значении названия этой главы «вещество в нашем окружении». Поэтому, чтобы узнать об этом, нам нужно сначала понять термин «окружающий».
Вы знаете, что означает слово «окружающий»?
Окружающим может быть все, что нас окружает: воздух, облака, здания, водоемы и т. д. Все это окружение.
Знаете ли вы, что все, что нас окружает, состоит из материи?
Всё вокруг нас, что имеет некоторую массу и занимает определённое пространство, когда мы его удерживаем, называется материей. В этой главе мы будем изучать материю, ее свойства и многое другое.
Видео-пояснение к главе 1 Материя в нашем окружении
Верх
Материя и ее классификация
Материей может быть все, что занимает Пространство и имеет некоторую Массу (масса может быть малой или больше, не имеет значения).
Как у нас есть газовый баллон. Хотя он наполнен только воздухом, но все же он слишком тяжелый. Значит, это тоже материя, так как она имеет массу и занимает пространство. Даже воздух материя. Если вы посмотрите вокруг, вы обнаружите, что все, что вас окружает, является материей.
Классификация веществ
- Ранее, когда Материя была классифицирована, древние ученые говорили, что Материя состоит из пяти основных Элементов, называемых: Воздух, Огонь, Земля, Вода и Небо. Эти пять компонентов называются «панчтатва».

- Но с развитием науки был сделан вывод о том, что материю можно классифицировать на основе двух основных свойств: физических и химических, и поэтому существует две основные категории материи, а именно:
Классификация веществ
- Химическая классификация
- Физическая классификация
Физическая классификация
Это делается на основе физических свойств, т.е.е. свойства, которые мы можем видеть, такие как жесткость, цвет и т. д.
Химическая классификация
Делается на основе Химического Состава Материи, что означает, какие частицы присутствуют, как они реагируют с другими, если не реагируют, то почему.
Давайте займемся изучением Материи. Эти мероприятия проводятся для того, чтобы узнать больше о материи и узнать об их свойствах.
Активность: Знаете ли вы, как мы узнали, что материя состоит из мелких частиц?
Давайте выполним действие: для этого нам понадобятся следующие вещи-
- стакан,
- соль поваренная, ложка
- стеклянная палочка
- Наполните стакан на 3/4 водой, отметьте уровень воды на стакане, затем добавьте в воду поваренную соль.

- При добавлении мы видим, что когда мы добавляем соль в воду, она оседает.
- При перемешивании начинает исчезать, а затем наступает стадия полного исчезновения.
Верх
Давайте посмотрим, что доказывает это наблюдение
- Поскольку мы не можем видеть частицы соли, это показывает, что это не одно сплошное состояние материи, а состоит из мелких частиц.
- Действительно, при перемешивании частицы соли растворяются в воде, но уровень воды остается прежним.Это показывает, что между частицами воды есть промежутки, которые заняты мелкими частицами соли.
Другая деятельность: Если мы рассмотрим движение частиц. Вы действительно думаете, что они могут показать движение? Если да, давайте отследим их перемещение?
Для выполнения действия необходимы следующие вещи —
Спичечный коробок
- Теперь давайте вытащим из пакета одну палочку, подержите ее на подставке, поставьте в угол комнаты и зажгите.
 Мы увидим, что его аромат равномерно распространится по комнате.
Мы увидим, что его аромат равномерно распространится по комнате. - Аромат ощущается во всей комнате. Он не ограничивается одним углом. Таким образом, наблюдение состоит в том, что «Вся комната начинает очень хорошо пахнуть»
Заключение на деятельность
- Это то, что частицы материи не неподвижны. Они постоянно движутся, и когда они дрейфуют в воздухе, мы можем почувствовать приятный аромат.
- Причина этого в том, что когда мы поджигаем палочку, выделяемая тепловая энергия поглощается частицами, что увеличивает их кинетическую энергию и заставляет ароматные частицы двигаться быстро.Они легко дрейфуют по воздуху и распространяют аромат.
Вы будете удивлены, узнав, что за этим стоит реальное явление. Феномен называется Диффузия.
Диффузия
Это перемещение любого вещества из места с более высокой концентрацией в место с более низкой концентрацией, или его также можно определить как смешение различных веществ.
Упражнение для демонстрации диффузии: возьмем две колбы, соединенные друг с другом ручкой.
Теперь предположим, что с одной стороны есть газ А, а с другой стороны газ Б. Когда ручка закрыта, оба газа находятся в своих собственных колбах. Но когда ручку открывают, два газа быстро смешиваются. В результате в обеих колбах будут частицы газа А и В. Это перемешивание называется диффузией.
Лучше всего это проявляется у газов, так как частицы газа обладают максимальной кинетической энергией.
Доказательство: частицы материи притягиваются друг к другу
Возьмем разные вещества, например
.
- железный гвоздь
- кусок дерева
- резинка
- Теперь попробуй разбить их молотком.
- Как известно, все три принадлежат к одним и тем же состояниям – твердым телам.
- Угадайте, что мы заметили?
- Мы заметили, что резиновую ленту легче забить, чем дерево и железный гвоздь.

- Причина в том, что частицы железного гвоздя настолько плотно упакованы, что их трудно разделить с помощью молотка по сравнению с на дерево или резиновую ленту.
Итоги этого задания:
В железе сила притяжения между частицами максимальна, когда частицы находятся ближе, тогда как в других они не так близки.
Все эти действия привели к получению дополнительной информации о материи и ее свойствах, что привело к введению Теории молекулярной структуры материи .
Верх
Теория молекулярного строения вещества
Согласно этой теории,
- Материя состоит из мелких частиц, называемых молекулами.
- Они находятся в состоянии непрерывного движения.Благодаря этому можно сказать, что они обладают К.Э.
- К.Э. Возрастает с ↑ se температуры.
- К.Э. Максимальная в газах и минимальная в твердых телах.

- Пространство между молекулами называется межмолекулярным пространством, которое наименьшее в твердых телах и максимальное в газах.
- Существует сила, которая существует между частицами материи и называется межмолекулярной силой
- Межмолекулярная сила ↓ ses с увеличением межмолекулярного пространства
Используемая терминология
Прежде чем мы начнем с других свойств материи, дайте нам знать некоторые термины, которые будут использоваться в этой главе.
- Материя: Все, что занимает пространство, является материей.
- Материал: Этот термин используется для описания определенного вида материи.
Материалы двух типов:
Однородные материалы : Те, которые имеют одинаковый состав и одинаковые свойства по всему образцу.
Например, если взять в стакан воду, добавить в нее соль и размешать. В результате образуется смесь с одинаковыми свойствами и однородным составом (то есть не видны отчетливые слои).Они тщательно перемешиваются. Если вы возьмете образец из любой части этой смеси, она проявит аналогичные свойства.
В результате образуется смесь с одинаковыми свойствами и однородным составом (то есть не видны отчетливые слои).Они тщательно перемешиваются. Если вы возьмете образец из любой части этой смеси, она проявит аналогичные свойства.
Гетерогенные материалы : материалы, имеющие разный состав и разные свойства в разных частях образца.
Например, если взять песок в воде, то мы увидим, что, несмотря на перемешивание, он в воде не растворяется. Он осядет на дно контейнера, и несколько частиц будут плавать в воде.Если вы возьмете образец из любой его части, он покажет разные свойства.
- Молекула: Термин, используемый для определенного типа материи, которая существует независимо в природе, такой как молекула кислорода, молекула углекислого газа, молекула воды и т.д. .
Верх
Молекулярные структуры и свойства твердых тел, жидкостей и газов
Теперь займемся физической классификацией материи: эта классификация делается на основе физических свойств материи, то есть свойств, которые можно увидеть или ощутить, потрогав, посмотрев и т. д.
д.
В соответствии с ним материя делится на 3 вида:
Твердые вещества
если взять любое твердое тело скажем возьмем древесину какие свойства можно в ней найти глядя на нее.
- Первое свойство, которое мы можем выделить, это то, что оно имеет фиксированную форму и объем: мы понимаем это, потому что, когда дерево держится на полу или любой другой поверхности, оно занимает определенное пространство.
- Еще одно свойство, которое мы заметили, это: Он не сжимаем: если мы попытаемся сжать его или изменить его форму, мы не сможем этого сделать.Вероятно, это связано с тем, что между твердыми частицами нет пространства, а для его сжатия между частицами должно быть пространство. Это потому, что когда мы применяем силу, частицы заполняют эти пустые пространства и приближаются.
- Еще одно свойство: им не нужен контейнер для хранения: нам не нужно помещать альмиру или любое другое твердое тело в контейнер.
 это может быть сохранено как таковое на поверхности.
это может быть сохранено как таковое на поверхности.
- Они не текут: Это потому, что когда древесина хранится на месте, она остается на том же месте.Он не течет и не движется сам по себе.
- Их тенденция к диффузии равна нулю: видно, что древесина не перемещается из одной стороны комнаты в другую сторону комнаты сама по себе, так как у частиц нет столько энергии, чтобы они продолжали двигаться.
Попробуем понять твердые тела на основе теории молекулярного строения:
Объяснение твердых тел на основе молекулярной структуры
- Если мы видим какое-либо твердое тело, мы замечаем, что в твердых телах частицы плотно упакованы.Они очень плотно упакованы, из-за чего между частицами практически нет пространства, или можно сказать, что межмолекулярных промежутков очень мало, и чем ближе частицы, тем сильнее межмолекулярные силы притяжения. В результате твердые тела имеют фиксированную форму, объем и не могут быть сжаты.

Теперь вы понимаете, почему древесина или любое другое твердое тело не течет, не сжимается и не рассеивается, и почему они обладают высокой плотностью.
Жидкости
Давайте рассмотрим любую жидкость, например воду, и попробуем определить разницу между частицами дерева и водой.Наблюдаем —
- Не имеет ни фиксированной формы, ни объема
- Может быть сжат больше, чем almirah
- Может течь во всех направлениях
- Может заполнить все пространство контейнера
- Может легко диффундировать больше, чем твердые вещества
- Имеет меньшую плотность, чем твердые тела
Объяснение молекулярной структуры жидкостей
В жидкостях частицы расположены не так близко друг к другу, как в твердых телах, из-за чего межмолекулярное пространство сравнительно больше, что приводит к меньшему притяжению между частицами.
Итак, межмолекулярная сила сравнительно меньше по сравнению с твердыми телами.
Газы
Суммируем свойства газов по сравнению с твердыми телами и жидкостями
- Они не имеют ни фиксированной формы, ни фиксированного объема
- Обладают высокой сжимаемостью
- Они могут течь, в значительной степени диффундировать
- У них очень-очень низкая плотность
- Они могут заполнить все пространство
Объяснение газов на основе молекулярной структуры
В газах частицы находятся очень далеко друг от друга.Благодаря этому они обладают высокой кинетической энергией и продолжают двигаться хаотично. В результате межмолекулярные пространства очень велики, а межмолекулярные силы почти равны нулю .
Верх
Плазма и состояние конденсата Бозе-Эйнштейна
Два состояния вещества — плазма и БЭК, давайте разберемся в них:
Плазма : состоит из ионизированного газа, частицы которого обладают сверхэнергией и сверхвозбуждением. В таких устройствах, как ламповые лампы и компактные люминесцентные лампы, газы ионизируются при прохождении тока и светятся цветом в зависимости от природы газа. Например: газ неон излучает красное свечение, аргон излучает зелено-желтый и т. д.
В таких устройствах, как ламповые лампы и компактные люминесцентные лампы, газы ионизируются при прохождении тока и светятся цветом в зависимости от природы газа. Например: газ неон излучает красное свечение, аргон излучает зелено-желтый и т. д.
Конденсат Бозе-Эйнштейна Состояние:
Это пятое состояние вещества, которое получается при переохлаждении газа почти до абсолютного нуля по Кельвину.
Верх
Класс 9 Естествознание по главам Объяснение
Температура и температурные шкалы
Вы часто болеете, иногда из-за высокой температуры.Затем первый шаг, который необходимо предпринять, — это измерить температуру с помощью термометра, который регистрирует температуру тела в заданной шкале.
Температура — это степень нагревания или холода тела или Мы также можем сказать, что температура измеряет степень движения атомов.
Измеряется термометром.
Существуют различные шкалы, по которым можно записывать температуру:
Обычно используются шкалы Цельсия и Кельвина
Шкала Цельсия:
- Записывается как OC
- На нем нижняя фиксированная точка (при которой тает лед) O oC
- Верхняя фиксированная точка на нем (при которой закипает вода) 100 oC
Шкала Кельвина:
- Нижняя фиксированная точка- 273K
- Верхняя фиксированная точка 373 K
- Кельвина называется абсолютной нулевой шкалой температуры, потому что на ней самая низкая возможная температура равна нулю.
Шкала
Соотношение b между K и oC : эти шкалы могут быть преобразованы друг в друга с использованием четко определенных соотношений, таких как
0 oC = 273 K
Итак, K = oC + 273 или oC = K -273
Например, если нам нужно преобразовать 25 oC в K, нам нужно добавить к этому 273, и получится 298K.
Верх
Взаимное превращение состояний материи
Вы, должно быть, замечали, что если мы не держим лед на кухне, со временем он превращается в воду или когда вода нагревается и вы забываете выключить ручку газа, то она продолжает кипеть и наступает стадия, когда сосуд становится пустым и воды внутри не видно.Это связано с взаимопревращением состояний вещества.
Явление, благодаря которому вещество переходит из одного состояния в другое, а затем обратно в исходное состояние при изменении условий температуры и давления, называется взаимопревращением состояний вещества.
Состояние вещества можно также изменить путем нагревания или применения давления.
Поскольку у всех вас дома есть баллоны со сжиженным нефтяным газом или вы наверняка видели баллоны с сжиженным природным газом, установленные в автомобилях, эти баллоны содержат сжиженный нефтяной газ или сжатый природный газ, что означает, что в этих баллонах газы сжижаются под давлением.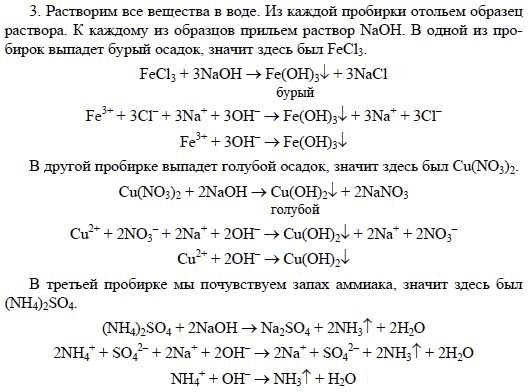
Итак, имейте в виду, что при приложении давления газ может перейти в жидкость.
Точно так же при приложении давления жидкость превращается в твердое тело.
Например, при воздействии давления на углекислый газ он образует сухой лед (твердое состояние).
Итак, взаимопревращение говорит нам об изменении одного состояния материи в другое состояние.
Твердое вещество ↔ жидкость ↔ газ
- Превращение твердого тела в жидкое называется плавлением и происходит при фиксированной температуре, называемой точкой плавления
- Превращение жидкости в газ называется испарением и происходит при фиксированной температуре, называемой точкой кипения
- Превращение газа в жидкость называется конденсацией или сжижением и происходит в точке сжижения
- Превращение жидкости в твердое состояние называется замерзанием и происходит при температуре, называемой точкой замерзания.
- Преобразование твердого 🡪 жидкого 🡪газа включает поглощение тепловой энергии
- А превращение газа 🡪жидкого 🡪 в твердое происходит с выделением тепловой энергии
Энергия, необходимая для изменения состояния независимо от того, выделяется она или поглощается, называется скрытой теплотой
Скрытая теплота
Количество теплоты, выделяемой или поглощаемой при изменении состояния вещества.
Твердое тело Жидкость
Как и при преобразовании твердого тела в жидкость, выделяется тепло, и это тепло называется скрытой теплотой плавления, то есть –
Скрытая теплота плавления: это количество тепла, необходимое для преобразования одной единицы массы вещества из твердого состояния в жидкое при его температуре плавления.
Пример: для льда оно равно 3,34 x 105 3/кг
Изменение состояния твердого тела на жидкое на основе молекулярной структуры
При нагревании любого твердого вещества частицы приобретают энергию и начинают вибрировать с большей амплитудой. Их кинетическая энергия увеличивается, за счет чего увеличивается их межмолекулярное пространство и уменьшается межмолекулярная сила, и они переходят в жидкое состояние.
Жидкое состояние Газообразное состояние
Кипение или испарение: это переход вещества из жидкого состояния в газообразное при температуре кипения.
Кипящая точка. => Температура, при которой жидкость переходит в газообразное состояние при нагревании.
Температура кипения воды => 100 oC
Скрытая теплота парообразования : количество теплоты, необходимое для превращения единицы массы вещества из жидкости в пар при температуре кипения.
Например, для h3O она равна 22,6 x 105 Дж/кг.
Переход из жидкого состояния в газообразное на основе молекулярной структуры
Когда мы нагреваем любое жидкое вещество, частицы получают энергию.В результате увеличивается их кинетическая энергия и они начинают колебаться с большей амплитудой, за счет чего увеличивается их межмолекулярное пространство и уменьшается межмолекулярная сила, и они переходят в газообразное состояние.
Газ Жидкость
Конденсация: Это переход газообразного состояния в жидкое при охлаждении. Это происходит при температуре ниже точки кипения вещества.
Переход из газообразного состояния в жидкое на основе молекулярной структуры
Это происходит путем приложения давления и снижения температуры
Пояснение: Когда к газу прикладывается высокое давление, расстояние между частицами уменьшается и частицы начинают притягиваться друг к другу и газ переходит в жидкое состояние.
Твердые Газовые
Вы наверняка заметили, что нафталиновые шарики используются для предотвращения роста насекомых в ящиках кроватей. Со временем эти шары исчезают. Вы знаете, какое явление стоит за этим исчезновением?
Сублимация : Это переход твердого состояния непосредственно в газообразное при нагревании и паров обратно в твердое при охлаждении.
Включает два термина, то есть
- Возвышенный: Газообразное состояние, которое образуется в результате сублимации твердого вещества
- Сублимация: это твердое вещество, которое сублимирует
.
Пример сублимации: сублимация нафталиновых шариков
Верх
Испарение
Вы, должно быть, видели, что когда мокрую одежду расстилают на солнце, она высыхает, или зерна пшеницы часто сушат на солнце, прежде чем отправить на мельницу для переработки в муку.Это связано с происходящим явлением испарения.
Испарение – это процесс превращения жидкости в пар при температуре ниже ее точки кипения.
Объяснение испарения на основе молекулярной структуры
При испарении частицы жидкости нагреваются или забирают тепловую энергию из окружающей среды. Когда тепло отводится частицами, увеличивается энергия частиц, за счет чего они начинают быстро двигаться.
В результате они сталкиваются друг с другом. В ходе столкновений одни частицы теряют энергию, а другие приобретают ее. В результате частицы с большей энергией преодолевают силу притяжения и улетучиваются в атмосферу.
В результате частицы с большей энергией преодолевают силу притяжения и улетучиваются в атмосферу.
Факторы, от которых зависит испарение:
- Площадь поверхности
- Температура
- Влажность
- Скорость ветра
Поясним зависимость явления от данных факторов:
1.Площадь поверхности – больше площадь открытой поверхности любого вещества, большее количество капель жидкости перейдет в состояние пара
Например: сушка мокрой одежды
Мы видели, что одежда сохнет быстрее, если ее расстелить на веревке. Причина в том, что когда мы их распределяем, площадь поверхности увеличивается, следовательно, испарение увеличивается по мере того, как подвергается воздействию все больше и больше молекул.
2. Температура: повышение температуры увеличивает кинетическую энергию молекул.Они разрушают свою силу притяжения, поэтому легко убегают или испаряются.
Например: образование водяного пара на чашке горячего чая. Это связано с тем, что при повышении температуры частицы начинают беспорядочно двигаться, поэтому скорость испарения увеличивается. Поэтому, когда они убегают, они также сталкиваются с чашкой и конденсируются.
Это связано с тем, что при повышении температуры частицы начинают беспорядочно двигаться, поэтому скорость испарения увеличивается. Поэтому, когда они убегают, они также сталкиваются с чашкой и конденсируются.
3. Влажность: чем больше влажность, тем меньше испарение
Например- Одежда с трудом сохнет во влажный день: чем выше влажность, тем больше паров в атмосфере.
Благодаря чему снижается тенденция испарения паров, а также уменьшается скорость испарения.
4. Скорость ветра: С увеличением скорости ветра увеличивается испарение.
Вот почему в ветреный день одежда сохнет быстрее. Поскольку скорость ветра высока, жидкие частицы поглощают энергию. В результате их кинетическая энергия увеличивается, и они легче убегают.
Испарение Причина Эффект охлаждения
Испарение — поверхностное явление.Частицы на поверхности с высокой К.Э. разрушают их силу притяжения и образуют пары. Поскольку энергия теряется, это означает, что температура снижается, а низкая температура означает эффект охлаждения, поэтому испарение приводит к эффекту охлаждения.
В. Знаете ли вы, почему мы чувствуем себя более комфортно, если летом носим хлопчатобумажную одежду?
А. Это потому, что хлопчатобумажная одежда очень хорошо впитывает воду. Они быстро впитывают пот, а затем испаряются, забирая у нашего тела большое количество тепла, тем самым создавая ощущение прохлады.
Верх
Материя в окружающем нас классе 9 Дополнительные вопросы
Q1: Что из следующего является материей: стул, стол, запах, ненависть, миндаль, мысль, холод, холодный напиток, запах духов?
Ответ: Стул, Миндаль, Воздух, Холодный напиток — примеры материи.
Q2: Объясните, почему запах горячей шипящей пищи доносится до вас на несколько метров, а чтобы почувствовать запах холодной, нужно подойти близко?
Ответ: Запах горячей пищи доходит до нас потому, что скорость диффузии газов увеличивается с повышением температуры.
Q3: Водолаз может прорезать воду в бассейне, какое свойство материи показывает это наблюдение?
Ответ: он способен рассекать воду, так как сила притяжения в молекулах воды мала.
Q4: Сведите в таблицу различия между характеристиками материи
Комментарий по жесткости, сжимаемости, текучести, форме, кинетической энергии и плотности.
Ответ:
(а)
| особенность |
твердый |
жидкость |
газ |
|
очень маленький |
маленький |
очень большой |
|
2.силы притяжения |
очень большой |
маленький |
нет |
|
3. |
нет |
низкий |
высокий |
|
4. жесткость |
высокий |
низкий |
нежесткий |
|
5.плотность |
высокий |
низкий |
очень низкий |
|
6. кинетическая энергия |
маленький |
большой по сравнению с маленьким |
очень высокий |
(б)
- Жесткость: это свойство, благодаря которому вещество может сохранять свою форму при приложении к нему силы. Твердые тела жесткие.
- Сжимаемость: Это свойство, благодаря которому объем вещества может быть уменьшен путем приложения силы или давления.
 Газы очень сжимаемы.
Газы очень сжимаемы. - Текучесть: Это свойство, благодаря которому молекулы одного вещества могут течь из одной точки в другую. Жидкости и газы могут течь.
- Форма: Это определенное геометрическое расположение частиц вещества. Твердые тела имеют определенную форму
- Кинетическая энергия: это энергия, которой обладает частица благодаря своему движению.Газообразные частицы обладают наибольшей кинетической энергией.
- Плотность: это масса на единицу объема вещества. Твердые тела имеют чрезвычайно высокую плотность.
Q5: Объясните следующее –
a. «Газ полностью заполняет сосуд, в котором находится»
Ответ: Это потому, что силы притяжения между частицами газа очень малы и молекулы движутся беспорядочно с высокой энергией.
б. «Газ давит на стенки сосуда»
Поскольку кинетическая энергия частиц газа очень велика, давление возникает из-за ударов молекул о стенки сосуда.
в. «Деревянный стол твердый»
Потому что силы притяжения высоки, а промежутки между частицами почти нулевые.
д. «Мы можем легко двигать рукой в воздухе, но не через твердый блок»
Потому что в воздухе есть межмолекулярные пространства, но не в твердом блоке
Q6: Жидкости обычно имеют меньшую плотность по сравнению с твердыми телами, но почему лед плавает на поверхности воды?
Ответ: Лед плавает на воде, потому что лед имеет меньшую плотность, чем жидкая вода, потому что при заданной массе льда объем больше, чем у жидкой воды.
Q7: Преобразовать 300К и 573К в Цельсия?
Ответ: 300K-273=27 градусов Цельсия.
573К -273 = 300 градусов Цельсия
Q8: Каково физическое состояние воды при 25 градусах Цельсия и 100 градусах Цельсия?
Ответ: При 25 градусах Цельсия это жидкость, а при 100 градусах Цельсия это газ.
Q9: Почему для любого вещества температура остается постоянной при изменении состояния?
Ответ: Это происходит потому, что поступающая или выделяемая тепловая энергия расходуется на увеличение или уменьшение пространств и межмолекулярных сил.
Q10: Предложите способ сжижения атмосферных газов?
Ответ: охлаждением под давлением
Материя в нашем окружении NCERT Book Solutions
Q1. Почему кулер в пустыне лучше охлаждает в жаркий сухой день?
А. Это связано с тем, что в жаркий сухой день из-за повышения температуры и меньшей влажности скорость испарения увеличивается.
Q2. Как вода, находящаяся в глиняном горшке (матке), становится прохладной летом?
А.Это потому, что вода выходит из пор матки и испаряется, а мы знаем, что испарение приводит к охлаждающему эффекту.
Q3. Почему наша ладонь становится холодной, когда мы наносим на нее ацетон, бензин или духи?
А. Это потому, что частицы ацетона забирают энергию у нашего тела и испаряются, а испарение вызывает охлаждение.
Q4. Почему мы можем быстрее пить горячий чай или молоко из блюдца, а не из чашки?
А.Мы можем быстрее пить горячий чай или молоко из блюдца, а не из чашки, потому что блюдце обеспечивает большую площадь поверхности, чем чашка, для испарения жидкости в пар и вызывает охлаждающий эффект.
В5. Какую одежду нам носить летом?
A. Летом нам следует носить хлопчатобумажную одежду, так как она быстро впитывает пот, а затем испаряет его, забирая большое количество тепла из нашего тела, создавая ощущение прохлады.
Q6. Переведите следующие температуры в шкалу Цельсия.
(а) 293 К (б) 470 К.
А. (а) 293К = 293 – 273 = 20⁰С
(б) 470К = 470 – 293 = 177⁰С
В7. Переведите следующие температуры в шкалу Кельвина.
(а) 25°С (б) 373°С.
А. (а) 25 градусов Цельсия = 25+273=298К
(б) 373 градуса Цельсия = 373+273=646К
В8. Обоснуйте следующие наблюдения.
(а) Нафталиновые шарики со временем исчезают, не оставляя твердого вещества.
(b) Мы можем почувствовать запах духов, сидя на расстоянии нескольких метров.
A. (а) Нафталиновые шарики со временем исчезают, не оставляя твердого тела, потому что нафталиновый шарик проявляет сублимацию.
(b) Мы можем почувствовать запах духов, сидя на расстоянии нескольких метров. Это связано с тем, что газы имеют более высокую скорость диффузии.
Q9. Расположите в порядке возрастания сил притяжения между частицами следующие вещества: вода, сахар, кислород.
А.В порядке возрастания сил притяжения между частицами их можно расположить так –
- кислород
- вода
- сахар
В10. Каково физическое состояние воды при…
(а) 25°С (б) 0°С (в) 100°С ?
А. Физическое состояние воды следующее –
- 25°C – вода
- 0°С – лед
- 100°С – газ
В11. Приведите две причины в оправдание —
(а) вода при комнатной температуре является жидкостью.
(b) железный альмира является твердым при комнатной температуре.
А. а) вода жидкая при комнатной температуре, потому что силы притяжения между молекулами воды малы и могут перемещаться из одной точки в другую.
(b) Альмира твердая при комнатной температуре, потому что молекулы плотно удерживаются сильными силами.
В12. Почему лед при температуре 273 К более эффективен для охлаждения, чем вода той же температуры?
A. Лед при температуре 273 К более эффективен для охлаждения, чем вода той же температуры, поскольку молекулы льда имеют меньшую энергию по сравнению с частицами в жидкой воде при той же температуре.Следовательно, для плавления им требуется больше скрытой теплоты плавления.
В13. Что вызывает более сильные ожоги, кипящая вода или пар?
A. Пар дает больше ожогов, потому что в паре молекулы имеют более высокую кинетическую энергию, чем в кипящей воде.
В14. Имя A, B, C, D, E и F на следующей диаграмме, показывающей изменение его состояния
А.
- А- сплав
- B- испарение
- С-конденсация
- D-отверждение
- Электронная сублимация
- F-сублимация
Верх
NCERT Класс 9 Химия Программа
Структура курса CBSE разработана таким образом, чтобы учащиеся не подвергались сильному давлению, кроме того, книги сделаны интерактивными и интересными, чтобы учащиеся получали удовольствие от учебы. Между главами включено множество забавных заданий, которые помогают учащимся учиться в игровой форме. Это делает процесс передачи знаний учащимся эффективным и здоровым.
Между главами включено множество забавных заданий, которые помогают учащимся учиться в игровой форме. Это делает процесс передачи знаний учащимся эффективным и здоровым.
Глава 1 Материя в нашем окружении
Здесь начиная с определения материи, эта глава делится на 5 блоков, это:
Физическое состояние материи
Здесь обсуждаются различные физические состояния материи, такие как твердое, жидкое и газообразное.Их различия, причины образования и т. д. поясняются с помощью примеров.
Характеристики частиц материи
Обсуждаются основные характеристики и особенности частиц материи, где межмолекулярные пространства, силы и непрерывное движение между частицами объясняются примерами здесь, в этом разделе.
Состояние вещества
Здесь подробно объясняются такие термины, как текучесть, кинетическая энергия, жесткость и т. д.
Может ли материя изменять свое состояние
Здесь обсуждаются основные причины, почему и как материя может изменять свое состояние, с помощью примеров и экспериментов для лучшего понимания.
Испарение
Здесь объясняется термин «Испарение», свойства, характеристики и т. д.
Глава 2 Материя вокруг нас чистая
Вот как составляется состав смеси, подробно объясняются такие термины, как суспензия, коллоиды и растворы. Кроме того, в этой главе хорошо преподается разделение твердых тел, жидкостей и газов.
Глава 3 Атомы и молекулы
Закон химического соединения
Это очень важная и приоритетная тема с экзаменационной точки зрения, где для лучшего понимания подробно объясняются законы сохранения массы и закон постоянной пропорции с примерами.
Что такое атом?
Начиная с определения атома, история атомов, такие термины, как атомная единица массы, ее важность в материи и других областях объясняется здесь с примерами.
Что такое молекула?
Начиная с истории, здесь объясняется определение молекулы, разница между атомом и молекулой с указанием нескольких наборов примеров для понимания.
Написание химических формул
Определение химических формул (символическое представление соединения), валентность, то, как происходит химическое взаимодействие, его важность подробно объясняются здесь и снабжены примерами уравнений для лучшего понимания.
Молекулярная масса и концепция молей
Определение молекулярной массы, разница между атомной массой и молекулярной массой, массой ионов и единицей массы также учат, как рассчитывать здесь с примерами. Концепция моля подробно объясняется здесь применительно к атомам и молекулам.
Глава 4 Структура атома
Начиная с введения атома, здесь также объясняются структура атома, природа и поведение атома, термин субатомные частицы (протон, электрон, нейтрон), его характеристики, природа.Здесь также обсуждаются различные теории и способы получения атомов.
План урока | Ядерная энергия: какова ваша реакция?
Разминка (15 минут)
1. Отобразите слайд для разминки на экране, чтобы учащиеся могли прочитать следующее:
Почти 40% еды в Соединенных Штатах выбрасывается. Поскольку для производства продуктов питания требуется много воды и энергии, впустую тратятся не только продукты, но и водные и энергетические ресурсы.Представьте себе, что школа пытается сократить количество пищевых отходов в собственной столовой, штрафуя учеников, которые не доедают еду, которую они покупают на обед. За каждый кусок еды, купленный в столовой и выброшенный вместо того, чтобы быть съеденным, студент должен заплатить 1 доллар.
Поскольку для производства продуктов питания требуется много воды и энергии, впустую тратятся не только продукты, но и водные и энергетические ресурсы.Представьте себе, что школа пытается сократить количество пищевых отходов в собственной столовой, штрафуя учеников, которые не доедают еду, которую они покупают на обед. За каждый кусок еды, купленный в столовой и выброшенный вместо того, чтобы быть съеденным, студент должен заплатить 1 доллар.
2. Согласен/Не согласен: Определите одну сторону класса как сторону «Согласен», а другую — как сторону «Не согласен». Предложите учащимся встать и пройти в ту сторону, которую они идентифицируют, получив следующую подсказку: Учащиеся должны быть оштрафованы за несъеденную еду, купленную в школьной столовой.
3. Выберите учащихся с обеих сторон для защиты своей позиции, используя рамки предложений «Я согласен… потому что…» или «Я не согласен… потому что…». Перечислите некоторые из их причин в таблице на доске.
Примеры:
Я согласен, потому что…
- Студенты, вероятно, не могут позволить себе платить штрафы, поэтому они будут осторожны, чтобы не выбрасывать еду.
- будут более разборчивы и вдумчивы в отношении еды, которую они покупают.
- несъеденная пища — это пустая трата важных ресурсов, и учащиеся должны нести за это ответственность.
Студенты
Не согласен, потому что…
- ученики будут чаще приносить обед из дома, и школа потеряет деньги.
- учащихся могут найти другие неправильные способы избавиться от еды, например, спрятать ее или выбросить на улицу.
- студента могут съесть слишком много, потому что даже если они сыты, они не хотят платить штраф.
4. После краткого обсуждения и обмена мнениями дайте учащимся возможность перейти на другую сторону, если они передумали.
5. Попросите добровольцев предложить альтернативное решение проблемы. Примеры: Предоставьте учащимся контейнеры на вынос, чтобы они могли сохранить несъеденную еду, или сделайте тарелки меньшего размера, чтобы учащиеся физически не могли купить столько еды.
Примеры: Предоставьте учащимся контейнеры на вынос, чтобы они могли сохранить несъеденную еду, или сделайте тарелки меньшего размера, чтобы учащиеся физически не могли купить столько еды.
6. В стиле «попкорн» или в группах предложите учащимся провести мозговой штурм и составить список информации, которую было бы полезно иметь, чтобы взвесить все «за» и «против» предлагаемого решения социальной проблемы (проблемы, затрагивающей людей). Примеры: Научные данные и доказательства, мысли, мнения и опасения людей, затронутых проблемой и предлагаемым решением, советы и знания экспертов, модели и т. д.
Справочная по ядерной энергии (45 минут)
1. Ознакомить учащихся с предпосылкой занятия:
Город (вымышленный) Солюшнвилль пытается найти способ заменить свои нынешние угольные электростанции более чистыми и устойчивыми источниками энергии. На недавнем городском собрании было предложено городу построить атомную электростанцию. Как гражданин Solutionville с правом голоса, вы должны решить, поддерживаете ли вы строительство атомной электростанции для обеспечения энергией и электричеством домов и предприятий.
Как гражданин Solutionville с правом голоса, вы должны решить, поддерживаете ли вы строительство атомной электростанции для обеспечения энергией и электричеством домов и предприятий.
2. Проведите анонимный опрос, чтобы определить, сколько жителей Солюшнвилля (учащихся класса) в настоящее время поддерживают ядерную энергию.
Совет учителю: Для быстрого, простого и анонимного опроса вы можете использовать кликеры или бесплатное приложение, такое как Socrative , которое позволяет учащимся голосовать с помощью своих смартфонов, планшетов или веб-браузера. Такие приложения, как Socrative, позволяют отображать результаты опроса в классе в режиме реального времени.
3. Покажите учащимся видеоролик Ядерная энергия: будущее за расщеплением? и обсудим некоторые преимущества и недостатки атомной энергетики, представленные в видео.
4. Разделите учащихся на группы по три человека. Раздайте каждому учащемуся по одному Руководству по выполнению заданий и кратко прочитайте инструкции. Дайте учащимся около 30 минут на исследование.
Дайте учащимся около 30 минут на исследование.
5. Нарисуйте на доске таблицу преимуществ и недостатков ядерной энергии, как показано в Чтениях по ядерной энергии. Кратко обсудите разницу между экологическими, социальными/культурными и экономическими измерениями.
6. Попросите каждую группу написать на стикерах преимущества и недостатки ядерной энергии (по одному на каждый листок) и поместить их в соответствующую строку/столбец на доске.
7. Обсудите таблицу класса. Попросите учащихся объяснить свое мнение и обосновать свою точку зрения, цитируя источники, которые они читали.
-
Учитывали ли вы все три аспекта при проведении исследования и анализа?
-
Как вы думаете, важно или полезно учитывать все три аспекта при взвешивании потенциального решения проблемы? Почему или почему нет?
8. День голосования! Проведите общественное голосование по вопросу о том, строить ли атомную электростанцию, а затем представьте учащимся результаты как первоначального, так и окончательного голосования. Прежде чем проводить официальное голосование, подумайте о том, чтобы позволить по одному защитнику от каждой стороны, если он заинтересован, «изложить свою позицию» перед классом; учащиеся могут как практиковаться в выслушивании доказательств, так и в уважительном слушании.
Прежде чем проводить официальное голосование, подумайте о том, чтобы позволить по одному защитнику от каждой стороны, если он заинтересован, «изложить свою позицию» перед классом; учащиеся могут как практиковаться в выслушивании доказательств, так и в уважительном слушании.
Подведение итогов и размышление
9. В конце урока или в качестве домашнего задания попросите учащихся написать размышления о том, что они узнали.
-
Насколько легко или сложно было найти достоверную информацию о ядерной энергии? Нашли ли вы какие-либо мнения или аргументы по поводу ядерной энергии, которые не были подкреплены доказательствами или вескими аргументами? Если да, то считали ли вы их по-прежнему обоснованными?
-
В своем исследовании вы нашли больше людей или организаций, поддерживающих или выступающих против ядерной энергии, или они кажутся равными? Как вы думаете, почему это было/есть?
-
Кто-нибудь передумал между первоначальным опросом и окончательным голосованием? Что заставило их передумать и почему?
- Почему важно уметь различать заслуживающие доверия и сомнительныененадежные источники информации?
- Как бы вы могли побудить людей быть более информированными голосующими гражданами? (например, кампания в социальных сетях)
Подготовка к экзамену 9 класса CBSE 2021 — Онлайн-классы 9 класса в Unacademy.

О CBSE Class 9
Центральный совет среднего образования (CBSE) Класс 9 формирует основу для высших классов. Предметы, преподаваемые в 9 классе CBSE, закладывают прочную основу для 10 класса и помогают хорошо подготовиться к экзаменам.
Учащиеся знакомятся с новыми предметами в 9 классе CBSE, чтобы они могли более четко обдумать варианты карьеры. Более того, учебная программа 9-го класса синхронизирована с 11-м классом CBSE. Четкое понимание концепций 9-го класса имеет решающее значение для получения хороших результатов в старших классах средней школы. Если вы правильно понимаете темы 9-го класса, решение сложных задач и вывод сложных теорем становится легким.
Все предметы
В CBSE Class 9 есть девять предметов, разделенных на две широкие категории — Scholastic и Co-scholastic.В учебных областях есть пять обязательных и два факультативных предмета. С другой стороны, есть два предмета внутренней оценки, которые входят в область совместного обучения.
Обязательные учебные предметы:
- Математика
- Социальные науки (география, экономика, история и политология)
- Наука (физика, химия и биология)
- Язык 1 — английский
- Язык 2 — хинди (или региональный язык из 37 вариантов)
Факультативные учебные предметы:
- Выбор навыков
- Любой другой академический предмет по выбору, кроме обязательных предметов или языка 3
Предметы внутреннего оценивания в Co-scholastic областях:
- Здоровье и физическая культура (включая опыт работы)
- Художественное образование
Поскольку CBSE Class 9 интегрирован с CBSE Class 10, вам нужно выбрать только те предметы, которые вы хотите изучать, и продолжить обучение в 10 классе.
Учебный план
Вы можете найти подробную программу CBSE Class 9 по каждому предмету на официальном сайте CBSE. Имея представление о всей программе и весе, придаваемом каждой теме, вы сможете схематически подготовиться к экзаменам в 9 классе. Для получения дополнительной помощи обратитесь к Unacademy, ведущей онлайн-платформе обучения, которая предлагает актуальную и всеобъемлющую программу CBSE Class 9, чтобы помочь учащимся в их подготовке.
Учебная программа 9 класса CBSE по естественным наукам (включая биологию, физику и химию) разделена на пять разделов: «Наша окружающая среда», «Организация живого мира», «Еда»; Производство пищи, Материя – ее природа и поведение, Движение, сила и работа.
Языковые предметы 9-го класса направлены на улучшение коммуникативных навыков путем сосредоточения внимания на навыках говорения, письма, аудирования и чтения учащегося. Учебная программа хинди имеет два варианта: курс хинди A и курс хинди B. Оба варианта схожи с точки зрения программы, но имеют разную схему оценивания по единицам. На английском языке есть три раздела: «Навыки чтения», «Навыки письма с грамматикой» и «Учебник литературы и дополнительный текст для чтения».
Программа социальных наук для 9 класса (история, экономика, география и политология) состоит из четырех разделов: «Современная Индия», «Экономика», «Индия и современный мир» и «Демократическая политика».Эти модули позволяют вам исследовать различные концепции, включая культуру, конституционные нормы, социальные и межличностные взаимодействия и т. д.
Программа CBSE Class 9 по математике включает семь отдельных разделов: алгебра, геометрия, статистика и вероятность, системы счисления, координатная геометрия и измерение. Единицы всех этих предметов, упомянутых выше, имеют общий вес 80 баллов, а внутренняя оценка имеет 20 баллов.
Учебный материал CBSE класса 9
Доступ к нужным учебным материалам чрезвычайно важен для хорошей подготовки к экзаменам.В дополнение к книгам CBSE Class 9 учащиеся должны подготовить подробные заметки по главам и обратиться к решениям NCERT, дополнительным практическим вопросам, справочникам и т. д.
Когда у вас есть правильный учебный материал, вы можете повторять и практиковать его лучше. Платформа онлайн-обучения Unacademy также предоставляет учащимся учебные материалы CBSE Class 9. С их подпиской Plus или Iconic вы получаете множество подробных учебных материалов, включая конспекты лекций в формате PDF, викторины, пробные тесты, загружаемые видеоуроки и многое другое.
Шаблон бумаги для вопросов
Для CBSE класса 9 — наука
- Бумага будет 80 марок
- Вопросник будет разделен на три части – A, B и C с весом 20, 30 и 30 баллов соответственно. Всего будет 36 вопросов
- Раздел A будет содержать 20 вопросов объективного типа по 1 баллу за каждый
- Раздел B будет состоять из 10 вопросов по 3 балла каждый, которые входят в итоговую оценку
- Раздел C состоит из шести вопросов по 5 баллов каждый
.
Для CBSE Class 9 — Математика
- Оценка по математике будет 80 баллов
- Экзамен будет состоять из четырех разделов — Экзамен будет состоять из четырех разделов – разделов A, B, C и D, всего 40 вопросов, всего 40 вопросов
- В разделе A всего 20 вопросов объективного типа с очень короткими ответами (VSA).Каждый вопрос оценивается одним баллом
- Раздел B требует, чтобы вы ответили на 6 вопросов с короткими ответами по 2 балла за каждый
- Раздел C будет содержать вопросы с 3 баллами. Будет 8 вопросов с короткими ответами
- В разделе D вам нужно будет решить 6 вопросов типа «длинный ответ» по 4 балла за каждый
.
Для 9 класса CBSE — Общественные науки
- Бумага будет 80 марок
- В документе будет три разных раздела с именами A, B и C.Общее количество вопросов будет 35
- В первом разделе, то есть в разделе A, будет 20 вопросов объективного типа. В этом разделе будут различные типы вопросов, такие как соответствие столбцу, вопросы с несколькими вариантами ответов (MCQ), заполнение пробелов, вопросы с очень короткими ответами и т. д. Каждый вопрос будет иметь один балл
- Раздел B будет состоять из 8 вопросов с кратким ответом, за каждый из которых будет по 3 балла
- Раздел C будет содержать длинные вопросы по 5 баллов.Всего будет 6 вопросов. Помимо длинных вопросов, в этом разделе будет 2 вопроса о карте; один из географии, а другой из истории. Вопросы карты оцениваются по 3 балла каждый
.
Для CBSE класса 9 — английский язык
- Английская бумага будет стоить 80 марок
- Вопросник разделен на три части. Раздел A: Чтение, Раздел B: Навыки письма и контекстуальная грамматика и Раздел C: Учебник по литературе и дополнительный учебник для чтения
- В Разделе А будет в целом два вопроса — фактическое и дискурсивное прохождение.На основе фактического отрывка вам нужно будет ответить на 8 вопросов объективного типа (включая MCQ) по 1 баллу за каждый. В дискурсивном отрывке вам потребуется ответить на 4 вопроса типа «краткий ответ» по 2 балла каждый. Кроме того, в нем будет 4 вопроса объективного типа (включая MCQ), каждый из которых оценивается по 1 баллу
- Раздел B будет содержать два письменных вопроса на выбор. Эти вопросы оцениваются по 10 баллов каждый. Вопросы, основанные на грамматике, будут включать вопросы по редактированию/заполнению пропусков/переходу по 4 балла и вопросы по написанию диалогов/репортажу по 6 баллов каждый
- В Разделе C будет 2 вопроса с кратким ответом по 2 балла каждый.Также будет 5 вопросов с короткими ответами по 2 балла каждый. Наконец, вам нужно ответить на 2 вопроса с длинным ответом, каждый из которых имеет 8 баллов
.
.
Для 9 класса CBSE — хинди (курсы A и B)
- Обе работы будут по 80 баллов каждая
- Оба экзамена будут проходить по одному и тому же образцу — 14 вопросов, разделенных на четыре разных раздела, а именно: чтение, письмо, грамматика и литература
План обучения для CBSE Class 9
CBSE Class 9 следует двухсеместровой системе, т.е.э., существуют полугодовые и годовые экзамены. Из-за длинной учебной программы по различным предметам подготовка может показаться немного сложной. Тем не менее, хорошо продуманный учебный план поможет вам охватить больше тем с полным пониманием за меньшее время.
Чтобы обеспечить четкое понимание предмета 9 класса, вы должны разработать стратегию, которая даст вам достаточно времени для повторения. Повторение уроков выявит ваши сильные и слабые стороны, чтобы помочь вам лучше подготовиться к экзаменам. Кроме того, убедитесь, что вы ссылаетесь на учебники NCERT, поскольку на экзаменах CBSE Class 9 есть вопросы, в основном основанные на этих книгах.
Самообучение необходимо для CBSE Class 9. Тем не менее, если вы столкнетесь с проблемами и не сможете решить их самостоятельно, необходимо обратиться за советом к специалисту. Unacademy — идеальная онлайн-платформа для обучения, которая поможет вам в подготовке к экзамену. С интерактивными живыми классами вы получите полное представление обо всех концепциях. Кроме того, учащиеся могут мгновенно прояснить свои сомнения в чате.
Лучшие способы подготовки к CBSE Class 9
Вот несколько советов, которые помогут вам хорошо сдать экзамены 9 класса CBSE:
Составьте расписание и придерживайтесь его. — Крайне важно составить ежедневное расписание и выделить соответствующее время для всех предметов.Регулярное изучение гарантирует, что незавершенные темы не накапливаются и не вызывают у вас стресса перед экзаменами. Соблюдение расписания также делает вас более эффективным, и у вас будет достаточно времени для окончательной проверки перед экзаменами!
Ведение листа с важными ярлыками — Лист со списком основных методов и ярлыков всегда пригодится. Возьмите за привычку записывать ключевые формулы, положения, законы, химические реакции, определения и т. д. и тщательно их выучивать. Имея под рукой эти основы, вы повысите скорость решения вопросов и улучшите понимание сложных тем.
Практика и улучшение ваших слабых мест — Некоторые предметы, такие как математика и физика, требуют ежедневной практики. Учащиеся иногда склонны пролистывать формулы и теоремы или пытаться их прочитать и выучить. Однако это неэффективно в долгосрочной перспективе. Запись формул и теорем поможет вам укрепить понятия и облегчить их запоминание.
Позаботьтесь о своем здоровье. . Убедитесь, что ваше здоровье не подвергается опасности чрезмерно продолжительными занятиями и экзаменационным стрессом.Соблюдайте сбалансированную диету, ешьте через равные промежутки времени и находите время, чтобы подышать свежим воздухом вместе с учебой. Регулярные тренировки надолго сохранят вашу активность и спокойствие. Кроме того, спите не менее 6-8 часов каждый день, чтобы расслабить свой разум и помочь себе сконцентрироваться.
Книги, на которые следует ссылаться для CBSE Class 9
Наука
- Учебник NCERT IX
- Лабораторное руководство NCERT
- Серия «Наука для 9 класса» (физика, химия и биология) — Лахмир Сингх и Манджит Каур
- Примеры проблем NCERT, класс 9
- Базовая научная физика для класса 9 — H.К. Верма
Математика
- Учебник NCERT IX
- Математика для 9 класса — РД Шарма
- Класс 9 Математика — RS Aggarwal
- Образец NCERT IX
- Математика для 9 класса — Ратна Сагар
Социальные науки
- Социальные науки «Все в одном», класс 9 — эксперты Ариханта
- Вместе на пути к более безопасной Индии (часть 2) — CBSE
- Учебник обществознания — Д.Н. Кундра
- Учебники NCERT для 9 класса по общественным наукам
- Вместе с учебными материалами по обществознанию для 9 класса — Нармата Сингх и Анита Джейн
Английский
- Beehsive — Учебник для 9 класса — NCERT
- Слова и выражения 1 — NCERT
- Все в одном Английский язык и литература — Эксперты Ариханта
- Моменты — дополнительный считыватель класса 9 — NCERT
Курс хинди A
- Критика (Часть 1) — NCERT
- Кшитий (Часть 1) — NCERT
- Золотой хинди: (с образцами документов) Книга с отличием (курс A) — Кишан Хари
Курс хинди B
- Санчаян (Часть 1) — NCERT
- Спарш (Часть 1) — NCERT
Золотой хинди: (с образцами документов) Книга с отличием (курс B) — Кишан Хари
Лучший способ подготовиться к экзамену 9 класса CBSE
Экзамены
CBSE Class 9, хотя и не являются экзаменами на доску, все же могут быть сложными.Тем не менее, вы можете получить хорошие оценки, если хорошо подготовитесь. Вот несколько практических советов, которые помогут вам блестяще сдать экзамены:
Создайте учебную среду без отвлекающих факторов
Всегда занимайтесь в месте, свободном от шума и отвлекающих факторов. Снова и снова доказано, что спокойная учебная атмосфера способствует повышению производительности и эффективности.
Хорошо выспитесь перед экзаменом
Крайне важно дать отдых разуму накануне экзамена.Не пытайтесь заниматься поздно вечером, потому что на следующий день вы можете чувствовать себя измотанным и скучным, что может повлиять на вашу успеваемость. Выспитесь в ночь перед экзаменами, чтобы проснуться бодрым в день экзамена.
Проверь себя
Наряду с самообучением возьмите за привычку часто проводить самопроверку. Лучший способ оценить свою подготовку — это решить образцы заданий CBSE, практические задания и вопросы прошлого года. Вы даже можете установить таймер и попробовать решить образцы работ в отведенное время и оценить свою скорость.С помощью этой техники вы научитесь тайм-менеджменту. Решение практических работ также помогает вам понять значимость темы и дает четкое представление о типах вопросов, которые чаще всего задают на экзаменах.
Избегайте приготовлений в последнюю минуту
Будьте уверены в своей подготовке и не подвергайте себя лишнему стрессу в день экзамена. Воздержитесь от того, чтобы приносить учебный материал в экзаменационный зал для окончательной зубрежки. Это может оказать обратное влияние на ваш разум и вызвать замешательство.Сохраняйте спокойствие и пишите в расслабленном состоянии ума.
.
 сжимаемость
сжимаемость