Контрольно-измерительные материала по химии
Филиал ГБПОУ Дуванский многопрофильный колледж с. Малояз
Комплект контрольно-измерительных материалов
(для итоговой аттестации)
по учебной дисциплине
Химия
Малояз, 2016
СОДЕРЖАНИЕ
|
1 |
ПАСПОРТ КОМПЛЕКТА КИМ ПО УЧЕБНОЙ ДИСЦИПЛИНЕ …………………………………………. |
3 |
|
2 |
СТРУКТУРА И ПЕРЕЧЕНЬ КОНТРОЛЬНО-ИЗМЕРИТЕЛЬНЫХ МАТЕРИАЛОВ ДЛЯ ИТОГОВОЙ АТТЕСТАЦИИ ПО ДИСЦИПЛИНЕ …………………………………………. |
6 |
|
3 |
ПЕРЕЧЕНЬ МАТЕРИАЛОВ И ИНФОРМАЦИОННЫХ ИСТОЧНИКОВ ……………. |
10 |
1. ПАСПОРТ КОМПЛЕКТА ИЗМЕРИТЕЛЬНЫХ МАТЕРИАЛОВ ПО УЧЕБНОЙ ДИСЦИПЛИНЕ
1.1. Общие положения
Контрольно-измерительные материалы (КИМ) предназначены для контроля и оценки образовательных достижений обучающихся, освоивших программу учебной дисциплины «Химия».
Содержание современного курса химии тесно связано не только с задачей получения фундаментального естественно — научного образования, но и с задачей формирования представлений о химии как о необходимой для каждого человека составляющей общих знаний о мире и понимания значимости этой науки для общественного прогресса. Важной частью общей культуры является широкий набор знаний, которые человек активно использует в быту, в профессиональной деятельности, на протяжении всей жизни. Умение применять полученные теоретические знания на практике может служить критерием оценки уровня культурного развития человека. Поэтому одним из традиционных направлений в преподавании химии является освещение вопросов прикладной направленности. Прикладная направленность химии осуществляется с целью повышения качества химического образования обучающихся, применения их химических знаний к решению задач повседневной практики и в профессиональной деятельности.
течение двух семестров. Формой промежуточной аттестации после изучения является дифференцированный зачет.
-
Результаты освоения дисциплины, подлежащие проверке
В ходе аттестации по дисциплине осуществляется проверка следующих умений, знаний и формирования общих компетенций
|
Результаты обучения (умения, знания) |
Основные показатели оценки результатов |
|
У.1. Применять основные законы химии для решения задач в области профессиональной деятельности; У.2 Использовать свойства органических веществ, дисперсных и коллоидных систем для оптимизации технологических процессов; У.3 Описывать уравнениями химических реакций процессы, лежащие в основе производства пищевых продуктов; У.4 Проводить расчеты по химическим формулам и уравнениям реакций; У.5 Использовать химическую посуду и оборудование; У.6 Выбирать метод и ход химического анализа, подбирать реактивы и оборудование; У.7 Проводить качественные реакции на неорганические вещества и ионы, отдельные классы органических соединений; У.8 Выполнять количественные расчеты состава вещества по результатам измерений; У.9 Соблюдать правила техники безопасности при работе в химической лаборатории. |
— Обоснованное применение законов химии в профессиональной деятельности; — Способность оптимизировать технологические процессы, основываясь на свойствах веществ, дисперсных и коллоидных систем; — Способность представить химизм процесса производства пищевых продуктов с помощью уравнений реакций; — Достоверный результат расчета; — Использование химической посуды и оборудования по назначению; — Обоснованный выбор метода проведения химического анализа; — Способность выполнить качественный анализ; — Способность провести количественный анализ с получением достоверного результата; — Умение соблюдать правила техники безопасности при работе в химической лаборатории; |
|
З.1 Основные понятия и законы химии; З.2 Теоретические основы органической, физической и коллоидной химии; З.3 Понятия химической кинетики и катализа; З.4 Классификацию химических реакций и закономерности их протекания; З.5 Обратимые и необратимые химические реакции, химическое равновесие, химическое равновесие и его смещение под действием различных факторов; З.6 Окислительно-восстановительные реакции, реакции ионного обмена; З.7 Гидролиз солей, диссоциацию электролитов в водных растворах, понятие о сильных и слабых электролитах; З.8 Тепловой эффект химических реакций, термохимические уравнения; З.9 Характеристики различных классов органических соединений, входящих в состав сырья и готовой пищевой продукции; З.10 Свойства растворов и коллоидных систем высокомолекулярных соединений; З.11 Дисперсные и коллоидные системы пищевых производств; З.12. Роль и характеристики поверхностных явлений в природных и технологических процессах; З.13 Основы аналитической химии; З.14 Основные методы классического количественного и физико-химического анализа; З.15 Назначение и правила использования лабораторного оборудования и аппаратуры; З.16 Методы и технику выполнения химических анализов; З.17 Приемы безопасной работы в химической лаборатории. |
– Знание основных понятий и законов химии – Знание основ органической, физической и коллоидной химии; – Знание сущности химической кинетики и катализа, в т.ч. факторов на него влияющих; — Знание различных вариантов классификации химических реакций; — Знание сущности химического равновесия и условий его смещения; — Знание сущности окислительно-восстановительных и обменных процессов; — Знание сущности процесса гидролиза и факторов на него влияющих; — Знание основных понятий и законов термохимии; — Знание общей характеристики и особенностей органических соединений, входящих в состав сырья и готовой пищевой продукции; — Знание свойств растворов и коллоидных систем высокомолекулярных соединений; — Знание дисперсных и коллоидных систем пищевых производств; — Знание сущности поверхностных явлений и их роли в природных и технологических процессах; — Знание основ аналитической химии; — Знание основных приемов и методов количественного и физико-химического анализа; — Знание назначений и правил использования лабораторного оборудования и аппаратуры; — Знание методов и техники выполнения химических анализов; — Знание приёмов безопасной работы в химической лаборатории. |
1.3 Критерии оценки знаний и умений
Итоговый тест за курс основной общей школы
Итоговый тест содержит задания по основным темам курса химии: «Строение атома», «Периодический закон и периодическая система химических элементов Д.И. Менделеева», «Строение вещества», «Химические реакции», «Основные закономерности протекания химических реакций», «Растворы. Теория электролитической диссоциации», «Окислительно-восстановительные реакции», «Классификация веществ», «Основные классы неорганических и органических соединений».
Задания оцениваются в 1 балл. Максимальная сумма баллов — 20.
Баллы, полученные за правильно выполненные задания, переводятся в традиционные отметки по шкале:
«5» — 18-20 балла «4» — 15-17 балла,
«3» — 12-14 баллов «2» — 11 баллов и менее.
Вариант 1
1. Число электронов, которые содержатся в атоме углерода равно:
1) 6; 2) 12; 3) 8
2. Электронная формула атома 1s 22s 22p 63s 23p2 . Химический знак этого элемента:
1) C; 2) O; 3) Si
3. Радиусы атомов химических элементов в ряду: хлор, фосфор, алюминий, натрий:
1) увеличиваются; 2) уменьшаются; 3) не изменяются.
4. Химическая связь в молекуле воды:
1) ионная; 2) ковалентная полярная; 3) ковалентная неполярная.
5. Формулы кислотных оксидов:
1) CO2 и CaO; 2) CO2 и SO3; 3) K2O и Al2O3
6. Формула сероводородной кислоты: 1) h3S; 2) h3SO4; 3) h3SO3
7. К реакциям обмена относится:
1) CaO + h3O= Ca(OH)2;
2) Сu(OH)2= CuO + h3O;
3) KOH + HNO3= KNO3 + h3O
8. Электролиты, при диссоциации которых образуются катионы металла, и анионы кислотного остатка называются:
1) кислотами;
2) солями;
3) основаниями.
9. Какая степень окисления хрома в К2Сr2О7?
1) +6; 2) +3; 3) -3; 4) -6.
10. Присутствие в растворе кислоты можно доказать с помощью:
1) лакмуса;
2) фенолфталеина;
3) щелочи
11. Вещества с общей формулой CnH2n относятся к классу
1) алканов 2) алкенов 3) алкинов 4) аренов
12. Вещество, формула которого С2Н6 относится к классу
1) алканов 2) алкенов 3) алкинов 4) Аренов
13. Вещество, формула которого СН3 – СН2 – СН2 – СН3 является
1) алканом 2) алкеном 3) алкином 4) ареном
14. Вещество, формула которого СН2 = СН – СН – СН3 называется
СН3
1) 2-метилбутен-3 2) 2-метилбутин-3 3) 3-метилбутен-1 4) 3-метилбутин-1
15. Характерной химической реакцией для веществ, имеющих общую формулу СnH2n+2, является реакция
1) замещения 2) гидрирование 3) присоединение 4) дегидрирование
16.Укажите «лишнее» вещество в ряду:
1) 3 -метилбутаналь; 2) изопропанол;
3) метаналь; 4) ацетальдегид.
17. Дайте название соединению
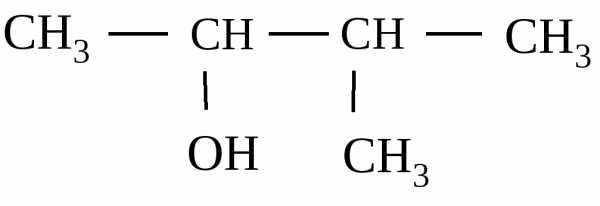
1) 3-метилбутанол-2; 2) 2-метилбутанол-3;
3) 3-метилпропанон-2; 4) 2-метилпропаналь-2.
18. Функциональная группа – СОН характерна для:
1) альдегидов; 2) сложных эфиров;
3) простых эфиров; 4) спиртов.
19. Вещество, относящееся к аминам, имеет формулу
1)С6Н5—NO2 2) С6Н5—Nh3
3)С6Н5—СН3 4) С6Н5—OH
20. Мономерами белков выступают:
1) аминокислоты; 2) моносахариды;
3) нуклеотиды; 4) остатки фосфорной кислоты.
Вариант 2
1. Число нейтронов, которые содержатся в атоме кислорода равно:
1) 6; 2) 12; 3) 8.
2. Формула высшего оксида элемента, электронная формула которого 1s 22s22p 63s 23p3 :
1) N2 O5 ; 2) P2 O5; 3) B2O3 .
3. Наиболее ярко выраженные неметаллические свойства проявляет:
1) фосфор; 2) сера; 3) кремний.
4. Формула вещества с ковалентной полярной связью:
1) h3O; 2) O2; 3) CaCl2
5. Формула основания и кислоты соответственно:
1) Ca(OH)2 и Be(OH)2 ;
2) NaOH и KHSO4;
3) Al(OH)3 и HNO3
6. Формула сульфита натрия:
1) Na2SO4; 2) Na2SO3; 3) Na2S
7. К реакциям замещения относится:
1) Ca + h3SO4= CaSO4 + h3;
2) Сu(OH)2= CuO + h3O;
3) KOH + HNO3= KNO3 + h3O
8. Электролиты, при диссоциации которых образуются катионы металла и гидроксид-ионы называются:
1) солями; 2) кислотами; 3) основаниями.
9. В ПСХЭМ в группе сверху вниз увеличивается:
1) металлические свойства; 2) сила высших кислот;
3) электроотрицательность атома; 4) неметаллические
10.Назовите элемент, электронная формула которого:
1s2, 2s2, 2p6, 3s2, 3p5
1) фосфор; 2) сера; 3) хлор; 4) кислород.
11. Для алканов характерна общая формула
1)Cnh3n 2)Cnh3n+2 3)Cnh3n-2 4)Cnh3n-6
12. К классу алкенов относится вещество с молекулярной формулой
1) С6Н10 2) С6Н6 3) С6Н12 4) С6Н14
13. Вещество, формула которого СН3 – С ≡ С – СН3 является
1) алканом 2) алкеном 3) алкином 4) ареном
14. Гомологом этана является
1) С2Н4 2) С2Н6 3) С3Н8 4) С3Н6
15. Укажите название соединения СН2 = СН — СН2 — СН2 — СН2 — СН3
1) 3,3-диметилбутин-1; 2) октин-1; 3) 3,3-диметилпентин-1; 4) гексен-1
16. Для алкенов характерна реакция
1) замещения 2) обмен 3) присоединения 4) дегидратации
17. Дайте название соединению:
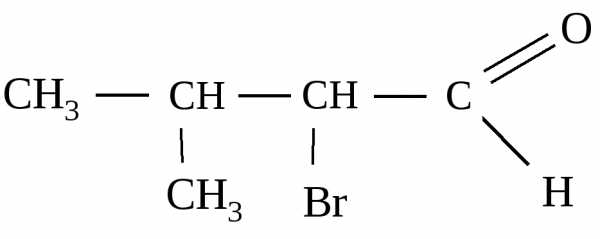
1) 2-метил-3-бромбутанол-1; 2) 2-бром-З-метилбутаналь;
3) 2-бром-З-метилпропаналь; 4) 2-метил-З-бромбутаналь.
18.Укажите «лишнее» вещество в ряду:
1) метанол; 2) этаналь; 3) пентанол; 4) бутиловый спирт.
19. Функциональная группа – СОО- характерна для
1) альдегидов; 2) сложных эфиров; 3) углеводов; 4) спиртов.
20. В состав белков может входить
1)пять аминокислот; 2) двадцать аминокислот;
3)десять аминокислот; 4) тридцать аминокислот
КЛЮЧИ К ДИФФЕРЕНЦИРОВАННОМУ ЗАЧЕТУ
|
В1 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
1 |
3 |
1 |
2 |
2 |
1 |
3 |
2 |
1 |
1 |
2 |
1 |
1 |
3 |
1 |
2 |
1 |
1 |
2 |
1 |
|
|
В2 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
3 |
2 |
2 |
1 |
3 |
2 |
1 |
3 |
1 |
3 |
2 |
3 |
3 |
3 |
4 |
3 |
2 |
2 |
2 |
|
Список использованной литературы
1. Габриелян О.С. Химия: учеб. для студ. проф. учеб. заведений / О.С. Габриелян, И.Г. Остроумов. – М., 2005.
2. Габриелян О.С. Химия в тестах, задачах, упражнениях: учеб. пособие для студ. сред. проф. учебных заведений / О.С. Габриелян, Г.Г. Лысова – М., 2006.
3. ПЕРЕЧЕНЬ МАТЕРИАЛОВ, ОБОРУДОВАНИЯ И ИНФОРМАЦИОННЫХ ИСТОЧНИКОВ
3.1 Рекомендуемая литература для разработки оценочных средств и подготовки обучающихся к аттестации
Габриелян О.С., Остроумов И.Г. Химия: — М.: Академия, 2010. – 257с.
Глинка Н.Л. Общая химия:- М.: Юрайт,2012. – 898с.
Харитонов Ю.Я. Аналитическая химия (аналитика). В 2кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа: Учеб. Для вузов. – 2-е изд., испр. – М.:Высш.шк., 2003. – 559с.: ил.
Физическая и коллоидная химия (в общественном питании): Учебное пособие/ С.В.Горбунцова, Э.А.Муллоярова, Е.С.Оробейко, Е.В.Федоренко. – М.: Альфа-М;ИНФРА-М, 2008. – 270с.: ил. – (Серия «Профиль»).
Белик В.В. Физическая и коллоидная химия: учебник для студ. сред. проф. учеб. заведений – 4-е изд., стер. – М.:Издательский центр «Академия», 2008. – 288 с.
Задачи и упражнения и упражнения по общей химии6 Учеб. пособие/ Б.И.Адамсон, О.Н.Гончарук, В.Н. Камышова и др.; Под ред. Н.В.Коровина. – 2-е изд., испр. – М.:Высш. шк., 2004. – 255 с.: ил.
xn--j1ahfl.xn--p1ai
Контрольно-измерительные материалы по химии
Итоговый тест содержит задания по основным темам курса химии: «Строение атома», «Периодический закон и периодическая система химических элементов Д.И. Менделеева», «Строение вещества», «Химические реакции», «Основные закономерности протекания химических реакций», «Растворы. Теория электролитической диссоциации», «Окислительно-восстановительные реакции», «Классификация веществ», «Основные классы неорганических и органических соединений».
Задания оцениваются в 1 балл. Максимальная сумма баллов — 20.
Баллы, полученные за правильно выполненные задания, переводятся в традиционные отметки по шкале:
«5» — 18-20 балла «4» — 15-17 балла,
«3» — 12-14 баллов «2» — 11 баллов и менее.
Вариант 1
1. Число электронов, которые содержатся в атоме углерода равно:
1) 6; 2) 12; 3) 8
2. Электронная формула атома 1s 22s 22p 63s 23p2 . Химический знак этого элемента:
1) C; 2) O; 3) Si
3. Радиусы атомов химических элементов в ряду: хлор, фосфор, алюминий, натрий:
1) увеличиваются; 2) уменьшаются; 3) не изменяются.
4. Химическая связь в молекуле воды:
1) ионная; 2) ковалентная полярная; 3) ковалентная неполярная.
5. Формулы кислотных оксидов:
1) CO2 и CaO; 2) CO2 и SO3; 3) K2O и Al2O3
6. Формула сероводородной кислоты: 1) H2S; 2) H2SO4; 3) H2SO3
7. К реакциям обмена относится:
1) CaO + H2O= Ca(OH)2;
2) Сu(OH)2= CuO + H2O;
3) KOH + HNO3= KNO3 + H2O
8. Электролиты, при диссоциации которых образуются катионы металла, и анионы кислотного остатка называются:
1) кислотами;
2) солями;
3) основаниями.
9. Какая степень окисления хрома в К2Сr2О7?
1) +6; 2) +3; 3) -3; 4) -6.
10. Присутствие в растворе кислоты можно доказать с помощью:
1) лакмуса;
2) фенолфталеина;
3) щелочи
11. Вещества с общей формулой CnH2n относятся к классу
1) алканов 2) алкенов 3) алкинов 4) аренов
12. Вещество, формула которого С2Н6 относится к классу
1) алканов 2) алкенов 3) алкинов 4) Аренов
13. Вещество, формула которого СН3 – СН2 – СН2 – СН3 является
1) алканом 2) алкеном 3) алкином 4) ареном
14. Вещество, формула которого СН2 = СН – СН – СН3 называется
СН3
1) 2-метилбутен-3 2) 2-метилбутин-3 3) 3-метилбутен-1 4) 3-метилбутин-1
15. Характерной химической реакцией для веществ, имеющих общую формулу СnH2n+2, является реакция
1) замещения 2) гидрирование 3) присоединение 4) дегидрирование
16.Укажите «лишнее» вещество в ряду:
1) 3 -метилбутаналь; 2) изопропанол;
3) метаналь; 4) ацетальдегид.
17. Дайте название соединению
1) 3-метилбутанол-2; 2) 2-метилбутанол-3;
3) 3-метилпропанон-2; 4) 2-метилпропаналь-2.
18. Функциональная группа – СОН характерна для:
1) альдегидов; 2) сложных эфиров;
3) простых эфиров; 4) спиртов.
19. Вещество, относящееся к аминам, имеет формулу
1)С6Н5—NO2 2) С6Н5—NH2
3)С6Н5—СН3 4) С6Н5—OH
20. Мономерами белков выступают:
1) аминокислоты; 2) моносахариды;
3) нуклеотиды; 4) остатки фосфорной кислоты.
Вариант 2
1. Число нейтронов, которые содержатся в атоме кислорода равно:
1) 6; 2) 12; 3) 8.
2. Формула высшего оксида элемента, электронная формула которого 1s 22s22p 63s 23p3 :
1) N2 O5 ; 2) P2 O5; 3) B2O3 .
3. Наиболее ярко выраженные неметаллические свойства проявляет:
1) фосфор; 2) сера; 3) кремний.
4. Формула вещества с ковалентной полярной связью:
1) H2O; 2) O2; 3) CaCl2
5. Формула основания и кислоты соответственно:
1) Ca(OH)2 и Be(OH)2 ;
2) NaOH и KHSO4;
3) Al(OH)3 и HNO3
6. Формула сульфита натрия:
1) Na2SO4; 2) Na2SO3; 3) Na2S
7. К реакциям замещения относится:
1) Ca + H2SO4= CaSO4 + H2;
2) Сu(OH)2= CuO + H2O;
3) KOH + HNO3= KNO3 + H2O
8. Электролиты, при диссоциации которых образуются катионы металла и гидроксид-ионы называются:
1) солями; 2) кислотами; 3) основаниями.
9. В ПСХЭМ в группе сверху вниз увеличивается:
1) металлические свойства; 2) сила высших кислот;
3) электроотрицательность атома; 4) неметаллические
10.Назовите элемент, электронная формула которого:
1s2, 2s2, 2p6, 3s2, 3p5
1) фосфор; 2) сера; 3) хлор; 4) кислород.
11. Для алканов характерна общая формула
1)CnH2n 2)CnH2n+2 3)CnH2n-2 4)CnH2n-6
12. К классу алкенов относится вещество с молекулярной формулой
1) С6Н10 2) С6Н6 3) С6Н12 4) С6Н14
13. Вещество, формула которого СН3 – С ≡ С – СН3 является
1) алканом 2) алкеном 3) алкином 4) ареном
14. Гомологом этана является
1) С2Н4 2) С2Н6 3) С3Н8 4) С3Н6
15. Укажите название соединения СН2 = СН — СН2 — СН2 — СН2 — СН3
1) 3,3-диметилбутин-1; 2) октин-1; 3) 3,3-диметилпентин-1; 4) гексен-1
16. Для алкенов характерна реакция
1) замещения 2) обмен 3) присоединения 4) дегидратации
17. Дайте название соединению:
1) 2-метил-3-бромбутанол-1; 2) 2-бром-З-метилбутаналь;
3) 2-бром-З-метилпропаналь; 4) 2-метил-З-бромбутаналь.
18.Укажите «лишнее» вещество в ряду:
1) метанол; 2) этаналь; 3) пентанол; 4) бутиловый спирт.
19. Функциональная группа – СОО- характерна для
1) альдегидов; 2) сложных эфиров; 3) углеводов; 4) спиртов.
20. В состав белков может входить
1)пять аминокислот; 2) двадцать аминокислот;
3)десять аминокислот; 4) тридцать аминокислот
КЛЮЧИ К ДИФФЕРЕНЦИРОВАННОМУ ЗАЧЕТУ
В1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
1
3
1
2
2
1
3
2
1
1
2
1
1
3
1
2
1
1
2
1
В2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
3
2
2
1
3
2
1
3
1
3
2
3
3
3
4
3
2
2
2
2
infourok.ru
Контрольно-измерительные материалы по химии
Бланк ответов для части II
I.
II.
ГОСУДАРСТВЕННОЕ АВТОНОМНОЕ ПРОФЕССИОНАЛЬНОЕ
ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ РЕСПУБЛИКИ БАШКОРТОСТАН
«СИБАЙСКИЙ МЕДИЦИНСКИЙ КОЛЛЕДЖ»
Рассмотрено и утверждено
на заседании ЦМК
ОГСЭ, ЕН и ОП дисциплин
Протокол № 1 зам. директора по учебной части
от «31» августа 2016 г.
Председатель ЦМК
___________М.Е.Малыгина
Специальность: 32.02.01
Сестринское дело
ОУД. 9 Химия
Тестовое задание
Вариант I
Утверждаю
Заведующий отделом по УР
_____________С.М.Утяшева
«31» августа 2016 г.
ЧАСТЬ I
1. Электроны атома фосфора, находящегося в основном состоянии, расположены на орбиталях так:
1) 5s25p5
2) 3s23p5
3) 3s23p3
4) 5s25p3
2.ВеществоSO3 –
1) кислотный оксид
2) основный оксид
3) амфотерный оксид
4) несолеобразующий оксид
3. Пептидная связь есть в веществе
1) R—C—O—CH—R
|| |
O NH2
2) R—CH2—N—R
|
H
3) R—C—O—NH2
||
O
4) R—C—N—R
|| |
O H
4. Коэффициент перед восстановителем в уравнении
AsH3 + AgNO3 + H2OH3AsO4 + Ag + HNO3 равен:
1) 1
2) 2
3) 3
4) 4
5. Укажите номер атома углерода, у которого происходит замещение атомов водорода при бромированиигексановой кислоты.
6. Азот проявляет степени окисления +3 и +5 в соединениях:
1) N2O5 и NH4OH;
2) KNO2 и N2O4;
3) N2O иCa(NO3)2;
4) N2O3 иNaNO3.
7. Газ и раствор вещества, в котором приобретает малиновую окраску фенолфталеин, образуется при взаимодействии:
1) воды с оксидом кальция;
2) цинка с соляной кислотой;
3) воды с натрием;
4) серной кислотой с сульфитом натрия.
8. Нейтральная среда в растворе аминокислоты, имеющей формулу
1) CH3—CH—COOH
|
NH2
2) CH2—CH2—CH—COOH
| |
NH2 NH2
3) HOOC—CH2—CH—COOH
|
NH2
4) CH3—CH—CH—COOH
| |
NH2 NH2
9. Тепловой эффект химической реакции не зависитот:
1) природы исходных веществ
2) промежуточных стадий получения веществ
3) агрегатного состояния исходных веществ
4) агрегатного состояния продуктов реакции
10. В каком ряду знаки химических элементов расположены в порядке увеличения атомных радиусов?
1) C N O F
2) Sr Ca Mg Be
3) Na Al P Cl
4) Si Al Mg Na
11.Обнаружить в растворе карбонат-ионы можно с помощью:
1) гидроксида натрия;
2) азотной кислоты;
3) хлорида калия;
4) лакмуса.
12.Для этилена ВЕРНЫ следующие утверждения
1. молекула содержит четыре атома углерода
2. является предельным углеводородом
3 .атомы углерода в молекуле соединены двойной связью
4. не вступает в реакцию присоединения
5. в результате термического разложения образуется углерод и водород
13.Многоатомными называют спирты, в молекуле которых
1) много атомов кислорода
2) много атомов углерода
3) две и более гидроксильных группы
4) две и более карбоксильных группы
14.Какой продукт преимущественно образуется при присоединении одной молекулы бромоводорода к бутадиену-1,3:
1) 3-бромбутен-1;
2) 4-бромбутен-1;
3) 1-бромбутен-2;
4) 3-бромбутен-2
15.Кальций и нитрат серебра можно использовать для осуществления реакций по схеме превращений:
1) KCl → CaCl2 → AgCl;
2) NaCl → AgCl → Ag;
3) CaCl2 → Cl2 → HCl;
4) HCl → CaCl2 → AgCl.
ЧАСТЬ II
1.К раствору силиката калия массой 20,53 г и массовой долей 15% прилили избыток раствора нитрата кальция. Вычислите массу образовавшегося осадка.
2. С помощью молекулярных и ионных уравнений реакций объясните, почему при сливании растворов хлорида алюминия и карбоната натрия выпадает студенистый неокрашенный осадок и выделяется газ.
ГОСУДАРСТВЕННОЕ АВТОНОМНОЕ ПРОФЕССИОНАЛЬНОЕ
ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ РЕСПУБЛИКИ БАШКОРТОСТАН
«СИБАЙСКИЙ МЕДИЦИНСКИЙ КОЛЛЕДЖ»
Рассмотрено и утверждено
на заседании ЦМК
ОГСЭ, ЕН и ОП дисциплин
Протокол № 1 зам. директора по учебной части
от «31» августа 2016 г.
Председатель ЦМК
___________М.Е.Малыгина
Специальность: 32.02.01
Сестринское дело
ОУД. 9 Химия
Тестовое задание
Вариант III
Утверждаю
Заведующий отделом по УР
_____________С.М.Утяшева
«31» августа 2016 г.
ЧАСТЬ I
1.Свежеосаждённый гидроксид меди(II) реагирует с
1) пропанолом-1
2) глицерином
3) этиловым спиртом
4) диэтиловым эфиром
2.Этанол не взаимодействует с:
1) Сu;
2) Nа;
3) НСl;
4) О2.
3.Среди перечисленных веществ: кислыми солями являются
А) NaHCO3
Б) HCOOK
В) (Nh5)2SO4
Г) KHSO3
Д) Na2HPO4
Е) Na3PO4
1) АГД 2) АВЕ 3) БДE 4) BДЕ
4.Окислительно-восстановительной не является реакция
1) 4KClO3 ⎯t⎯°→ KCl + 3KClO4
2) СаСО3 ⎯t⎯°→ CaO + CO2
3) Nh5NO3 ⎯t⎯°→ N2O + 2h3O
4) h3S ⎯t⎯°→ S + h3
5.Углеводом является вещество, формула которого:
1) C5 h20 O;
2) C6 h22 O2;
3) C12 h32 O11;
4) C6 h22;.
6.Валентность углерода в пропане равна:
1) 4;
2) 2;
3) 8;
4) 3.
7.Верны ли следующие суждения о соединениях металлов:
А. Степень окисления бериллия в высшем
оксиде равна +2.
Б. Оснóвные свойства оксида магния
выражены сильнее, чем у оксида алюминия.
верно только А
2)
верно только Б
3)
верны оба суждения
4)
оба суждения неверны
8.Химическое равновесие в системе
2HBr (г)— »h3 (г) + Br2 (г) – Q
сместится в сторону продуктов реакции при
1) повышении давления
2) повышении температуры
3) понижении давления
4) использовании катализатора
9.Диметиламин
1) твердое вещество
2) плохо растворим в воде
3) взаимодействует с серной кислотой
4) образуется при восстановлении нитросоединений
5) реагирует с бромметаном
6) горит на воздухе
10.Вещества СН2=СН–СН2–СН3 и СН3–СН=СН–СН3
являются изомерами:
1) углеродного скелета;
2) положения двойной связи;
3) оптическими изомерами.
11.Жир впервые (1854) синтезировал:
1) А.М.Бутлеров;
2) В.В.Марковников;
3) Н.Н.Зинин;
4) М.Бертло.
12.Сокращённому ионному уравнению
Н+ + ОН– = Н2О
соответствует взаимодействие
1) h3SO4 иNaOH
2) Cu(OH)2 иHCl
3) Nh5ClиKOH
4) HCl и HNO3
13. В отличие от фенола метанол
1) взаимодействует с растворами щелочей
2) вступает в реакции поликонденсации
3) взаимодействует с бромоводородом
4) при окислении образует формальдегид
5) вступает в реакции этерификации
6) реагирует с хлоридом железа (III)
14.Назовите жидкий галоген:
1)Хлор,
2) Йод,
3) Бром
4) калий
15. Теорию химического строения органических веществ сформулировал:
1) Н.Н.Зинин;
2) Ф.Велер;
3) А.М.Бутлеров;
4) Д.И.Менделеев
ЧАСТЬ II
1.Даны водные растворы: сульфида натрия, сероводорода, хлорида алюминия и хлора. Напишите уравнения четырех возможных реакций между этими веществами
2. Определите молекулярную формулу ацетиленового углеводорода, если молярная масса продукта его реакции с избытком бромоводорода в 4 раза больше, чем молярная масса исходного углеводорода.
ГОСУДАРСТВЕННОЕ АВТОНОМНОЕ ПРОФЕССИОНАЛЬНОЕ
ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ РЕСПУБЛИКИ БАШКОРТОСТАН
«СИБАЙСКИЙ МЕДИЦИНСКИЙ КОЛЛЕДЖ»
Рассмотрено и утверждено
на заседании ЦМК
ОГСЭ, ЕН и ОП дисциплин
Протокол № 1 зам. директора по учебной части
от «31» августа 2016 г.
Председатель ЦМК
___________М.Е.Малыгина
Специальность: 32.02.01
Сестринское дело
ОУД.9 Химия
Тестовое задание
Вариант II
Утверждаю
Заведующий отделом по УР
_____________С.М.Утяшева
«31» августа 2016 г.
ЧАСТЬ I
1.Раствор бромной воды обесцвечивается каждым из двух веществ: ..
1) метан, бутан
2) циклобутан , этан
3) этилен ,ацителен
4) пропин , пропан
2. В ряду химических элементов Si – P – S
1) уменьшается число протонов в ядре
2) уменьшается электроотрицательность
3) увеличивается число электронов во внешнем электронном слое
4) увеличивается радиус атомов
5) усиливаются неметаллические свойства
3.Водород вступает в реакцию с
1) сульфатом цинка (раствор)
2) оксидом меди (II)
3) аммиаком
4) водой
5) кислородом
4.Атомы азота и мышьяка имеют одинаковы
1) заряды ядер
2) формулы высших оксидов
3) атомные радиусы
4) значения электроотрицательности
5.Выберите уравнения реакций, в которых элемент углерод является окислителем.
1) C + 2h3 = Ch5
2) 2С + O2 = 2CO
3) CO2 + 2Mg = 2MgO + C
4) Ch5 + 2O2 = CO2 + 2h3O
5) C + 2h3SO4 = CO2 + 2h3O + 2SO2
6.Метан
1) является составной частью природного газа
2) относится к непредельным углеводородам
3) хорошо растворяется в воде
4) не реагирует с кислородом
5) вступает в реакцию с хлором
7.Какая из указанных солей подвергается гидролизу?
1) KCI
2) KI
3) KBr
4) KF
8.Ацетилен может взаимодействовать с..
1) Br2
2) CO
3) Н2 СО3
4) N2
9.При комнатной температуре с наибольшей скоростью происходит реакция между водой и …
1) Mn
2) Al
3) Fe
4) Na
10.В молекуле кислорода число общих электронных пар равно …
1) 1
2) 2
3) 3
4) 4
9)
10)
11.Кислород образуется при электролизе водного раствора …
1) хлорида рубидия
2) бромида натрия
3) нитрата калия
4) иодида лития
12.Установите соответствие между исходными веществами и продуктами реакции.
ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
A) Fe(OH)2 t → D 1) Fe(OH)3↓ + NaCl
Б) FeCl3 + NaOH → 2) Fe + h3O
В) h3SO4(р-р) + Fe →3) FeSO4 + h3↑
4) FeO + h3O
5) Fe2 (SO4)3 + h3↑
13.К s-элементам относится
1) углерод
2) сера
3) фтор
4) водород
14.Высшая степень окисления элемента, имеющего электронную формулу …3d34s2 равна …
1) +3
2) +5
3) +1
4)- 3
15.При взаимодействии гидроксида железа(II) с раствором серной кислоты образуются
1) FeSO4 и h3O
2) Fe2(SO4)3 и h3O
3) FeSO4 и h3
4) Fe2(SO4)3 иh3
ЧАСТЬ II
1.170 г раствора нитрата серебра смешали с избытком раствора хлорида натрия. Выпал осадок массой 8,61 г. Вычислите массовую долю соли в растворе нитрата серебра.
2.Напишитеуравненияреакций, спомощьюкоторых можно осуществить следующие превращения:
CuCl2 → X → Cu(NO3)2 → Cu
ГОСУДАРСТВЕННОЕ АВТОНОМНОЕ ПРОФЕССИОНАЛЬНОЕ
ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ РЕСПУБЛИКИ БАШКОРТОСТАН
«СИБАЙСКИЙ МЕДИЦИНСКИЙ КОЛЛЕДЖ»
Рассмотрено и утверждено
на заседании ЦМК
ОГСЭ, ЕН и ОП дисциплин
Протокол № 1 зам. директора по учебной части
от «31» августа 2016 г.
Председатель ЦМК
___________М.Е.Малыгина
Специальность: 32.02.01
Сестринское дело
ОУД.9 Химия
Тестовое задание
Вариант IV
Утверждаю
Заведующий отделом по УР
_____________С.М.Утяшева
«31» августа 2016 г.
ЧАСТЬ I
1.В какой последовательности восстанавливаются данные металлы при электролизе растворов их солей:
1) Au, Cu, Hg, Fe;
2) Fe, Cu, Au, Hg;
3) Fe, Cu, Hg, Au;
4) Au, Hg, Cu, Fe
2.Вещества бутан и изобутан являются:
а) изомерами;
б) антиподами;
в) аллотропными видоизменениями;
г) гомологами
3.Элемент проявляет в соединениях максимальную степень окисления +5. Какую электронную конфигурацию валентных электронов может иметь этот элемента в основном состоянии:
а) 2p5
б) 2s22p3
в) 3s23p5
г) 4s23d3
4.Какое из соединений кальция входит в состав земной коры?
а) Оксид;
б) нитрит;
в) карбид;
г) карбонат
5.Процессу высыхания стен, покрытых штукатуркой, приготовленной на основе гашеной извести, соответствует химическое уравнение:
1) Ca(OH)2 = CaO + H2O;
2) Ca(OH)2 + CO2 = CaCO3 + H2O;
3) CaO + H2O = Ca(OH)2;
4) CaO + CO2 = CaCO3.
6.В уравнении реакции, схема которой
KMnO4 + HCl ?KCl + MnCl2 + Cl2 + H2O
коэффициент перед формулой восстановителя равен:
1) 5;
2) 10;
3) 12;
4) 16.
7.Какое физическое свойство не является общим для всех металлов?
а) электропроводность;
б) теплопроводность;
в) твердое агрегатное состояние при стандартных условиях;
г) металлический блеск.
8.Свойство, присущее большинству органических веществ:
а) высокие температуры кипения и плавления;
б) высокая электропроводность;
в) горючесть;
г) большая плотность
9.Метиламин взаимодействует с:
1) пропаном
2) хлорметаном
3) кислородом
4) гидроксидом натрия
5) хлоридом калия
6) серной кислотой
10.Степень окисления фосфора в соединении Mg3P2:
а) +3
б) +2
в) -2
г) -3
11.Формальдегид не реагируетс:
1) Ag2O (Nh4 р-р)
2) O2
3) h3
4) СН3ОСН3
12.Изомером аминоэтана является:
а) аминометан;
б) диметиламин;
в) этиламин;
г) 2-аминопропан
13.Вещества с общей формулой СnН2nО могут относиться:
а) к простым и сложным эфирам;
б) альдегидам и кетонам;
в) карбоновым кислотам и альдегидам;
г) карбоновым кислотам и сложным эфирам
14.В ряду спиртов: метиловый, этиловый, пропиловый – температура кипения:
а) увеличивается;
б) уменьшатся;
в) не изменяется;
г) сначала увеличивается, затем уменьшается.
15.. Щавелевую кислоту из неорганических соединений впервые (1824) получил:
а) Ф.Велер;
б) Д.И.Менделеев;
в) А.М.Бутлеров;
г) Н.Н.Зинин.
ЧАСТЬ II
1.К раствору гидроксида натрия массой 1200 г прибавили 490 г 40%-ного раствора серной кислоты. Для нейтрализации получившегося раствора потребовалось 143 г кристаллической соды . Рассчитайте массу и массовую долю гидроксида натрия в исходном растворе.
2.Используя метод электронного баланса, составьте уравнение реакции
Na2SO3 + … +KOHK2MnO4 + … + H2O
Определите окислитель и восстановитель.
infourok.ru
Контрольно-измерительный материал по химии
Комплект
контрольно-измерительных материалов
по учебной дисциплине ОП.03. «Химия»
Содержание
-
Паспорт комплекта контрольно-измерительных материалов.
-
Формы контроля для освоения учебной дисциплины.
-
Материалы для текущего контроля.
-
Материалы для промежуточной аттестации.
1. Паспорт комплекта контрольно-измерительных материалов (КИМ)
Контрольно-измерительный материал по дисциплине ОП.03. «Химия» являются частью нормативно-методического обеспечения системы оценивания качества освоения студентами основной профессиональной образовательной программы среднего профессионального образования по специальностям 050141 Физическая культура, 050142 Адаптивная физическая культура и обеспечивают повышение качества образовательного процесса.
КИМы по дисциплине представляют собой совокупность контролирующих материалов, предназначенных для измерения уровня достижения обучающихся установленных результатов обучения. КИМы по дисциплине используются при проведении текущего контроля успеваемости и промежуточной аттестации обучающихся в форме дифференцированного зачета.
Структура контрольной работы
В работе выделены три части, которые различаются по содержанию и степени сложности включаемых в них заданий.
Часть А включает 14 заданий с выбором ответа, содержание которых в целом охватывает основные вопросы органической химии, изучаемые в 10 классе. Их обозначение в работе А 1, А 2, А 3… А 14 ( уровень сложности базовый). Выполнение этих заданий позволяет оценить подготовку учащихся на базовом уровне.
Часть В включает 6 заданий повышенной сложности с кратким свободным ответом. Их обозначение в работе В 1, В 2… В 6.
Часть С содержит 3 задания с развернутым свободным ответом (уровень сложности – высокий).
Распределение заданий работы по частям:
Части
работы
Число
заданий
Максимальный
первичный
балл
% максималь
ного первичного балла
Тип
заданий
1.
А
14
14
36
Задания с выбором ответа
2.
В
6
12
32
Задания с кратким ответом
3.
С
3
12
32
Задания с развернутым ответом
Итого: 23 38 100
Задания контрольной работы ориентированы на проверку элементов содержания трех содержательных блоков: «Вещество», «Химическая реакция», «Познание и применение веществ человеком». Распределение заданий по данным блокам проведено с учетом того, какой объем занимает содержание каждого из них в общей структуре курса органической химии, какое время отводится на изучение этого материала, а также со степенью трудности усвоения учащимися того или иного материала.
Кодификатор элементов содержания, используемый для составления КИМ.
код
блока
код
элемента
элементы содержания,
проверяемые заданиями КИМ
№
задания
3
3.1
Теория строения органических соединений: гомология и изомерия. Взаимное влияние атомов в молекулах.
А1, А6,А9 В4
3.2
Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал, функциональная группа.
А2,В2
3.3
Классификация органических веществ. Номенклатура.
А5, В6
3.4
Характерные химические свойства углеводородов.
А3, А4
3.5
Характерные химические свойства спиртов и фенолов.
А11
3.6
Характерные химические свойства альдегидов, кислот и эфиров.
А8, А14
3.7
Характерные химические свойства азотсодержащих орг. соединений: аминов и аминокислот.
А6, А13
3.8
Биологически важные вещества: жиры, белки, углеводы.
В3
3.9
Взаимосвязь орг. соединений.
С2
4.1
4.1.7
Основные способы получения углеводородов (лабораторные)
А7, А10
4.1.8
Основные способы получения кислородсодержащих соединений (лаб)
В5
4.2
4.2.2
Общие научные принципы хим. производства. Химическое загрязнение окружающей среды и его последствия.
А13
4.2.3
Природные источники углеводородов, их переработка.
А7
4.3
4.3.4
Расчеты теплового эффекта реакции.
А12
4.3.5
Расчеты массы, объема, количества вещества продуктов реакции, если одно из веществ имеет примеси.
В1, С3
4.3.7
Нахождение молекулярной формулы вещества
С1
Проверяемые виды деятельности:
-
Называть и определять вещества, их свойства, признаки и классификации веществ, типы реакций и др.
-
Составлять формулы веществ, уравнения химических реакций.
-
Характеризовать свойства и применение веществ.
-
Объяснять закономерности в изменении свойств веществ, сущности химических реакций.
-
Проводить вычисления по химическим формулам и уравнениям.
Время выполнения работы – 80 минут.
Система оценивания.
Верное выполнение каждого задания части А оценивается 1 баллом, части В –1-2 баллами. Задание части С имеет пять элементов содержания, каждый из которых оценивается в 1 балл, а задание в целом – в 5 баллов.
Оценка за выполнение работы определяется по пятибалльной шкале:
от 29 до 39 баллов – оценка 5,
от 20 до 28 баллов – оценка 4,
от 12 до 19 баллов – оценка 3,
менее 12 баллов – оценка 2.
Дополнительные материалы
-
Периодическая система химических элементов Д.И.Менделеева.
-
Таблица растворимости солей, кислот и оснований в воде.
-
Электрохимический ряд напряжений металлов.
-
Калькулятор.
Контрольная работа по органической химии (итоговая).
1 вариант
Инструкция для учащихся
Тест состоит из частей А, В и С. На его выполнение отводится 80 минут. Задания рекомендуется выполнять по порядку. Если задание не удается выполнить сразу, перейдите к следующему. Если останется время, вернитесь к пропущенным заданиям.
Часть А
К каждому заданию части А даны несколько ответов, из которых только один верный. Выберите верный, по Вашему мнению, ответ.
А1. Вещества, имеющие формулы СН3 – О – СН3 и СН3 – СН2 – ОН, являются
1) гомологами; 2) изомерами;
3) полимерами; 4) пептидами.
А2. Углеводород, в молекуле которого атомы углерода имеют sp3 гибридизацию
1) бутен-1; 2) бутан; 3) бутадиен-1,2; 4) бутин-1.
А3. Продуктом гидратации этилена является: 1) спирт; 2кислота;
3) альдегид; 4) алкан.
А4. Только в одну стадию может протекать гидрирование этого углеводорода:
1) бутадиен-1,3; 2) бутен-1; 3) бензол; 4) бутин-2.
А5. Количество атомов водорода в циклогексане:
1) 12; 2) 8; 3) 10; 4) 14.
А6. Реакция среды в водном растворе глицина: 1) нейтральная; 2) кислая; 3) соленая; 4) щелочная.
А7. В промышленности ароматические углеводороды получают из… 1) природного газа; 2) нефти; 3) остатков горных пород; 4) торфа.
А8. Уксусная кислота не вступает во взаимодействие с веществом
1) оксид кальция 3) медь
2) метанол 4) пищевая сода
А9. Ацетилен принадлежит к гомологическому ряду:
1) алканов; 2) алкинов; 3) аренов; 4) алкенов
А10. Полипропилен получают из вещества, формула которого
1) СН2 = СН2; 2) СН СН; 3) СН3 – СН2 – СН3; 4) СН2 = СН – СН3.
А11. К ядовитым веществам относится:
1) метанол; 2) этанол; 3) пропанол; 4) бутанол.
А12. При сгорании 3 моль метана по термохимическому уравнению
СН4 + 2О2 = СО2 + 2Н2О + 880 кДж выделилось:
1) 293,3 кДж; 2) 1760 кДж; 3) 2640 кДж; 4) 880 кДж.
А 13. Фенол нельзя использовать для получения
1) красителей 3) пищевых добавок
2) капрона 4) взрывчатых веществ
А 14. Формалин – это водный раствор
1) уксусного альдегида 3) муравьиного альдегида
2) уксусной кислоты 4) этилового спирта
Часть В
Ответом к заданиям этой части( В1-В5) является последовательность цифр или число, которые следует записать в бланк ответов №1 справа от номера соответствующего задания, начиная с первой клеточки. Каждую цифру и запятую в записи десятичной дроби пишите в отдельной клеточке в соответствии с приведенными в бланке образцами.
-
Объем газа, который выделится при гидролизе 6,4 г карбида кальция, равен _________ л (запишите число с точностью до десятых).
-
Установите соответствие между названием вещества и числом -связей в его молекуле.
Название вещества Число -связей в молекуле
1) этан а) ноль
2) бутадиен-1,3 б) одна
3) пропен-1 в) две
4) ацетилен г) три
д) четыре
-
Установить соответствие:
вещество нахождение в природе
1) Глюкоза а) в соке сахарной свеклы
2) Крахмал б) в зерне
3) Сахароза в) в виноградном сахаре
4) Целлюлоза г) в древесине
-
Число изомерных циклоалканов состава С5Н10 равно:
_____________________ (запишите целое число).
-
Установите соответствие между реагентами и типом реакции.
Реагенты Тип реакции
1) С2Н4+ О2 -> а) замещение
2) СН4 -> б) окисление
3) СН3СООН + КОН -> в) присоединение
4) СН4+ Cl2 -> г) обмена
д) разложение
-
Установите соответствие между названием вещества и его формулой.
Название вещества Формула
1) этан а) СН3-СН3
2) метанол б) СН3-ОН
3) пропановая кислота в) СН=СН
4) ацетилен г) СН3-СН2-СОН
д) СН3-СН2-СООН
Часть С
-
При сгорании углеводорода выделилось 0,22 г углекислого газа и 0,09 г паров воды. Плотность этого вещества по воздуху равна 1,45. Определите молекулярную формулу углеводорода.
-
Запишите реакции, соответствующие схеме:
карбид кальцияацетиленбензолхлорбензолтолуол2,4,6-трибромтолуол.
-
Какой объем оксида углерода (IV ) (н.у.) выделится при взаимодействии раствора, содержащего 2,3 г муравьиной кислоты с избытком карбоната кальция.
Ответы и решения. (1 вар)
С 3 Н6
1,12
Содержание верного ответа задания С 1 и указания по его оцениванию
Баллы
Элементы ответа:
-
Определена масса (количество) углерода: х=0,22*12/44=0,06 (г).
-
Определена масса (количество) водорода: у=0,09*2/18=0,01 (г).
-
Определено простейшее соотношение: х: у=0,06/12: 0,01/1=1:2
-
Определена Мr(CхНу)= 1,45*29 = 42.
-
Определена формула вещества: 42/14= 3 – С3Н6
Ответ правильный и полный, включает все названные выше элементы
5
Правильно записаны 4 элемента ответа
4
Правильно записаны 3 элемента ответа
3
Правильно записано 2 элемента ответа
2
Правильно записан 1 элемент ответа
1
Все элементы ответа записаны неверно
0
Содержание верного ответа задания С 2 и указания по его оцениванию
Баллы
Элементы ответа:
Приведены уравнения реакций, соответствующие схеме:
-
СаС2 +2H2O = C2H2 +Ca(OH)2
-
3C2H2 = C6H6
-
C6H6 + Cl2 = C6H5Cl + HCl
-
C6H5Cl + CH3Cl + Zn = C6H5CH3 + ZnCl2
-
C6H5CH3 + 3Br2 = C6H2Br3CH3 + 3HBr
Ответ правильный и полный, включает все названные выше элементы
5
Правильно записаны 4 уравнения реакций
4
Правильно записаны 3 уравнения реакций
3
Правильно записаны 2 уравнения реакций
2
Правильно записано 1 уравнение реакции
1
Все элементы ответа записаны неверно
0
Содержание верного ответа задания С 3. 3
Элементы ответа
Правильно записано уравнение химической реакции
CaCO3 + 2HCOOH = (HCOO)2Ca + H 2O 1
найдено количество вещества углекислого газа х=2,3*22,4:46 х=0,05моль 1
найден объем газа V= 0,05*22,4=1,12 (л) 1
Контрольная работа по органической химии (итоговая)
2вариант
Инструкция для учащихся
Тест состоит из частей А, В и С. На его выполнение отводится 80 минут. Задания рекомендуется выполнять по порядку. Если задание не удается выполнить сразу, перейдите к следующему. Если останется время, вернитесь к пропущенным заданиям.
Часть А
К каждому заданию части А даны несколько ответов, из которых только один верный. Выберите верный, по Вашему мнению, ответ.
А1. Изомером 2-метилбутена-1 является
1) бутен-1; 2) 2-метилпентен-1;
3) пентан; 4) пентен -1.
А2. В молекуле пропена гибридизация орбиталей атомов углерода:
1) sp2; 2) sp3; 3) sp; 4) sp3 и sp.
А3. Продуктом присоединения хлороводорода к этену является: 1) 2-хлорпропан; 2) 1-хлорэтан;
3) 2,2-дихлорпропан; 4) 1,1-дихлорэтан.
А4. С каждым из веществ: бромоводород, водород, вода – будет взаимодействовать:
1) пропан; 2) этен; 3) этан; 4) фенол.
А5. К соединениям, имеющим общую формулу СnH2n, относится
1) бензол; 2) гексен; 3) гексан; 4) гексин.
А6. К какому классу принадлежат белки: 1) сложные эфиры; 2) полинуклеотиды;
3) простые эфиры; 4) полиамиды.
А7. Промышленным способом получения углеводородов является: 1) гидрирование; 2) изомеризация; 3) гидролиз; 4) крекинг.
А8. Реакцию «серебряного зеркала» дает:
1) фенол; 2) муравьиная кислота
3) глицерин; 4) бензол
А9. Пропаналь принадлежит к гомологическому ряду:
1) фенолы; 2) сахариды; 3) амины; 4) альдегиды
А10. Полимер состава (СН2СН2)n получен из:
1) этилена; 2) этана; 3) бутана; 4) этина.
А11. К наркотическим веществам относится:
1) этанол; 2) пропанол; 3) метанол; 4) бутанол.
А12. В результате реакции, термохимическое уравнение которой
С2H5OH + 3O2 2CO2 + 3H2O + 1374 кДж,
выделилось 687 кДж теплоты. Количество вещества этанола равно
1) 0,5 моль; 2) 1 моль; 3) 1,5 моль; 4) 2 моль.
А13. Глицерин нельзя использовать для получения
1) взрывчатых веществ 3) лекарств
2) этилового спирта 4) кремов и мазей в парфюмерии
А14. Подсолнечное, льняное, хлопковое масла относятся к классу:
1) углеводы 3) жиры
2) белки 4) фенолы
Часть В
Ответом к заданиям этой части( В1-В5) является последовательность цифр или число, которые следует записать в бланк ответов №1 справа от номера соответствующего задания, начиная с первой клеточки. Каждую цифру и запятую в записи десятичной дроби пишите в отдельной клеточке в соответствии с приведенными в бланке образцами.
-
Масса циклогексана, полученная в результате взаимодействия 7,8г бензола с водородом равна _______г (запишите число с точностью до десятых).
-
Установите соответствие между названием вещества и классом соединений.
Название вещества Класс органических соединений
1) пропин а) альдегиды
2) этаналь б) алкины
3) толуол в) карбоновые кислоты
4) ацетилен г) арены
д) алкены
-
Уксусная кислота вступает в реакцию с:
А) соляной кислотой
Б) гидроксидом натрия
В) азотной кислотой
Г) оксидом кальция
Д) карбонатом натрия
Е) хлоридом меди (II)
Запишите перечень букв в алфавитном порядке без пробелов______________.
-
Число изомерных алкенов состава С4Н8 равно:
_____________________ (запишите целое число).
-
Установите соответствие между реагентами и типом реакции.
Реагенты Тип реакции
1) С2Н4+ Н2О а) галогенирование
2) С2Н2+ Н2 б) гидратация
3) 2СН3Сl + Zn в) гидрирование
4) С2Н4+ Cl2 г) гидрогалогенирование
д) синтез Вюрца.
-
Установить соответствие между функциональной группой и классом вещества:
функциональная группа класс вещества
1) – COOH а) спирты
2) – OH б) фенолы
3) – NH2 в) кетоны
4) – COH г) карбоновые кислоты
5) — C=O д) альдегиды
е) амины
Часть С
-
При сгорании углеводорода массой 11,4 г выделилось 35,2 г углекислого газа и 16,2 г паров воды. Плотность этого вещества по водороду равна 56. Определите молекулярную формулу вещества.
-
Запишите реакции, соответствующие схеме:
этанолэтилен1,2-дихлорэтанэтинбензолхлорбензол.
3. Какой объем водорода (н.у.) выделится при взаимодействии 0,1 моль этанола с избытком металлического натрия.
Ответы и решения. (2вар)
С8 Н16
1,12
Содержание верного ответа задания С 1 и указания по его оцениванию
Баллы
Элементы ответа:
-
Определена масса (количество) углерода: х=35,2*12/44=9,6 (г).
-
Определена масса (количество) водорода: у=16,2*2/18=1,8 (г).
-
Определено простейшее соотношение: х: у =9,6/12: 1,8/1=0,8:1,8 =1:2
-
Определена Мr(CхНу)= 56*2 = 112.
-
Определена формула вещества: 112/14= 8 – С8Н16
Ответ правильный и полный, включает все названные выше элементы
5
Правильно записаны 4 элемента ответа
4
Правильно записаны 3 элемента ответа
3
Правильно записано 2 элемента ответа
2
Правильно записан 1 элемент ответа
1
Все элементы ответа записаны неверно
0
Содержание верного ответа задания С 2 и указания по его оцениванию
Баллы
Элементы ответа:
Приведены уравнения реакций, соответствующие схеме:
-
С2Н5ОН = C2H4 + H2O
-
C2H4 + Cl2 = C2H4Cl2
-
C2H4Cl2 + 2NaOH = C2H2 + 2NaCl + 2Н2О
-
3C2H2 = C6H6
-
C6H6 + Сl2 = C6H5Сl + НСl
Ответ правильный и полный, включает все названные выше элементы
5
Правильно записаны 4 уравнения реакций
4
Правильно записаны 3 уравнения реакций
3
Правильно записаны 2 уравнения реакций
2
Правильно записано 1 уравнение реакции
1
Все элементы ответа записаны неверно
Содержание верного ответа задания С 3. 3
Правильно записано уравнение химической реакции
2C 2H 5OH +2Na =2C 2H 5ONa + H2 1
Найдено количество вещества водорода х = 0,1*1:2 =0,05 моль 1
Найден объем газа водорода V(H2 ) =0,05*22,4=1,12 (л) 1
0
infourok.ru
Контрольно – измерительные материалы по химии для учащихся 8 класса.
Тест 1. Сведения о строении атома химического элемента. Изотопы.
Вариант 1
А1. Каков заряд ядра атома магния?
1)+24
2)+12
3)+36
4)-12
А2. Определите элемент, если в его атоме 40 электронов.
1) алюминий
2) германий
3) цирконий
4) галлий
А3. Чему равняется количество протонов, нейтронов
и электронов в атоме фосфора?
1) 31 протон, 16 нейтронов, 31 электрон
2) 15 протонов, 15 нейтронов, 15 электронов
3) 15 протонов, 31 нейтрон, 15 электронов
4) 15 протонов, 16 нейтронов, 15 электронов
А4. Сколько нейтронов в атоме изотопа калия с массовым
числом 40?
1)19
2)40
3)21
4)59
В1. Установите соответствие.
А. Медь
Б. Сера
В. Кислород
Г. Алюминий
1) 13 протонов, 13 электронов, 14 нейтронов
2) 29 протонов, 29 электронов, 35 нейтронов
3) 16 протонов, 16 электронов, 16 нейтронов
4) 13 протонов, 13 электронов, 14 нейтронов
5) 8 протонов, 8 электронов, 16 нейтронов
6) 8 протонов, 8 электронов, 8 нейтронов
С1. В чем состоит сходство и отличие в составе атомов химического элемента углерода с массовыми числами 14, 12 и 15? Обоснуйте ответ.
Тест 1. Сведения о строении атома химического элемента. Изотопы.
Вариант 2
А1. Каков заряд ядра атома цинка?
1)-30
2)+65
3)+35
4)+30
А2. Определите элемент, если в его атоме 25 электронов.
1) титан
2) хром
3) марганец
4) бром
А3. Чему равняется количество протонов, нейтронов
и электронов в атоме кальция?
1) 20 протонов, 40 нейтронов, 20 электронов
2) 40 протонов, 20 нейтронов, 40 электронов
3) 20 протонов, 20 нейтронов, 20 электронов
4) 40 протонов, 40 нейтронов, 40 электронов
А4. Сколько нейтронов в атоме изотопа хлора с массовым
числом 37?
1)20
2)17
3)36
4)53
В1. Установите соответствие.
А. Аргон
Б. Бром
В. Азот
Г. Калий
1) 19 протонов, 19 электронов, 20 нейтронов
2) 7 протонов, 7 электронов, 14 нейтронов
3) 35 протонов, 35 электронов, 45 нейтронов
4) 40 протонов, 40 электронов, 19 нейтронов
5) 18 протонов, 18 электронов, 22 нейтрона
6) 7 протонов, 7 электронов, 7 нейтронов
С1. В чем состоит сходство и отличие в составе атомов химического элемента кислорода с массовыми числами 16, 18 и 17? Обоснуйте ответ.
Тест 2. Строение электронных оболочек атомов. Периодическая система химических элементов
Д.И. Менделеева.
Вариант 1
А1. Каков физический смысл порядкового номера химического элемента?
1) это число энергетических уровней в атоме
2) это заряд ядра атома
3) это относительная атомная масса
4) это число нейтронов в ядре
А2. Каков физический смысл номера периода таблицы
Д.И. Менделеева?
1) это заряд ядра атома
2) это число электронов на внешнем энергетическом
уровне атома
3) это число электронов в атоме
4) это число энергетических уровней в атоме
А3. Чему равно число электронов на внешнем энергетическом уровне атома?
1) порядковому номеру
2) номеру периода
3) номеру группы
4) числу нейтронов в ядре
А4. Почему свойства химических элементов периодически повторяются?
1) заряд ядра атома возрастает
2) атомная масса химического элемента возрастает
3) строение внешних энергетических уровней атомов
периодически повторяется
4) число энергетических уровней в атоме возрастает
А5. Укажите количество электронов на внешнем энергетическом уровне в атоме Сl.
1) 2 электрона
2) 5 электронов
3) 7 электронов
4) 17 электронов
В1. Установите соответствие.
Число энергетических уровней в атоме
Символ химического элемента
А. 1
Б. 2
В. 3
Г. 4
1)K
2)Н
3)Р
4)Сu
5)Не
6)Sr
7)С
8)Rb
9)Na
10)F
В2. Установите соответствие.
Число электронов на внешнем энергетическом уровне атома
Символ химического элемента
А. 7
Б. 4
В. 5
Г. 1
1)P
2)Sn
3)I
4)К
5)Si
6)As
7)Mn
8)F
9)H
10)Zr
С1. Электронная схема атома химического элемента 2e, 8e, 2e. Определите химический элемент, найдите в Периодической системе химических элементов Д.И. Менделеева сходный с ним по свойствам элемент и напишите его электронную схему строения атома. Назовите общие признаки строения атомов сходных химических элементов.
Тест 2. Строение электронных оболочек атомов. Периодическая система химических элементов
Д.И. Менделеева.
Вариант 2
А1. Каков физический смысл порядкового номера химического элемента?
1) это число нейтронов в атоме
2) это относительная атомная масса
3) это число энергетических уровней в атоме
4) это число протонов в ядре
А2. Каков физический смысл номера периода таблицы
Д.И. Менделеева?
1) это число электронов на внешнем энергетическом
уровне атома
2) это заряд ядра атома
3) это число энергетических уровней в атоме
4) это число электронов в атоме
А3. Чему равно число электронов на внешнем энергетическом уровне атома?
1) номеру группы
2) порядковому номеру
3) числу нейтронов в ядре
4) номеру периода
А4. Почему свойства химических элементов периодически повторяются?
1) число энергетических уровней в атоме возрастает
2) строение внешних энергетических уровней атомов
периодически повторяется
3) атомная масса химического элемента возрастает
4) заряд ядра атома возрастает
А5. Укажите количество электронов на внешнем энергетическом уровне в атоме N.
1) 7 электронов
2) 2 электрона
3) 3 электрона
4) 5 электронов
В1. Установите соответствие.
Число энергетических уровней в атоме
Символ химического элемента
А. 5
Б. 2
В. 3
Г. 4
1)Zn
2)I
3)Al
4)Br
5)Ag
6)Sr
7)Be
8)Rb
9)S
10)N
В2. Установите соответствие.
Число электронов на внешнем энергетическом уровне атома
Символ химического элемента
А. 6
Б. 3
В. 2
Г. 8
1)Al
2)S
3)Ca
4Ga
5)Te
6)As
7)Ba
8)Xe
9)He
10)Ar
С1. Электронная схема атома химического элемента 2e, 8e, 5e. Определите химический элемент, найдите в Периодической системе химических элементов Д.И. Менделеева сходный с ним по свойствам элемент и напишите его электронную схему строения атома. Назовите общие признаки строения атомов сходных химических элементов.
Тест 3. Химическая формула. Вычисления по химическим формулам.
Вариант 1
А1. В каком ряду расположены сложные вещества?
1)S, Аl, N2
2)СO2, Fе, Н2O
3)НNО3, СаО, РН3
4)Si, Р4, Fе2O3
А2. Каков количественный и качественный состав молекулы серной кислоты Н2SО4?
1) 1 атом водорода, 1 атом серы, 4 атома кислорода
2) 2 атома водорода, 1 атом углерода, 4 атома кислорода
3) 2 атома водорода, 1 атом серы, 4 атома кислорода
4) 2 атома кислорода, 1 атом серы, 4 атома водорода
А3. Какова относительная молекулярная масса молекулы С2Н2O4?
1)130
2)29
3)90
4)49
А4. Какое соединение обладает наибольшей относительной молекулярной массой?
1)МgO
2)ВаО
3)S
4)SгО
4)СаО
В1. Установите соответствие.
А. НВг
Б. С2Н2
В. РbО
Г. СS2,
1) 2 атома углерода и 2 атома водорода
2) 1 атом водорода и 1 атом бора
3) 1 атом свинца и 1 атом кислорода
4) 1 атом водорода и 1 атом брома
5) 1 атом серы и 2 атома углерода
6) 1 атом углерода и 2 атома серы
С1. Вычислите соотношение масс и массовые доли элементов в соединении К2СгО4. (хромат калия).
Тест 3. Химическая формула. Вычисления по химическим формулам.
Вариант 2
А1. В каком ряду расположены сложные вещества?
1)S, Аl, N2
2)СO2, Fе, Н2O
3)НNО3, СаО, РН3
4)Si, Р4, Fе2O3
А2. Каков количественный и качественный состав молекулы гидрокарбоната кальция Са(НСО3)2?
1) 1 атом водорода, 1 атом углерода, 3 атома кислорода,
1 атом кальция
2) 2 атома водорода, 1 атом углерода, 6 атомов кислорода, 1 атом калия
3) 2 атома водорода, 2 атома углерода, 6 атомов кислорода, 1 атом кальция
4) 5 атомов кислорода, 3 атома углерода, 3 атома водорода, 1 атом кальция
А3. Какова относительная молекулярная масса молекулы Н2СгO4?
1)117 2)118
3)101,5 4)69
А4. Какое соединение обладает наименьшей относительной молекулярной массой?
1)ТеО3 2)SеО3
3)SO3 4)РоO3
В1. Установите соответствие.
А.НСl
Б. С6Н10
В.NО
Г. РН3
1) 6 атомов серы и 10 атомов водорода
2) 1 атом водорода и 1 атом хлора
3) 1 атом фосфора и 3 атома водорода
4) 1 атом водорода и 1 атом хрома
5) 1 атом азота и 1 атом кислорода
6) 6 атомов углерода и 10 атомов водорода
С1. Вычислите соотношение масс и массовые доли элементов в соединении Na2SiO3 (силикат натрия).
Тест 4. Химическая связь.
Вариант 1
А1. Ионная химическая связь возникает в результате:
1) образования общих электронных пар
2) обобществления электронов внешнего энергетического уровня многих атомов
3) взаимного притяжения разноименно заряженных ионов
4) различия в электроотрицательности атомов
А2. Укажите пару химических элементов, между атомами которых может возникнуть ковалентная неполярная связь.
1) водород и фосфор
3) кислород и натрий
2) натрий и фтор
4) азот и азот
А3. Укажите формулу соединения с ковалентной полярной связью.
1)O3
2)КВr
3)СF4
4)Р4
А4. Какие частицы обусловливают такие свойства металлов, как пластичность, металлический блеск, электрическая проводимость, теплопроводность?
1) атомы
2) ионы
3) молекулы
4) обобществленные электроны (электронный газ)
В1. Установите соответствие.
Вид химической связи
Химическое соединение
А. Ковалентная неполярная связь
Б. Ионная связь
В. Ковалентная полярная связь
Г. Металлическая связь
1)N2O5
2)СаСl2
3)Zn
4)O3
5)К3Р
6)НF
С1. Составьте схему образования молекулы: а) NН3; б) СаF2.
Тест 4. Химическая связь.
Вариант 2
А1. В чем сходство ионной и ковалентной химических связей?
1) образование молекул веществ
2) образование общих электронных пар
3) частицы, возникающие в результате образования химической связи, приобретают завершенный внешний энергетический уровень и становятся более устойчивыми, чем атомы
4) различия в электроотрицательности атомов
А2. Укажите пару химических элементов, между атомами которых может возникнуть ковалентная неполярная связь.
1) водород и фосфор
2) кислород и кислород
3) натрий и фтор
4) азот и азот
А3. Укажите формулу соединения с ковалентной неполярной связью.
1)O3
2)КВг
3)СF4
4)РН3
А4. Для какого вида химической связи характерно обобществление электронов внешнего энергетического уровня многих атомов?
1) для ковалентной полярной
2) для ионной
3) для металлической
4) для ковалентной неполярной
В1. Установите соответствие.
Вид химической связи
Химическое соединение
А. Ковалентная неполярная связь
Б. Ионная связь
В. Ковалентная полярная связь
Г. Металлическая связь
1)МgСl2
2)Са
3)Zn
4)Вг2
5)Н2
6)НF
С1. Составьте схему образования молекулы: а) Н2S; б) МgО.
Тест 5. Бинарные соединения.
Вариант 1
А1. В каком ряду расположены формулы оксидов?
1) NН3, СuО, K2О
2) ОF2, СO2, Аl2O3
3) СаО, N2O5, СгO3
4) СS2, Р2O5, В2O3
А2. В каком соединении степень окисления хрома равна+6?
1) СгО3
2) Сг2S3
3) СгСl2
4) Сг
А3. Укажите летучее водородное соединение.
1) NаН
2) NН3
3) KOH
4) СаН2
А4. Какое соединение соответствует оксиду марганца (IV)?
1) МnО
2) МnO2
3) Мn2O7
4) МnСl2
В1. Установите соответствие.
Название вещества
Формула вещества
А. Сульфид железа (II)
Б. Нитрид кальция
В. Фторид кислорода (II)
Г. Гидрид натрия
1) NaH
2) Fе2S3
3) Са3N2
4) ОF2
5) FеS
6) CО
С1. Сравните количество атомов кислорода в оксиде железа (II) количеством вещества 1,5 моль и в оксиде железа (III) количеством вещества 0,5 моль. Ответ подтвердите вычислением.
Тест 5. Бинарные соединения.
Вариант 2
А1. В каком ряду расположены формулы оксидов?
1) NН3, СuО, K2О
2) ОF2, СH4, Аl2O3
3) СаО, N2O5, СгCl3
4) СO2, Р2O5, В2O3
А2. В каком соединении степень окисления серы равна+4?
1) SO3
2) Н2S
З) SСl4
4) S
А3. Укажите нелетучее водородное соединение.
1) НСl
2) Аl4С3
3) KOH
4) МgН2
А4. Какое соединение соответствует оксиду хлора (V)?
1) Сl2O
2) Сl2O3
3) Сl2O7
4) Сl2O5
В1. Установите соответствие.
Название вещества
Формула вещества
А. Хлорид олова (II)
Б. Оксид серы (VI)
В. Сульфид углерода (IV) Г. Гидрид алюминия
1) SO2
2) СS2
3) SnСl4
4) SO3
5) А1Н3
6) SnСl2
С1. Сравните количество атомов серы в сульфиде железа (II) количеством вещества 0,5 моль и в сульфиде железа (III) количеством вещества 0,5 моль. Ответ подтвердите вычислением.
Тест 6. Оксиды, основания, кислоты и соли.
Вариант 1
А1. Укажите формулу растворимого основания.
1) Сu(ОН)2
2) Аl(ОН)3
3) Ва(ОН)2
4) Fе(ОН)2
А2. Укажите формулу бескислородной кислоты.
1) НСlO
2) Н2SO3
3) HCN
4) Н3РO4
А3. Укажите формулу сульфита натрия.
1) Nа3S
2) Nа2SO4
3) Nа2S4
4) Nа2SO3
А4. Укажите формулу оксида марганца (VII).
1) МnО
2) Мn2O7
3) МnO2
4) Мn2O3
В1. Установите соответствие.
Название кислоты
Формула кислоты
А. Серная
Б. Кремниевая
В. Азотная
Г. Хлороводородная
1) НСl
2) НNO3
3) Н2SО4
4) НNO2
5) Н2S
6) Н2SiO3
С1. а) Дайте характеристику ортофосфорной кислоты по плану: формула, наличие кислорода, основность, растворимость, степени окисления элементов, образующих кислоту, заряд иона кислотного остатка, соответствующий оксид, молярная масса;
б) вычислите количество вещества, соответствующее 19,6 г ортофосфорной кислоты.
Тест 6. Оксиды, основания, кислоты и соли.
Вариант 2
А1. Укажите формулу нерастворимого основания.
1) Сa(ОН)2
2) Аl(ОН)3
3) Ва(ОН)2
4) KОН
А2. Укажите формулу кислородсодержащей кислоты.
1) НСlO
2) Н2S
3) HCN
4) НBr
A3. Укажите формулу карбоната кальция.
1) CaCO3
2) Ca(HCO3)2
3) CaSO3
4) CaSiO3
А4. Укажите формулу оксида хлора (I).
1) Cl2O3
infourok.ru
ГДЗ по химии за 11 класс контрольно-измерительные материалы Стрельникова Е.Н., Троегубова Н.П.
GDZ.RU
-
1 класс
- Математика
- Английский язык
- Русский язык
- Информатика
- Музыка
- Литература
- Окружающий мир
- Человек и мир
-
2 класс
- Математика
- Английский язык
- Русский язык
- Немецкий язык
- Белорусский язык
- Информатика
- Музыка
- Литература
- Окружающий мир
- Человек и мир
-
3 класс
- Математика
- Английский язык
- Русский язык
- Немецкий язык
- Белорусский язык
- Информатика
- Музыка
- Литература
- Окружающий мир
- Человек и мир
- Испанский язык
-
4 класс
- Математика
- Английский язык
- Русский язык
- Немецкий язык
- Информатика
- Музыка
- Литература
- Окружающий мир
- Человек и мир
- Испанский язык
gdz.ru
Контрольно-измерительные материалы по химии
Государственное профессиональное образовательное
автономное учреждение
Амурской области
«Райчихинский индустриальный техникум»
Комплект контрольно-оценочных средств
по учебной дисциплине
БД.06 Химия___
основной профессиональной образовательной программы (ОПОП) по специальности СПО
13.02.06 Релейная защита и автоматизация электроэнергетических систем
21.02.15 Открытые горные работы
Комплект КОС рассмотрен на заседании цикловой комиссии
протокол № от 201 года
пред. ЦК_______________________________
Рекомендован методическим советом РИТ
протокол № от 201 года
______________________________
Общие положения
Результатом освоения учебной дисциплины являются освоенные умения и усвоенные знания, направленные на формирование общих и профессиональных компетенций.
Формой аттестации по учебной дисциплине является зачет в 1 семестре, экзамен во 2-ом.
Итогом экзамена является качественная оценка в баллах от 2-х до 5-ти.
Раздел 1. Результаты освоения учебной дисциплины, подлежащие проверке
1.1. Освоенные умения
В результате контроля и оценки по учебной дисциплине осуществляется комплексная проверка следующих умений:
уметь:
У 1. выполнять расчетные задачи;
У 2. пользоваться лабораторной посудой и оборудованием;
У 3. определять характер химических связей, степень окисления;
У. 4 составлять уравнения химической реакции;
1.2.: Усвоенные знания
В результате контроля и оценки по учебной дисциплине осуществляется проверка следующих знаний:
знать:
З 1. формулировки основных законов химии;
З 2. формулировку периодического закона;
З 3. виды химической связи;
З 4. виды химической связи;
З 5. теорию электролитической диссоциации;
З 6. положение металлов и неметаллов в периодической системе;
З 7. основные положения теории химического строения органических веществ;
З 8. общую формулу алконов, алкенов, алкинов, алкадиенов, Аренов и других органических кислот и соединений. Гомологический ряд и виды изомерии.
Раздел 2. Формы контроля и оценивания по учебной дисциплине
Таблица 1
Раздел / тема учебной дисциплины
Форма текущего контроля и оценивания
Раздел 1. Общая неорганическая химия
К/р(1)
Раздел 2. Органическая химия
К/р № (2)
УД (в целом): зачет
УД (в целом): экзамен
Раздел 3. Оценка освоения учебной дисциплины
3.1. Общие положения
Основной целью оценки освоения учебной дисциплины является оценка освоенных умений и усвоенных знаний.
Оценка учебной дисциплины предусматривает использование накопительной системы оценивания. _______________________________________________________
3.2. Экзамен
Типовые задания для оценки освоения разделов / тем учебной дисциплины
1) Типовые задания для оценки освоения раздела 1
Раздел 1. Общая неорганическая химия
ИТОГОВАЯ КОНТРОЛЬНАЯ РАБОТА ПО ТЕМЕ: «ОБЩАЯ ХИМИЯ»
Вариант 1
ЧАСТЬ А. Тестовые задания с выбором ответа
1. (2 балла). Электронная конфигурация атома химического элемента Э, высший оксид которого соответствует формуле ЭО2:
А. …3s23p63d104s24p2
Б. …3s23p63d104s24p5
В. …3s23p63d104s24p3
Г. …3s23p63d104s24p4
2. (2 балла). Укажите соединение, в котором ковалентные связи неполярные:
А. SiH4
Б. Fe2O3
В. I2
Г. SO3
3. (2 балла). Вещества с металлической кристаллической решеткой:
А. летучие
Б. растворимы в воде
В. проводят электрический ток
Г. обладают низкой тепло и электропроводностью
4. (2 балла). К 80 г 10% раствора добавили 20 г воды. Массовая доля полученного раствора равна:
А. 40%
Б. 8%
В. 10%
Г. 25%
5. (2 балла). Окислителем в химической реакции, протекающей в водном растворе согласно уравнению
Fe + CuCl2 → Cu + FeCl2 является:
0
А. Cu
+2
Б. Cu
0
В. Fe
+2
Г. Fe
6. (2 балла). Химическое равновесие реакции, уравнение которой 2CO(г) + O2 ↔ 2CO2(г) + Q
сместится в сторону продуктов реакции в случае:
А. применения катализатора
Б. увеличения температуры
В. увеличения давления
Г. уменьшения концентрации О2
7. (2 балла). В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
А. Rb, K, Na, Li
Б. Be, Mg, Ca, Sr
В. In, Ga, Al, B
Г. Sr, Ga, Si, C
8. (2 балла). Для получения 56 л (н.у.) углекислого газа, согласно уравнению реакции
CaCO3(тв) = CaO(тв) + CO2(г) – 180 кДж необходимо затратить теплоту в количестве:
А. 90 кДж
Б. 180 кДж
В. 450 кДж
Г. 540 кДж
9. (2 балла). Сокращенное ионное уравнение SiO32- + 2H+ → H2SiO3↓ соответствует взаимодействию:
А. оксида кремния (IV) с водой
Б. оксида кремния (IV) с серной кислотой
В. силиката натрия с серной кислотой
Г. силиката кальция с серной кислотой
10. (2 балла). Степень окисления азота в сульфате аммония равна:
А. -3
Б. -1
В. +1
Г. +3
ЧАСТЬ Б. Задания со свободным ответом.
11. (3 балла). На основании положения в ПСХЭ расположите элементы: бериллий, бор, магний, натрий – в порядке возрастания восстановительных свойств. Объясните ответ.
12. (8 баллов). Расставьте коэффициенты методом электронного баланса.
K2Cr2O7 + H2S + H2SO4 → Cr2(SO4)3 + K2SO4 + S + H2O
Укажите окислитель и восстановитель, процессы окисления и восстановления.
13. (5 баллов). Составьте уравнение химической реакции ионного обмена между сульфатом хрома (III)
и гидроксидом натрия. Сделайте вывод об обратимости этой реакции.
14. (8 баллов). Вычислите объем водорода (н.у.), который может быть получен при растворении в воде 11,5 г натрия, содержащего 2% примесей, если выход составляет 95% от теоретически возможного.
15. (6 баллов). Смешали 150 г 10% и 300 г 25% раствора. Вычислите массовую долю полученного раствора.
ИТОГОВАЯ КОНТРОЛЬНАЯ РАБОТА ПО ТЕМЕ: «ОБЩАЯ ХИМИЯ»
Вариант 2
ЧАСТЬ А. Тестовые задания с выбором ответа
1. (2 балла). Электронная конфигурация атома химического элемента Э, высший оксид которого соответствует формуле ЭО3:
А. …3s23p63d104s24p2
Б. …3s23p63d104s24p5
В. …3s23p63d104s24p3
Г. …3s23p63d104s24p4
2. (2 балла). Укажите соединение, в котором все связи ковалентные полярные:
А. Na2SO4
Б. NH4Cl
В. CaCl2
Г. MgCO3
3. (2 балла). Вещества только немолекулярного строения расположены в ряду:
А. S8, O2(г), лед
Б. Fe, NaCl(тв), алмаз
В. CO2(г), N2(тв), Al
Г. графит, Na2CO3(тв), I2
4. (2 балла). Из 80 г 10% раствора выпарили 30 г воды. Массовая доля полученного раствора равна:
А. 40%
Б. 37%
В. 72%
Г. 16%
5. (2 балла). Окислителем в химической реакции CuO + H2 → Cu + H2O является:
0
А. H2
+2
Б. Cu
-2
В. O
0
Г. Cu
6. (2 балла). В каком случае увеличение давления вызовет смещение равновесия влево:
А. CO2(г) + C → 2CO(г)
Б. CO(г) + Cl2(г) → COCl2(г)
В. 2CO(г) + O2(г) → 2CO2(г)
Г. C + O2(г) → CO2(г)
7. (2 балла). Окислительные свойства элементов усиливаются в ряду:
А. F, Cl, Br, I
Б. F, O, N, C
В. I, Br, Cl, F
Г. Cl, S, P, Si
8. (2 балла). Известно термохимическое уравнение реакции горения метана CH4 + 2O2 → CO2 + 2H2O + 896 кДж.
Какое количество вещества метана расходуется при выделении 89,6 кДж теплоты?
А. 0,1 моль
Б. 0,2 моль
В. 0,25 моль
Г. 0,5 моль
9. (2 балла). Сокращенное ионное уравнение SO32- + 2H+ → SO2 + H2O соответствует взаимодействию:
А. оксида серы (VI) и воды
Б. оксида серы (VI) и азотной кислоты
В. сульфита натрия и азотной кислоты
Г. сульфата натрия и водорода
10. (2 балла). Степень окисления хрома в соединении K2Cr2O7 равна:
А. +2
Б. +3
В. +6
Г. +7
ЧАСТЬ Б. Задания со свободным ответом.
11. (3 балла). На основании положения в ПСХЭ расположите элементы: германий, мышьяк, сера, фосфор – в порядке убывания окислительных свойств. Объясните ответ.
12. (8 баллов). Расставьте коэффициенты методом электронного баланса.
K2Cr2O7 + H2S + H2SO4 → Cr2(SO4)3 + K2SO4 + S + H2O
Укажите окислитель и восстановитель, процессы окисления и восстановления.
13. (5 баллов). Составьте уравнение химической реакции ионного обмена между сульфитом натрия
и фосфорной кислотой. Сделайте вывод об обратимости этой реакции.
14. (8 баллов). Какой объем водорода (н.у.) выделится при взаимодействии 730 г 30% раствора соляной кислоты с необходимым по реакции количеством вещества цинка? Какое это количество?
15. (6 баллов). Смешали 200 г 10% и 300 г 20% раствора. Вычислите массовую долю полученного раствора.
ИТОГОВАЯ КОНТРОЛЬНАЯ РАБОТА ПО ТЕМЕ: «ОБЩАЯ ХИМИЯ»
Вариант 3
ЧАСТЬ А. Тестовые задания с выбором ответа
1. (2 балла). Электронная конфигурация атома химического элемента Э, высший оксид которого соответствует формуле Э2О5:
А. …3s23p63d104s24p2
Б. …3s23p63d104s24p5
В. …3s23p63d104s24p3
Г. …3s23p63d104s24p4
2. (2 балла). Соединения с ковалентной неполярной связью расположены в ряду:
А. O2, Cl2, H2
Б. HСl, N2, F2
В. O3, P4, H2O
Г. NH3, S8, NaF
3. (2 балла). Атомную кристаллическую решетку имеют все соединения ряда:
А. алмаз, графит,
оксид кремния
Б. оксид углерода, оксид кремния, белый фосфор
В. красный фосфор, азот(тв.), йод(тв.)
Г. оксид фосфора (V),
оксид азота (II), алмаз
4. (2 балла). К 180 г 20% раствора добавили 20 г воды. Массовая доля полученного раствора равна:
А. 18%
Б. 20%
В. 10%
Г. 25%
5. (2 балла). Окислителем в химической реакции 2AgNO3 + Cu → Cu(NO3)2 + 2Ag является:
0
А. Ag
+1
Б. Ag
+2
В. Cu
0
Г. Cu
6. (2 балла). Химическое равновесие процесса N2+O2 ↔ 2NO — Q не изменится при:
А. повышении температуры
Б. понижении температуры
В. повышении концентрации азота
Г. повышении давления
7. (2 балла). В каком ряду галогены расположены в порядке увеличения их неметаллических свойств:
А. F, Cl, Br, I
Б. I, Br, Cl, F
В. I, Cl, Br, F
Г. F, Br, Cl, I
8. (2 балла). Согласно уравнению реакции 2CO(г) + O2(г) = 2CO2(г) + 566 кДж
при сжигании оксида углерода (II) выделилось 152 кДж теплоты. Объем (н.у.) сгоревшего газа составил:
А. 6 л
Б. 12 л
В. 44,8 л
Г. 120 л
9. (2 балла). Сокращенное ионное уравнение Cu2+ + 2OH— → Cu(OH)2 соответствует взаимодействию:
А. сульфата меди (II) и гидроксида калия Б. сульфида меди (II) и гидроксида натрия
В. хлорида меди (II) и гидроксида магния Г. нитрата меди (II) и гидроксида железа (II)
10. (2 балла). Степень окисления хлорa в соединении NaClO равна:
А. -1
Б. +1
В. +3
Г. +5
ЧАСТЬ Б. Задания со свободным ответом.
11. (3 балла). На основании положения в ПСХЭ расположите элементы: бериллий, бор, магний, натрий – в порядке возрастания восстановительных свойств. Объясните ответ.
12. (8 баллов). Расставьте коэффициенты методом электронного баланса.
KNO2 + KMnO4 + H2O → MnO2 + KNO3 + KOH
Укажите окислитель и восстановитель, процессы окисления и восстановления.
13. (5 баллов). Составьте уравнение химической реакции ионного обмена между хлоридом алюминия и гидроксидом натрия. Сделайте вывод об обратимости этой реакции.
14. (8 баллов). Какой объем водорода (н.у.) потребуется для взаимодействия с оксидом железа () массой 640 кг, содержащего 25% примесей? Какое количество вещества воды при этом образуется?
15. (6 баллов). Смешали 250 г 15% и 300 г 20% раствора. Вычислите массовую долю полученного раствора.
ИТОГОВАЯ КОНТРОЛЬНАЯ РАБОТА ПО ТЕМЕ: «ОБЩАЯ ХИМИЯ»
Вариант 4
ЧАСТЬ А. Тестовые задания с выбором ответа
1. (2 балла). Электронная конфигурация атома химического элемента Э, высший оксид которого соответствует формуле Э2О7:
А. …3s23p63d104s24p2
Б. …3s23p63d104s24p5
В. …3s23p63d104s24p3
Г. …3s23p63d104s24p4
2. (2 балла). Укажите соединение, в котором ковалентные связи неполярные:
А. PCl3
Б. CO
В. Na2O2
Г. P4
3. (2 балла). Вещества с какой кристаллической решеткой более других электропроводны:
А. металлической
Б. ионной
В. ковалентной полярной
Г. атомной
4. (2 балла). К 400 г 10% раствора добавили 100 г соли. Массовая доля полученного раствора равна:
А. 40%
Б. 8%
В. 80%
Г. 25%
5. (2 балла). Окислителем в химической реакции CuO + CO → Cu + CO2 является:
+2
А. C
+4
Б. C
+2
В. Cu
0
Г. Cu
6. (2 балла). Химическое равновесие процесса CO2 + C ↔ 2CO — Q смещается в сторону продуктов реакции при одновременном:
А. понижении температуры и давления
Б. повышении давления и понижении температуры
infourok.ru