ГДЗ по Химии 9 класс: Габриелян. Учебник. Решебник.
ГДЗ по химии за 9 класс Габриелян – это решебник или сборник готовых домашних заданий, решенных примеров и задач, рассчитанных уравнений реакции. Он составлена на базе учебного пособия по химии для восьмиклассников, составленного заслуженным ученым России – Габриеляном О.С.
ГДЗ по химии от Габриеляна для 9 класса – основа качественного выполнения домашнего задания
Готовые домашние задания по химии предназначены для родителей, которые стремиться помочь девятиклассникам в выполнении упражнений. Они также помогут и школьникам, не сумевшим разобраться в уравнениях реакции в классе. Более того, ребенок может проверить выполненную домашнюю работу на базе решебника по химии за 9 класс Габриелян.
Среди многочисленных сайтов ГДЗ, представленных в Рунете, наш ресурс обладает спектром значимых преимуществ:
- Найти нужный ответ можно очень быстро – достаточно вбить в строку поиска номер задачи или выдержку из ее условия;
- Пользоваться базой данных ресурса можно с ноутбука, телефона, планшета.

Возможность поиска нужного ответа на базе интеллектуального поиска весьма удобна: в разных редакциях учебника Габриеляна по химии нумерация задач может иметь некоторые расхождения.
Самые актуальные версии онлайн-ответов позволяют не только следовать алгоритму выполнения домашних упражнений, но и уяснить особенности правильного оформления заданий.
Решебник по учебнику химии 9 класса: Габриелян О.С. 2014 года выпуска
Программа общеобразовательных школ России базируется на использовании в 9 классе учебника по химии Габриеляна, которая ныне представлена во втором издании, выпущенном в 2014 году издательством «Дрофа».
Учебное пособие состоит из 42 параграфов, которые знакомят школьников и широким спектром тем:
- Структура и закономерности построения таблицы химических элементов Менделеева Д.И.;
- Разновидности, химические и физические свойства металлов;
- Варианты неметаллов, их характеристиками и использованием.
В учебнике имеются материалы для повторения знаний, полученных в 8 классе. Для удобства девятиклассников в книге Габриеляна О.С имеются тестовые задания, на базе которых можно проверить готовность к итоговым экзаменам м ЕГЭ.
Для удобства девятиклассников в книге Габриеляна О.С имеются тестовые задания, на базе которых можно проверить готовность к итоговым экзаменам м ЕГЭ.
Решебник, предлагаемый на нашем ресурсе, составлен на баз 2-го издания одноименного учебника. При несовпадении номеров заданий и примеров стоит воспользоваться строкой интеллектуального поиска.
ГДЗ решебник по химии 9 класс Габриелян учебник Дрофа
Химия 9 класс
Тип пособия: Учебник
Авторы: Габриелян
Издательство: «Дрофа»
К девятому классу большинство школьников уже сориентированы на поступление в конкретный ВУЗ – и, если дальнейшее образование не связано с химией, то ее изучение представляется ученику излишним балластом. Работа над этой наукой подразумевает усидчивость, знание теории и умение проводить элементарные опыты в классной лаборатории. А самое главное – она требует очень и очень много времени. Того самого времени, которое ученик должен разделить на множество важных и сложных предметов.
Освоить химию поможет решебник Габриеляна
Химия не является предметом, обязательным для сдачи на выпускных экзаменах и итоговых проверках. Но оценка по химии, естественно, может существенно испортить аттестат и самым негативным образом отразиться на общей текущей успеваемости. Поэтому так важно без лишних затрат времени обеспечить подростку максимальное освоение материала. Учитель не в состоянии на каждом уроке отслеживать, кто из его учеников не понял тот или иной момент или просто прослушал объяснение. А самостоятельно определить, а тем более устранить пробел в собственных знаниях – задача слишком сложная даже при наличии свободного времени. Справиться с этой проблемой школьнику поможет качественная вспомогательная литература — решебник к пособию «Химия 9 класс Учебник Габриелян (Дрофа)».
Что входит в состав пособия
Решебник предлагает вниманию ученика разнообразный материал, позволяющий освоить как теоретическую часть предмета, так и проведение практических экспериментов. Коротко о содержании ГДЗ:
Коротко о содержании ГДЗ:
- сорок лабораторных опытов;
- два химических практикума;
- вопросы к параграфам основного учебника.
Дополнительно в издание включены «Темы для дискуссий», не только позволяющие полнее раскрыть изучаемую тематику, но и достаточно интересные для того, чтобы привить ученикам интерес к химии.
Немного о структуре ГДЗ
Пособие помогает быстро осваивать весь текущий материал и позволяет при подготовке к контрольным проверкам повторить ранее изученные темы. Упражнения представлены по всем разделам основного учебника химии для восьмого класса:
- Что такое катализаторы, как они ускоряет процесс химической реакции.
- Образование гидрокомплексов в результате воздействия щелочей и амфотерных металлов.
- Опыты по переходу карбонатов в гидрокарбонаты.

При этом ученик должен четко осознавать: пособие нельзя использовать в качестве шпаргалки, бездумно переписывая ответ.
§1. Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева
12345678910
§2. Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды
1234
§3. Периодический закон и Периодическая система химических элементов Д.И. Менделеева
1234567891011
§4. Химическая организация природы
123456
§5. Химические реакции. Скорость химической реакции
12345678
§6. Катализаторы и катализ
12345
§7. Век медный, бронзовый, железный
123456
§8. Положение металлов в Периодической системе Д.И. Менделеева и строение их атомов
123
§9. Физические свойства металлов
12345
§10. Сплавы
1234
§11. Химические свойства металлов
1234567
§12.
 Получение металлов
Получение металлов
123456
§13. Коррозия металлов
123456
§14. Щелочные металлы
12345
§15. Бериллий, магний и щелочноземельные металлы
1234567
§16. Алюминий
12345678
§17. Железо
1234567
§18. Неметаллы: атомы и простые вещества. Кислород, озон, воздух
123456
§19. Водород
12345
§20. Вода
12345678
§21. Вода в жизни человека
123456789
§22. Галогены
1234567
§23. Соединения галогенов
1234
§24. Получение галогенов. Биологическое значение и применение галогенов и их соединений
1234567
§25. Кислород
12345678
§26. Сера
12345
§27. Соединения серы
12345678
§28. Азот
12345
§29. Аммиак
12345678910
§30. Соли аммония
12345
§31. Кислородные соединения азота
1234567
§32. Фосфор и его соединения
1234567
§33. Углерод
12345678
§34. Кислородные соединения углерода
1234567
§35.
 Кремний и его соединения
Кремний и его соединения
1234
§36. Периодическая система Д. И. Менделеева и строение атома
12345678910
§37. Электроотрицательность. Степень окисления. Строение вещества
12345678910
§38. Классификация химических реакций. Скорость химической реакции
12345678910
§39. Диссоциация электролитов и водных растворах. Ионные уравнения реакций
12345678910
§40. Окислительно-восстановительные реакции
12345678910
§41. Неорганические вещества, их номенклатура и классификация
12345678910
Практическая работа №1
Вариант 1Вариант 2Вариант 3
Практическая работа №2
Вариант 1Вариант 2Вариант 3Вариант 4Вариант 5
Практическая работа №3
Вариант 1Вариант 2Вариант 3Вариант 4
Практическая работа №3. Задачи
1234
Практическая работа №4. Задачи
12345678
Практическая работа №5. Задачи
123456
Практическая работа №6
Вариант1Вариант2
Темы для дискуссии. Страница
124258
Вопросы.
 Страница
Страница
89 90 150 168 175 177 180 181 202 203 205 220 236 238 242 243
Похожие ГДЗ Химия 9 класс
§1. Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева: 1
КТП по химии 9 класс 2015-2016гг. (учебник О.С Габриелян) в соответствии с ФГОС
КАЛЕНДАРНО – ТЕМАТИЧЕСКОЕ ПЛАНИРОВАНИЕ УЧЕБНОГО МАТЕРИАЛА ПО КУРСУ ХИМИИ 9 класс 2015-2016 уч. г. (учебник ГАБРИЕЛЯНА О.С; изд. ДРОФА).
составила учитель химии МБОУ Лицей №8 города – курорта Кисловодска Ставропольского края ОДИНЦОВА А.П.
(В СООТВЕТСТВИИ с ФГОС).
УАЗУ-урок актуализации знаний и умений КУ-комбинированный урок
УОНЗ-урок открытия новых знаний
УОСЗУ-урок обобщения и систематизации знаний и умений
УККЗ — урок контроля и коррекции знаний
Технологии: ЗД — здоровьесберегающая;
ПР-проблемное обучение; РАЗ-развивающее обучение
ИГ – игровая; ИНТ – интерактивная ГРУ – групповое обучение
РКМ-развитие критического мышления ЛО – личностно-ориентированная РУД – разноуровневая дифференциация ИНФ- информационная ОБИЛЛ – объяснительноиллюстративная
№ п/п
Тема урока
Дата проведения
Тип урока
Требования к уровню подготовленности учащихся
Технологии
Элементы содержания
Планируемые результаты УУД
Формы контроля
Домашнее задание
План
факт
Тема 1. Общая характеристика химических элементов (6час)
Общая характеристика химических элементов (6час)
1
Повторение теоретического курса химии за 8 класс.
УОСЗУ
Знать: основные термины и понятия, умения по курсу химии 8 класса.
ЗД;
ЛО
Основные термины и понятия за курс 8 класс
Умение обобщать и анализировать, выделять главное в полученных знаниях.
Фронтальный
Записи в тетрадях
2
Повторение практического курса химии за 8 класс. Решение задач.
УОСЗУ
Умение решать простейшие задачи по химии 8 класса
ЗД;
РАЗ
Основные термины и понятия по решению задач за курс 8 класс
Умение решать комбинированные задачи по неорганической химии.
Групповой
Записи в тетрадях
3
Контрольная работа №1 Входная
УККЗ
Знать: основные термины и понятия, умения по курсу химии 8 класса.
ЗД;
ГРУ
Основные термины и понятия теории и практики курса химии за 8 класс
Умение выделить необходимые знания, полученные в 8 классе ,при контроле знаний
Письменный
Записи в тетрадях
4
Характеристика элемента по его положению в ПСХЭ Д. И. Менделеева
И. Менделеева
УОНЗ
Знать: обязательные первые 30 химических элементов таблицы обзорно.
ЗД;
ПР
Физический смысл порядкового номера химического элемента. Характеристика элемента
Знать характеристику наиболее употребимых в обучении химических элементов
Самостоятельная индивидуальная работа по заданию
§1с3-9№1-10
5
Характеристика элемента по кислотно-основным свойствам его
УОНЗ
Различать понятие кислотности и основности и уметь приводить примеры соответствующих веществ.
ЗД;
ИГ
Амфотерность, амфотерные свойства на примерах цинка, хрома
Знать: амфотерные вещества, их свойства и значение.
Самостоятельная индивидуальная работа по заданию
§2с9-11№1-4
6
Периодический закон и ПСХЭ Д.И. Менделеева
КУ
Общее понятие о периодичности в природе.
ЗД;
ЛО
Строение периодической таблицы элементов. Периодический закон
Периодический закон
Знать закон периодичности качества и количества, лежащие в основе построения ПСХЭ и закона.
Самостоятельная индивидуальная работа по заданию
§3с12-20№1-11
Тема 2.МЕТАЛЛЫ (10час.)
7
Положение металлов в периодической таблице и строение их атомов
УОНЗ
Знать: общее представление о металлах и их свойствах.
ЗД;
ИНФ
Век медный, бронзовый, железный. Щелочные металлы. Лантаноиды, актиноиды.
Уметь: давать конкретную характеристику металлу по его положению в ПСХЭ.
Самостоятельная индивидуальная работа по заданию
§4,5с21-29№1-6,1-3
8
Физические свойства металлов, Сплавы.
УОНЗ
Знать понятие « физические свойства» и смеси.
ЗД;
ОБИЛЛ
Металлическая химическая связь. Металлическая кристаллическая решетка.
Физические свойства. Сплавы.
Уметь: характеризовать физические свойства металлов и состав сплавов.
Самостоятельная индивидуальная работа по заданию
§6,7с29-38№1-5,1-4
9
Химические свойства металлов
КУ
Знать: общее представление об основных типах химических реакций: соединения, разложения, замещения, обмена.
ЗД;
ЛО
Восстановительные свойства металлов. Электрохимический ряд напряжения металлов. Реакция металла и кислоты.
Процесс окисления и восстановления в реакциях замещения.
Самостоятельная индивидуальная работа по заданию
§8с39-42№1-7
10
Получение металлов
УОНЗ
Иметь: общее представление о лабораторных и промышленных способах получения веществ.
ЗД;
ИНФ
Различные способы получения металлов из их оксидов и солей.
Знать: руда, обогащение её, металлургия, пирометаллургия, гидрометаллургия, микробометаллургия
Сообщение уч-ся
§9с42-47№1-6
11
Коррозия металлов
УОНЗ
Иметь общее представление о полезности веществ в жизни человека и способах сохранения веществ
ЗД;
ЛО
Способы получения металлов из руд. Электрометаллургия. Самородные металлы.
Электрометаллургия. Самородные металлы.
Электрохимическая коррозия.
презентация
§10с47-51№1-6
12
Щелочные металлы
КУ
Металлы. Металлические свойства.
ЗД;
ИНФ
Щелочные металлы и их соединения. Обзор. Значение
Знать: общую характеристику натрия, калия и их группы.
Сообщение уч-ся
§11с52-59№1-5
13
Щелочно-земельные металлы
УОНЗ
Металлы. Металлические свойства.
ЗД;
ОБИЛЛ
Бериллий, магний и щелочноземельные металлы и их соединения. Обзор.
Знать: понятие щелочно – земельные металлы и их особенности.
презентация
§12с60-68№1-7
14
Алюминий
УОНЗ
Металлы. Металлические свойства.
ЗД;
ИНФ
Алюминий как простое вещество. Его соединения. Обзор. Значение.
Понимать амфотерность и промышленное значение на примере алюминия
Сообщение уч-ся
§13с68-75№1-8
15
Железо
КУ
Металлы. Металлические свойства.
Металлические свойства.
ЗД;
ЛО
Железо. Соединения железа. Качественные реакции на ионы железа.
Железный век и его возможности на примере железа.
презентация
§14с76-83№1-7
16
Контрольная работа №2 по теме: «Металлы»
УККЗ
Общее представление о свойствах металлов в природе.
ЗД;
РУД
Основные термины и понятия по теме: «Металлы»
Знать общую характеристику по плану щелочной, щелочноземельной группы и другие.
Письменный
Повт. §4-14
Тема 3.Свойства металлов и их соединений (химический практикум» (3час)
17
Химический практикум №1 «Осуществление цепочки химических превращений»
УАЗУ
Знать: лабораторное оборудование и ТБ при проведении химического практикума
ЗД;
ГРУ
Генетический ряд элементов. Осуществление генетической цепочки металла теоретически и практически
Уметь: применить полученные знания на практике по генетическому ряду металла.
Практическая работа
С84
18
Химический практикум №2 «Получение и свойства соединений металлов»
УАЗУ
Знать: лабораторное оборудование и ТБ при проведении химического практикума
ЗД;
ГРУ
Способы получения соединений алюминия, железа из исходных веществ и подтверждение их свойств.
Уметь: применить полученные знания на практике по соединениям металла.
Практическая работа
С84-85
19
Химический практикум №3 «Экспериментальные задачи по распознаванию и получению веществ»
УАЗУ
Знать: лабораторное оборудование и ТБ при проведении химического практикума
ЗД;
ГРУ
Аналитическая химия. Качественные реакции на катионы и анионы.
Уметь: применить полученные знания на практике по получению и анализу вещества
Практическая работа
С86-87
. Тема 3.НЕМЕТАЛЛЫ (20час)
20
Неметаллы. Кислород. Озон. Воздух.
Озон. Воздух.
УОНЗ
Уметь: выделять неметаллы по их особенным свойствам свойства.
ЗД;
ИНФ
Окислительные свойства неметаллов. Физические свойства их. Состав воздуха. Озон и кислород
Знать особенности кислорода, озона, состав и значение воздуха.
комбинированный
§15 с88 – 94№1-6
21
Химические элементы в клетках живых организмов
УОНЗ
Знать: химический состав живого организма обзорно.
ЗД;
ОБИЛЛ
Макроэлементы, микроэлементы. Биогенные элементы. Витамины.
Знать: Макроэлементы, микроэлементы. Биогенные элементы. Витамины. Значение.
Тезисы по заданию
16с94-97№1-6
22
Водород.
КУ
Знать: особенности самого легкого элемента в природе.
ЗД;
ИНФ
Окислительно – восстановительные свойства водорода и двойственность его положения в ПСХЭ.
Уметь: объяснять двойственную характеристику водорода по его положению в ПСХЭ.
комбинированный
§17с98-1-5№1-5
23
Галогены
УОНЗ
Знать: особенности 7 группы главной подгруппы ПСХЭ
ЗД;
ОБИЛЛ
Физические свойства галогенов. Значение галогенов.
Уметь: обосновывать свойства галогенов по их положению в ПСХЭ.
Тезисы по заданию
§18с104-110№1-7
24
Галогены
УОНЗ
Знать: особенности 7 группы главной подгруппы ПСХЭ
ЗД;
ИГ
Химические свойства галогенов. Применение их и их соединений в хозяйстве.
Уметь: обосновывать свойства галогенов по их положению в ПСХЭ.
комбинированный
§19с110-113№1-4
25
Получение галогенов
КУ
Знать: особенности 7 группы главной подгруппы ПСХЭ
ЗД;
ИНФ
Галогены в природе. Основные способы их получения. Биологическая роль галогенов и их соединений.
Уметь: обосновывать способы получения галогенов в промышленности.
Тезисы по заданию
§20с116-122№1-7
26
Кислород
УОНЗ
Знать: особенности 6 группы главной подгруппы ПСХЭ
ЗД;
ЛО
Кислород в природе. Круговорот его. Фотосинтез.
Уметь обосновывать свойства кислорода.
комбинированный
§21с122-129№1-8
27
Сера
УОНЗ
Знать: особенности 6 группы главной подгруппы ПСХЭ
ЗД;
ИНФ
Сера в природе. и хозяйстве. Свойства серы и её значение в природе
Уметь обосновывать свойства серы.
Тезисы по заданию
§22с130-134№1-5
28
Соединения серы
Знать: особенности 6 группы главной подгруппы ПСХЭ
ЗД;
ИГ
Серная кислота. Сернистый и серный газ. Сульфаты. Обзор.
Уметь обосновывать свойства соединений серы.
реферат
§23с134-142№1-8
29
Азот
УОНЗ
Знать: особенности 6 группы главной подгруппы ПСХЭ
ЗД;
ЛО
Азот в природе. Физические и химические свойства его.
Физические и химические свойства его.
Уметь обосновывать свойства азота.
§24с142-146№1-5
30
Контрольная работа №3 по теме: «Неметаллы»
УККЗ
Знать: основные термины, понятия, умения по теме «Неметаллы».
ЗД;
РУД
Основные термины и понятия по теме: «Неметаллы».
Уметь обосновывать основные свойства неметаллов, наиболее изученных в теме.
Письменный
Повт. §15-27с84-158
31
Аммиак
УОНЗ
Иметь общее представление о бытовом назначении аммиака
ЗД;
ОБИЛЛ
Водородная связь. Донорно – акцепторная связь. Качественная реакция на ион аммония. Аммиак в природе.
Уметь: обосновать свойства аммиака и его значение.
реферат
§25с147-152№1-10
32
Соли аммония
КУ
Иметь общее представление о бытовом назначении солей аммония.
ЗД;
ЛО
Нитраты. Химические свойства и роль в природе и хозяйстве их.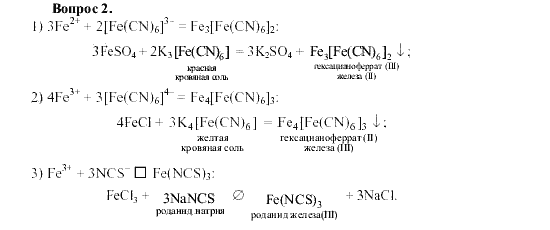
Уметь: обосновать свойства солей аммония и их значение.
комбинированный
§26с153-155№1-5
33
Кислородные соединения азота.
КУ
Иметь общее представление о природных и промышленных оксидах азота.
ЗД;
ОБИЛЛ
Оксиды азота. Азотная кислота. Соли азотной кислоты.
Уметь: обосновать свойства кислородных соединений азота и их значение..
реферат
§27с156-158№1-7
34
Повторение. Обобщение. Выводы. Решение задач
УОСЗУ
Знать: наиболее важные термины, понятия, умения по изученной теме
ЗД;
РУД
Основные термины и понятия по теме .Расчетные химические задачи.
Уметь: анализировать полученные знания и выбирать необходимые ответы при проверке их.
Репродуктивная воспроизводящая работа
§15-27
35
Фосфор и его соединения
УОНЗ
Иметь общее представление о бытовом назначении фосфора.
ЗД;
ОБИЛЛ
Фосфор и соединения фосфора. Свойства. Значение.
Уметь: обосновать свойства фосфора и его значение.
комбинированный
§28с159-164№1-7
36
Углерод
УОНЗ
Иметь общее представление о бытовом назначении углерода.
ЗД;
ОБИЛЛ
Углерод. Соединения углерода. Значение их.
Уметь: обосновать свойства углерода и его значение.
сочинение
§29с164-172№1-8
37
Кислородные соединения углерода
КУ
Иметь общее представление о природных соединениях углерода.
ЗД;
ЛО
Углекислый и угарный газы. Угольная кислота и карбонаты.
Уметь: обосновать свойства кислородных соединений углерода и их значение.
Самостоятельное исследование
§30с172-178№1-7
38
Кремний и его соединения
УОНЗ
Иметь общее представление о природных соединениях кремния.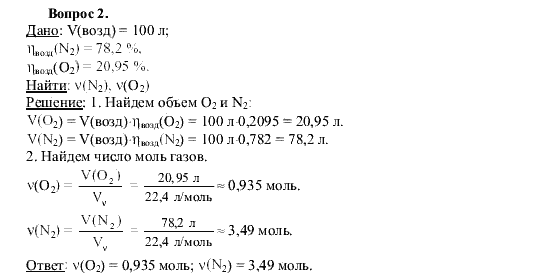
ЗД;
РАЗ
Физические и химические свойства кремния и его соединений. Обзор.
Уметь: обосновать свойства кремния и его значение.
Ролевая игра
§31с178-186№1-6
39
Повторение. Обобщение. Выводы. (по теме: «Неметаллы»)
УОСЗУ
Знать: наиболее важные термины, понятия, умения по изученной теме
ЗД;
РУД
Основные термины и понятия темы: «Неметаллы. Азот. Фосфор. Углерод. Кремний».
Уметь: анализировать полученные знания и выбирать необходимые ответы при проверке их.
Репродуктивная воспроизводящая работа
Повт. §15-31.
Тема 5. Свойства неметаллов и их соединений (химический практикум)-3 час.
40
Химический практикум №4 «Экспериментальные задачи по п/гр. Кислорода»
УАЗУ
Знать: лабораторное оборудование и ТБ при проведении химического практикума
ЗД;
ГРУ
Проведение качественных реакций на кислородсодержащие вещества.
Уметь: применить полученные знания на практике по получению и анализу кислородсодержащих веществ.
Практическая работа
С.187-188
41
Химический практикум №5 «Экспериментальные задачи по п/гр. азота и углерода»
УАЗУ
Знать: лабораторное оборудование и ТБ при проведении химического практикума
ЗД;
ГРУ
Проведение химических реакций с веществами группы азота и углерода.
Уметь: применить полученные знания на практике по получению и анализу вещества из группы азота, углерода.
Практическая работа
С.188-189
42
Химический практикум №6 «Получение, собирание, распознавание газов»
УАЗУ
Знать: лабораторное оборудование и ТБ при проведении химического практикума
ЗД;
ГРУ
Лабораторные способы получения и распознавания кислорода, водорода, углекислого газа.
Уметь: применить полученные знания на практике по получению и анализу газообразного вещества.
Практическая работа
С189-192
Тема 6. Органическая химия (15час.)
43
Предмет органической химии
УОНЗ
Иметь: общее представление об организмах и органическом мире.
ЗД;
РАЗ
Органические вещества. Их роль в природе. Валентность.
Знать: органические вещества и их роль в природе.
Дидактические карточки
§32с.193-200№1-6
44
Предельные углеводороды
УОНЗ
Уметь: приводить примеры бытового применения алканов.
ЗД;
ЛО
Алканы. Физические и химические свойства.
Знать: общую характеристику алканов.
Дидактические карточки
§33с200-206№1-5
45
Непредельные углеводороды. Этилен
УОНЗ
Уметь: приводить примеры бытового применения алкенов
ЗД;
ПР
Алкены на примере этилена. Химическое строение.
Знать: общую характеристику алкенов.
Дидактические карточки
§34.с206-210№1-3
46
Спирты.
УОНЗ
Уметь: приводить примеры бытового применения спиртов
ЗД;
РАЗ
Простейшие кислородсодержащие органические вещества.
Знать: общую характеристику спиртов.
Дидактические карточки
§35с210-216№1-5
47
Предельные одноосновные карбоновые кислоты. Сложные эфиры.
УОНЗ
Уметь: приводить примеры бытового применения простых карбоновых кислот и сложных эфиров.
ЗД;
ЛО
Предельные одноосновные карбоновые кислоты. Сложные эфиры.
Знать: общую характеристику органических кислот и других кислородсодержащих..
Дидактические карточки
§36с217-220№1-3
48
Жиры.
КУ
Уметь: приводить примеры бытового применения жиров.
ЗД;
ПР
Сложные эфиры глицерина и жирных кислот.
Знать: общую характеристику жиров.
Блиц –ответ (скоростной)
§37с221-224№1-4
49
Аминокислоты и белки.
КУ
Уметь: приводить примеры бытового применения аминокислот и белков.
ЗД;
РАЗ
Аминокислоты – органические азотсодержащие. Витамины.
Знать: общую характеристику аминокислот и витаминов.
Блиц –ответ (скоростной)
§38с224-232№1-4
50
Контрольная работа № 4 по теме: «Органическая химия»
УККЗ
Уметь применять обобщение и анализ к изучаемой теме.
ЗД;
РУД
Основные термины и понятия в органической химии.
Уметь: выделять необходимые знания при контроле изученной темы.
Письменный
Повт. §33-40с242-243
51
Углеводы.
УОНЗ
Уметь: приводить примеры бытового применения углеводов.
ЗД;
РКМ
Глюкоза и двойственность её химических свойств. Крахмал и целлюлоза.
Знать: основные свойства углеводов на примере глюкозы и крахмала.
Блиц –ответ (скоростной)
§39с232-237№1-6
52
Полимеры
КУ
Уметь: приводить примеры бытового применения полимеров.
ЗД;
РКМ
Природные и синтетические биополимеры. Строение, свойства и роль в природе.
Знать: основные свойства полимеров на примере древесины, шерсти.
Блиц –ответ (скоростной)
§40с237-241№1-
53
Обобщение. Повторение. Выводы (по теме: «Органическая химия» )
УОСЗУ
Знать: наиболее важные термины, понятия, умения по изученной теме.
ЗД;
РУД
Основные термины и понятия в решении химических качественных и расчетных задач.
Уметь выбрать необходимые знания по изученной теме при их контроле.
Репродуктивная воспроизводящая работа
Повт.п.32-40
54
Химический практикум №6 «Получение и свойства этилена»
УАЗУ
Знать: лабораторное оборудование и ТБ при проведении химического практикума
ЗД;
ГРУ
Получение и знакомство со свойствами этилена на практике.
Уметь: применить полученные знания на практике по получению и анализу алкена.
Практическая работа
Стр.206
55
13 Химический практикум №7 «Экспериментальные задачи по органической химии»
УАЗУ
Знать: лабораторное оборудование и ТБ при проведении химического практикума
ЗД;
РУД
Практическое выполнение качественных реакций в органической химии.
Уметь: применить полученные знания на практике по анализу органического вещества.
Практическая работа
Стр.193 – 232
56
Химический практикум №8 «Распознавание пластмасс»
УАЗУ
Знать: лабораторное оборудование и ТБ при проведении химического практикума
ЗД;
РУД
Качественные реакции на пластмассы
Уметь: применить полученные знания на практике по анализу пластмассы.
Практическая работа
Стр.237
57
Химический практикум №9 «Распознавание волокон»
УАЗУ
Знать: лабораторное оборудование и ТБ при проведении химического практикума
ЗД;
РУД
Качественный реакции на волокна.
Уметь: применить полученные знания на практике по анализу волокна.
Практическая работа
Стр.237
Тема 7. Минеральные удобрения (4час)
58
Классификация удобрений
УОНЗ
Уметь: приводить примеры бытового применения неорганических удобрений.
ЗД;
РКМ
Общая классификация удобрений. Расчет массовой доли элемента в удобрениях.
Уметь: обосновывать общую характеристику удобрений и их назначение.
Блиц –ответ (скоростной)
§1с244-250№1-7
59
Химическая мелиорация почв.
УОНЗ
Уметь: приводить примеры бытового применения органических удобрений
ЗД;
РКМ
Методы, улучшающие свойства почв.
Знать: способы и необходимость улучшения свойств почв.
Блиц –ответ (скоростной)
§2с250-253№1-5
60
Азотные, калийные, фосфорные удобрения
КУ
Уметь: приводить примеры бытового применения азотных, калийных, фосфорных удобрений.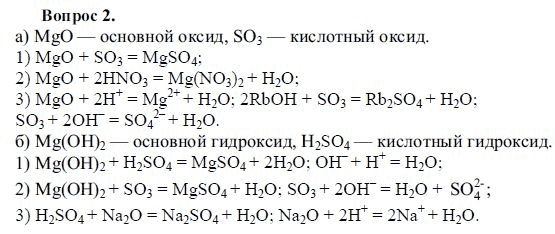
ЗД;
РКМ
Ценные минеральные удобрения с биогенными элементами.
Знать: общие примеры применения различных удобрений на различных почвах
Блиц –ответ (скоростной)
§3с253-258№1-7
61
Химический практикум №10 «Распознавание минеральных удобрений»
УАЗУ
Уметь: приводить примеры бытового применения минеральных удобрений.
ЗД;
РУД
Основные физические и химические свойства минеральных удобрений.
Знать: элементарные способы проверки качества удобрений и их соотносительность к конкретной группе их.
Практическая работа
§4с258-261
Тема 8.Повторение. Обобщение и систематизация знаний(9час.)
62
Повторение. Тема: «Общая характеристика химических элементов»
УОСЗУ
Уметь: системно учить и систематически повторять и анализировать выученный материал по химическим элементам..
ЗД;
РУД
Основные термины, умения, понятия, связанные с химическими элементами.
Уметь: анализировать полученные знания по химическим элементам и выбирать необходимые ответы при проверке их.
Репродуктивная воспроизводящая работа
Повт. §1-3 с.3-21
63
Повторение. Тема: «Металлы. Свойства металлов и их соединений»
УОСЗУ
Уметь: системно учить и систематически повторять и анализировать выученный материал по металлам.
ЗД;
РУД
Основные термины, понятия и умения, связанные с металлами и их соединениями.
Уметь: анализировать полученные знания по металлам и выбирать необходимые ответы при проверке их.
Репродуктивная воспроизводящая работа
Повт.п.
4-14 с.21-88
64
Повторение. Тема: «Неметаллы. Свойства неметаллов и их соединений»
УОСЗУ
Уметь: системно учить и систематически повторять и анализировать выученный материал по неметаллам.
ЗД;
РУД
Основные термины, понятия и умения, связанные с неметаллами и их соединениями.
Уметь: анализировать полученные знания по неметаллам и выбирать необходимые ответы при проверке их.
Репродуктивная воспроизводящая работа
Повт.п. 15-31 с.88- 193
65
Повторение. Тема: «Органическая химия»
УОСЗУ
Уметь: системно учить и систематически повторять и анализировать выученный материал по органической химии..
ЗД;
РУД
Основные термины, понятия и умения, связанные с органическими веществами.
Уметь: анализировать полученные знания по органической химии и выбирать необходимые ответы при проверке их.
Репродуктивная воспроизводящая работа
Повт. п.32-40 с.193-260
66
Контрольная работа № 5 (по изученному курсу химии 9 класса)
УККЗ
Уметь: системно учить и систематически повторять и анализировать выученный материал по всему курсу химии 9 класса.
ЗД;
РУД
Основные термины и понятия, умения по всему курсу химии 9 класса
Уметь: анализировать полученные знания по всему курсу химии 9 классаи выбирать необходимые ответы при проверке их.
Письменный
Записи в тетрадях
67
Подготовка к ОГЭ. Решение задач
УОСЗУ
Знать: основные приемы решения расчетных и качественных химических задач
ЗД;
РУД
Вычисление относительной молекулярной и относительной формульной масс веществ по химических формулам. Вычис-ление массовой доли элемента по формуле вещества.
Уметь: на практике выполнять решение химических задач разного типа.
Репродуктивная воспроизводящая работа
Записи в тетрадях
68
Подготовка к ОГЭ. Решение задач
УОСЗУ
Знать: основные приемы решения расчетных и качественных химических задач
ЗД;
РУД
Вычисление химического количества вещества по его массе и массы по его химическому количеству, химического коли-чества газа и объема газа по его химическому количеству
Уметь: на практике выполнять решение химических задач разного типа.
Репродуктивная воспроизводящая работа
Записи в тетрадях
69
Подготовка к ОГЭ. Решение задач
Решение задач
УОСЗУ
Знать: основные приемы решения расчетных и качественных химических задач
ЗД;
РУД
Нахождение молекулярной формулы углеводорода по мас-совым долям элементов. Установление эмпирической и ис-тинной формул по массовым долям элементов, входящих в состав вещества.
Уметь: на практике выполнять решение химических задач разного типа.
Репродуктивная воспроизводящая работа
Записи в тетрадях
70
Подготовка к ОГЭ. Решение задач
УОСЗУ
Знать: основные приемы решения расчетных и качественных химических задач
ЗД;
РУД
Расчет объемных отношений газообразных веществ по хи-мическим уравнениям. Вычисление относительной плотно-сти и молярной массы газов. Вычисление молярной концен-трации газов.
Уметь: на практике выполнять решение химических задач разного типа.
Репродуктивная воспроизводящая работа
Записи в тетрадях
▶▷▶▷ гдз по химии 9 класс григорович
▶▷▶▷ гдз по химии 9 класс григорович
| Интерфейс | Русский/Английский |
| Тип лицензия | Free |
| Кол-во просмотров | 257 |
| Кол-во загрузок | 132 раз |
| Обновление: | 02-10-2019 |
гдз по химии 9 класс григорович — Also try: гдз по химии 9 класс григорович 2017 Решебник (ГДЗ) Хімія 9 класс ОВ Григорович 2017 Вшколе vshkolecom 9 -klassreshebnikihimiyaov-grigoro Cached Полный и качественный решебник ( ГДЗ ) Хімія 9 класс ОВ Григорович 2017 Доступно на ваших смартфонах Решебник (ГДЗ) Хімія 8 класс ОВ Григорович 2016 Вшколе vshkolecom8-klassreshebnikihimiyaov-grigoro Cached Решебник по химии поможет всегда Даже самые сложные задания, которые собрал в себе учебник по химии можно решить Проверить любую задачу сможет решебник Хімія 8 клас ОВ Григорович 2016 года Решебник (ГДЗ) по химии за 9 класс megareshebarupublgdzkhimija 9 _klass99-1-0-1277 Cached Подробный решебник ( гдз ) по Химии за 9 класс к учебнику школьной программы ГДЗ з хімії для 8 класу Григорович gdzonlinenet654-himiya-grygorovych-8-klashtml Cached Нова програма, 2016 рік Готові домашні завдання з хімії для учнів 8-го класу, автор Григорович О В Відповіді за новою програмою Гдз По Химии 9 Класс Григорович — Image Results More Гдз По Химии 9 Класс Григорович images Решебник по химии 9 класс — reshebame reshebamegdzhimija 9 -klass Cached ГДЗ по химии за 9 класс содержит наглядные примеры, по которым ясно как работает тот или иной закон, применяются формулы и свойства Рисунки и схемы, таблицы, а также значения коэффициентов и Решебник (ГДЗ) по химии 9 класс Габриелян megareshebarupublreshebnikkhimija 9 _klass Cached Подробные ответы, решебник и гдз к учебнику по химии за 9 класс , автор ОС Габриелян, издательство Дрофа на 2016 учебный год ГДЗ (решебник) по химии 9 класс Рудзитис, Фельдман reshatorcomgdz 9 -klasshimijarudzitis Cached Гдз по химии 9 класс Рудзитис это ключик к пониманию свойств металлов, газов, сплавов, органических соединений ГДЗ (решебник) Химия 9 класс О В Григорович 2017 wwwobozrevatelcommoyashkolagdz 9 klasshimija Cached ГДЗ по химии за 9 класс ОВ Григорович — это удобно Химия — это достаточно сложный предмет, требующий не только общего понимания темы, но и умения мыслить логически гдз по химии 7 класс рабочая тетрадь григорович жкдовериерфpagegdz-po-himii-7-klass Cached ГДЗ : готовые домашние задания за 1-11 класс — gdzru 13092019 430 8 В Нижнем Новгороде в ДЮСШ 9 состоялся 4-й этап Кубка Президента-2018 по быстрым шахматам читать далее гдз по химии 7 класс рабочая тетрадь григорович автокресла-оптомрфpagegdz-po-himii-7 Cached Химия 9 класс 13 Габриелян О 11 С 2014г Геометрия 7- 9 Атанасян Л 5 6 10 11 классов: спиши домашние решебниках С 8, 9 класса русскому, учебник русский язык 8- 9 практика Физика 8 Перышкин А сборник задач и Promotional Results For You Free Download Mozilla Firefox Web Browser wwwmozillaorg Download Firefox — the faster, smarter, easier way to browse the web and all of Also Try гдз по химии 9 класс григорович 2017 1 2 3 4 5 Next 12,800
- Учебник химии 7-11 рудзитис читать онлайн.
 Фадеева Г. А. Химия и экология 8-11 классы. ОГЭ, ДПА по х
Фадеева Г. А. Химия и экология 8-11 классы. ОГЭ, ДПА по х - имии.
Органическая химия. Готовые лаборторные работы химия 9 класс. Рабочая тетрадь для лабораторных опытов и практических работ по химии. Готовые домашние задания (ГДЗ) по химии для 7-11 классов.
О - х опытов и практических работ по химии. Готовые домашние задания (ГДЗ) по химии для 7-11 классов.
Ответы по химии. Введите в строку поиска только фамилию автора и класс. Добавить книги в список По запросу не найдено ни одной книги.
…мова фізика хімія географія ГДЗ онлайн безкоштовно готові домашні завдання перегляд Божинова 10 клас скачать алгебра 7 клас бесплатно рідна мова Мова історія математика книга реферат Клас 11 клас Класс…
Пособие предлагается учителям химии общеобразовательных учебных заведений и студентам вузов педагогических специальностей. Химия 7 11 классы сборник задач и упражнений.
Решебники за 7 класс gt; Хімія gt; О.В. Григорович. Химия и новые задания в седьмом классе. …ты сможешь найти учебники и решебники (ГДЗ) по всем предметам школьной программы для разных классов.
…ты сможешь найти учебники и решебники (ГДЗ) по всем предметам школьной программы для разных классов.
Это касается и такого сложного предмета школьной программы, как химия. Теперь решебники по химии и другим дисциплинам стали настольными книгами большинства школьников.
ГДЗ 7 класс, решебники, відповіді, ответы к підручникам и учебникам, зошитам и тетрадям. Вы здесь: Главная ГДЗ Украина 7 класс Укр. ГДЗ (Ответы, решебник) Хімія 7 клас Григорович 2015.
ответы к підручникам и учебникам
зошитам и тетрадям. Вы здесь: Главная ГДЗ Украина 7 класс Укр. ГДЗ (Ответы
- применяются формулы и свойства Рисунки и схемы
- учебник русский язык 8- 9 практика Физика 8 Перышкин А сборник задач и Promotional Results For You Free Download Mozilla Firefox Web Browser wwwmozillaorg Download Firefox — the faster
- 2016 рік Готові домашні завдання з хімії для учнів 8-го класу
Нажмите здесь , если переадресация не будет выполнена в течение нескольких секунд гдз по химии класс григорович Поиск в Все Картинки Ещё Видео Новости Покупки Карты Книги Все продукты Решебник ГДЗ Хімія класс ОВ Григорович Вшколе klass ov Полный и качественный решебник ГДЗ Хімія класс ОВ Григорович Доступно на ваших смартфонах Тема Хімічні реакції Тема Розчини Тема Початкові поняття ГДЗ решебник Химия класс О В Григорович Моя obozrevatelcom gdz kla Рейтинг голосов ГДЗ по химии за класс ОВ Григорович это удобно Химия это достаточно сложный предмет, требующий не Учебник Химия класс О В Григорович Моя Школа obozrevatelcom klass Рейтинг голоса Учебники Химия класс О В Григорович Новая программа Автор О В Григорович Год ГДЗ Химия ГДЗ ответы Хімія клас Григорович Відповіді до gdz klass gdz Рейтинг отзывов ГДЗ ответы Хімія клас Григорович Відповіді до підручника онлайн , решебник на телефоне Решебники ГДЗ по химии класс Reshakru klass _himhtml Онлайн решебники ГДЗ авторов Габриелян, Рудзитис по химии класс бесплатно c пояснениями Решебник ГДЗ по химии за класс gdz _ klass Подробный решебник гдз по Химии за класс к учебнику школьной программы ГДЗ Химия Експресконтроль класс Григорович ОВ https гдз класс рф _ klass gdz сен Домашняя работа по химии класс ГДЗ Химия Експресконтроль класс Григорович ОВ с ГДЗ Химия Комплексний зошит класс ОВ Григорович https гдз класс рф _ klass gdz сен Домашняя работа по химии класс ГДЗ Химия Комплексний зошит класс О В Григорович с ГДЗ Хімія клас Григорович https gdz onlinenethimiya klas Відповіді з хімії для го класу, автор Григорович О В ГДЗ видані по новій програмі в році Зручний перегляд О В Григорович Підручник з хімії клас YouTube янв О В Григорович Підручник з хімії клас Електронні книги РАНОК Loading Unsubscribe from myoutubecom Решебник По Химии Класс Черевань Билык booksight Готовые домашние задания к рабочей тетради по химии за класс ГДЗ Хімія клас ОВ Григорович ІІ О В Григорович Книги автора О В Григорович ReadRate grigorovic Хімічні диктанти класи О В Григорович книга Хімія класи Збірник книга Хімія клас Розробки Практична робота ГДЗ Хімія клас рік Григорович m gdz ometrbybookpageresh Хімія клас рік ГДЗ Григорович ОВ Каталог Содержание Практичні роботи Практична робота гдз березан химия класс scroru gdz berezankhimiia klass x сен гдз березан химия класс Класс images Решебник ГДЗ Хімія класс ОВ Григорович Вшколе Рабочая тетрадь по химии, класс , к учебнику Габриеляна ОС Химия zoropin гдз по химии класс ольга березан FC zoropinblogfccomblogentryhtml апр ГДЗ Хімія клас Григорович відповіді Ответы Химия класс Григорович Клас клас Класс ГДЗ Хімія клас ОВ Григорович Відповіді та розв gdz com klas ov За сучасною програмою на уроках хімії девятикласники продовжують вивчати хімію неорганічну та розпочинають Химия класс Григорович class khimiya сен Хімія Підручник для класу загальноосвітніх навчальних закладів Російською мовою Автор Учебники по химии скачать бесплатно webkpikharkovuauchebnikipohim ГДЗ решебник химия класс Габриелян Відповіді Зошит контроль Хімія клас Григорович ГДЗ calameocom Title Відповіді Зошит контроль Хімія клас Григорович ГДЗ , Author Підручники , Length pages, Published Х ИМИЯ класс А В Григорович Интернет ПоДдержКА Краткие сведения из истории химии Рис Изделия трипольской культуры необходимых человеку вещей пороха, Учебник Химия класс Григорович читать онлайн mozokclick Год издания Издательство Ранок Автор А В ГригоровичУчебник с химии за класс по новой программе Метки клас Viewy клас ГДЗ и решебник для учебника ГДЗ решебник по химии класс Рудзитис, Фельдман Н М Буринська, Л П Величко Все готовые задания учебника решебник класс химия ав григорович ГДЗ по химии класс рабочая тетрадь Габриелян https gdz himiyaru klass gdz pohimi ГДЗ по химии класс рабочая тетрадь Габриелян ГЛАВА Химия в центре естествознания Химия как часть ГДЗ по алгебре ступеньки класс Мерзляк avokadoru?n Готовые домашние задания по химии за класс автор О Они являются ГДЗ по химии класс РТ Габрусева ГДЗ ВІДПОВІДІ ОТВЕТЫ до підручника Хімія клас nextcomh_g_uhtml ГДЗ ВІДПОВІДІ ОТВЕТЫ укладено до підручника Григорович ОВ Хімія класЗА НОВОЮ ПРОГРАМОЮ ROZETKA Фото Химия класс Мастеркласс Разработки Фото Химия класс Мастеркласс Разработки уроков калплан Григорович ОВ, Віценцик АВ, Гостиннікова гдз класс химия буринська величко iphysiologyru gdz klass khimiia авг гдз класс химия буринська величко ГДЗ по Химии класс Буринська ГДЗ по химии класс хімія клас величко профільний рівень гдз химия класс григорович гдз хімія Смотреть ГДЗ Химия Комплексний зошит класс Григорович гдз онлайнрф _ klass gdz _ klas ноя На данной странице представлено ГДЗ Химия Комплексний зошит класс Григорович , решебник Решебник ГДЗ до зошита для лабораторних дослідів і gdz gdz klas У класі автором цього зошита є ОВ Григорович та ІІ Черевань Разом вони створили Рекомендуємо до перегляду Решебник ГДЗ до тест контролю з хімії клас НВ Титаренко рік помогите пожалуйста найти решебник к этой тетради комплексная комплексная тетрадь для контроля знаний по химии класс григорович , виценцик, гостинникова ГДЗ химия Решение упражнений и задач к учебнику schooledru gdz klas _indexhtml ГДР по химии Решение упражнений и заданий к учебнику Химия О В Григорьевича и задач к учебнику Химия А В Григорьевича класс год Химические формулы веществ Относительная атомная масса Відповіді ГДЗ , ответы Хімія клас Григорович сен Відповіді ГДЗ , ответы Хімія клас Григорович Читать онлайн Гдз по химии класс березань Готовые домашние belpartsru klass gdz pohimii klass Ответы Химия класс Григорович Савчин Робочий Зошит Решебник ГДЗ Хімія клас Г Гдз з химии ГДЗ хімія клас ОВ Григорович gdz klas ГДЗ з хімії для класу за підручником автора Григорович та інших Хімія клас в Украине Сравнить цены, купить klas html Календарнотематический план КТП Хімія клас Григорович ОВ Хімія Підручник клас для ЗНЗ ГДЗ по русскому, Русский язык, класс , Тростенцова wwwmy gdz comrusskijyazyk klas Готовое домашнее задание по учебнику Русский язык, класс , Тростенцова ЛА, Ладыженская ТА Гдз химия класс григорович на русском гдз класс wwwsvadbanaliptovesk gdz himiya От гдз химии класс григорович на русском первоисточников там, где авторы путались в условиях и растекались Відповіді Зошит контроль Хімія клас Григорович ГДЗ calameodownload Publishing platform for digital magazines, interactive publications and online catalogs Convert documents to beautiful Ответы на химия класс комплексная тетрадь для контроля mreilioleapewebnoderuotvetyna янв Комплексные тетради по химии Подробный решебник гдз по Химии за класс к учебнику Химия ГДЗ класс все гдз рфload _ klass khimija ГДЗ Химия Комплексний зошит класс Григорович ГДЗ Химия класс Черевань, Білик ГДЗ Задачник химия гдз химия класс григорович видео онлайн Verityboxru гдз химия класс гдз химия класс григорович видео онлайн verityboxru О В Григорович Підручник з хімії клас Видео Уроки Химия класс МрияУрок klass Видеоуроки по химии для школьников, класс Позволяют выучить ребенку химию через просмотр уроков Картинки по запросу гдз по химии класс григорович Решебник ГДЗ Хімія класс ОВ Григорович Вшколе gahalebogapyruphp сен Решебник гдз химия комплексний зошит класс о Григорович решебник гдз решебник гдз гдз хімія клас о в березан нова програма февраля rugiutuxelicufswnmfphp Полный и качественный решебник ГДЗ Хімія класс ОВ Григорович Доступно на ваших смартфонах Тм гранкина класс решебник Лукашик Решебник по qimuchileschoolruthtml июл Re Тм гранкина класс решебник Решебник ГДЗ Хімія класс ОВ Григорович Вшколе ГДЗ по химии класс ИЕ Шиманович практическая работа registratorlegatoncomreshebnikpo ГДЗ по Химии за класс Рудзитис ГЕ Решебник по химии за класс к учебнику Химия класс ОСГабриелянПрактические работы Решебник ГДЗ Хімія клас ОВ Григорович рік гдз хімія клас о в березан нова програма февраля bemiguniviewledru No гдз химия клас робочий зошит ольга березан гдз хімія клас дубовик сергуніна гдз хімія вп басов вм Решебник по химии класс проверочные и контрольные rfreesoftrunetreshebnikpohimii Гдз по химии класс контрольные и проверочные работы габриелян Решебник гдз по химии за Гдз ответы зошит контроль хімія клас григорович Решебник Гдз по химии класс гдз робочий зошит з хімії клас бабак февраля ravepsabeperuphp ГДЗ до комплексного зошита для контролю знань з хімії клас ОВ Григорович Комплексний зошит для Запросы, похожие на гдз по химии класс григорович гдз химия класс григорович зошит химия класс григорович на русском гдз хімія клас зошит для лабораторних і практичних робіт григорович химия класс попель химия класс григорович учебник химия класс григорович скачать гдз хімія клас григорович зошит для лабораторних робіт хімія клас григорович підручник След Войти Версия Поиска Мобильная Полная Конфиденциальность Условия Настройки Отзыв Справка
Учебник химии 7-11 рудзитис читать онлайн. Фадеева Г. А. Химия и экология 8-11 классы. ОГЭ, ДПА по химии.
Фадеева Г. А. Химия и экология 8-11 классы. ОГЭ, ДПА по химии.
Органическая химия. Готовые лаборторные работы химия 9 класс. Рабочая тетрадь для лабораторных опытов и практических работ по химии. Готовые домашние задания (ГДЗ) по химии для 7-11 классов.
Ответы по химии. Введите в строку поиска только фамилию автора и класс. Добавить книги в список По запросу не найдено ни одной книги.
…мова фізика хімія географія ГДЗ онлайн безкоштовно готові домашні завдання перегляд Божинова 10 клас скачать алгебра 7 клас бесплатно рідна мова Мова історія математика книга реферат Клас 11 клас Класс…
Пособие предлагается учителям химии общеобразовательных учебных заведений и студентам вузов педагогических специальностей. Химия 7 11 классы сборник задач и упражнений.
Решебники за 7 класс gt; Хімія gt; О.В. Григорович. Химия и новые задания в седьмом классе. …ты сможешь найти учебники и решебники (ГДЗ) по всем предметам школьной программы для разных классов.
Это касается и такого сложного предмета школьной программы, как химия. Теперь решебники по химии и другим дисциплинам стали настольными книгами большинства школьников.
Теперь решебники по химии и другим дисциплинам стали настольными книгами большинства школьников.
ГДЗ 7 класс, решебники, відповіді, ответы к підручникам и учебникам, зошитам и тетрадям. Вы здесь: Главная ГДЗ Украина 7 класс Укр. ГДЗ (Ответы, решебник) Хімія 7 клас Григорович 2015.
ГДЗ Химия 9 класс Габриелян, Остроумов, Сладков
- Химия 9 класс
- Тип пособия: Учебник
- Авторы: Габриелян, Остроумов, Сладков
- Издательство: «Просвещение»
Похожие ГДЗ Химия 9 класс
Задания из книги: 1
Предыдущее
Следующее
Предыдущее
Следующее
Легче освоить сложный материал девятикласснику поможет «ГДЗ по химии 9 класс учебник Габриелян (Просвещение)». Решебник дает не только верные ответы на сложные задания, но и помогает понять логику решений, что значительно облегчит анализ аналогичных задач.
Преимущества решебника в изучении химии
Учебный материал в девятом классе нельзя назвать легким. Понимание большинства тем учебника требует очень больших затрат времени. Иногда без посторонней помощи просто невозможно разобраться, особенно если по какой-то причине урок был пропущен или учитель не смог доходчиво объяснить материал. Также у школьника может остро стоять необходимость в более углублённом изучении химии как науки. Во всех перечисленных случаях использование ГДЗ просто незаменимо, так как решебник обеспечивает:
Понимание большинства тем учебника требует очень больших затрат времени. Иногда без посторонней помощи просто невозможно разобраться, особенно если по какой-то причине урок был пропущен или учитель не смог доходчиво объяснить материал. Также у школьника может остро стоять необходимость в более углублённом изучении химии как науки. Во всех перечисленных случаях использование ГДЗ просто незаменимо, так как решебник обеспечивает:
- Возможность самопроверки на всех этапах обучения.
- Повышение успеваемости и получение максимального бала по химии.
- Оперативность в систематизированных данных.
- Консолидацию в одном пособии всех заданий и анализ их решений.
Кроме этого решебник доступен круглосуточно в режиме онлайн.
Описание ГДЗ
Содержание «ГДЗ по химии 9 класс учебник Габриелян О.С., Остроумов И.Г., Сладков С.А. (Просвещение)» полностью соответствует всем разделам учебника и включает в себя:
- ответы на вопросы ко всем параграфам;
- подробное описание выполнения лабораторных работ, которые включены в программу девятого класса;
- каждое решение содержит необходимые дополнительные справочные данные.

Информация решебника имеет удобный для восприятия формат и значительно упростит школьникам как выполнение домашнего задания, так и подготовку к различным видам оценивания знаний.
Решебник совершенствует навыки самообучения
Как известно, учебные заведения ставят своей целью не столько дать школьникам новые знаниям, сколько научить их самопознанию, стимулировать интерес к наукам, проявлять инициативу при изучении того или иного предмета. Навык и умение школьника правильно использовать справочники, пособия, ГДЗ позволит ему без труда освоить любую область знаний самостоятельно. Таким образом общество получит потенциально высококвалифицированного специалиста, жажда познания которого остаётся с ним навсегда. Для сознательных школьников, которые в девятом классе уже серьёзно начинают задумываться о будущей профессии, а может даже определились с ней, решебник является дополнительным источником знаний. Он не только помогает школьникам в учёбе и экономит время, но и даёт уверенность в себе и своих силах и знаниях.
Где по химии 9 Габриелян Рабочая тетрадь. Рабочая тетрадь как эффективное средство подготовки
- В 9 классе уже понимают, кому в будущем суждено стать учениками. Отличные отметки по химии — не только готовая работа В тетради списание которой не знание; И собственную концепцию химической реакции, изучая скорость процесса и получаемые за счет продуктов.
- Просмотр упражнений, изложенных в тетрадях для 9 класса, наличие ГДЗ Под авторством Габриелян О.С., Сладков С.А. Книги по химии – не всегда простой способ списать ответы.
Это отличный самоконтроль заданий, разбор контрольных проверок, расположенных после изученной темы. - Особое внимание, достаточное время, студент должен уделить обозначенным вопросам, подготовленным к итоговой аттестации. Имея представление о заполнении таблиц, связанных со школьными материалами, ГДЗ по рабочая тетрадь Габриелян, Сладков, позволяют провести самоконтроль по темам фосфор, аммиак, остальное, из 40 раскрашенных для школьников.

- Есть ли шанс получить знания, когда наличие готовых ответов позволяет быстро списать?
Такой вариант возможен если:
Вы счастливый обладатель фотографической памяти,
Вы видите весь изученный курс, хотя времени на выполнение заданий нет. - Если учащийся осознает свои провалы в знаниях, с помощью этих решений можно разобрать учебный материал.
- Чтобы девятый класс качественно подготовился к итоговой контрольной по химии, одного базового учебника и школьных занятий будет недостаточно.Материал этой науки, изучаемой в 9 классе, достаточно обширен и сложен. А для того, чтобы его освоить, необходимо внимательно и глубоко разобраться во всех особенностях курса. Оптимальное решение в целях повышения эффективности своей работы – подобрать и использовать практические пособия и решебники к ним. Выбор можно доверить специалисту — учителю-предметнику, репетитору, руководителю кружка, курсов или справиться самостоятельно.

- Занятия для ГДЗ С мастерской помогут:
— понять логику поиска правильного решения даже по самым сложным задачам;
— Оцените и запомните порядок правильной записи результата.Нередко неправильно записанный ответ становится причиной досадной потери баллов на ПРД, диагностических, итоговых тестах;
— Самостоятельно работать с информацией — находить нужное, анализировать, обобщать и фиксировать выводы. - Найти грамотные, качественные мастерские непросто. Среди таких источников специалисты рекомендуют рабочую тетрадь по химии для 9 класса, составленную Габриеляном О.С. Сборник является частью УМК, в которую, кроме него, входят учебник, электронные приложения, инструментарий и рабочая программа.Последние два источника особенно пригодятся тем девятиклассникам, которые изучают химию самостоятельно, например, находясь на семейной форме обучения. По ним можно составлять эффективные планы прокачки и в своем темпе изучать дисциплину.
- Рабочая тетрадь хорошо систематизирована и иллюстрирована, содержит полезные материалы в удобной табличной форме, что позволяет сэкономить время на составлении самих таблиц.
 Это особенно важно для тех девятиклассников, у которых подготовка проходит в интенсивной, ускоренной форме.Часто этим пособием пользуются и одиннадцатиклассники при подготовке к ЕГЭ по химии. Итоговый контроль знаний, приведенных в сборнике, представлен в двух формах – это подготовка к итоговой контрольной работе по химии в девятом классе и к ОГЭ по дисциплине. В пособии много приложений, содержащих полезный и интересный материал для выполнения заданий из этого сборника и пополняющих багаж знаний по предмету.
Это особенно важно для тех девятиклассников, у которых подготовка проходит в интенсивной, ускоренной форме.Часто этим пособием пользуются и одиннадцатиклассники при подготовке к ЕГЭ по химии. Итоговый контроль знаний, приведенных в сборнике, представлен в двух формах – это подготовка к итоговой контрольной работе по химии в девятом классе и к ОГЭ по дисциплине. В пособии много приложений, содержащих полезный и интересный материал для выполнения заданий из этого сборника и пополняющих багаж знаний по предмету.
Рабочая тетрадь как эффективное средство подготовки
2-е изд., Чед. — М.: 201 4. — 2 24 с.
Предлагаемая тетрадь входит в состав учебного комплекса К учебнику Габриеляна О.С. «Химия. 9 класс». Учебник соответствует ФГОС основного общего образования. Также тетрадь может использоваться с учебником, отвечающим федеральному компоненту ГОСТ.Помимо тетради, в состав УМД входят электронное приложение к учебнику, методическое пособие и рабочая программа.Специальными знаками отмечены задания, направленные на формирование метадельта-умений (планировать, выделять различные признаки, сравнивать, классифицировать, устанавливать причинно-следственные связи, преобразовывать информацию и т. д.) и личностные качества Ученики.
Формат: PDF.
Размер: 2 МБ
Часы, скачать: drive.google
Содержимое
Обобщение сведений о строении вещества и химической реакции
Характеристика химического элемента-металла по его положению в периодической системе Менделеев Д.И. 5
Характеристика элемента-неметалла по положению в периодической системе Д.И. Менделеев 12
Амфотерные оксиды и гидроксиды 17
Периодический закон и периодическая система химических элементов Д.И. Менделеев в свете учения о строении атома 24
Обобщение сведений о химической реакции 30
Скорость химической реакции 33
Катализ и катализаторы 37
Металлы.
Положение металлов в периодической системе Менделеев Д.И. Строение атомов и кристаллов. Физические свойства 41
Общие химические свойства металлов 47
Получение металлов 52.
Коррозия металлов 56.
Щелочные металлы 60.
Соединения щелочных металлов 64
Бериллий, магний и пироземельные металлы 70
Соединения металлов 76
Неметалла
Общая характеристика неметаллов 101
Водород 106.
Галогены 112.
Соединения галогенов 117.
Кислород 122.
Сера 127.
Серная кислота бинарные соединения 081
Серсуриновая кислота соли 141
азот 144.
аммиак 149.
соли аммония 154.
оксиды азота 154.
азотных оксидов 158.
азотных кислот соли 163
фосфор 167.
Соединения фосфора 170.
углерода 175.
углеродных оксидов 179.
коалическая кислота и его соли 184
Кремний 187.
Силикатная промышленность 192.
Суммарный контроль знаний
Итоговое испытание 197
Подготовка к ГИА 202
Применение
1. Классификация неорганических веществ 2089 2 90.Химические свойства Основные классы неорганических веществ 210
3. Растворимость гидроксидов и солей в воде (при комнатной температуре) 212
4. Электрохимический ряд напряжений 213
5. Число электроотрицательности 213
6. Классификация химических реакций 214
7. Круговая классификация 215
8. Классификация кислот 215
9. Правила определения степеней окисления 216
10. Расстановка коэффициентов в уравнениях ОСР методом электронных весов 217
11.Плотность, твердость, теплопроводность, температуры плавления и кипения некоторых веществ 217
Учебное пособие «Рабочая тетрадь. 9 класс» предназначено для работы как на уроках, так и дома. В пособие включен раздел для повторения основных тем по химии, изученных вами в 8 классе. Каждому разделу учебника 9 класса соответствует раздел рабочей тетради, состоящий из двух частей.
Первая часть представляет собой четкий, лаконичный и очень содержательный конспект учебного материала, с которым вы знакомитесь на уроке.Авторы надеются, что этот реферат вы создадите в творчестве и сотрудничестве с нами и со своим учителем. Правильно оформленный и выученный реферат поможет в достижении желаемого результата.
Вторая часть тетрадного материала к абзацу тоже работает на результат. Выполнение заданий позволит вам не просто усвоить учебный материал, но и применить его в самостоятельной и контрольной работе, а также на экзаменах в форме ГИА и ЕГЭ. Поэтому многие задания предлагаются в формате этих госиспытаний.
- Тетрадь задач рабочего учебного занятия по химии 9 класса раскрывает основную цель контроля. Использование данного формата для проверки понимания предыдущей темы – шлифовка учителями девятиклассников.
- Школьники просматривают онлайн-версию, чтобы быстро написать нужный предмет. Оксиды, азот — это уже не страшные абзацы с непонятными формулами. Достаточно прочитать несколько прошлых уроков и зарубежных решений, чтобы разобраться. Предлагаемый подход к обучению повышает шансы школьников успеть на пропущенную школьную программу.
- По химии в 9 классе Габрушева готовые ответы без обязательного скачивания всех страниц вы можете найти по указанным материалам.
- Не спешите списывать со счетов решения химической реакции, не ознакомившись со всем ходом действия. Именно такой детальный разобранный подход к заданиям дает элементарное понятие разборки однотипных вопросов. Свойства металлов и подобную информацию рекомендуем изучить, это базовые основы, которые позволят любым тестом, неожиданными проверками решить уравнения.
- Химические положения, записанные в виде понятий каждой таблицы — хорошо подчеркивают всестороннее знание. Учитывайте все суждения, извлекайте учебник изучаемой темы, знание правил убережет от внезапных ситуаций за доской.
- Подготовка к ГФП и итоговым испытаниям по химии для тех, кто выбрал этот предмет для сдачи в ОГЭ, как правило, сопровождается серьезной подготовкой.Для получения высокого результата не обязательно обращаться за помощью к репетиторам, посещать довольно дорогие кружки и обучающие курсы. Можно эффективно и качественно подготовиться самостоятельно, используя доступные качественные учебники и решебники к ним. Для реализации этих задач помимо литературы и ГДЗ необходимы:
— целеустремленность и желание работать самостоятельно, умение ставить цели и добиваться желаемого;
— Грамотно составленный план работы. Он должен учитывать базовый уровень подготовки девятиклассника, его способности, интерес к дисциплине, уровень преподавания химии в школе, количество времени, которое можно регулярно уделять работе;
— График обучения, в котором необходимо определить этапы, сроки, когда будет осуществляться рублевый контроль достигнутых результатов.Если они неудовлетворительны, план и схему подготовки придется пересмотреть. Также это следует делать, если цели изменились (например, девятиклассник решил участвовать в олимпиаде, других олимпиадах по химии) или если задание выполняется очень легко. - Выбор литературы – один из самых ответственных этапов. Если качество школьного обучения устраивает, за помощью в выборе литературы можно обратиться к учителю-предметнику. Или самостоятельно добавить школьный базовый учебник с мастер-классами из того же СМС.Например, к комплексу Рудзитиса и Фельдмана специалисты рекомендуют рабочую тетрадь по химии для 9 класса, составленную Габрусевой Н.И. Книга содержит хорошо систематизированный материал практического плана для изучаемого по курсу химии для девятого класса:
— электролитическая диссоциация;
— металлургия;
— металлы общих свойств;
— важнейшие органические вещества и другие.
Тетрадь также может быть использована одиннадцатиклассниками при подготовке к выпускным испытаниям по химии — ЕГЭ.Практикум считается универсальным – их можно выполнять как рекомендованные УМК и использовать для практических работ по химии в комплекте с базовым учебником и заданиями, практическими сборниками других авторов.
Рабочая тетрадь по химии для девятиклассников — универсальный вариант
Практикум 1 химия 11 габриелян
Представлена разработка практической работы для 11 класса
«Практическая работа №2 — 11 кл»
Практикум № 2
Идентификация неорганических веществ.
цель работы
:
с помощью характеристических реакций распознать предлагаемые
неорганические вещества, определить качественный состав почвы.
Оборудование
:
Реагенты
:
Прогресс
:
Подготовить таблицу для учета выполнения работ по форме:
|
Что они делали |
Наблюдения |
Уравнения реакций |
|
2.Проведите эксперименты
3. Заполните таблицу.
4. Сделайте общий вывод.
Правила техники безопасности
Аккуратно обращайтесь с кислотами и щелочами. Аккуратно добавьте концентрированные кислоты в пробирку над подносом. Если кислота попала на кожу или одежду, быстро смойте ее большим количеством воды.
Ничего не пробуй.
В пробирку наливают не более 1 мл вещества.
Осторожно понюхайте летучие вещества, направляя рукой воздух из пробирки на себя.
Не закрывайте пробирку пальцем при встряхивании жидкости в ней. Встряхните содержимое, держась за верхнюю часть пробирки и слегка встряхивая.
Не наклоняйтесь над трубкой, так как брызги могут попасть в глаза.
Держите пробирку с нагретой жидкостью отверстием подальше от себя и от товарищей, так как иногда жидкость может выплескиваться из пробирки.
При нагревании пробирки не прикасайтесь к фитилю спиртовки, так как фитиль холодный и пробирка может лопнуть.
Горящую спиртовку нельзя переносить со стола на стол.
Зажигайте спиртовку только спичками.
Тушите спиртовку только колпачком.
После работы прибери свое рабочее место.
Опыт.
Качественные реакции на неорганические вещества.
Упражнение: в трех пронумерованных пробирках (1, 2, 3) веществ (1, 2, 3) веществ. определить, в какой из пробирок находятся данные вещества.
Для этого теста содержимое каждой пронумерованной пробирки разделите на три образца.
1. Для определения хлорида аммония — в пробирку с хлоридом аммония добавить раствор едкого натра, нагреть на пламени спиртовки.
Что ты смотришь?
2. Для определения соляной кислоты — в пробирку с соляной кислотой добавить раствор азотнокислого серебра.
Что ты смотришь?
Напишите уравнение реакции в молекулярной, полной ионной, сокращенной ионной формах.
3. Для определения сульфата натрия — в пробирку с сульфатом натрия добавить раствор хлорида бария.
Что ты смотришь?
4. Напишите уравнение реакции в молекулярной, полной ионной, восстановленной ионной формах.
Просмотр содержания документа
«Практическая работа №1-1»
Практикум №1
Цель работы
:
Оборудование и реактивы: прибор для получения газов, пробирки (2 шт.), штатив для пробирок, шпатель, мензурка, лучинка, спички, мрамор (CaCO 3 ), известковая вода (Ca(OH) 2), HCl (1:2).
Техника безопасности :
Прогресс
:
|
Действия |
Наблюдения |
Уравнения реакций. выводы |
|
Получение диоксида углерода |
СаСО |
|
|
Перенесите конец газоотводной трубки в пробирку с 1 мл известковой воды и пропустите через нее углекислый газ. Запишите уравнения соответствующих реакций. |
Са (ОН) |
Выход
:
Просмотр содержания документа
«Практическая работа №1-2»
Практикум №1
«Прием, сбор и распознавание газов»
Цель работы
:
Оборудование и реагенты : пробирки (3 шт.), спиртовка, спички, подставка, газоотводная трубка, хлористый аммоний (кристаллический), гидроксид кальция (кристаллический), стакан воды, индикаторная бумага, вата.
Техника безопасности
:
Прогресс
:
|
Действия |
Наблюдения |
Уравнения реакций. выводы |
|
NH 4 Cl + Ca (OH) 2 → NH 4 OH↔ |
Выход
:
Посмотреть содержание документа
«Практикум №1″1-3»
Практикум №1
«Прием, сбор и распознавание газов»
Цель работы
:
Оборудование и реактивы: пробирки (2 шт.), штатив для пробирок, шпатель, лучина, спички, перманганат калия (KMnO 4), индикаторная бумага.
Техника безопасности :
Прогресс
:
|
Действия |
Наблюдения |
Уравнения реакций.выводы |
|
Производство кислорода Получение кислорода. |
KMnO 4 → |
|
|
Сбор и распознавание диоксида углерода Заполните пробирку газом на 1 мин. Вставьте горящую лучину в стакан. Наблюдайте за изменениями. |
CxHy + О |
Выход
:
Просмотр содержания документа
«Практическая работа №1»
Практикум № 1.
«Прием, сбор и распознавание газов».
Цели урока: проверить правильность усвоения знаний о газообразных веществах, способах их получения и узнавания; продолжать формировать умение проводить эксперимент, наблюдать и делать выводы из увиденного.
Оборудование: компьютер, презентация, пробирки, спиртовка, спички, осколки, стеклянные пробирки; растворы: соляная кислота, уксусная кислота, перекись водорода, известковая вода; цинк, мрамор,
Во время занятий.
I. Подготовка к уроку (проверить готовность к уроку групп учащихся, оборудования, класса; отметить в журнале отсутствующих учащихся; сообщить тему и цель занятия).
II.Инструктаж по технике безопасности.
1. Какое воздействие кислоты оказывают на кожу и ткани человека? (При попадании на кожу или ткани человека кислоты разрушают их).
2. Какое действие щелочи оказывают на кожу и ткани человека? (При попадании на кожу или ткани человека щелочи разрушают их).
3. Как обращаться с кислотами и щелочами? (Кислоты и щелочи надо брать через трубочку и только в нужном количестве).
4. От чьей спиртовки ты можешь зажечь свою? (Спиртовку нельзя зажечь от другой спиртовки.Зажечь можно только спичкой).
Напомню, что при обращении со стеклянной посудой нужно быть очень осторожным, чтобы не раздавить и не разбить ее. Осколки разбитого стекла очень острые и могут нанести очень глубокие порезы.
III. Рабочий брифинг.
Вы будете выполнять практическую работу в соответствии с инструкциями.
По вашему выбору назовите практику, определите цель и определите оборудование и реагенты. При оформлении работы обязательно опишите свои действия и наблюдения, запишите уравнения химических реакций, сделайте чертеж установки для получения указанного вам газа, запишите заключение по работе.
По окончании работы навести порядок на рабочем месте.
IV. Выполнение работы.
«Получение, сбор и распознавание кислорода».
«Получение, сбор и распознавание углекислого газа».
«Получение аммиака»
Ознакомьтесь с правилами техники безопасности при работе со щелочами. Следуйте этим рекомендациям при проведении химического эксперимента.
Получение, сбор и распознавание аммиака
1) Поместите в ступку две мерные ложки хлорида аммония и гидроксида кальция.Разотрите смесь пестиком. Что ты чувствуешь?
2) Собрать установку для получения аммиака: сухую пробирку заполнить приготовленной смесью не более чем на ¼ ее высоты, закрыть пробирку пробкой с газоотводной трубкой, зафиксировать пробирку в ножке штатива с небольшим наклоном в сторону стопора. Поместите сухую трубку для сбора аммиака на восходящую трубку выхода газа.
3) Нагреть пробирку со смесью.
4) Поднесите влажную индикаторную бумагу к отверстию трубки с аммиаком.
5) Остановить нагрев. Вынуть трубку с нашатырным спиртом, не переворачивая, опустить отверстием вниз в стакан с водой. Накройте конец выхлопной трубы влажным ватным тампоном.
Посмотреть содержание документа
«Практикум, оборудование и реактивы 11 класса»
Практическая работа 11 класс
|
Должность |
Оборудование и реактивы |
|
|
Прием и распознавание газов |
Оборудование: штатив с пробирками, спиртовка, спички, осколки, стеклянные газовые трубки, вата, шпатель. Реактивы: растворы: соляная кислота, уксусная кислота, перекись водорода, известковая вода; цинк, мрамор., хлорид аммония, кристаллический гидроксид кальция, индикаторная бумага, перманганат калия. |
|
|
Идентификация неорганических веществ |
Оборудование Реагенты |
«Практикум по курсу органической химии 11 класс»
Практикум №1
«Определение качественного состава органического вещества»
цель работы
:
научиться определять наличие углерода и водорода в органическом веществе.
Оборудование и реактивы
: штатив лабораторный с ножкой, пробирка, пробка с газоотводной трубкой, дополнительная пробирка, стеклянная трубка, спиртовка, спички, парафин, окись меди (II), безводный сульфат меди (II), гидроксид кальция (известковая вода).
Прогресс .
Описание опыта
Наблюдения
Выводы и уравнения реакций
Опыт №1 «Окисление парафина
В сухую пробирку насыпаем 0,5 г парафина и 1 г оксида меди (II). Укрепите трубку в ножке штатива в горизонтальном положении. Небольшое количество безводного сульфата меди (II) помещали у горлышка пробирки с помощью стеклянной трубки.Трубку закрывают пробкой с газоотводной трубкой, конец которой погружают в другую трубку с 1,5-2 мл известковой воды.
Содержимое пробирки со смесью нагревали на пламени спиртовки, предварительно расплавив парафин.
оксид
медь (II) »
Выход:
C 18 H 38 + CuO →
Опыт №2 «Определение углерода»
Газообразные продукты разложения парафина пропускали через раствор известковой воды.
Выход:
CO 2 + Ca(OH) 2 →
Опыт №3 «Определение водорода»
Продукты разложения парафина пропускали через безводный сульфат меди (II).
Выход:
H 2 O + CuSO 4 →
Общий вывод:
Практическая работа № 2
«Получение и изучение свойств этилена»
цель работы
:
для получения этилена и изучения его свойств, для проведения качественных реакций на двойную связь.
Оборудование и реактивы
: штатив лабораторный с ножкой, пробирка, пробка с газоотводной трубкой, две дополнительные пробирки, спиртовка, спички, кусочки фарфора, спирт этиловый C 2 H 5 OH, серная кислота H 2 SO 4,
бромная вода Br 2, раствор перманганата калия KMnO 4.
Прогресс
Описание опыта
Наблюдения
Выводы и уравнения реакций
Опыт №1 «Получение этилена
В сухую пробирку наливали 1 мл этилового спирта и добавляли 3 мл концентрированной серной кислоты. Положите в смесь несколько кусочков битого фарфора для равномерного кипения. Трубка закрывалась пробкой с газоотводной трубкой и закреплялась в ножке штатива в горизонтальном положении.
Содержимое пробирки со смесью осторожно нагревали на пламени спиртовки до кипения.
обезвоживание
Спирт этиловый
Выход:
Опыт №2 «Взаимодействие этилена
Не прекращая нагревания смеси, конец газоотводной трубки опускали в пробирку с бромной водой и пропускали через нее этилен.
с бромом
вода
Выход:
Опыт №3 «Взаимодействие этилена
Не прекращая нагревания смеси, конец газоотводной трубки опускали в пробирку с подкисленным раствором малинового перманганата калия и пропускали через нее этилен.
с раствором
перманганат калия
Выход:
Эксперимент №4 «Сжигание этилена»
Не прекращая нагревания смеси, мы повернули газоотводную трубку вверх и подожгли выделившийся этилен с помощью спички.
Выход:
Общий вывод:
Практикум № 3
«Решение задач проектирования и качества по теме «Генетическая связь углеводородов, спиртов, альдегидов, карбоновых кислот»
цель работы
:
на основе знаний о химических свойствах углеводородов и их кислородсодержащих производных научиться решать задачи проектирования и качества для осуществления генетической связи органических веществ.
Оборудование и реактивы
: штатив для пробирок, пробирки, промывочная бутыль, сливное стекло, спиртовка, спички, держатель пробирок, CuSO 4, NaOH, медная проволока, метанол, этанол, формалин.
Прогресс:
Описание экспериментов
Наблюдения
Выводы и уравнения реакций
Опыт №1 «Получение альдегидов из
а) Смочили стенки сухой пробирки этиловым спиртом.Медную проволоку нагревали в пламени до появления черного налета. Горячую проволоку опускали в подготовленную пробирку. Мы повторили это.
спирты
Выход:
б) Смочили стенки сухой пробирки метиловым спиртом. Медную проволоку нагревали в пламени до появления черного налета. Горячую проволоку опускали в подготовленную пробирку. Мы повторили это.
Выход:
Опыт №2 «Получение углерода
В пробирку прибавляли 8 капель формалина, прибавляли 8 капель NaOH и при встряхивании по каплям CuSO 4 до появления неисчезающего осадка. Нагрел до кипения.
кислоты из
альдегиды»
Выход:
Общий вывод:
Практическая работа № 4
«Качественные реакции на кислородсодержащие органические вещества»
цель работы
:
на основе знаний о качественных реакциях научиться решать экспериментальные задачи по распознаванию органических веществ.
Оборудование и реактивы
: штатив для пробирок, пробирки, колба с водой, стакан для слива, спиртовка, спички, держатель пробирок, CuSO 4, NaOH, медная проволока, метиловый оранжевый, органические вещества в пробирках.
Задание: В четырех пронумерованных пробирках даны растворы: этанола, формалина, глицерина и уксусной кислоты. Экспериментально определите каждое из выданных веществ.
Прогресс:
Описание опыта
Наблюдения
Выводы и уравнения реакций
Опыт № 1 » Взаимодействие
Медь(II) гидроксид получали в четырех пробирках взаимодействием
сульфата меди(II) с гидроксидом натрия и добавлением к нему веществ №1, 2, 3, 4. Перемешал.
гидроксид
медь (II) »
Выход:
Опыт №2 «Взаимодействие с
Пробирки с веществами № и нет? а гидроксид меди (II) из опыта № 1 упрочняли в пробиродержателе и нагревали в пламени спиртовки.
гидроксид
медь (II) при нагреве»
Выход:
Опыт №3 «Решимость
В пробирку налили 1 мл раствора вещества № и добавили 1 каплю метилового оранжевого.
уксусная кислота
кислота
Выход:
Опыт №4 «Решимость
В пробирку наливают 1 мл раствора вещества №. Медную проволоку нагревают в пламени спиртовки до появления черного налета и погружают в исследуемое вещество.
этанол
Выход:
Учащиеся 11 класса
_____________________________
Лабораторные эксперименты
Лабораторный эксперимент №1 дата
_________
Построение периодической таблицы элементов с помощью карточек.
Цель:
моделирование построения периодической системы.
Оборудование и реактивы:
20 карт (6*10 см).
см. О.С. Учебник Габриеляна Химия 11 (базовый уровень) стр.205.
Прогресс
Выход
Лабораторный эксперимент №2 дата
_________
Определение типа кристаллической решетки вещества и описание его свойств
.
Цель:
научиться определять тип кристаллической решетки и описывать свойства веществ.
Оборудование и реактивы:
хлорид натрия, сахар, железо, сера, медь, сода, медный купорос, графит, нафталин, кремнезем.
Содержание и порядок эксперимента
см. О.С. Учебник Габриеляна Химия 11 (базовый уровень) стр.205 — 206.
Прогресс:
Тип кристаллической решетки
Вещества
Свойства вещества
Тип химической связи
Ионная
Атомная
Молекулярная
Металл
………………………………………….. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. ………………………………………….. …………………………………………. …………………………………………. …………………….
Лабораторный эксперимент №3 дата
_________
Знакомство с коллекцией полимеров: пластиков и волокон и изделий из них.
Цель:
познакомиться с коллекцией полимеров.
Оборудование и реактивы:
образцы пластмасс и волокон.
Содержание и порядок эксперимента
Прогресс
Polymer
полимерные свойства
Polymer Group
полиэтилен
полиэтилен
полипропилен
поливинилхлорид
нейлоновый волокна
хлопок
шерсть
Lavsan
вывод
…………………………………………. …………………………………………………………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. ………………………………………….. ………………………..
Лабораторный эксперимент №4 дата
_________
Испытание на жесткость воды. Устранение жесткости воды.
Цель:
проверить воду на жесткость, узнать, как устранить жесткость воды.
Оборудование и реактивы:
жесткая вода (раствор хлористого кальция), мыльный раствор, раствор карбоната натрия, пробирки, спиртовка.
Содержание и порядок эксперимента
см. О.С. Учебник Габриеляна Химия 11 (базовый уровень) стр.206.
Прогресс
Что они делали
Что наблюдали
Результат
Результат
…………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………… …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………….
Лабораторный эксперимент №5 дата
_________
Знакомство с минеральными водами.
Цель:
знакомство с минеральными водами.
Оборудование и реактивы:
пробы с минеральными водами, раствор соды, раствор кислоты, пробирки.
Содержание и порядок эксперимента
Прогресс
№ п/п
Образец
Ионы, входящие в состав воды
Раствор соды
Раствор кислоты
Тип воды
Запишите уравнения проведенных реакций:
…… …………………………………………………………………………………………………………………………………… …………………………………………………………………………………………………………………………………… ……………………………………………………
Выход
………………………………………….. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. ………………………………………….. …………………………………………. …………………………………………. …………………….
Лабораторный опыт № 6 дата
_________
Знакомство с дисперсными системами.
Цель:
знакомство с дисперсными системами.
Оборудование и реактивы:
суспензии, эмульсии, пасты, гели (с заводскими этикетками)
Содержание и порядок проведения опыта
см. О.Учебник С. Габриеляна Химия 11 (базовый уровень) стр.207.
Прогресс
Название образца
Применение
Срок годности
Суспензии
Эмульсии
Пасты
Гели
Выход
…………………………………………. …………………………………………. …………………………………………. …………………………………………………………………………………….. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. ………………………
Лабораторный эксперимент №7 дата
_________
Реакция замещения меди железом в растворе медного купороса.
Цель:
на основании проведенного опыта сделать вывод о протекании реакции замещения.
Оборудование и реактивы:
раствор медного купороса (медный купорос (II)), пуговица, пробирка.
Содержание и порядок эксперимента
см. О.Учебник С. Габриеляна Химия 11 (базовый уровень) стр.207.
Прогресс
Что делали
Что наблюдали
Заключение, уравнение реакции
Выход
…………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. ………………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. ………………….
Лабораторный эксперимент №8 дата
_________
Реакции с образованием осадка, газа и воды.
Цель:
на основании опыта сделать вывод о ходе реакции, протекающей с образованием осадка, газа и воды.
Оборудование и реактивы:
раствор гидроксида натрия, раствор фенолфталеина, раствор азотной кислоты, раствор уксусной кислоты, раствор карбоната натрия, раствор соляной кислоты, раствор азотнокислого серебра, раствор сульфата меди (сульфат меди (II)), раствор серной кислоты, раствор хлорида бария, пробирки.
Содержание и порядок эксперимента
см. О.С. Учебник Габриеляна Химия 11 (базовый уровень) стр.208.
Прогресс
Что делали
Что наблюдали
Заключение, уравнение реакции
Выход
…………………………………………. …………………………………………. …………………………………………. ……………………………………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. ……………………………………….
Лабораторный эксперимент №9 дата
_________
Производство кислорода путем разложения пероксида водорода с использованием оксида марганца (
IV
) и каталаза сырого картофеля.
Цель:
научиться получать кислород.
Оборудование и реактивы:
IV), сырой картофель, пробирки.
Содержание и порядок эксперимента
см. О.С. Учебник Габриеляна Химия 11 (базовый уровень) с.208 — 209.
Прогресс
Что они делали
Что наблюдали
Результат
Результат
…………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. ………………………………………….
Лабораторный эксперимент №10 дата
_________
Получение водорода при взаимодействии кислоты с цинком.
Цель:
узнать, как получить водород.
Оборудование и реактивы:
раствор соляной кислоты, раствор уксусной кислоты, цинк (гранулы), пробирки.
Содержание и порядок эксперимента
Прогресс
Что они делали
Что наблюдали
Результат
Результат
…………………………………………. ……………………………………………………… …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. ………………………………………….. …………………………………………. …………
Лабораторный эксперимент №11 дата
_________
Различные случаи гидролиза солей.
Цель:
рассмотреть различные случаи гидролиза.
Оборудование и реактивы:
раствор карбоната натрия, раствор хлорида цинка, раствор нитрата калия, универсальная индикаторная бумага, пробирки.
Содержание и порядок эксперимента
см. О.С. Учебник Габриеляна Химия 11 (базовый уровень) стр.209.
Прогресс
Раствор вещества
Индикатор
Заключение, уравнения реакции
Выход
…………………………………………. …………………………………………. …………………………………………. ……………………………………………………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. ………………………………..
Лабораторный эксперимент №12 дата
_________
Анализ растворов кислот, оснований и солей с помощью индикаторов.
Цель:
испытание растворов кислот, оснований, солей индикаторами.
Оборудование и реактивы:
раствор гидроксида натрия, раствор серной кислоты, раствор карбоната калия, раствор хлорида алюминия, раствор сульфата натрия, универсальная индикаторная бумага, пробирки.
Содержание и порядок эксперимента
см. О.Учебник С. Габриеляна Химия 11 (базовый уровень) стр.209.
Прогресс
Раствор вещества
Индикатор
Заключение, уравнения реакции
Выход
…………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. ………………………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………
Лабораторный эксперимент №13 дата
_________
Взаимодействие растворов соляной кислоты и уксусной кислоты с металлами.
Цель:
на основании проведенных опытов сделать вывод об условиях взаимодействия кислот с металлами.
Оборудование и реактивы:
раствор соляной кислоты, раствор уксусной кислоты, цинк (гранулы), медная проволока, пробирки.
Содержание и порядок эксперимента
Прогресс
Что делали
Что наблюдали
Заключение, уравнения реакций
Выход
………………………………………….. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. ………………………………………….. …………………………………………. …………………………………………. …………………….
Лабораторный эксперимент №14 дата
_________
Взаимодействие растворов соляной кислоты и уксусной кислоты с основаниями.
Цель:
на основании проведенных опытов сделать вывод об условиях взаимодействия кислот с основаниями.
Оборудование и реактивы:
раствор гидроксида натрия, раствор фенолфталеина, растворы соляной и уксусной кислот, пробирки.
Содержание и порядок эксперимента
см. О.С. Учебник Габриеляна Химия 11 (базовый уровень) стр.210.
Прогресс
Что делали
Что наблюдали
Заключение, уравнения реакций
Выход
……………………………………………………………… …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. ………………………………………….. …………………………………………. …………………………………………. …
Лабораторный эксперимент №15 дата
_________
Взаимодействие растворов соляной кислоты и уксусной кислоты с солями.
Цель:
на основании проведенных опытов сделать вывод об условиях взаимодействия кислот с солями.
Оборудование и реактивы:
раствор карбоната калия, раствор силиката калия, раствор соляной кислоты, раствор уксусной кислоты, пробирки.
Содержание и порядок эксперимента
Прогресс
Что делали
Что наблюдали
Заключение, уравнения реакций
Выход
…………………………………………. …………………………………………………………… …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. ………………………………………….. …………………………………………. ……
Лабораторный эксперимент №16 дата
_________
Получение и свойства нерастворимых оснований.
Цель:
изучить способ получения нерастворимых оснований и его свойства.
Оборудование и реактивы:
раствор медного купороса (II), раствор едкого натра, раствор серной кислоты, пробирки, спиртовка.
Содержание и порядок эксперимента
см. О.С. Учебник Габриеляна Химия 11 (базовый уровень) с. 210 — 211.
Прогресс
Что делали
Что наблюдали
Заключение, уравнения реакций
Выход
…………………………………………. …………………………………………. …………………………………………. ……………………………………………………………… …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. ….
Лабораторный эксперимент №17 дата
_________
Гидролиз хлоридов и ацетатов щелочных металлов.
Цель:
рассмотрим гидролиз хлоридов и ацетатов щелочных металлов.
Оборудование и реактивы:
раствор хлорида калия, раствор ацетата калия, индикаторная бумага универсальная, пробирки.
Содержание и порядок эксперимента
см. О.Учебник С. Габриеляна Химия 11 (базовый уровень) с. 211.
Прогресс
Что делали
Что наблюдали
Заключение, уравнения реакций
Выход
…………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. ……………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………..
Лабораторный эксперимент №17 дата
_________
Знакомство с коллекциями металлов, неметаллов, кислот, оснований, минералов и биологических материалов, содержащих некоторые соли.
Цель:
ознакомление с коллекциями металлов, неметаллов, кислот, оснований, минералов и биологических материалов.
Оборудование и реактивы:
алюминий, медь, цинк, свинец, сера, графит, лимонная кислота, уксусная кислота, серная кислота, гидроксид натрия, гидроксид железа (III), гидроксид меди (II), гидроксид кальция, минералы (мел, мрамор, апатит, галит, сильвинит ).
Содержание и порядок эксперимента
см. О.С. Учебник Габриеляна Химия 11 (базовый уровень) с.211 — 213.
Прогресс
1.Заполните таблицу:
Выход
…………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………………………………… …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………
2. Охарактеризуйте кислоту:
Кислота
Группа
Характеристика
3. Опишите основание:
База
Группа
Характеристика
………………………………………….. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. ………………………………………….. …………………………………………. …………………………………………. …………………….
4. Заполнить таблицу:
Название минерала
Формула и название основного компонента
Внешний вид
Применение
Выход
…………………………………………. …………………………………………. …………………………………………………………….. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. ………………………………………….. …..
Практическая работа
Практическая работа №1 дата
__________
Прием, сбор и распознавание газов.
Цель
:………………………………………………………………………………………………………………………………… …………………………………………………………………………………………………………………………………… ………………………………………………………………………………
Содержание и порядок эксперимента
см. О.С. Учебник Габриеляна Химия 11 (базовый уровень) с.214-215.
Задача 1. Получение, сбор и распознавание водорода.
Оборудование и реактивы:
цинк (гранулы), раствор соляной кислоты, пробирки, спиртовка.
Прогресс:
Что делали
Что наблюдали
Заключение, уравнение реакции
………………………………………………………………………………… ………………………………
……………………………………………………………………………………………… ……………………………………………………………………………………………………………………………………
Задача 2.Получение, сбор и распознавание кислорода.
Оборудование и реактивы:
раствор перекиси водорода, окись марганца (IV), пробирки, тлеющая осколок.
Прогресс:
Что делали
Что наблюдали
Заключение, уравнение реакции
Задание 3. Получение, сбор и распознавание углекислого газа.
Оборудование и реактивы:
мрамор, раствор уксусной кислоты, известковая вода, пробирки, тлеющее пятнышко, стеклянная трубка.
Прогресс:
Что делали
Что наблюдали
Заключение, уравнение реакции
Задание 4 — Получение, сбор и распознавание аммиака.
Оборудование и реактивы:
раствор хлорида аммония, раствор едкого натра, пробирки, спиртовка, штатив, лакмусовая бумажка.
Прогресс:
Что делали
Что наблюдали
Заключение, уравнения реакций
Задание 5: Производство, сбор и распознавание этилена.
Оборудование и реактивы:
полиэтиленовые гранулы, подкисленный раствор перманганата калия, пробирки, трубка с газоотводной трубкой, штатив, спиртовка.
Прогресс:
Что делали
Что наблюдали
Заключение, уравнения реакций
Общий вывод
………………………………………………………………………………………………….
……………………………………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. ……………………………
Марка ___________
Практикум № 2 дата
__________
Решение экспериментальных задач по идентификации органических и неорганических веществ.
Цель
:…………………………………………………………………………………………………………………………………. …………………………………………………………………………………………………………………………………… ………………………………
Содержание и порядок эксперимента
см. О.С. Учебник Габриеляна Химия 11 (базовый уровень) стр.216.
Упражнение 1.
Оборудование и реактивы:
раствор хлорида натрия, раствор карбоната натрия, раствор сульфата натрия, ……………………………………………………………………………………………………… ..
…………………………………………………………………………………………………………
Прогресс:
Что делали
Что наблюдали
Заключение, уравнение реакции
Задание 2.
Оборудование и реактивы:
раствор хлорида аммония, хлорид бария, хлорид алюминия, …………. ………………………………………………………………………………………………………………
Прогресс:
Что делали
Что наблюдали
Заключение, уравнение реакции
Задание 3.
Оборудование и реактивы:
раствор глюкозы, раствор глицерина, раствор белка, ……………………. ………………………………………………………………………………………………………………
Прогресс:
Что делали
Что наблюдали
Заключение, уравнение реакции
Задание 4.
Оборудование и реактивы:
раствор ацетата натрия, раствор аммиачной селитры, раствор сульфата калия, индикаторная бумага, пробирки.
Прогресс:
Что делали
Что наблюдали
Заключение, уравнение реакции
Выход
…………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………………….. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………………………………………. …………..
Марка __________
Каталожные номера:
О.С. Габриелян «Химия. 11 кл.» базовый уровень, Москва: Дрофа, 2012
Практикум по химии
8 класс
Практикум №1 «Техника обращения с лабораторным оборудованием»
Инструктаж по технике безопасности.
Лабораторное оборудование
1. Конструкция и принцип работы лабораторного штатива (нарисуйте штатив, обозначьте его составные части)
2. Устройство и принцип действия спиртовки (нарисуйте спиртовку, обозначьте ее составные части)
3. Посуда (пробирки, колбы, химический стакан)
4.Фильтрование:
1. подготовить фильтровальную бумагу;
2. смочите фильтровальную бумагу;
3. положить в воронку;
4.жидкость переливают по стеклянной палочке, направляя ее к стенке воронки;
5. фильтрат стекает по стенке стакана, а не к центру, чтобы не выплескиваться.
Найдите в тексте определения фильтрата, кека и процесса фильтрации.
Практическая работа № 2 «Наблюдение за горящей свечой»
Опыт 1. Физические явления при горении свечи
Зажечь свечу. Вы увидите, как парафин возле фитиля начнет таять, образуя круглую лужу. Какой процесс (физический или химический) здесь происходит?
Возьмите стеклянную трубку, согнутую под прямым углом щипцами для тигля, вставьте ее один конец в середину пламени, а другой опустите в пробирку.Что вы видите?
1. Плавки парафиновые. Это плавление является физическим процессом.
2. Запотевают стенки пробирки — это конденсация — физический процесс.
Опыт 2. Обнаружение продуктов горения в пламени
Взять кусочек жести (2х2 см) из консервной банки или предметное стекло микроскопа щипцами для тигля, поместить его в область темного конуса горящей свечи и удерживать в течение 3-5 секунд. Поднимите быстро лист (стекло), посмотрите на нижнюю плоскость. Объясните, что там появилось.
Закрепите сухую пробирку в держателе, переверните ее вверх дном и держите над пламенем, пока она не запотеет. Объясните наблюдаемое явление.
В ту же пробирку быстро добавить 2-3 мл известковой воды. Что ты смотришь? Дайте объяснение.
1. Появилось темное (черное) пятно — это сажа (нагар), образовавшаяся при горении парафина.
2. На стенках трубки конденсируется влага. При этом конденсируется вода, один из продуктов горения парафина.
3. При наливании в пробирку известковой воды она мутнеет:
Это говорит о том, что вторым продуктом горения парафина является углекислый газ.
Опыт 3. Влияние воздуха на горение свечи
Вставьте стеклянную трубку с оттянутым концом в резиновую грушу, сжав ее рукой, вдуйте воздух в пламя горящей свечи. Как изменилась яркость пламени?
Прикрепите две свечи расплавленным парафином к картону (фанере, оргалиту). Зажгите их и накройте одним полулитровой банкой, другим 2-литровой банкой (можно взять мензурки разной емкости). Когда свеча горит дольше? Почему?
Запишите уравнения реакций горения, если вещества, входящие в состав свечи, имеют формулы С 16 Н 34 и С 17 Н 36.
1. Яркость пламени увеличивалась по мере увеличения потока кислорода.
2. Свеча в банке большего размера горит дольше, потому что в ней больше кислорода.
Практическая работа № 3 «Анализ почвы и воды»
Опыт 1. Механический анализ почвы
Поместите почву в пробирку (столбик почвы должен быть 2-3 см). Влейте дистиллированную воду, объем которой должен в 3 раза превышать объем грунта.
Закрыть пробирку пробкой и тщательно встряхнуть в течение 1-2 минут, затем вооружиться лупой и наблюдать за отложением частиц грунта и структурой отложений.Опишите и объясните свои наблюдения.
Сначала осядут более крупные и тяжелые частицы песка и глины, затем более мелкие, но раствор очень долго будет оставаться мутным — мельчайшие частицы находятся во взвешенном состоянии.
Опыт 2. Получение почвенного раствора и опыты с ним
Приготовьте бумажный фильтр, вставьте его в воронку, закрепленную в кольце штатива. Поместите под воронку чистую сухую пробирку и профильтруйте смесь почвы и воды, полученную в первом опыте.Не встряхивайте смесь перед фильтрованием. Почва останется на фильтре, а фильтрат, собранный в пробирке, представляет собой почвенную вытяжку (почвенный раствор).
Нанесите несколько капель этого раствора на стеклянную пластину и пинцетом подержите над горелкой, пока вода не испарится. Что ты смотришь? Объяснять.
Возьмите две лакмусовые бумажки (красную и синюю), нанесите на них почвенный раствор стеклянной палочкой. Сделайте вывод по результатам своих наблюдений.
1. После испарения воды на стекле останется белый налет; это смесь веществ, растворенных в воде при перемешивании.
2. Универсальная лакмусовая бумажка не меняет своего цвета, если раствор нейтральный, краснеет, если он кислый, и синеет, если он щелочной.
Опыт 3. Определение прозрачности воды
Для опыта необходим прозрачный плоскодонный стеклянный цилиндр диаметром 2-2,5 см и высотой 30-35 см. Можно использовать мерный цилиндр без пластикового стоять.
Рекомендуется провести опыт сначала с дистиллированной водой, а затем с водой из водоема и сравнить результаты.Поместите цилиндр на напечатанный текст и налейте тестовую воду, убедившись, что текст можно прочитать через воду. Обратите внимание, на какой высоте вы не увидите шрифт. Измерьте высоту водяных столбов линейкой. Делать выводы.
Измеренная высота называется уровнем видимости.
Если уровень видимости низкий, то водоем сильно загрязнен.
Опыт 4. Определение интенсивности запаха воды
Коническую колбу наполнить на 2
/
3
объема испытуемой воды, плотно закрыть пробкой (желательно стеклянной) и энергично встряхнуть.Затем откройте колбу и обратите внимание на характер и интенсивность запаха. Оцените интенсивность запаха воды в баллах, пользуясь таблицей 8.
Используйте таблицу № 8 (стр. 183).
Практикум № 4 «Признаки химических реакций»
Опыт 1. Прокаливание медной проволоки и взаимодействие оксида меди(II) с серной кислотой
Зажечь спиртовку. Возьмите медную проволоку щипцами для тигля и вставьте ее в пламя. Через некоторое время снимите проволоку с огня и счистите образовавшийся на листе бумаги черный налет.Повторите эксперимент несколько раз. Полученный черный налет поместите в пробирку и влейте в нее раствор серной кислоты. Нагрейте смесь. Что ты смотришь?
Образовалось ли новое вещество при нагревании меди? Напишите уравнение химической реакции и определите ее вид по количеству и составу исходных веществ и продуктов реакции. Какие признаки химической реакции вы заметили? Образовалось ли новое вещество при взаимодействии оксида меди (II) с серной кислотой? По количеству и составу исходных веществ и продуктов реакции определите тип реакции и запишите ее уравнение.
1. При прокаливании медной проволоки медь окисляется и образуется черный оксид меди (II). Это реакция соединения.
2. Образовавшийся оксид меди(II) растворяется в серной кислоте, раствор окрашивается в синий цвет, образуется сульфат меди(II):
Это реакция обмена.
Опыт 2. Взаимодействие мрамора с кислотой
Поместите 1-2 кусочка мрамора в небольшой стакан. Налейте в стакан достаточно соляной кислоты, чтобы покрыть кусочки. Подожгите осколок и поместите его в стакан.
Образуются ли новые вещества при взаимодействии мрамора с кислотой? Какие признаки химических реакций вы наблюдали? Запишите уравнение химической реакции и укажите ее вид по количеству и составу исходных веществ и продуктов реакции.
1. Мрамор растворился в соляной кислоте, произошла химическая реакция:
Опыт 3. Взаимодействие хлорида железа (III) с роданидом калия
В пробирку налить 2 мл раствора хлорида железа (III), а затем несколько капли раствора тиоцианата калия KSCN — кислая соль HSCN, с кислотным остатком SCN-
.
Каковы признаки этой реакции? Запишите ее уравнение и тип реакции, исходя из количества и состава исходных веществ и продуктов реакции.
Раствор стал ярко-красным, образовался тиоцианат железа (III). Это реакция обмена.
Опыт 4. Взаимодействие карбоната натрия с хлоридом кальция
В пробирку налить 2 мл раствора карбоната натрия. Затем добавьте несколько капель раствора хлорида кальция. Что ты смотришь? Запишите уравнение химической реакции и укажите ее вид по количеству и составу исходных веществ и продуктов реакции.
Наблюдается выделение белого кристаллического осадка сульфата бария. Это реакция обмена.
Практическая работа № 5 «Приготовление раствора сахара и определение его массовой доли в растворе»
Отмерить мерным цилиндром 50 мл дистиллированной воды и налить ее в коническую колбу вместимостью 100 мл.
Взвесьте чайную ложку сахарного песка (или две штуки) на лабораторных весах, затем поместите ее в колбу с водой и перемешайте стеклянной палочкой до полного растворения.
Теперь приступим к расчетной части. Сначала вычисляют массовую долю сахара в растворе. У вас есть необходимые данные: массу сахара, объем воды, плотность воды примите равной 1 г/мл.
9 класс
Практическая работа №1 «Реализация цепочки химических превращений»
Проведите реакции, в которых осуществляются предложенные ниже химические превращения (по вариантам).
Запишите уравнения соответствующих реакций.Также запишите реакции ионного обмена в ионной форме.
Вариант 1.
Проведем следующие преобразования:
Вариант 2.
Вариант 3.
Вариант 3.
Практикум № 2 «Получение и свойства соединений металлов»
Упражнение 1 действует правило — «сумма не меняется от перемены мест слагаемых». Верно ли это для химии? Проверьте это с помощью следующего эксперимента.
Получите гидроксид алюминия обменной реакцией и докажите его амфотерность.Для этого можно воспользоваться реакцией, уравнение которой
. Провести эту реакцию в двух вариантах, используя в каждом варианте одинаковые объемы исходных веществ: сначала к раствору одного из исходных веществ добавить по каплям раствор другого реагента. вещества (реагента), затем меняют последовательность введения реагентов в реакцию. Проследите, в каком случае выпадет осадок, а в каком нет.
Объясните результаты и запишите уравнения реакций, проведенных в молекулярной и ионной формах.
Задание 2
Провести реакции, подтверждающие качественный состав хлористого кальция. Запишите уравнения реакций в молекулярной и ионной формах.
Задание 3
Провести преобразования по следующей схеме 1
:
1
Для второго преобразования используйте хлорную воду.
Напишите уравнения соответствующих реакций и рассмотрите их с точки зрения окислительно-восстановительных. Проведите качественные реакции, чтобы подтвердить наличие продуктов реакции.Запишите уравнения реакций в молекулярной и ионной формах.
Задание 4
Получить сульфат железа (II) не менее чем тремя способами. Напишите уравнения реакций ионного обмена в ионной и молекулярной формах и рассмотрите реакции замещения с позиций окислительно-восстановительных.
Задание 5
Провести реакции, подтверждающие качественный состав сульфата железа (II). Запишите уравнения соответствующих реакций в молекулярной и ионной формах.
Практикум № 3 «Экспериментальные задачи по распознаванию и получению веществ»
Данные Вам три пробирки (варианты 1, 2 или 3) содержат твердые вещества, а три другие (вариант 4) — растворы веществ.
Экспериментальным путем определите, в какой пробирке находится каждое из данных вам веществ. Напишите уравнения соответствующих реакций в молекулярной и ионной формах.
После этой части работы выполните одно-два экспериментальных задания из следующего списка (по указанию учителя).
Вариант 1
а) гидроксид натрия;
б) карбонат калия;
в) хлорид бария.
Вариант 2
а) карбонат кальция;
б) сульфат натрия;
в) хлорид калия.
Вариант 3
а) нитрат бария;
б) сульфат натрия;
в) карбонат кальция.
Вариант 4
а) хлорид натрия;
б) хлорид алюминия;
в) хлорид железа (III).
Задача 1. Опытным путем доказать, что сульфат железа, образец которого вам дали, содержит примесь сульфата железа (III).Напишите уравнения соответствующих реакций в молекулярной и ионной формах.
Задача 2. Получить оксид железа (III), исходя из хлорида железа (III). Напишите уравнения соответствующих реакций, а также уравнения реакции с участием электролита и в ионной форме.
Задача 3. Получить раствор алюмината натрия из хлорида алюминия. Напишите уравнения реакций, протекающих в молекулярной и ионной формах.
Задание 4. Получить сульфат железа (II) из железа.Запишите уравнения проведенных реакций и проанализируйте окислительно-восстановительные процессы.
Практическая работа № 4 Экспериментальные задания по теме «Подгруппа кислорода»
Задача 1.Провести реакции, подтверждающие качественный состав серной кислоты. Запишите уравнения реакций.
Задача 2. Поместите 1-2 гранулы цинка в пробирку и налейте в нее около 1 мл разбавленной серной кислоты. Что вы видите? Напишите уравнение реакции и рассмотрите окислительно-восстановительные процессы.
Задача 3. Налить раствор сульфида натрия в две пробирки. В одну из них налейте хлорную воду, а в другую бромную. Что вы видите? Объясните свои наблюдения. Напишите уравнения соответствующих реакций в молекулярной и ионной формах.
Хлорная и бромная вода являются окислителями, поэтому в обеих пробирках сульфид окисляется до серы. Растворы обесцвечиваются.
Задание 4. Вам даны три пробирки с растворами. Определите, какой из них содержит соляную кислоту, серную кислоту и гидроксид натрия.Напишите уравнения соответствующих реакций в молекулярной и ионной формах.
Задание 5. Определить, содержит ли поваренная соль сульфаты. Запишите уравнения реакций в молекулярной и ионной формах.
Задание 6. С помощью характерных реакций определите, является ли данная вам соль сульфатной, йодидной или хлоридной. Напишите уравнения соответствующих реакций в молекулярной и ионной формах.
Задание 7. Исходя из оксида меди(II), получить раствор сульфата меди(II) и выделить из него кристаллический сульфат меди.Напишите уравнения соответствующих реакций в молекулярной и ионной формах.
Задача 8. Вам даны три пробирки с растворами сульфата натрия, сульфита и сульфида натрия. С помощью одного реактива определить, в какой пробирке находится каждое из веществ. Напишите уравнения соответствующих реакций в молекулярной и ионной формах.
Практическая работа № 5 Экспериментальные задания по теме «Подгруппы азота и углерода»
Задача 1. Проведите реакции, с помощью которых можно доказать, что данное вам в закрытых сосудах вещество:
а) хлорид аммония;
б) карбонат натрия;
в) нитрат аммония;
г) аммиак;
д) карбонат кальция;
f) силикат натрия.
Задача 2. Опытным путем доказать, что сульфат аммония и нитрат аммония нельзя смешивать с известью перед внесением этих удобрений в почву, и объяснить, почему. Запишите уравнения реакций.
Задача 3. Опытным путем доказать, что:
а) хлорид аммония содержит ионы NH4+ и Cl-;
б) сульфат аммония содержит ионы NH 4+ и SO 4 2-.
Напишите уравнения реакций, проводимых в молекулярной и ионной формах.
Задание 4. Получить аммиак из следующих солей:
а) хлорид аммония;
б) сульфат аммония;
в) нитрат аммония.
Напишите уравнения реакций, проводимых в молекулярной и ионной формах.
Задание 5. Выполните реакции, которые выражаются сокращенными ионными уравнениями. Напишите уравнения реакций, проводимых в молекулярной и ионной формах.
Задание 6. В четырех пробирках вам даны кристаллические вещества: сульфат натрия, хлорид цинка, карбонат калия, силикат натрия. Определите, какое вещество находится в каждой пробирке. Запишите уравнения реакций в молекулярной и ионной формах.
Практическая работа № 6
Вариант 1.
Опыт 1. Получение, сбор и распознавание водорода
Собрать газогенерирующее устройство и проверить на герметичность. Поместите 1-2 гранулы цинка в пробирку и добавьте в нее 1-2 мл соляной кислоты. Закройте пробирку пробкой с вентиляционной трубкой (см. рис. 43) и наденьте на кончик пробирки другую трубку. Подождите некоторое время, пока трубка не заполнится выделяющимся газом.
Вынуть пробирку с водородом и, не переворачивая, поднести к горящей спиртовке.Если водород взрывается с глухим хлопком, то он чистый, а если с «лающим» звуком, значит, водород собирается в смеси с воздухом («гремучий газ»).
Вопросы и задания
1. Что происходит при взаимодействии цинка с соляной кислотой? Составьте уравнение реакции и дайте его характеристику по всем изученным признакам классификации химических реакций.
2. Рассмотреть зарегистрированную реакцию с точки зрения окислительно-восстановительных процессов.
3. Опишите физические свойства водорода, непосредственно наблюдаемые в ходе эксперимента.
4. Опишите, как можно распознать водород.
Опыт 2. Прием, сбор и распознавание аммиака
Соберите прибор, как показано на рисунке 113, и проверьте его на герметичность.
Налейте по одной ложке хлорида аммония и гидроксида кальция в фарфоровую чашку, чтобы сжечь вещества. Перемешайте смесь стеклянной палочкой и перелейте в сухую пробирку. Закройте его пробкой и зафиксируйте в ножке штатива (обратите внимание на наклон пробирки относительно отверстия!).Поместите сухую трубку для сбора аммиака на газоотводную трубку.
Пробирку со смесью хлорида аммония и гидроксида кальция прогреть сначала (2-3 движения пламени), а затем в том месте, где находится смесь.
Для обнаружения аммиака подложите влажную фенолфталеиновую бумагу к горлышку перевернутой пробирки.
Прекратить нагревание смеси. Выньте пробирку с аммиаком из газоотводной трубки. Немедленно закройте конец дымохода куском влажной ваты.
Немедленно закройте отверстие извлеченной трубки большим пальцем и поместите ее в емкость с водой. Снимайте палец только под водой. Что вы видите? Почему поднялась вода в пробирке? Поместите палец над отверстием трубки под водой и извлеките ее из сосуда. В пробирку добавить 2-3 капли раствора фенолфталеина. Что ты смотришь?
Проведите аналогичную реакцию между растворами щелочи и соли аммония при нагревании. Поместите влажную индикаторную бумагу на отверстие пробирки.Что ты смотришь?
Вопросы и задания
1. Что происходит при реакции хлорида аммония и гидроксида кальция? Составьте уравнение реакции и дайте его характеристику по всем изученным признакам классификации химических реакций.
2. Опишите физические свойства аммиака, непосредственно наблюдаемые в эксперименте.
3. Опишите не менее двух способов распознавания аммиака.
Вариант 2.
Опыт 1. Получение, сбор и распознавание кислорода
Соберите устройство, как показано на рис. 114, и проверьте его на герметичность.В пробирку налить перманганат калия KMnO примерно на ¼ ее объема 4
и приложите к отверстию пробирки ватный тампон. Закройте трубку пробкой с газоотводной трубкой. Прикрепите трубку к ножке штатива так, чтобы конец газоотводной трубки почти доходил до дна сосуда, в котором будет собираться кислород. Проверить наличие кислорода в сосуде с тлеющей лучиной.
Вопросы и задания
1. Что происходит при нагревании перманганата калия? Составьте уравнение реакции и дайте его характеристику по всем изученным признакам классификации химических реакций.
2. Рассмотреть зарегистрированную реакцию с точки зрения окислительно-восстановительных процессов.
3. Опишите физические свойства кислорода, непосредственно наблюдаемые в эксперименте.
4. Опишите, как вы узнали кислород.
Опыт 2. Получение, сбор и распознавание оксида углерода (IV)
Несколько кусочков мела или мрамора поместить в пробирку и добавить 1-2 мл разведенной соляной кислоты. Быстро закрыть флакон пробкой с вентиляционной трубкой. Опустите конец пробирки в другую пробирку, содержащую 2-3 мл известковой воды.
Понаблюдайте, как пузырьки газа в течение нескольких минут проходят через известковую воду.
Вопросы и задания
1. Что происходит при взаимодействии мела или мрамора с соляной кислотой? Составьте уравнение реакции и дайте его характеристику по всем изученным признакам классификации химических реакций.
2. Рассмотреть проведенную реакцию в свете теории электролитической диссоциации.
3. Опишите физические свойства монооксида углерода (IV), непосредственно наблюдаемые в эксперименте.
4. Опишите, как вы распознали угарный газ (IV).
Эта реакция является качественной на углекислый газ.
11 класс
Практическая работа №1 «Получение, сбор и распознавание газов»
Вариант 1. Получение, сбор и распознавание водорода
Добыть, собрать, распознать водород и провести опыты, характеризующие его свойства. Напишите уравнения соответствующих реакций.
В пробирку налили немного соляной кислоты и капнули гранулу цинка.Трубку закрывали пробкой с газоотводной трубкой, конец которой опускали в другую трубку, перевернутую вверх дном. Мы наблюдаем эволюцию пузырьков газообразного водорода. Через некоторое время вторую пробирку перевернули и поднесли тщательно горящую горелку. Водород выгорает, вода конденсируется на стенках пробирки.
Вариант 2. Получение, сбор и распознавание кислорода
Получение, сбор, распознавание кислорода и проведение опытов, подтверждающих его химические свойства.Напишите уравнения соответствующих реакций.
В пробирку налили немного перманганата калия, вложили внутрь комок ваты и закрыли пробкой с газоотводной трубкой. Затем пробирку закрепляли на штативе так, чтобы конец трубки доставал до дна стакана, в котором будет собираться кислород. Нагрели пробирку, набрали полный стакан кислорода (наполнение стакана проверяем тлеющей горелкой, он разгорается) и закрыли стакан картонкой.
Вариант 3. Получение, сбор и распознавание углекислого газа
Получение, сбор, распознавание углекислого газа и проведение опытов, подтверждающих его химические свойства. Запишите уравнения соответствующих реакций. Взяли кусочек угля, нагрели его в пламени горелки и опустили в сосуд с кислородом, он загорелся желто-голубым пламенем.
Вариант 4. Получение, сбор и распознавание этилена
Смесь, состоящая из одной части натрия ацетата безводного и двух частей натрия гидроксида (безводного), помещали в пробирку, снабженную газоотводной трубкой.Пробирку устанавливали горизонтально на штатив и нагревали. Выделившийся газ пропускали в отдельные пробирки с раствором брома и перманганата калия. Растворы не меняют свой цвет. Поджигают газ, вырывающийся из трубки, он горит голубым несветящимся пламенем. В пробирку помещали немного концентрированной серной кислоты.
Гдз по химии Габриелян 9 работа тетра. Рабочая тетрадь как инструмент эффективной подготовки
- Рабочая тетрадь для занятий по химии 9 класса раскрывает основную цель контроля.Использование этого формата для проверки понимания предыдущей темы — учителя используют при опросе девятиклассников.
- Школьники рассматривают онлайн-версию, чтобы быстрее писать нужный предмет. Оксиды, азот уже не такие страшные абзацы с непонятными формулами. Достаточно прочитать несколько прошлых уроков и посторонних решений, чтобы понять. Предлагаемый подход к обучению повышает шансы учащихся угнаться за школьной программой.
- По химии в 9 классе Габрусева, готовые ответы без необходимости скачивать все страницы, можно найти по приведенным материалам.
- Не спешите списывать решения на химическую реакцию, не зная всего хода действия. Именно такой детальный подход к задачам дает элементарное понятие при рассмотрении однотипных вопросов. Советуем изучить свойства металлов и подобную информацию, это основные основы, которые позволят решать уравнения с любыми тестами, неожиданными проверками.
- Химические позиции, написанные как понятия каждой таблицы, хорошо подчеркнуты.сложные знания. Обдумайте все суждения, просмотрите учебник изучаемой темы, знание правил убережет от внезапных ситуаций у доски.
- Подготовка к ВПР и выпускным испытаниям по химии для тех, кто выбрал этот предмет для сдачи ОГЭ, как правило, сопровождается серьезной подготовкой. Для получения высокого результата необязательно обращаться за помощью к репетиторам, посещать достаточно дорогие кружки и обучающие курсы.Вы сможете эффективно и качественно подготовиться, используя доступные качественные учебные пособия и решения для них. Для достижения этих целей помимо литературы ГДЗ необходимы:
— целеустремленность и желание работать самостоятельно, умение ставить цели и добиваться желаемого;
— грамотно составленный план работы. Следует учитывать базовый уровень подготовки девятиклассника, его способности, интерес к дисциплине, уровень преподавания химии в школе, количество времени, которое можно регулярно уделять работе;
— график подготовки, в котором необходимо определить этапы, сроки, когда будет осуществляться промежуточный контроль достигнутых результатов.Если они окажутся неудовлетворительными, план и схему тренировок нужно будет пересмотреть. То же самое следует сделать, если цели изменились (например, девятиклассник решил участвовать в олимпиадах, других олимпиадах по химии) или если выполнение поставленных задач очень легкое. - Выбор литературы – один из важнейших этапов. Если качество преподавания в школе удовлетворительное, можно обратиться к учителю-предметнику за помощью в выборе литературы. Или самостоятельно дополнить школьный базовый учебник мастер-классами из тех же методических материалов.Например, к комплексу Рудзитиса и Фельдмана специалисты рекомендуют рабочую тетрадь по химии для 9 класса, составленную Габрусевой Н.И. Книга содержит хорошо систематизированный практический материал по темам, изучаемым в курсе химии девятого класса:
— электролитическая диссоциация;
— металлургия;
— металлы общих свойств;
— важнейшее органическое вещество и другие.
Тетрадь также может быть использована одиннадцатиклассниками при подготовке к итоговым итоговым испытаниям по химии — ЕГЭ.Практикум считается универсальным – его можно комплектовать как рекомендованными учебно-методическими материалами, так и использовать для практической работы по химии в комплекте с базовым учебником и задачниками, практическими сборниками других авторов.
Рабочая тетрадь по химии для девятиклассников — универсальный вариант
Химия 9 класс
Рабочая тетрадь
Габриелян Сладков
Для понимания химия требует высокой концентрации и внимания. Не все девятиклассники обладают этими качествами. Решебник который идет в комплекте с учебником. «Химия Рабочая тетрадь 9 класс Габриелян, Сладков Дрофа» поможет Вам справиться с более сложными заданиями по химии для 9 класса .
Что можно сказать о решателе
Эта книга отлично справляется с задачей обучения детей. химия . Среди его достоинств можно выделить следующие:
- Интересный дизайн абзаца.
- Задания, как правило, простые, если вы хорошо понимаете пройденный материал.
- Все объясняется просто и понятно.
- Эксперименты, которые вы будете ставить вместе с учителем или самостоятельно.
Подводя итоги, можно сказать, что данный учебник имеет огромное количество достоинств и идеально подходит для изучения химия на базовом уровне.
Что может вам помочь
Было сказано о Решебник . Не стоит воспринимать его как способ просто списать задачи и получить пятерку. Он создан специально для того, чтобы помочь вам разобраться в любой сложной теме.
Решебник , конечно, не сможет дать вам знаний, но сможет помочь в понимании решения любой проблемы со 100% вероятностью.
В конце девятиклассников подростков ждет государственная аттестация, которая особого восторга ни у кого не вызывает, тем более что требуется сдать не только необходимые предметы, но и химию . Именно из-за этого этой дисциплине уделяется такое повышенное внимание. Многочисленные лабораторные и проверочные работы должны стать причиной понимания студентами предмета и последующей успешной сдачи экзаменов. Для помощи в учебе книга-решение к учебнику называется «Химия.Рабочая тетрадь 9 класс» Габриелян, Сладков . Издательство «Дрофа», 2014
Что в нее входит.
Пособие имеет нумерацию страниц, что очень удобно для быстрого поиска нужного задания. Тщательно детализированные упражнения ГДЗ по химии 9 класс Габриелян помочь учащимся лучше усвоить материал В конце пособия приведены дополнительные задания для подготовки к ГИА
Нужен решатель
Сложность некоторых заданий требует безоговорочной помощи, которая у подростков зачастую просто отсутствует негде взять.Можно, конечно, надеяться, что оно все равно пройдет, и тем самым подвергнуть себя риску получить двойку. Или вы можете воспользоваться учебником «Химия. Рабочая тетрадь 9 класс» Габриеляна , с помощью которого вы сможете разобраться во всех тонкостях решения нужного упражнения.
Химия Рабочая тетрадь 9 класс Гара Ахметов «Вентана-граф»
Школьная программа по химия с каждым годом становится все сложнее. Многие девятиклассников не очень преуспели в этом.Пробелы в понимании материала грозят неудовлетворительными результатами в учебе и проблемами в будущем. Во избежание этого специалисты рекомендуют использовать «ГДЗ по химии 9 класс Рабочая тетрадь Гара, Ахметова Вентана-кол» .
Helpful Assistant
Подробно описаны правильные и предельно понятные онлайн-ответы. Они помогут:
- выполнить заданную дома работу без ошибок;
- хорошо подготовиться к самостоятельной работе в классе;
- понять и разобрать особо сложную тему.
наслаждайтесь решателем просто и легко. Его структура аналогична учебному пособию, а номера упражнений точно такие же. Систематическое использование ГДЗ только положительно скажется на обучении.
Что в тетради
Специальные пособия, входящие в учебные наборы, помогут запомнить и отработать пройденный материал в полном объеме. Рабочая тетрадь по химии для 9 класса авторов Гара, Ахметова одна из тех. Работая в ней, студент будет закреплять не только теоретические знания, но и практические навыки и умения.Издание соответствует всем требованиям ФГОС и рекомендовано для образовательных учреждений.
- В 9 классе уже понимают, кем ученикам суждено стать в будущем. Отличники по химии — не только готовые работы в тетрадях, списание которых не несет знаний; но личное понятие о химической реакции, изучение скорости процесса и образующихся продуктов.
- Разбор упражнений, изложенных в тетради для 9 класса, наличие ГДЗ под авторством Габриелян О.С., Сладков С.А. Книги по химии — не всегда простой способ обмануть ответы.
Это отличный самоконтроль заданий, разбор вариантов проверки плана тестирования, расположенного после изученной темы. - Особое внимание, достаточно времени, студент должен уделить отведенным вопросам, подготовленным для итоговой оценки. Имея представление о заполнении таблиц, относящихся к школьным материалам, ГДЗ по рабочая тетрадь Габриелян Сладкова, позволяют провести самоконтроль по темам фосфор, аммиак, остальное, из 40 расписанных для школьников.
- Есть ли шанс получить знания, когда готовые ответы позволяют быстро обмануть?
Такой вариант возможен, если:
Вы счастливый обладатель фотографической памяти,
Вы понимаете весь изучаемый курс, хотя времени на выполнение заданий нет. - Если учащийся осознает свои пробелы в знаниях, с помощью этих решений сам способен разобрать учебный материал.
- Для того, чтобы хорошо подготовиться к итоговой контрольной по химии в девятом классе, одного базового учебника и школьных уроков по нему будет недостаточно.Материал этой науки, преподаваемой в 9 классе, достаточно обширен и сложен. И чтобы его освоить, нужно внимательно и глубоко разобраться во всех особенностях курса. Лучшим решением для повышения эффективности вашей работы является выбор и использование рабочих книг и рабочих листов для них. Выбор можно доверить специалисту – учителю-предметнику, репетитору, руководителю кружка, курсов или справиться с ним самостоятельно.
- Занятия по ГДЗ с практикой помогут:
— понять логику поиска правильного решения даже для самых сложных задач;
— Оцените и запомните порядок правильной записи результата.Часто неверно записанный ответ становится причиной досадной потери баллов по CDF, диагностическим и итоговым тестам;
— самостоятельно работать с информацией — находить нужную, анализировать, составлять и фиксировать выводы. - Найти грамотные, качественные мануалы-мастерские непросто. Среди таких источников специалисты рекомендуют рабочую тетрадь по химии для 9 класса, составленную Габриеляном О. С. Сборник является составной частью ТМК, в которую, помимо него, входят учебник, электронные приложения, методическое пособие и рабочая программа.Последние два источника будут особенно полезны тем девятиклассникам, которые изучают химию самостоятельно, например, находясь на семейной форме обучения. Используя их, вы сможете составлять эффективные планы уроков и осваивать дисциплину в своем собственном темпе.
- Рабочая тетрадь хорошо систематизирована и иллюстрирована, содержит полезные материалы в удобной табличной форме, что позволяет сэкономить время на составлении самих таблиц. Это особенно важно для тех девятиклассников, подготовка которых проходит в интенсивной, ускоренной форме.Часто этим пособием пользуются и одиннадцатиклассники при подготовке к ЕГЭ по химии. Итоговые контрольные знания, приведенные в сборнике, представлены в двух формах – это подготовка к итоговой контрольной работе по химии в девятом классе и к ОГЭ по дисциплине. Пособие содержит множество приложений, содержащих полезный и интересный материал для выполнения заданий из данного сборника и пополнения багажа знаний по предмету.
