Конспект урока химии по теме «Водород» (9 класс)
Муниципальное общеобразовательное учреждение «Средняя школа №1 имени Героя Советского Союза П.И. Николаенко»
с. Степного Степновского района Ставропольского края
Методическая разработка урока химии в 9-м классе по теме
«Водород»
Cоставитель:
Матюшина Оксана Михайловна
учитель химии и биологии
2019г
Тема урока: «Водород»
Цель: Создать условия для формирования знаний о водороде.
Задачи:
Образовательные: сформировать знания о простом веществе – водороде.
Развивающие:
продолжать развивать общеучебные умения – охарактеризовать свойства вещества на основе его положения в ПСХЭ;
умения составлять уравнения реакций (ОВР) на примере химических свойств водорода.;
интеллектуальные умения – устанавливать причинно-следственные связи, строить рассуждения, делать выводы по теме, систематизировать материал;
речевые умения – строить связные высказывания в учебно-научном стиле при работе в группах;
коммуникативные умения – высказывать свою точку зрения, выслушивать мнение своего товарища.
Воспитывающие: способствовать воспитанию определенных черт личности: усидчивости, умение работать в группе.
Оборудование: учебник Химия 9 О.С.Габриелян. ЦОРы, компьютер, проектор.
Химические реактивы и оборудование: цинк, соляная кислота, аппарат Киппа, металлический штатив, пробирка, спички, вата.
Тип урока: урок изучения и первичного закрепления новых знаний.
План урока:
1. Организационный момент
2. Этап подготовки учащихся к активному сознательному усвоению знаний
3.Этап усвоения новых знаний
4. Этап закрепления новых знаний
5. Этап информации учащихся о домашнем задании и инструкции по его выполнению.
ХОД УРОКА
1. Организационный момент (1 мин.)
Приветствие учителя и учащихся
Определение отсутствующих
2. Этап подготовки учащихся к активному сознательному усвоению знаний (3 мин.)
Формулировка темы и цели урока учащимися:
Отгадайте загадку о чем идет речь?
Я, газ, легчайший и бесцветный,
Неядовитый и безвредный,
Соединяясь с кислородом,
Я для питья даю вам воду!
(Учащиеся формулируют цели и задачи урока, демонстрируются слайды 1-3)
3. Актуализация знаний
Историческая справка (сообщения учащихся).
В трудах химиков 16 и 17 веков неоднократно упоминалось о выделении горючего газа при действии кислот на металлы. В 1766 году Г. Кавендиш собрал и исследовал выделяющийся газ, назвав его «горючий воздух». Будучи сторонником теории флогистона, Кавендиш полагал, что этот газ и есть чистый флогистон. В 1783 году А. Лавуазье путем анализа и синтеза воды доказал сложность ее состава, а в 1787 определил «горючий воздух» как новый химический элемент (Водород) и дал ему современное название hydrogene (от греч. hydor – вода и gennao – рождаю), что означает «рождающий воду»; этот корень употребляется в названиях соединений Водорода и процессов с его участием (например, гидриды, гидрогенизация). Современное русское наименование «Водород» было предложено М. Ф. Соловьевым в 1824 году.
Применение Водорода. В промышленном масштабе Водород стали получать в конце 18 века для наполнения воздушных шаров. В настоящее время Водород широко применяют в химической промышленности, главным образом для производства аммиака. Крупным потребителем Водорода является также производство метилового и других спиртов, синтетического бензина и других продуктов, получаемых синтезом из Водорода и оксида углерода (II). Водород применяют для гидрогенизации твердого и тяжелого жидкого топлив, жиров и других, для синтеза HCl, для гидроочистки нефтепродуктов, в сварке и резке металлов кислородо-водородным пламенем (температура до 2800°С) и в атомно-водородной сварке (до 4000°С). Очень важное применение в атомной энергетике нашли изотопы Водорода – дейтерий и тритий. Говоря о применении водорода, стоит рассказать о его использовании в синтезе НСl и Nh4, а также резке, сварке и получении металлов, в переработке нефти и жиров.
4. Этап усвоения новых знаний (20 мин.)
-
Нахождение в природе (слайды 6-10).
Учащиеся разгадывают тайнопись и характеризуют нахождение водорода в природе. Заполняют схему в инструктивной карте (прил. 1).
-
Что означают эти цифры?
70% 8%
1% 50%
-
Положение водорода в периодической системе.
Давайте с вами разберемся почему водород занимает двойственное положение в ПСХЭ.
-
Строение атома водорода – визитка химического элемента
Индивидуальная работа
(1 ученик работает у доски – составляет схему строения атома водорода, остальные пишут в тетради, демонстрируется слайд 11-12)
Характеризуя водород по положению в периодической системе химических элементов Д. И. Менделеева, следует обратить внимание на особенности строения атома водорода – самого простейшего из химических элементов.
-
Символ – Н;
-
Порядковый номер – 1
-
Группа – IА,(VIIА)
-
Период – 1
-
Относителная ат. масса – 1
-
Степени окисления: +1,0,-1
-
Число е, p+, n0 – 1,1,0
Молекула водорода двухатомная, связь ковалентная неполярная (Н:Н или Н-Н).
Вывод: строение обусловливает разнообразие свойств водорода, его двойственное положение в системе Д. И. Менделеева – в I и VII группах (слайд 13).
-
Физические свойства водорода (слайд 14).
Учащимся предлагается разгадать ребус и предсказать физические свойства водорода.
Водород – газ без цвета, вкуса и запаха, плохо растворим в воде, в 14,5 раз легче воздуха, температура кипения — 253 0С
Демонстрация видеофрагмента «Мыльные пузыри с водородом».
Интересный факт из жизни ученых (сообщение учащихся).
Как-то ученый Пилатр де Розьер решил проверить, что будет, если вдохнуть водород; до него никто такого эксперимента не проводил. Не заметив никакого эффекта, ученый решил убедиться, проник ли водород в легкие. Он еще раз глубоко вдохнул этот газ, а затем выдохнул его на огонь свечи, ожидая увидеть вспышку пламени. Однако водород в легких экспериментатора смешался с воздухом, и произошел сильный взрыв.
-
Получение водорода (слайд 15-18).
1. Демонстрация видеофрагмента « Получение водорода в лаборатории».
2. Лабораторный опыт.
Работают в группах пользуясь инструктивными карточками (выполняют опыт)
-
Получить водород из цинка и соляной кислоты.
-
Собрать водород в пробирку методом вытеснения воздуха.
-
Проверить наличие водорода с помощью реакции горения (над пламенем спиртовки).
-
Записать уравнение реакции.
3. Записывают способы получения водорода в лаборатории и в промышленности (с помощью учителя)
1) В лаборатории:
Zn + 2HCl = ZnCl2 + H2
2К+2H2O=2KOH+H2
2) В промышленности:
С + Н2О = СО + Н2
СН4 + Н2О = СО + 3Н2
2Н2О = 2Н2 + О2
Не шутите с Водородом!
Он горит, рождая воду,
В смеси с Кислородом-братом
Он взрывается, ребята!
Вам скажу на всякий случай –
Эту смесь зовут « гремучей».
Демонстрация видеофрагмента «Взрыв гремучего газа»
-
Химические свойства водорода (слайд 22-23).
Учитель организует фронтальную работу по изучению химических свойств водорода и подводит к выводу об ОВ свойствах водорода
Учащиеся по очереди выходят к доске и записывают уравнения реакций, отражающих основные химические свойства водорода.
-
2Н2 + О2 = 2Н2О
-
3H2 + N2 = 2NH3
-
H2 + 2Na = 2NaH
-
H2 + Ca = CaH2
-
CuO + H2 = Cu + H2O
-
Применение водорода (слайд 24-27).
Учитель организует дискуссию, а учащиеся отвечают на вопросы:
-
Какие свойства водорода находят применение в современном мире и в прошлые столетия?
-
Чем опасен водород?
-
Этап закрепления новых знаний (10 мин.)
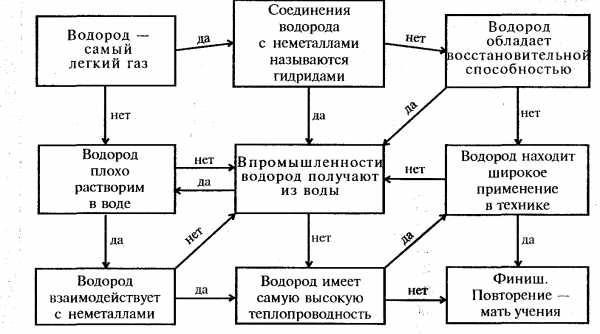
Задание 1(слайд 28): Найдите путь, который приведет вас к финишу. Начните прохождение лабиринта с верхней левой клетки. Если суждение, вписанное в эту клетку, правильно, то продолжаете путь по стрелке с обозначением «да». Если данное суждение ошибочно, то вам следует продолжить путь по стрелке с обозначением «нет». Для полного усвоения сведений, приведенных в лабиринте, выбирайте в качестве исходных разные клетки лабиринта.
Задание 2 (слайд 29-30): Как называются вещества: H2O, NH3, H2S ? В каком из предложенных веществ
массовая доля водорода наибольшая?
ω (Н) = 2*1/ 18 = 0,11 = 11% в H2O
ω (Н) = 3*1/ 17 = 0,18 = 18% в NH3
ω (Н) = 2*1/ 34 = 0,06 = 6% в H2S
Массовая доля водорода наибольшая в NH3
Задание 3(слайд 31-32): «Телеграмма»
Напишите пропавшие вещества и расставьте коэффициенты (выполняется самостоятельно по вариантам).
1 вариант
Мg + ……… = MgH2
….. + H2 = H2S
Al + HCI = ……….
Fe3O4 + H2 = Fe +…..
2 вариант
…….. + H2 = KH
H2 + …….. = H2 O
Zn + H2 SO4 = ……..
WO3 + H2 = W + ….
Котрольный тест.
Задание. Необходимо выбрать правильные утверждения. В рабочей тетради в столбик проставьте цифры с 1 по 12. Если вы согласны с утверждением, ставьте напротив цифры плюс, если нет, то минус.
Учитель зачитывает утверждения.
1. Водород – самый распространённый элемент во Вселенной.
2. Водород — самый распространённый газ на Земле.
3. Основным соединением водорода на нашей планете является вода.
4. Благодаря водороду есть жизнь на Земле.
5. Степень окисления водорода равна +2.
6. Формула простого вещества водорода Н2.
7. Газ водород обладает наименьшей среди всех веществ молекулярной массой.
8. Газообразный водород хорошо растворим в воде.
9. Водород в смеси с кислородом взрывоопасен.
10. Чтобы собрать водород, пробирку надо держать отверстием вверх.
11. Водород можно собрать методом вытеснения воды.
12.Водород помогает получать металлы
Учитель зачитывает ответы, учащиеся проверяют и оценивают: без единой ошибки – «5», 1 ошибка – «4», 2 ошибки – «3», 3 и более ошибок — неудовлетворительно.
-
Рефлексия (4 мин.)
Учитель создаёт условия для заключительной рефлексии:
Выберите подходящее словосочетание, чтобы определить ваше отношение к сегодняшнему уроку (слайд 35): .
Важная тема Урок понравился
Есть вопросы Ничего не понятно
Здорово Мне было интересно
Было скучно Легкая тема
Ничего особенного Оценка урока — хорошо
Оценка урока – отлично Доволен оценкой
Я молодец!
-
Информация о домашнем задании – слайд 34(1 мин.)
-
Конспект (читать)
-
Запишите уравнения химических реакций, осуществив следующие превращения:
H2 → CaH2 → H2 → H2S
↓
Ca (OH)2
-
Рассчитайте объем водорода (н.у.), который потребуется для восстановления оксида меди (II) массой 127 кг, содержащего 8% посторонних примесей.
-
Подготовить сообщения по темам (по желанию)
«Водород во Вселенной»,
«Старинные способы получения водорода»,
«Из истории развития воздухоплавания».
Оценка «5» — если выполнены 1-3 задание, оценка «4» — 1,2 задание, оценка «3» — 1 задание.
Литература
-
Кузьменко Н.Е., Еремин В.В. Химия. Пособие для 8-11 классов средней школы. – М.: Экзамен, 2002. – 448с.
-
Габриелян О.С., Воскобойникова Н.П., Яшукова А.В. Настольная книга учителя. Химия. 9 класс. – М.: Дрофа, 2003. – 400с.
-
Габриелян О.С., Смирнова Т.В. Изучаем химию в 9 классе: дидактическое пособие к учебнику О.С. Габриеляна «Химия-9» для учащихся и учителей. – М.: БЛИК и К, 2004. – 224с.
-
Шукайло А.Д. Тематические игры по химии. 8 класс. Методическое пособие для учителя. – М.: ТЦ Сфера, 2004. – 96с.
Приложение 1
Инструктивная карта
Опорный конспект
Открытие простого вещества
В природе:
— Водород составляет % массы солнца
— На Земле – %
— В свободном виде – в газах нефтяных скважин, в верхних слоях атмосферы.
-В воде.
-В органических соединениях, в белках, жирах, углеводах — %.
— Из водорода состоят межзвездный газ и газовые туманности (во вселенной — %).
Строение атома
атом Н:
Порядковый номер –
Группа –
Период –
z = , p+ = , n0=
e = , Ar =
Электронная формула:
Металл (неметалл)
Изотопы водорода:
Водород – простое
вещество – H2
Степень окисления =
Связь —
Электронная формула –
Структурная формула —
Перекрываются две
S – орбитами с образованием
s – s связи
, В,Ц,З,M
H2
Mr=2
(легче воздуха)
(в 100v H2О растворяется 2v H2 при t0=200С
p=1атм.)
Ткип= -2530С
Тпл= — 2590С
Жидкий водород – самая легкая жидкость
Способы собирания
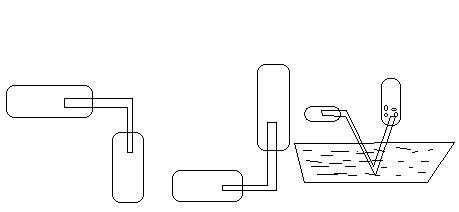
Вытеснением
воздуха
Вытеснением
Воды (над водой)
Химические свойства
Применение водорода
Домашнее задание
-
Конспект (читать)
-
Запишите уравнения химических реакций, осуществив следующие превращения:
H2 → CaH2 → H2 → H2S
↓
Ca (OH)2
-
Рассчитайте объем водорода (н.у.), который потребуется для восстановления оксида меди (II) массой 127 кг, содержащего 8% посторонних примесей.
-
Подготовить сообщения по темам (по желанию)
«Водород во Вселенной»,
«Старинные способы получения водорода»,
«Из истории развития воздухоплавания».
Оценка «5» — если выполнены 1-3 задание, оценка «4» — 1,2 задание, оценка «3» — 1 задание.
“Кроссворд”
Работайте в парах.
Ключевым словом является название ближайшей к Земле звезды, на которой преобладает химический элемент водород. Каждое предложенное химическое явление подтвердите соответствующими уравнениями химических реакций.
-
Сложные вещества, при взаимодействии которых с водородом получают металлы.
-
Вещество, которое образуется при горении водорода в кислороде.
-
Кислоты, состоящие из атомов водорода и другого химического элемента.
-
Кислота, которая легко разлагается на оксид углерода (IV) и воду.
-
Металл, непосредственно взаимодействующий с водородом.
-
Кислота, по уровню производства которой можно судить о мощности химической промышленности страны.
infourok.ru
План-конспект урока по химии (9 класс): Урок «Решение задач по химии»
Муниципальное общеобразовательное учреждение
Игримская общеобразовательная средняя школа № 1
Урок квест
«Решение задач по химии»
9 класс
Черёмина Л. Н.
МБОИСОШ № 1
п. Игрим 2019 г
Цель урока: формирование навыков решения типовых задач по химии.
Требования к результатам обучения:
Личностные: сформированность познавательных интересов и мотивов, направленных на решение задач, интеллектуальных умений (доказывать, строить рассуждения, анализировать)
Метапредметные: умение адекватно использовать речевые средства для дискуссии и аргументации своей позиции.
Предметные: повторить решение типовых задач.
Личностные УУД
Л 1. Умение вести диалог на основе равноправных отношений и взаимного уважения.
Л 2. Готовность к равноправному сотрудничеству.
Регулятивные УУД:
Р 1. Самостоятельно формулируют познавательную цель и строят действия в соответствии с ней.
Р 2. Составляют план и последовательность действий.
Р 3. Сличают свой способ действия с эталоном.
Познавательные УУД:
П 1. Анализируют условия и требования задач.
П 2. Осуществляют поиск и выделение необходимой информации.
П 3. Выбирают наиболее эффективные способы решения задачи.
Коммуникативные УУД:
К 1. Умеют слушать и слышать друг друга.
К 2. Планируют общие способы работы.
К 3. Определяют цели и функции участников, способы взаимодействия.
К 4. Вступают в диалог, участвуют в коллективном обсуждении проблем.
К 5. Учатся устанавливать и сравнивать разные точки зрения, прежде чем принимать решение и делать выбор.
К 6. Обмениваются знаниями между членами группы для принятия эффективных совместных решений.
К 7. Проявляют уважительное отношение к партнерам, внимание к личности другого, адекватное межличностное восприятие.
План урока
|
№ |
Этапы урока |
Время в минутах |
Деятельность учителя |
Деятельность учеников |
УУД |
|
1 |
Орг.момент |
3 |
+ Объяснение хода урока |
+ |
Л 2. |
|
2 |
Основная часть. |
||||
|
А. Формирование групп, получение задание, выработка способа работы группы |
2 |
+ |
+ (распределение работы с консультантом) |
Р 1, Р 2 К 2, К 3, К 7. |
|
|
Б. Работа с консультантами по решению задач. (Консультант отрабатывает алгоритм) |
4 (общ 16) |
+ Регламент времени |
+ (вопросы консультанту) |
Л 1, П 2 |
|
|
В. Решение задач своей группы |
16 |
+ Регламент времени, обращение групп к знатоку химии |
+ (работа с заданием для группы) |
Л 2, Р 3 П 1, П 2, П 3 К 2, К 5, К 6 |
|
|
Г. Получение ключа «буквы» от знатока химии. (знаток химии выдает ключ или указывает на ошибку) |
1 |
+ (можно в течение времени решения задач) |
+ (установка букв в общую фразу урока) |
К 1, К 7 |
|
|
3 |
Заключительная часть |
2 |
+ (учитель читает фразу с доски, указывает на то, что учащиеся вместе шли к цели, делая посильный вклад, отмечает лучших) |
+ (ученики осуществляют рефлексию) |
Л 1, К 7 |
Огр. Момент.
Учитель объясняет, что класс поделён на 4 группы. Каждая группа должна решить 4 задачи, при этом можно воспользоваться знаниями консультанта (их 4 по количеству типов задач). Каждая команда планирует общие способы работы своей группы, после решения задач обращается к знатоку химии, который меняет ответ задачи на букву. Из букв составляется фраза к концу урока. Побеждает команда которая первой завершит поиск 4 букв для общей фразы.
Основная часть.
А. Группа получает задание, прочитывает. Вырабатывает действия своей группы при работе с консультантом. Возможно распределяет задаваемые вопросы – вырабатывает стратегию дальнейших действий.
Б. Работа группы с консультантом ограничена во времени- 4 минуты, он показывает алгоритм действий и отвечает на вопросы группы. Движение групп организуется от консультанта к другому консультанту по часовой стрелке. Задачи в заданиях и бейдж консультантов выделены цветоа (красный, зеленый, синий, фиолетовый) Не дает решения задач!
В. Группы решают задание. В это же время они могут подойти с ответом решённой задачи к знатоку химии и получить ключ, либо отказ с указанием ошибки решения.
Г. По истечению времени все ответы меняются на буквы и выставляются в заранее подготовленном порядке. (Лучше на интерактивной доске записать фразу и закрыть прямоугольниками с номерами, номера будут повторяться)
Заключительная часть.
Открываем фразу: «Химия – наука о веществах, их свойствах.
Выигрывает команда, которая воспользовалась услугами консультантов, решила все задачи самой первой. Команда получает поощрительные значки «химчики». (накопив такие за несколько уроков можно обменять на оценку)
Приложение: На интерактивной доске в закрытом виде
|
23 |
10 |
14 |
10 |
33 |
— |
15 |
1 |
21 |
12 |
1 |
|
|
16 |
3 |
6 |
27 |
6 |
19 |
20 |
3 |
1 |
23 |
, |
|
|
10 |
23 |
19 |
3 |
16 |
11 |
19 |
20 |
3 |
1 |
23 |
На интерактивной доске в открытом виде
|
Х |
и |
м |
и |
я |
— |
н |
а |
у |
к |
а |
|
|
0 |
в |
е |
щ |
е |
с |
т |
в |
а |
х |
, |
|
|
и |
х |
с |
в |
о |
й |
с |
т |
в |
а |
х |
Приложение 2. (задачи для групп, ответы для учителя и знатока химии)
Задание первой группы.
- Найдите массу хлорида алюминия, полученного при взаимодействии 75, 6 г 25 % раствора соляной кислоты с избытком алюминия. (23 г)
- Найдите массу оксида марганца (IV), полученного из 40,3 г перманганата калия, содержащего 10 % примесей.(10 г)
- Найдите массу осадка. образованного 18 г гидроксида бария и 5,9 г серной кислоты. (14 г)
- Найдите объем воздуха, необходимого для сжигания 3,63 г пентанола. (33 л)
Задание второй группы.
- Найдите массу кислорода, полученного из 2, 86 г хлората калия, содержащего 12 % примесей. (1г)
- Найдите массу осадка, образованного 40 г сульфата меди (II) и 17,2 г гидроксида натрия. (21 г)
- Найдите объем воздуха, необходимого для сжигания 1, 39 гг бутанола. (12 г)
- найдите массу ортофосфата кальция, полученного при взаимодействии 47, 5 г 20 % раствора ортофосфорной кислоты с избытком кальция.(15 г)
Задание третьей группы.
- Найдите массу осадка. образованного 70 г нитрата железа () и 33,6 г гидроксида калия. (27 г)
- Найдите объем воздуха необходимого для сжигания 2 г гексанола. (19 л)
- Найти массу хлорида магния, полученного при взаимодействии 82 г 15 % раствора соляной кислоты с избытком магния. (16 г)
- Найдите массу оксида меди (II), полученного из 4,08 г гидроксида меди (II), содержащего 15 % примесей.(3 г)
Задание четвертой группы.
- Найдите объем воздуха необходимого для сжигания0,66 г пентанола. (6 л)
- найдите массу сульфата цинка, полученного при взаимодействии 67,8 г 18 % раствора серной кислоты с избытком цинка. (20 г)
- Найдите массу оксида железа (III), полученного из 15,5 г гидроксида железа (III), содержащего 5 % примесей. (11 г)
- Найдите массу осадка, образованного 8,15 г хлорида натрия и 93, 8 г нитрата серебра. (20 г)
nsportal.ru
Урок химии «Качественный анализ неорганических соединений»
План урока
«Качественный анализ неорганических соединений»
Школа: КГУ «Бескольская средняя школа №2»
Дата: 12.07.2019г
Ф.И.О. учителя: Бакулина Динара Мухамедовна
Класс: 9
Участвовали: Не участвовали:
Тема урока:
Качественные реакции на катионы. Лабораторный опыт №3 «Определение катионов Li+, Na+ ,K+ ,Ca2+ ,Sr2+, Ba2+,Cu2+ по окрашиванию пламени». Лабораторный опыт №4 «Качественные реакции на катионы Fe2+, Fe3+, Cu2+ взаимодействие со щелочами».
Учебные цели, достигаемые на этом уроке.
9.4.1.8. — описывать и проводить реакции окрашивания цвета пламени для определения катионов металлов: Li+, Na+ K+, Ca2+, Sr2+, Ba2+, Cu2+.
9.4.1.9. — проводить качественные реакции на определение катионов: Fe2+, Fe3+, Cu2+.
Цель урока
К концу урока учащиеся, проведут качественные реакции на катионы, а так же заполнят таблицу качественных реакций на примере 9 катионов.
Критерии оценки
Обучающиеся:
-на примере качественных реакций 9 катионов выполняют лабораторные опыты;
-заполняют таблицу качественных реакций.
Языковые ценности
Учащиеся должны охарактеризовать свойства катионов, записывать и объяснять уравнения взаимодействия качественных реакций на катионы металлов.
«Терминология химии»: качественная реакция, аналитическая химия, реактив на определяемый ион, цвет пламени, реагент, образование осадка, продукты реакции, изменение цвета.
Привитие ценностей
Общенациональная идея «Мәңгілік Ел»
Экономический рост на основе индустриализации и инновации. Коммуникативное взаимодействие через активные методы обучения, доброжелательное сотрудничество.
Развитие интеллектуальных способностей, навыков самообразования.
Межпредметная связь
Физика, экология
Предшествующие знания
Катод, анод, вещества выпадающие в осадок, условия протекания реакций до конца, заряд иона, катионы металлов.
Ход урока
Начало урока
1 мин
6 мин
Действия учителя:
1.Приветствие. Учитель создаёт коллаборативную атмосферу в классе, задавая вопрос «Какое у вас настроение на урок?»
Метод «Большой палец»
Действие учащихся:
Ученики показывают большим пальцем, какое у них настроение:
Поднятый вверх большой палец — настроение отличное;
В сторону — хорошее;
Вниз — плохое.
Актуализация знаний.
Для повторения изученного материала в 8 классе предлагается выполнение задания:
Форма работы: Индивидуальная работа
Формативное оценивание: Взаимооценивание с помощью приема «Светофор» .
Задание 1.
А) KOH + HCl = K+ + Cl– + H2O.
H+ + OH– = H2O. (Pеакция нейтрализации)
Б) Na2S + H2SO4 = Na2SO4 + H2S↑
2Na+ + S2– + 2H+ + SO42– = 2Na+ + SO42– + H2S↑
2H+ + S2– = H2S (Pеакция идущая с выделением газа)
В) FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl
Fe 3+ + 3Cl – + 3Na+ + 3OH– =
Fe(OH)3↓+ 3Na+ + 3Cl –
Fe 3+ + 3OH – = Fe(OH)3↓ (Реакция идущая с выпадением оcадка)
Правильные ответы записаны на презентации.
Задание 2. поиграем в игру «Третий лишний». Среди данных ионов определите катионы:
Са2+ , Fe2+, S2 —; Ag+, Sr2+; K+, Na+, NО3— Li+, Cu2+ Cl –, Ba2+
Форма работы: Индивидуальная работа
Формативное оценивание: Взаимооценивание с помощью смайлика, по дескрипторам.
Критерии оценивания: Знает катионы и анионы
Дескрипторы: определяет 1 лишний ион;
определяет 2 лишних иона; определяет 3 лишних иона.
Навык: знание, понимание.
Дифференциация обучения: скаффолдинг.
Действия учителя:
По данным уравнениям реакции, и по каким признакам вы можете определить о чём идет речь?
Учащиеся дают ответ.
Тема урока: Качественные реакции на катионы. Лабораторный опыт №3. «Определение катионов Li+, Na+ ,K+ ,Ca2+ ,Sr2+, Ba2+,Cu2+ по окрашиванию пламени».
Лабораторный опыт №4. «Качественные реакции на катионы Fe2+, Fe3+, Cu2+ взаимодействие со щелочами».
Работа по карточкам
Распечатанные задания
Середина урока
1 мин
15 мин
10 мин
Изучение новой темы
Действия учителя: вопрос учащимся «Где в повcедневной жизни они вcтречаются с химичеcкими pеакциями?»
Учащиеся дают свои ответы
АМО «Мозговой штурм»
Навык: знание, понимание.
Форма работы: Индивидуальная работа
Цель: учащихся нацелить на новую тему урока
Проблемный вопрос: «Почему реакции называют качественными?»
Деление на 2 группы
Актуализация знаний по правилам ТБ
Групповая работа (2 группы)
Задания для формативного оценивания
1.Лабораторный опыт №3 «Определение катионов Li+, Na+ ,K+ ,Ca2+ ,Sr2+, Ba2+,Cu2+ по окрашиванию пламени».
Работа в группах
АМО «Лабораторный опыт»
Навык: применение
Дифференциация обучения: По типу восприятия, скаффолдинг.
Критерии оценивания: на примере 9 катионов заполняет таблицу.
(А) Обучающиеся прокаливают нихромовую проволоку над спиртовкой и осуществляют прикрепление на её петельку кристаллов LICl, NaСl, KCl, CaCl2, SrCl2, BaCl2, CuCl2 записывают свои наблюдения. Они видят изменение цвета проволоки.
(В) Обсудите наблюдения и сделайте выводы по определению катионов;
2.Показ видеоролика. «Определение катионов по окрашиванию пламени».
Вам необходимо внимательно посмотреть видеоролик и запомнить как изменится цвет пламени катионов металлов.
Работа в группах
Дифференциация обучения: По типу восприятия, по ролям в группе.
Учитель оpганизует работу по постановке эффективных вопросов, в ходе которой, учащиеся пpиходят к выводу о cуществовании новой химичеcкой реакции, которая является сегодняшней темой урока «Качественные реакции на катионы».
АМО «Метод эффективных вопросов»
Прием: Формативный опроc
Обсуждение. Вопросы к видеоматериалу.
1.Какое окрашивание пламени дает катион Li+?
2. Какое окрашивание пламени дает катион Na+?
3. Какое окрашивание пламени дает катион K+ ?
4. Какое окрашивание пламени дает катион Sr2+?
5. Какое окрашивание пламени дает катион Ва2+?
6.Как определяют катионы металлов по окрашиванию пламени?
Учащиеся заполняют таблицу:
Изменение цвета пламени доказывает присутствие катионов в кристаллах. Каких?
Дескрипторы:
1.Указан 1 этап проведения эксперимента
2.Указан 2 этап проведения эксперимента
3.Оформлен вывод проведенного эксперимента
Учитель наблюдает и корректирует (если требуется).
Лабораторный опыт №4 «Качественные реакции на катионы Fe2+, Fe3+, Cu2+ взаимодействие со щелочами».
Показ видеоролика. Работа в парах
АМО «Лабораторный опыт»
Дифференциация обучения: По типу восприятия.
Критерии оценивания: заполняет таблицу качественных реакций
Цель опыта: исследовать химические реакции, которые идут с выпадением осадков.
(С). Предложите учащимся получить качественную реакцию на катионы металлов: Fe2+, Fe3+, Cu2+ ;
Объясните признаки выпадения трех осадков и опишите изменение окраски.
Что наблюдаете? Оформите вывод.
Дескрипторы:
1.Указана очередность проведения эксперимента
2.Оформлен вывод проведенного эксперимента.
А теперь ребята ответьте мне на вопрос «Почему реакции называют качественными?»
Учащиеся дают ответ.
Таблица: «Качественные реакции 9 катионов»
Определя-
емый ион
Реактив используемый для определения
Результаты качественной реакции
Cu2+
OH –
Fe2+
OH –
Fe3+
OH –
Ва2+
SO42-
Ca2+
СО3 2-
K+
—
Na+
—
Sr2+
—
Li+
—
Формулируют общий вывод по лабораторным опытам.
Формативное оценивание: письменный комментарий учителя
Реактивы:
Кристаллы LICl, NaСl, KCl, CaCl2, SrCl2, BaCl2, CuCl2 нихромовая проволока,
спиртовка, спички.
Компьютер, интерактивная доска
Распечатанные карточки
Компьютер, интерактивная доска
Реактивы приборы:
Растворы FeSO4,NaOH, Fe2(SO4)3, CuCl2 , пробирки и штатив
Распечатанные карточки
Распечатанные карточки
Конец урока
6 мин
1 мин
Закрепление
АМО: Разноуровневые задания
Цель: определить на каком уровне знаний учащийся находится.
Навык: знание, понимание, применение
Диффеpенциация обучения : по типу сложности задания.
Уровень А. Напишите уравнение реакции взаимодействия хлорида бария с серной кислотой в молекулярном, полном и сокращенном ионном виде
Уровень В. Закончите уравнение реакции взаимодействия хлорида бария с серной кислотой в молекулярном, сокращенном ионном виде
Уровень С. Закончите уравнение реакции взаимодействия хлорида бария с серной кислотой в молекулярном виде.
Формативное оценивание: Взаимооценивание по технике «Светофор», устный комментарий учителя.
Рефлексия: Метод «Лесенка успеха». Каждый учащийся закрепляет человечка на тот уровень, который соответствует его состоянию на уроке.
Домашнее задание: параграф 11 прочитать и написать мини-эссе на тему «Применение качественных реакций в промышленности».
Распечатанные
задания
Ватман,
стикеры
На уроке использованы виды дифференсации:
-
По форме работы: индивидуальная, групповая.
-
По уровню ЗУН, разноуровневые задания
-
Диффpенциpованное д/з – по уpовню мыслительных навыков
-
По типу восприятия материала- слушание, визуалирование, наблюдение
-
По оцениванию – словесный комментарий учителя, взаимооценивание- стикеpы.
ФО:
-
Взаимооценивание
-
словесные комментарии учителя
-
письменный комментарий учителя
-
Взаимооценивание техники «Светофор»
Напоминание о соблюдении правил техники безопасности при выполнении опытов
Здоpовьесбеpегающие технологии.
Рефлексия по уроку
Метод «Лесенка успеха»
Общая оценка
две вещи, лучше всего прошедшие на уроке (касающиеся преподавания и обучения)
1:
2:
Что могло бы посодействовать тому, чтобы урок прошел лучше (касающиеся преподавания и обучения)
1:
2:
Что я выяснил на этом уроке о классе или о достижениях/ затруднениях отдельных учеников на что обратить внимание на следующем уроке?
infourok.ru
Технологическая карта урока по теме: «Основания» (Химия. 8 класс)
Технологическая карта урока «Основания» в 8 классе
Урок открытия «новых» знаний
Место урока или другой формы организации учебной деятельности в структуре учебного занятия
-
Степень окисления. Бинарные соединения.
-
Оксиды.
-
Важнейшие оксиды в природе и жизни человека. Водородные соединения элементов.
-
Основания.
-
Кислоты.
-
Соли.
-
Составление формул солей.
-
Кристаллические решетки
-
Чистые вещества и смеси
-
Практическая работа №2 «Очистка загрязненной поваренной соли»
-
Массовая и объемная доли компонентов смеси (раствора)
-
Практическая работа №3 «Приготовление раствора сахара и расчет его массовой доли в растворе»
-
Решение расчетных задач с использованием понятия «доля».
-
Контрольная работа №3 по теме «Соединения химических элементов».
Учебная задача
Познакомить учащихся с понятием «основания», дать знания о составе данного класса соединений, классификации, физических свойствах, а так же практическом применении оснований.
Реактивы и оборудование
Растворы NaOH, KOH, Ca(OH)2, Al(OH)3, Cu(OH)2, индикаторы: лакмусовая бумажка, фенолфталеин, метилоранж, пробирки (3), штатив для пробирок.
Техническое обеспечение
Мультимедийный проектор, персональный компьютер
Цель: углубление представлений о материальном единстве и возможности познания окружающего мира; формирование комплекса знаний об основаниях как о новом классе неорганических веществ; совершенствование умений выделять проблему в теме занятия, формулировать познавательные цели, контролировать и оценивать достижение результата, строить содержательную коммуникацию при групповой работе.
Задачи:
Предметные: умение определять отличительные признаки состава оснований, проанализировав их формулы; сравнивать основания по различным признакам, определять основания среди соединений других классов; находить степень окисления элементов в основаниях, заряд гидроксогруппы; указывать связь оснований с другими классами неорганических соединений, приводить доказательства целесообразности использования некоторых индикаторов для определения щелочной среды через заполнение сравнительной таблицы, рассматривать практическую значимость данного класса соединений в жизни человека
Метапредметные: умение осознать ограниченность собственного знания, выделять проблему и цель через выполнение задания на сравнение и классификацию веществ; анализировать при групповой работе информацию из разных источников, структурировать её через перевод текстовой информации в символы, схемы; выразить в ходе рефлексивной деятельности свои мысли с достаточной полнотой и точностью; умение работать с текстовой информацией при обращении к учебному пособию; готовить презентации и сообщения; осуществлять логические операции при разрешении проблемной ситуации, решении ситуационных задач и выполнении заданий тестового характера; организовывать собственную познавательную деятельность; концентрировать внимание; свободно и правильно излагать свою точку зрения при ведении дискуссии и в процессе эвристической беседы; продуктивно участвовать в эвристической беседе, дискуссии, осуществлять самоконтроль и оценку своей деятельности; предвидеть возможные результаты своих действий.
Личностные: обучающиеся убедятся в осознании ценности формирования экологической культуры и экологического типа мышления на примере анализа проблем, связанных с производством, применением данного класса соединений в промышленных масштабах, формирование осознанного, уважительного и доброжелательного отношения к другому человеку, его мнению, мировоззрению, готовности и способности вести диалог с другими людьми и достигать в нем взаимопонимания освоение социальных норм, правил поведения, ролей и форм социальной жизни в группах, формирование основ экологической культуры, соответствующей современному уровню экологического мышления, наличие опыта экологически ориентированной рефлексивно-оценочной и практической деятельности в жизненных ситуациях.
Ресурсы:
https://xn--j1ahfl.xn--p1ai/data/files/docs/5888972de2acf.docx
http://pedsovet.su/metodika/priemy/5714
Метод «Фишбоун» (Рыбий скелет): что это такое, формы работы на уроке и примеры
Федеральный центр информационно-образовательных ресурсов: http://fcior.edu.ru
Единая коллекция образовательных ресурсов http://school-collection.edu.ru
ЭОРы
Установление соответствия: основание — оксид металла
http://school-collection.edu.ru/catalog/res/0ab6ce99-4185-11db-b0de-0800200c9a66/?from=d05469af-69bd-11db-bd13-0800200c9c08&interface=pupil&class=50&subject=31
Состав и классификация оснований
http://fcior.edu.ru/card/10935/sostav-i-klassifikaciya-osnovaniy.html
Химические формулы оснований
http://fcior.edu.ru/card/13431/himicheskie-formuly-osnovaniy.html
Правила техники безопасности при работе со щелочами
http://school-collection.edu.ru/catalog/res/0ab6ce9b-4185-11db-b0de-0800200c9a66/?from=d05469af-69bd-11db-bd13-0800200c9c08&interface=pupil&class=50&subject=31
Изменение окраски индикаторов в растворах щелочей
http://school-collection.edu.ru/catalog/res/bb156370-aae7-11db-abbd-0800200c9a66/?from=d05469af-69bd-11db-bd13-0800200c9c08&interface=pupil&class=50&subject=31
Этап урока
Деятельность учителя
Деятельность ученика
Формируемые УУД
1. Организационный момент.
Самоопределение к деятельности.
Приветствует обучающихся, определяет готовность к уроку.
Учащиеся готовятся к учебной деятельности. Приветствуют учителя, проверяют свои рабочие места.
Коммуникативные: планирование учебного сотрудничества с учителем и сверстниками.
2. Актуализация знаний и фиксация затруднений в деятельности.
Проводит беседу и организует выполнение задания.
Что изучает химия?
Что такое вещества?
Как делятся вещества по составу?
C какими сложными веществами мы уже знакомы?
Создаёт проблемную ситуацию путём предложения задания №1.
(см. задание 1).
Распределите вещества на группы. Дайте им названия.
Na2O, NaOH, CaO, Cu(OH)2, N2O5, CO2, Fe(OH)3.
К какой группе веществ мы отнесём NaOH, Cu(OH)2, Fe(OH)3?
Отвечают на вопросы, дают им определения.
Изучили класс оксидов, бинарные соединения.
Выполняют задание – выделяют 2 группы веществ по признакам классов: оксиды, и вещества второй группы неизвестны.
Познавательные: логические – анализ объекта с целью выделения существенных признаков;
Коммуникативные: планирование учебного сотрудничества с учителем и сверстниками. Уметь оформлять свои мысли в устной и письменной форме.
3. Создание проблемной ситуации.
Поиск способа решения проблемной ситуации.
Обеспечение мотивации и принятия цели учебно-познавательной деятельности.
Создаёт условия для формулирования темы, цели и задач урока.
Для того, чтобы узнать название группы веществ, к которой относятся данные вещества вам предстоит выполнить задание №2.
(см. задание 2).
Мы нашли название группы веществ второго класса.
На основе выполнения заданий №1-2 предлагает сделать вывод, о каком классе веществ идет речь, таким образом, определяя тему урока.
Организует деятельность учащихся на осмысление понятия: основания.
(см. задание 3).
Выберите признаки оснований, подчеркните их прямой линией. Какие из признаков являются существенными, подчеркните их волнистой линией.
1. В состав молекулы входит металл.
2. Молекула содержит гидроксогруппу.
3. Растворяются в воде.
4. Едкие.
5. Мылкие.
6. Изменяют окраску индикаторов.
Мы можем выполнить данное задание? Почему? Какова будет цель урока? Что мы можем узнать об основаниях?
Вернёмся к выполнению задания после изучения данного вопроса.
Выполняют задание №2 и получают слово – ОСНОВАНИЯ.
(получившиеся числа – 16,19,15,16,3,1,15,10,33)
Определяют тему урока — «Основания», цель и задачи.
Самостоятельно формулируют учебные гипотезы для решения проблемной ситуации, используя имеющийся набор знаний, применяют логические операции. Самостоятельно создают алгоритм деятельности при решении поставленной проблемы.
Регулятивные: умение самостоятельно определять цели обучения, ставить и формулировать новые задачи в учебе и познавательной деятельности, развивать мотивы и интересы своей познавательной деятельности; целеполагание как постановка учебной задачи, планирование и прогнозирование.
Коммуникативные: умение организовывать учебное сотрудничество и совместную деятельность со сверстниками; работать индивидуально и в группе: находить общее решение; аргументировать и отстаивать свое мнение;
Познавательные: решение задач и формулирование познавательной цели.
уметь анализировать результаты, ориентироваться в своей системе знаний: отличать новое от уже известного.
4. Построение проекта выхода из затруднения.
Проанализируйте формулы
NaOH, Cu(OH)2, Fe(OH)3 по составу и ответьте на вопросы:
1. Это вещества простые или сложные?
2. Есть ли сходства в элементном составе молекул?
3. Как по-латински произносится О-кислород и Н-водород? Предложите название группы ОН.
4. Какую суммарную степень окисления имеет группа -ОН?
5. Есть ли отличия в молекулах оснований?
6. Расставьте степени окисления элементов в молекулах оснований.
7. От чего зависит число гидроксогрупп в молекулах оснований?
8. Предложите общую формулу оснований.
Отвечают на вопросы во время диалога, ведут записи в тетради
Коммуникативные: инициативное сотрудничество учащихся в поиске и выборе информации;): формируют собственное мнение, устанавливают и сравнивают разные точки зрения, принимают решение.
Регулятивные: учащиеся самостоятельно анализируют условия достижения цели на основе учёта выделенных учителем ориентиров действия;
Познавательные: общеучебные – смысловое чтение, поиск и выделение необходимой информации, умение структурировать знания; логические – построение логической цепочки рассуждений, анализ, синтез.
5. Этап реализации построенного проекта.
Организует работу по исследованию класса оснований, предлагает выполнить
задание 4
(см. задание 4).
Заполняют таблицу, формулируют выводы.
Коммуникативные: инициативное сотрудничество в поиске и выборе информации;
Регулятивные: самостоятельно анализируют условия достижения цели на основе учёта выделенных учителем ориентиров действия;
Познавательные: общеучебные – смысловое чтение, поиск и выделение необходимой информации, умение сравнивать и делать выводы.
6. Физкультминутка
Цель: развитие здорового образа жизни.
Предлагает сделать зарядку, обеспечивает эмоциональную разгрузку учащихся.
Повторение упражнений. Учатся переключаться
на другой вид деятельности, формируют представление о значении физминутки.
7. Первичное закрепление
Как можно распознать основания среди растворов других веществ?
Правила Т.Б.
http://school-collection.edu.ru/catalog/res/0ab6ce9b-4185-11db-b0de-0800200c9a66/?from=d05469af-69bd-11db-bd13-0800200c9c08&interface=pupil&class=50&subject=31
Организует работу по выполнению лабораторной работы
(см. задание 5).
http://school-collection.edu.ru/catalog/res/bb156370-aae7-11db-abbd-0800200c9a66/?from=d05469af-69bd-11db-bd13-0800200c9c08&interface=pupil&class=50&subject=31
Организует работу по отработке умения устанавливать соответствия:
Формула основания – формула оксида.http://school-collection.edu.ru/catalog/res/0ab6ce99-4185-11db-b0de-0800200c9a66/?from=d05469af-69bd-11db-bd13-0800200c9c08&interface=pupil&class=50&subject=31
Выполняют лабораторную работу, заполняют таблицу «Действие щелочей на индикаторы».
Составляют оксиды, соответствующие основаниям.
Регулятивные: контроль, оценка, коррекция.
Познавательные: общеучебные– выделение необходимой информации, умение наблюдать, анализировать и делать выводы по результатам лабораторной работы. овладение основами химической грамотности — способность анализировать и объективно оценивать жизненные ситуации, связанные с химией, навыками безопасного обращения с веществами, используемыми в повседневной жизни; использовать вещества в соответствии с их предназначением и свойствами, описанными в инструкции по применению.
Коммуникативные: инициативное сотрудничество при выполнении лабораторной работы с акцентированием практического и общественно-социального значения полученных знаний;
планирование своей деятельности для решения поставленной задачи и контроль полученного результата.
8. Самостоятельная работа.
Где применяются основания?
Организует деятельность по применению новых знаний в форме схемы-Фишбоун, анализирует выполнение обучающимися заданий, корректирует, оценивает их деятельность
(см приложение– задание 6). Пользуясь нижеприведённым текстом, ответьте на вопрос: Где применяют основания?
В качестве ответа заполните схему — рыбу, в которой верхние рёбра – это название вещества, обладающего щелочными свойствами, нижние рёбра – способы его использования. Сделайте вывод одним предложением и запишите его на хвосте рыбы.
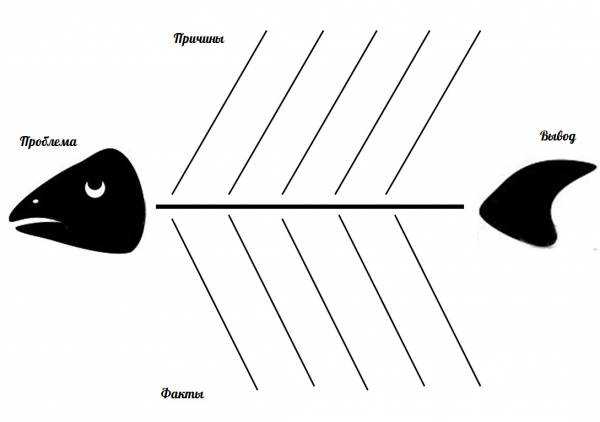
Заполняют схему Фишбоун на установление причинно-следственных связей и формулирование вывода-хвоста рыбы.
Мыло – растворяет жир и смывает грязь;
Сода – в кулинарии, для полоскания горла;
Раствор аммиака – стеклоочиститель;
Гашёная известь – строительство, побелка;
Хлорная известь – дезинфицирующее средство;
Гидроксид натрия – щелочные батарейки;
Гидроксид калия — производство тугоплавкого стекла.
Регулятивные: контроль, коррекция, выделение и осознание того, что уже усвоено и что подлежит усвоению.
Личностные: самоопределение.
Познавательные: общеучебные – смысловое чтение, поиск и выделение необходимой информации, умение структурировать знания; логические – построение логической цепочки рассуждений, анализ, синтез; умение определять возможные источники необходимых сведений, производить поиск информации.
9. Домашнее задание
Цель: закрепить изученный материал.
Объясняет домашнее задание
Формулирует задание, комментируя его по необходимости: параграф 20, вопросы 1-2, составить кроссворд по теме «Основания». Приготовить сообщение по теме «Индикаторы»
(по желанию).
Фиксируют задание: записывают задание в тетрадь.
Личностные: имеет внутреннюю позицию, адекватную мотивацию учебной деятельности, включая учебные и познавательные мотивы.
Регулятивные: выделение и осознание учащимся того, что уже усвоено и что еще подлежит усвоению, оценивание качества и уровня усвоения;
саморегуляция как способность к мобилизации сил и энергии; способность к волевому усилию – выбору в ситуации мотивационного конфликта и к преодолению препятствий.
10. Рефлексия деятельности
(итог урока)
Организует рефлексию в форме анкетирования –
(см. задание 7).
Оцените свою работу и работу товарищей на занятии.
Молодцы, вы сегодня хорошо работали. Мы все вместе узнали что-то новое и всё же каждый для себя совершил какое-то открытие. Поделитесь этим открытием, закончите предложение:
Сегодня на уроке
-
Я узнал
-
Я научился …
-
Было сложно
-
Было легко
-
Мне понравилось
-
Не понравилось
-
Меня удивило
-
Я не понял
-
Мне необходимо …
Запишите продолжение этого предложения в тетрадях.
Итак, озвучьте свои записи.
На уроке я работал(а): Активно/пассивно
Своей работой на уроке я:
Доволен/ не доволен
(мы сегодня научились находить формулы оснований среди других веществ, называть основания и составлять формулы по названиям, познакомились с отдельными представителями оснований.)
Выставляются оценки учащимся за работу на уроке
Осуществляют самоанализ, дают качественную и количественную оценку урока.
Высказывают свои мысли. Дополняют предложения.
Участвуют в беседе с учителем.
Познавательные: рефлексия;
Личностные: смыслообразование;
Коммуникативные: умение с достаточной полнотой и точностью выражать свои мысли.
infourok.ru
| Автор | Сообщение | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
advissor ®
Мистер Стабильность Uploader 100+
Стаж: 9 лет 10 мес. Сообщений: 16457 Ratio: 1061,429 Раздал: 123,5 TB Поблагодарили: 583127 100% |
|
|||||||||||||||||||||||||
|
tipa_pasha
Стаж: 7 лет 4 мес. Сообщений: 10 Ratio: 8,965 2.81% |
||||||||||||||||||||||||||
|
advissor ®
Мистер Стабильность Uploader 100+
Стаж: 9 лет 10 мес. Сообщений: 16457 Ratio: 1061,429 Раздал: 123,5 TB Поблагодарили: 583127 100% |
||||||||||||||||||||||||||
|
Trends Стаж: 7 мес. 6 дней Сообщений: 1 Ratio: 2,242 0% |
||||||||||||||||||||||||||
|
Leha-ha
Стаж: 7 лет 10 мес. Сообщений: 441 Ratio: 28,985 100% |
||||||||||||||||||||||||||
|
vipmolodoi
Стаж: 5 лет 9 мес. Сообщений: 202 Ratio: 18,621 Раздал: 6,881 TB 100% |
||||||||||||||||||||||||||
|
ramzes_sp
Стаж: 3 года 7 мес. Сообщений: 1 Ratio: 6,47 0% |
|
|||||||||||||||||||||||||
|
Tank
Стаж: 8 мес. 20 дней Сообщений: 3 Ratio: 32,328 100% |
||||||||||||||||||||||||||
kpozk.4failast-portgek.info