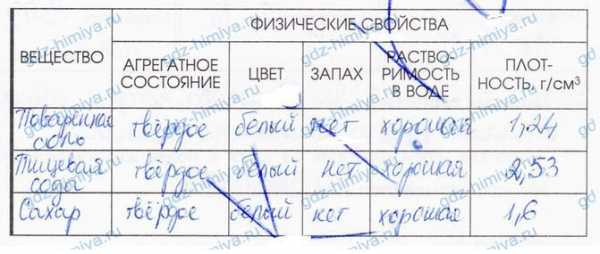
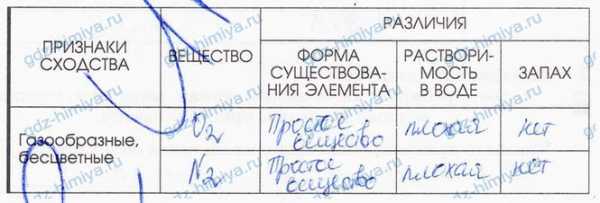
Помогите с заполнением таблицы) Химия, 8 класс, параграф 32, 1 вопрос. Рудзитис и Фельдман
Я в столбик напишу тебе, сама в табличку впишешь
Кислотами называются сложные вещества, в состав молекул которых входят атомы водорода, способные замещаться атомами металла.
Кислоты кислородосодержащие
ΗΝO3 — кислотный остаток NO3 — валентность I
H2SO4 — кислотный остаток SO4 — валентность II
Н3РO4 — кислотный остаток РO4 — валентность III
H2SO3 — кислотный остаток SO3 — валентность II
HNO2 — кислотный остаток NO2 — валентность I
Н2СO3 — кислотный остаток СO3 — валентность II
НВO3 — кислотный остаток ВO3 — валентность I
H3AsO4 — кислотный остаток AsО4 — валентность III
Кислоты бескислородные
НСl — кислотный остаток Сl — валентность I
H2S — кислотный остаток S — валентность II
HF — кислотный остаток F — валентность I
HI — I — валентность I
НВr — кислотный остаток Вr — валентность I
НСl — кислотный остаток Сl — валентность I
HF — кислотный остаток F — валентность I
HI — кислотный остаток I — валентность I
НВг — кислотный остаток Вr — валентность I
ΗΝO3 — кислотный остаток NO3 — валентность1
HNO2 — кислотный остаток NO2 — валентность I
НВO3 — кислотный остаток ВO3 — валентность I
H2SO4 — кислотный остаток SO4 — валентность II
Кислоты двухосновные
H2SO3 — кислотный остаток SO3 — валентность II
Н2СO3 — кислотный остаток СO3 — валентность II
H2S — кислотный остаток S — валентность II
Кислоты трехосновные
Н3РO4 — кислотный остаток РO4 — валентность III
H3AsO4 — кислотный остаток AsO4 — валентность III
class.rambler.ru
Предмет химии. Вещества — ГДЗ Габриелян Сладков 8 класс рабочая тетрадь
Часть 1
1. Химия изучает:
— вещества
— их строения
— их свойства
2. Вещество это —
то, из чего состоят физические тела.
3. Признаки, по которым одни вещества отличаются от других,
— это свойства, например: агрегатное состояние, цвет, запах, плотность и т.д.
4. Существует взаимосвязь: свойство вещества — применение вещества.
Например, для стекла:
1) Прозрачное — оконные стекла
2) изготовление хрусталя
3) витражное стекло
5. Вещества состоят из молекул, которые, в свою очередь, образованы из атомов. Определенный вид атомов называют химическим элементом. Всего известно 120 химический элементов.
6. Химический элемент существует в трех формах.
Часть 2
1. Установите соответсвие между понятием и примером.
2. Вычеркните лишнее:
колба, приборка, химический стакан, мензурка, ступка, мерный цилиндр, кристаллизатор.
Укажите признак, общий для оставшихся объектов.
Химическая посуда из стекла
3. Составьте задание, аналогичное предыдущему.
Вычеркните лишнее — приборка, мерная колба, цилиндр, штатив.
4. Заполните таблицу «Физические свойства вещества». В качестве примеров опишите вещества, используемые на кухне.
5. Укажите прилагательные, которые характеризуют свойства воды.
1) жидкая
2) пластичная
3) бесцветная
4) прозрачная
5) ароматная
6) электропроводная
Ответ: 1, 3, 4
6. Заполните таблицу «Сравнение физических свойств газообразных веществ».
7. Заполните таблицу «Сравнение физических свойств меди и железа».
8. Составьте кроссворд о свойствах и применении какого-либо вещества (по своему выбору).
9. На примере химического элемента водорода укажите правильную последовательность (1-2-3) перечисленных понятий от единичного к общему. Конкретизируте ее, используя слова и рисунки моделей частиц.
3) Вещество — это то, из чего состоят физические тела.
1) Атом — это химически неделимая частица.
2) Молекула — это наименьшая частица вещества.
10. Выражения, являющиеся синонимами понятия «химический элемент».
1) вид одинаковых атомов
2) вид одинаковых молекул
3) вид атомов, имеющих одинаковые свойства
4) простые вещества
5) названия видов атомов
Ответ: 1, 3
11. Установите соответствие между формой существования химического элемента и рисунками моделей частиц.
12. Проанализируйте рисунки и впишите пропущенные слова.
На рисунках изображено две молекулы сложных веществ, образованных из двух химических элементов.
13. Отметьте фразы, в которых говорится о сере как о химическом элементе. Из букв, соответствующих правильным ответам, вы составите название химического элемента, соединения которого используют для обеззараживания воды: хлор.
В тех фразах, которые вы не выбрали, речь идет о сере как о простом вещества.
gdz-himiya.ru
Для учащихся 8 класса — Сайт lysakovaen!
«Единственный путь, ведущий к знаниям, — это деятельность».
(Бернард Шоу)
Пусть зимний день с метелями
Мне навевает грусть.
Таблицу Менделеева
Я знаю наизусть!
Динамическая таблица Менделеева
Игра «Таблица Менделеева» — жми на картинку и играй!
Таблица с русскими и латинскими названиями химических элементов
ХЭ таблица.png
Portable Network Image Format
9.3 KB
Естественные семейства элементов
Зависимость свойств элементов от атомног
JPG Image
135.2 KB
Примеры составления молекулярных и структурных формул
Составление структурных формул 8 кл.gif
Graphic Interchange format
12.5 KB
Правила определения валентности
РАЗДАТОЧНЫЙ валентность 8 класс.doc
Microsoft Word Document
35.5 KB
Изменение цвета индикаторов в различных средах
Изменение окраски кислотно-основных инди
Microsoft Word Document
39.5 KB
Таблица растворимости
Таблица растворимости солей, кислот и ос
Microsoft Word Document
43.0 KB
Важнейшие классы неорганических соединений
Опорный конспект Классы неорган соед.doc
Microsoft Word Document
92.5 KB
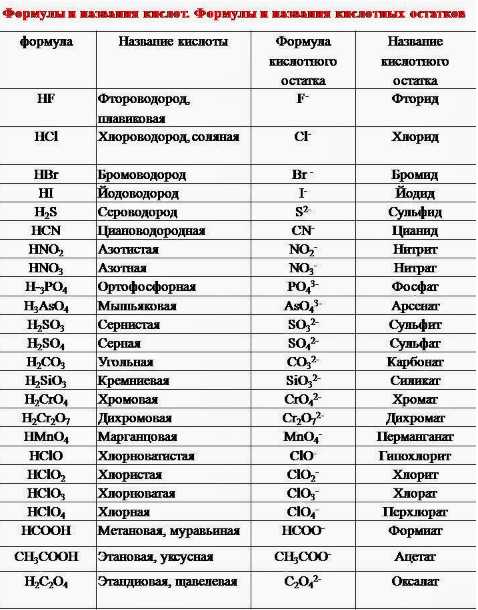
Таблица с названиями кислот и их кислотных остатков
кислоты и остатки.doc
Microsoft Word Document
59.0 KB
Оксиды и соответствующие им гидроксиды
Раздаточный ОКСИДЫ 8 класс.doc
Microsoft Word Document
87.0 KB
Опорная схема Генетическая связь между классами неорганических соединений
Генетическая связь.jpg
JPG Image
110.5 KB
Опорная схема «Оксиды»
ОС Оксиды 8 кл.docx
Microsoft Word Document
88.0 KB
Опорная схема «Основания»
ОС Основания 8 кл.docx
Microsoft Word Document
76.5 KB
Опорная схема «Кислоты»
ОС Кислоты 8 кл.docx
Microsoft Word Document
60.1 KB
Определение степеней окисления
1.png
Portable Network Image Format
431.7 KB
Составление формул по с/о
2.png
Portable Network Image Format
383.1 KB
Опорная схема «П/гр Азота»
ОС пгр Азота.docx
Microsoft Word Document
81.8 KB
Опорная схема «Азот»
ОС Азот простое вещество.docx
Microsoft Word Document
62.9 KB
Опорная схема «Аммиак»
ОС Аммиак.docx
Microsoft Word Document
51.2 KB
ЭХ ряд активности металлов, таблица и закономерности
ПАМЯТКА ЭХ ряд Ме.doc
Microsoft Word Document
74.0 KB
ОЭО
Относительные электроотрицательности эле
Microsoft Word Document
43.5 KB
Металлы
доп мат-л по Ме.doc
Microsoft Word Document
2.0 MB
Тривиальные названия некоторых веществ

Кислоты и их кислотные остатки
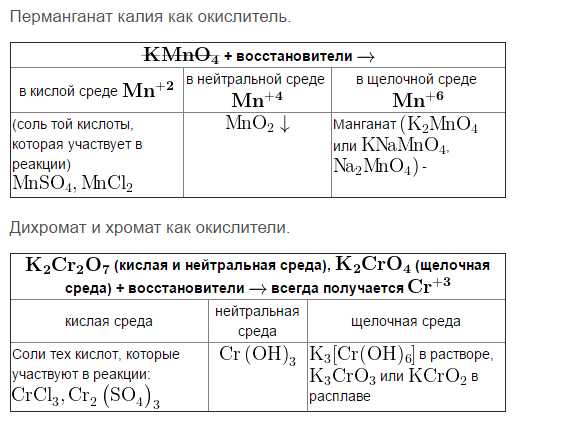




Экзамен по химии за 10 класс
Экзамен ХИМИЯ за 10 класс.doc
Microsoft Word Document
58.5 KB
ВАЖНЕЙШИЕ альфа АМИНОКИСЛОТЫ.doc
Microsoft Word Document
44.0 KB
Онлайн тест для учащихся 10 и 11 класса
Интерактивный мультимедиа учебник по органической химии
Химия в таблицах и схемах 1
Хим в табл и сх1.zip
Compressed Archive in ZIP Format
1.3 MB
Химия в таблицах и схемах 2
Хим в табл и сх2.zip
Compressed Archive in ZIP Format
1.5 MB
Химия в таблицах и схемах
Хим в табл и сх1.zip
Compressed Archive in ZIP Format
1.3 MB
Краткая характеристика самостоятельных работ учащихся
Виды самостоятельных работ.docx
Microsoft Word Document
13.0 KB
Требования к оформлению реферата
Требования к оформлению реферата.doc
Microsoft Word Document
40.5 KB
Требования к оформлению презентаций
Требования к презентациям.doc
Microsoft Word Document
235.0 KB
lysakovaen.jimdo.com
Урок 42. Классификация химических элементов. Амфотерные соединения (Страницы 116,117,118)
Главная › 8 класс › Химия › Рабочая тетрадь по химии Боровских 8 класс
1. Амфотерными соединениями называют оксиды и гидроксиды, которые способны регировать и с кислотами и со щелочами.
2. Распределите на группы следующие оксиды:
3. Составьте уравнения реакций оксидов алюминия и бериллия с соляной кислотой и гидроксидом натрия (при сплавлении).
4. Составьте уравнения реакций гидроксидов алюминия и бериллия с соляной кислотой и гидроксидом натрия (при сплавлении).
5. Прочитайте §34. Заполните таблицу.
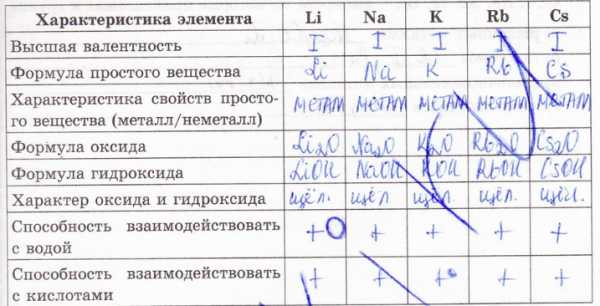
Что такое «естественные семейства химических элементов»? Какие естественные семейства вы знаете?
Являются группами химических элементов.
Щелочные металлы, щелочноземельные металлы, переходные металлы, халькогены, галогены, инертные газы, актиноиды.
6. В чем проявляется сходство между элементами: углеродом, кремнием, германием, оловом и свинцом?
Все они образуют соединения типа RO2, RH4.
7. Составьте формулы соединений с водородом и высших оксидов и гидроксидов селена и теллура, зная, что эти элементы образуют естественное семейство с кислородом и серой.
8. Среди следующих химических элементов выберите те, которые принадлежат к группе
Урок 41. Проверь свои знания по теме: «Основные классы неорганических соединений» — стр. 113-115Уроки 43-44. Периодический закон Д.И.Менделеева. Периодическая таблица. Группы, периоды — стр. 119-120
Сохраните или поделитесь с одноклассниками:
dourokov.ru
Урок по химии «Периодическая таблица химических элементов. Группы и Периоды» (8 класс)
Разработка урока в 8 классе
По теме : «Периодическая таблица химических элементов. Группы и Периоды.»
Цель урока: закрепить знания об изменении свойств элементов в периодах и группах, формировать и развивать умение пользоваться периодической системой для характеристики химических элементов.
Развивающие задачи: — развивать познавательную активность, умение устанавливать связь между местом элемента в периодической таблице и строением его атома;
— развивать внимание, память, химическую речь, логическое мышление, умение анализировать, сравнивать, делать выводы, самостоятельно добывать знания по теме, работать с компьютером;
— формировать творческую, социальную и информационную компетентность.
Воспитательная цель: воспитывать культуру поведения во время урока, культуру взаимоотношений.
Учащиеся должны знать: — структуру периодической системы;
— технику безопасности работы с компьютером.
Уметь: анализировать информацию, заложенную в периодической системе и использовать её для характеристики химического элемента, составлять схемы строения их атомов, формулы высших оксидов, гидроксидов, определять характер их химических свойств.
Тип урока: повторение усвоенных знаний, усовершенствование умений и навыков.
Метод: проблемно-поисковый.
Формы работы: групповая, парная, решение расчетных задач, работа с учебным диском, беседа, разноуровневая самостоятельная работа.
Оборудование: периодическая система химических элементов Д.И.Менделеева.
План урока
1. Актуализация знаний и умений
2. Повторение пройденного материала
3. Новый материал
4. Обобщение и систематизация знаний
5. Контроль и оценка знаний учащихся
6. Домашнее задание
Ход урока
1.Актуализация
Фронтальная беседа:
1. Раскрыть физическую сущность порядкового номера, химического элемента, номера группы, периода.
2. Как изменяются свойства элементов в периодах и группах? Приведите примеры.
3. Чем отличаются между собой электронные конфигурации металлов и неметаллов?
4. Что общего в строении атомов элементов одной подгруппы? Одного периода?
5. Как изменяется радиус атома в периоде, группе? Почему? Приведите примеры.
Химическая игра «Третий лишний», эстафета:
На карточках в вертикальных столбцах написаны формулы элементов, их простых и сложных веществ. Учащиеся вычеркивают ту формулу вещества, которая не принадлежит к данной группе или подгруппе элементов, а также к классу веществ, образованных этими элементами. Учащиеся разделены на команды по 5-6 человек и работают по принципу эстафеты. Побеждает та команда, которая закончит игру.
I группа
1) Li 2)Cl2 3)Mg(OH)2 4)Ne 5)N2
Na Br2 NaOH F O2
Ba H2 KOH Ar S
II группа
1) С 2) Ca 3) S 4)Ca(OH)2 5) F2
P Mg Se Cr(OH)2 O2
Si Cu I Sr(OH)2 Cl2
Ш группа
1)Mg 2)H2SiO3 3) Si 4)Kr 5) H2Se
Cu H3AlO3 B Xe HF
Ag H2CO3 Al Fe H2Te
I группа
1) Li 2)Cl2 3)Mg(OH)2 4)Ne 5)N2
Na Br2 NaOH F O2
Ba H2 KOH Ar S
II группа
1) С 2) Ca 3) S 4)Ca(OH)2 5) F2
P Mg Se Cr(OH)2 O2
Si Cu I Sr(OH)2 Cl2
Ш группа
1)Mg 2)H2SiO3 3) Si 4)Kr 5) H2Se
Cu H3AlO3 B Xe HF
Ag H2CO3 Al Fe H2Te
2. Повторение пройденного материала
(индивидуальная работа с предоставленной таблицей)
Мы с вами, ребята, уже достаточно вооружены знаниями о периодическом законе Д.И. Менделеева и теорией о строении атома. Сегодня на уроке мы закрепим наши умения и навыки в использовании периодической системы, а также знания об основных классах неорганических соединений.
Сейчас вы продолжаете работать в парах, учитесь давать характеристику химического элемента самостоятельно по вариантам.
Согласно своему варианту заполните таблицу
I вариант
элемент №11
I вариант элемент №16
I
Название элемента, символ.
II
Положение в периодической системе:
1)порядковый номер;
2)номер периода;
3)номер группы, подгруппы.
III
Строение атома:
1)заряд ядра;
2)количество р, п, е
3)электронная формула;
4)графическая электронная формула внешнего слоя;
5)количество электронов на внешнем слое.
IV
Характер простого вещества (металл или неметалл).Привести пример по одной реакции.
V
Формула высшего оксида, его характер (по одной реакции).
VI
Формула высшего гидроксида, его характер (по одной реакции).
VII
Формула летучего соединения с Гидрогеном.
Согласно своему варианту заполните таблицу
I вариант
элемент №11
I вариант элемент №16
I
Название элемента, символ.
II
Положение в периодической системе:
1)порядковый номер;
2)номер периода;
3)номер группы, подгруппы.
III
Строение атома:
1)заряд ядра;
2)количество эл., нейтр., прот.
3)электронная формула;
4)графическая электронная формула внешнего слоя;
5)количество электронов на внешнем слое.
IV
Характер простого вещества (металл или неметалл).Привести пример по одной реакции.
V
Формула высшего оксида, его характер (по одной реакции).
VI
Формула высшего гидроксида, его характер (по одной реакции).
VII
Формула летучего соединения с Гидрогеном.
3. Новый материал
У атомов металлов малых периодов (I—III) на внешнем электронном слое находится от 1 до 3 электронов, а у атомов неметаллов — от 4 до 8. Исключение составляют атомы водорода — 1 электрон
и бора — 3 электрона.
Зная характер изменения радиусов атомов по группам и периодам, а также их электронную структуру, можно объяснить причину изменения металлических и неметаллических свойств атомов элементов, точнее, их простых веществ.
Проявление металлических свойств определяется, прежде всего, способностью атомов данного элемента отдавать электроны с внешнего электронного слоя. Именно наличием у металлов свободных электронов обусловлена их высокая электропроводность.
И наоборот, способность атомов данного элемента присоединять электроны определяет неметаллические свойства его простого вещества.
Усиление металлических свойств щелочных металлов с возрастанием атомного номера элемента связано прежде всего с увеличением радиусов их атомов, т. е. с ростом числа электронных слоев. Электрон на внешнем электронном слое у этих атомов все слабее связан с ядром, поэтому легче отрывается. Одновременно усиливаются основные свойства оксидов и гидроксидов этих элементов, поскольку они определяются металлическими свойствами.
В противоположность этому неметаллические свойства элементов группы галогенов ослабевают с увеличением зарядов ядер их атомов, так как растет число электронных слоев. Внешний слой находится все дальше от ядра, поэтому электроны, находящиеся на этом слое, слабее связаны с ядром. Кислотные свойства у оксидов и гидроксидов этих элементов также ослабляются.
Таким образом, в главных группах (группах А) периодической системы с ростом зарядов ядер атомов химических элементов усиливаются металлические свойства их простых веществ и, соответственно, ослабевают неметаллические. Это особенно наглядно проявляется в группе IV (A). В ней свойства простых веществ химических элементов изменяются от неметаллических (у углерода и кремния) к металлическим (у олова и свинца).
Закономерности изменения различных характеристик химических элементов в малых периодах и главных группах периодической системы на примере IVA-группы показаны в таблице ниже.
Номер периода
Символ элемента
Заряд ядра атома
Число электронных слоев
Число электронов на внешнем слое
Валентность в высших оксидах
1
—
—
—
—
—
2
С
6+
2
4
IV
3
Si
14+
3
4
IV
4
Ge
32+
4
4
IV
5
Sn
50+
5
4
IV
6
Pb
82+
6
4
IV
В малых периодах с ростом зарядов ядер атомов увеличивается и число электронов на внешнем слое. Они сильнее притягиваются к ядру, поэтому атомам все труднее отдавать электроны и легче присоединять их. По этой причине в периоде у атомов химических элементов ослабевают металлические и усиливаются неметаллические свойства. Аналогично в периоде с ростом зарядов ядер атомов свойства оксидов и гидроксидов изменяются от основных к кислотным.
Номер периода равен общему числу энергетических уровней, заполняемых электронами, у атомов данного элемента.
В малых периодах и нечётных рядах больших периодов с ростом положительного заряда ядер возрастает число электронов на внешнем энергетическом уровне. С этим связано ослабление металлических и усиление неметаллических свойств элементов слева направо.
Необходимо помнить:
Ядро атома:
занимает большую часть объёма атома
занимает ничтожно малую часть объёма атома
занимает примерно половину объёма атома
не имеет определённых размеров
Химическая активность металлов и неметаллов – простых веществ элементов 2 и 3 периода. Падает металлическая активность, нарастают неметаллические свойства, что связанно с увеличением количества электронов на внешнем энергетическом уровне. Каждый из этих периодов начинается с активного щелочного металла, состоит из 8 элементов, плавно нарастают неметаллические свойства и заканчивается инертным газом.
Рассмотрите таблицу № 6 в учебнике, на странице 188
Какие выводы вы можете сделать применяя эти свойства к элементам 3-го периода натрию, алюминию и сере?
Рассмотрите таблицу № 8 в учебнике, на странице 190
Какие выводы вы можете сделать применяя эти свойства к элементам 3-го периода натрию, алюминию и сере?
4. Обобщение и систематизация знаний
Сегодня на уроке мы закрепили знания об изменении свойств элементов в малых периодах, пользуясь периодической системой для характеристики химических элементов малых периодов.
Ответе на вопросы (фронтальный опрос):
-какие периоды называют «малыми»?почему?
-какими элементами они начинаются и какими заканчиваются?
-как изменяются химические свойства простых в-в этих элементов в периодах?
5. Контроль и оценка знаний учащихся
Решение расчетных задач на нахождение элемента по периодической системе.
Задача 1
Назвать элемент по таким данным: находится в III группе, относительная молекулярная масса высшего оксида 102.
Дано: Решение:
R2O3
Mr(R2O3)=102
Mr(R2O3)=102, Ar(O)=16
2x+16*3=102
2x=102-48
2x=54
x=27 Ответ: Алюминий.
R-?
Задача 2
При взаимодействии 6 г двухвалентного металла с сульфатной кислотой выделилось 5,6 л водорода. Определить металл.
Решение:
6г 5,6 л
X + h3SO4 = XSO4 + h3
n (h3)= n (X) = V/V н.у.= 5,6/22,4 = 0,25 моль
Mr (X)= m/n= 6/ 0,25= 24 г/моль
Металл – Магний
Задача 3
Определите металл, если при разложении 9 г гидроксида металла (II) образуется 7,2 оксида металла (II)
Решение:
9г 7,2
X (OH)2= XO + h3O
n(XO)=n(X(OH)2)=7,2/х+16= 9/х+34
9(х+16)=7,2 (х+34)
9х+144=7,2+244,8
1,8х=100,8
Х=56 Металл – Железо
6. Домашнее задание:
7. Рефлексия.
infourok.ru