Химия — с нуля! 1-й шаг. Учимся составлять, называть и понимать формулы веществ | Репетитор Богунова В.Г.
Вы хотите познавать химию и профессионально, и с удовольствием? Тогда вам сюда! Автор методики системно-аналитического изучения химии Богунова В.Г. раскрывает тайны решения задач, делится секретами мастерства при подготовке к ОГЭ, ЕГЭ, ДВИ и олимпиадам
Хочешь сдать ЕГЭ по химии и биологии на 90+? WhatsApp репетитора Богуновой В.Г. +7(903)186-74-55
Сайт репетитора Богуновой В.Г.
Репетитор Богунова В.Г. ВК
Ютуб-канал репетитора Богуновой В.Г.
Полный каталог статей — на авторском сайте в разделе «Статьи репетитора Богуновой В.Г.»
Внимание! Продолжается набор учеников на летний онлайн-курс «Стартап+ (химия с нуля по-взрослому)» с 12 июня по 28 августа.
Подробная информация по WhatsApp +7(903)186-74-55
Обязательно прочитайте мою статью «Летний курс Стартап+ (химия с нуля по-взрослому).
Присоединяйся!» Там вы найдете много интересных, важных и нужных учебных материалов как для самостоятельной работы, так и для занятий с репетитором.
Знаете, в чем ошибка большинства преподавателей химии и репетиторов? Желая продемонстрировать степень собственного образования и никчемность знаний абитуриента, они, практически с первых занятий, начинают решать трудные задачи «уровня Белавина» и задания олимпиад. Кстати, профильные лицеи при ведущих медицинских ВУЗах — не исключение (у каждого ученика есть репетиторы). Как результат, у ребенка формируется страх перед сложным и объемным учебным материалом, который необходимо освоить. Нервная система включает защитный механизм — блокирование негативно воспринимаемой информации. И все … у абитуриента развивается стойкое отвращение к предмету! Теперь, чтобы инициировать ребенка на изучение химии, необходим опытный Преподаватель и много-много времени для работы. И нет никакой гарантии, что ученик раскроется и позволит Учителю выстроить у себя в голове стройную систему предмета.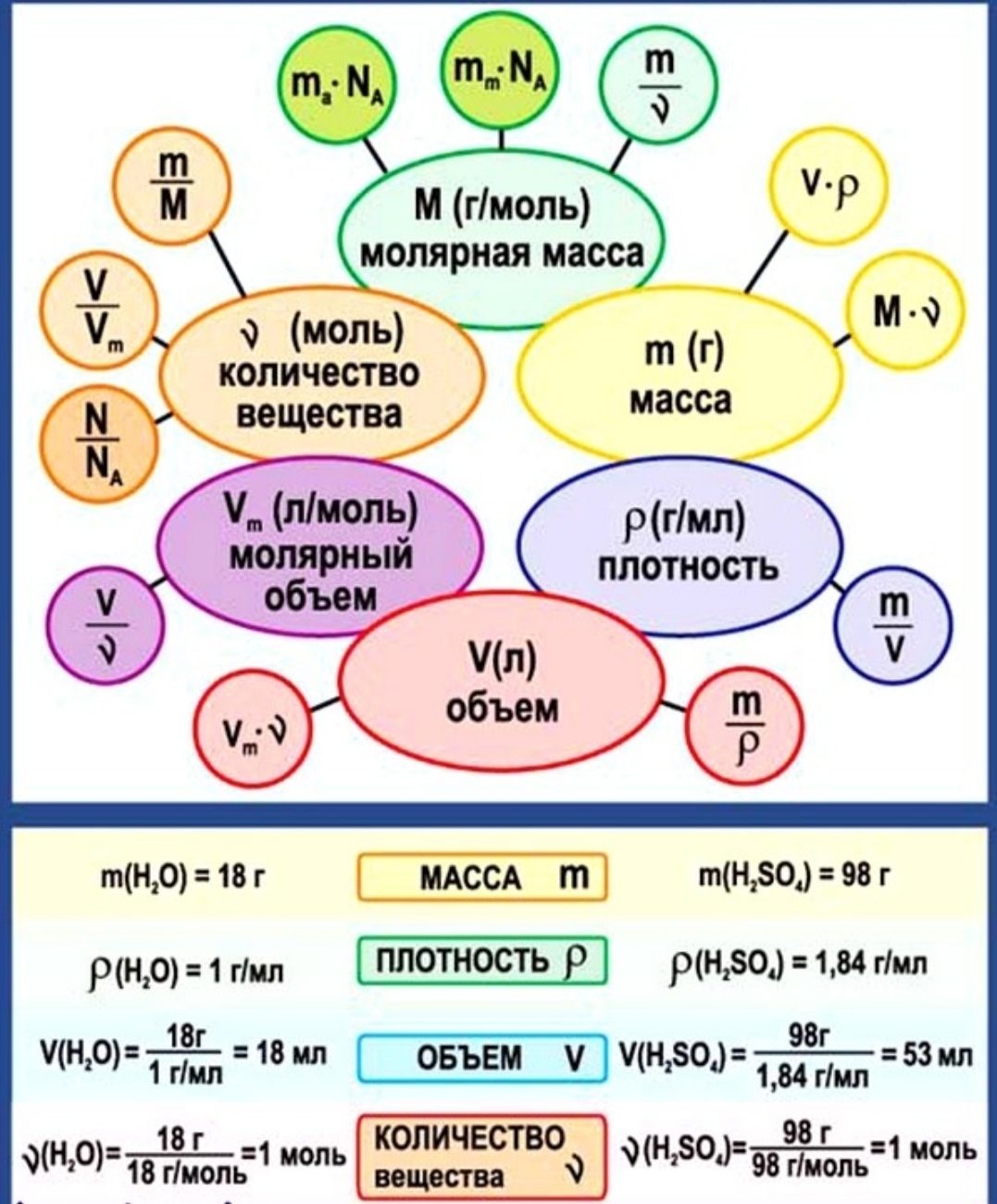 Поэтому, в преподавании, как и во врачевании, важны принципы: «Не навреди!», «Пироги должен печь пирожник, а не сапожник»! Это я к тому, что репетиторов в последнее время развелось, как тараканов, очень много, а преподавателей среди них — днем с огнем не найдешь!
Поэтому, в преподавании, как и во врачевании, важны принципы: «Не навреди!», «Пироги должен печь пирожник, а не сапожник»! Это я к тому, что репетиторов в последнее время развелось, как тараканов, очень много, а преподавателей среди них — днем с огнем не найдешь!
Не будем спотыкаться о чужие ошибки (своих не допустить бы, тьфу-тьфу), начнем изучение химии с нуля и сделаем первый шаг — составление, название и понимание формул веществ.
Конспект репетитора
Химическая формула — это запись состава вещества с помощью символов элементов и подстрочных индексов.
Индекс (подстрочный) обозначает число атомов данного элемента в молекуле вещества.
Коэффициент — число, стоящее перед химической формулой, обозначает число молекул вещества.
Например, запись 7h3SO4 означает: семь молекул серной кислоты, каждая из которых состоит из двух атомов водорода, одного атома серы и четырех атомов кислорода.
Познакомимся с алгоритмом составления формул веществ на примере бинарных соединений.
Бинарные соединения — вещества, образованные двумя химическими элементами (h3O, Al2S3, PCl5, Nh4 и др.). Поучимся составлять формулы бинарных соединений по конкретному заданию.
Задание
Написать одну из формул и назвать соединение, молекула которого содержит атомы серы и фосфора
Алгоритм составления формул:
1. Выписать символы химических элементов в порядке увеличения их электроотрицательности.
Электроотрицательность (ЭО на схеме) — способность атома притягивать к себе электроны (и свои, и чужие).
2. Определить валентность элементов
Валентность — способность атомов химических элементов образовывать определенное число химических связей.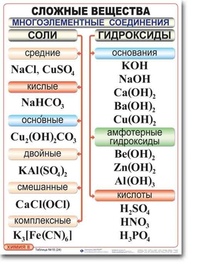
Высшая валентность (в) равна номеру группы. У первого элемента, стоящего левее, валентность либо определена, либо высшая. В нашем случае валентность фосфора не озвучена, поэтому берем высшую.
Низшая валентность (н) равна «восемь минус номер группы» (определяется только для элементов IVA-VIIA групп). У второго элемента, стоящего правее, валентность всегда низшая. В нашем случае сера — элемент VIA-группы, ее низшая валентность равна 8-6=2.
Запомнить: у кислорода валентность всегда 2, у фтора — всегда 1!
3. Определить число атомов каждого элемента (нижние индексы).
Для этого находим наименьшее общее кратное значений валентностей и делим его на каждое из них.
Для справки
Наименьшее общее кратное двух целых чисел m и n есть наименьшее натуральное число, которое делится на m и n без остатка.
4. Назвать вещество
Название бинарного соединения состоит из двух слов.
Первое слово — название второго элемента, стоящего правее (с низшей валентностью) с добавлением суффикса -ИД. В нашем случае — сульфид. Таким образом, суффикс -ИД указывает на то, что этот элемент имеет низшую валентность «восемь минус номер группы».
Второе слово — название первого элемента, стоящего левее (с более низкой электроотрицательностью) — в родительном падеже. В нашем случае — фосфора (кого? чего?).
Если первый элемент может иметь несколько значений валентности, то в конце названия указывается конкретное значение валентности в скобках римскими цифрами. В нашем случае фосфор может иметь валентности 3 и 5, поэтому название вещества — сульфид фосфора (V).
Репетитор Богунова В.Г. с учениками
Репетитор Богунова В.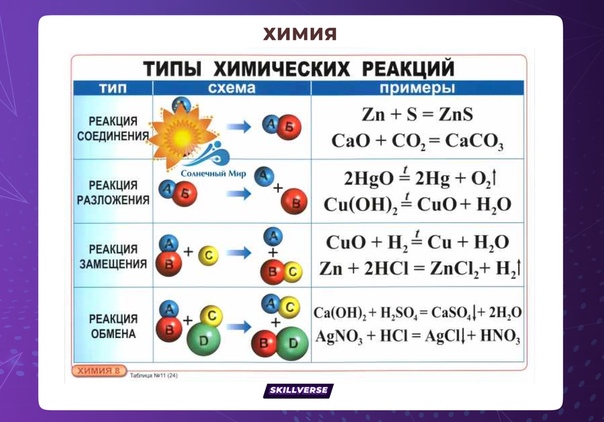 Г. с учениками
Г. с учениками
Вы хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии. Здесь вы найдете огромное количество задач, заданий, теоретического материала и познакомитесь с моими учениками, многие из которых уже давно закончили ВУЗы и, работая врачами, спасают наши с вами жизни.
На странице ВК я анонсирую свои публикации, вебинары, уроки, рассказываю и показываю решение задач и заданий, выкладываю новинки теоретического материала, конспекты и лекции. Добавляйтесь ко мне в друзья, и вы всегда будете в курсе всех событий, связанных с подготовкой к ЕГЭ, ДВИ, олимпиадам!
Полный каталог статей репетитора Богуновой В.Г. вы найдете на странице сайта Статьи репетитора
Подписывайтесь на YouTube-канал Репетитор по химии и биологии.
Здесь ежедневно появляются новые вебинары, видео-уроки, видео-консультации, видео-решения.
Пишите мне в WhatsApp +7(903)186-74-55, я отвечу вам обязательно.
Приходите ко мне на занятия, я помогу вам фундаментально изучить химию и биологию, научу решать любые задачи, даже самые сложные.
Репетитор по химии и биологии кбн В.Богунова
Как выучить химию. Несколько полезных советов.
Содержание
1. Почему химия один из самых трудных школьных предметов?
2. Как учить химию эффективнее? О нестандартных методах как выучить химию самостоятельно
2.1 Как решать задачи по химии?
2.2 Как легко запомнить таблицу Менделеева?
3. Почему важно знать химию?
3.1 Значение химии в жизни современного человека
3. 2 Химические явления в природе
2 Химические явления в природе
3.3 Интересная химия: факты о химических явлениях
4. Так зачем учить химию?
Почему химия один из самых трудных школьных предметов?
Химия является наукой, которая сформировалась в глубокой древности. Жрецы Древнего Египта использовали свои знания по этому предмету, чтобы держать в своей власти граждан страны. Сейчас же данная дисциплина доступна каждому, кто изучает её в средней и старшей школах. Это предмет о веществах и их превращениях.
Трудно определить, как выучить химию с нуля, посетив лишь один-два урока. Для некоторых составляет трудность освоить науку даже на втором или третьем году обучения. Причин этому может быть несколько:
- сложность запоминания теоретической информации, содержащего множество деталей различной тематики;
- отсутствие мотивации к изучению предмета со стороны учителей;
- наличие множества взаимосвязей между отдельными отраслями химии, которые могут быть использованы для решения комбинированных задач;
- различные типы заданий, предлагающихся для решения, алгоритмы для которых запомнить трудно;
- отсутствие практических наглядных примеров того, что изложено в учебнике или пособии;
- изучение последующей темы без надлежащего усвоения предыдущей.

Подготовка к экзаменам по химии при этом превращается в повторение объемного материала, но без стройной системы знаний это сделать очень трудно.
Грамотный репетитор по химии сможет изменить отношение ребёнка к данному предмету, открыв для него возможность эффективно обучаться самостоятельно в дальнейшем.
Вернуться в начало
Как учить химию эффективнее? О нестандартных методах как выучить химию самостоятельно
В случае, если было пропущено достаточно много учебного материала, может возникнуть проблема, как выучить химию с нуля и как готовиться к очередному уроку. Даже если в предыдущих знаниях существуют пробелы, достаточно внимательно перечитать предыдущие несколько параграфов, расположенных перед текущей темой и рассмотреть примеры решения заданий.
Быстро и эффективно изучить материал можно, если не рассматривать его как сухую теорию. В качестве альтернативы используются мнемотехнические или ассоциативные формулы для запоминания терминологии и алгоритмов решения заданий. В этом случае для каждой химической взаимосвязи используются известные с обыденной жизни примеры (пример химического раствора — сахар в воде). Это один из способов, как выучить химию самостоятельно.
В этом случае для каждой химической взаимосвязи используются известные с обыденной жизни примеры (пример химического раствора — сахар в воде). Это один из способов, как выучить химию самостоятельно.
Чтобы начать изучать науку самостоятельно, необходимо представить, зачем и с чего начать учить химию. Эта дисциплина — не просто строки в очередной книге, наполненные непонятными и сложными формулами, как и в физике. Всё, что было изложено на уроках, находится вокруг каждого человека. Просто необходимо внимательно наблюдать, чтобы увидеть химические превращения.
Более эффективно этого можно достичь, пользуясь услугами частных преподавателей. Существует даже услуга «онлайн репетитор по химии» — чтобы обучаться даже не придётся выходить из дому, учитель придёт сам.
Вернуться в начало
Как решать задачи по химии?
Особенно важной частью в изучении химической науки является понять, как решать задачи по химии. В школьном и университетском курсах дисциплины предлагается множество заданий не только одного направления, но и сочетающих в себе несколько типов.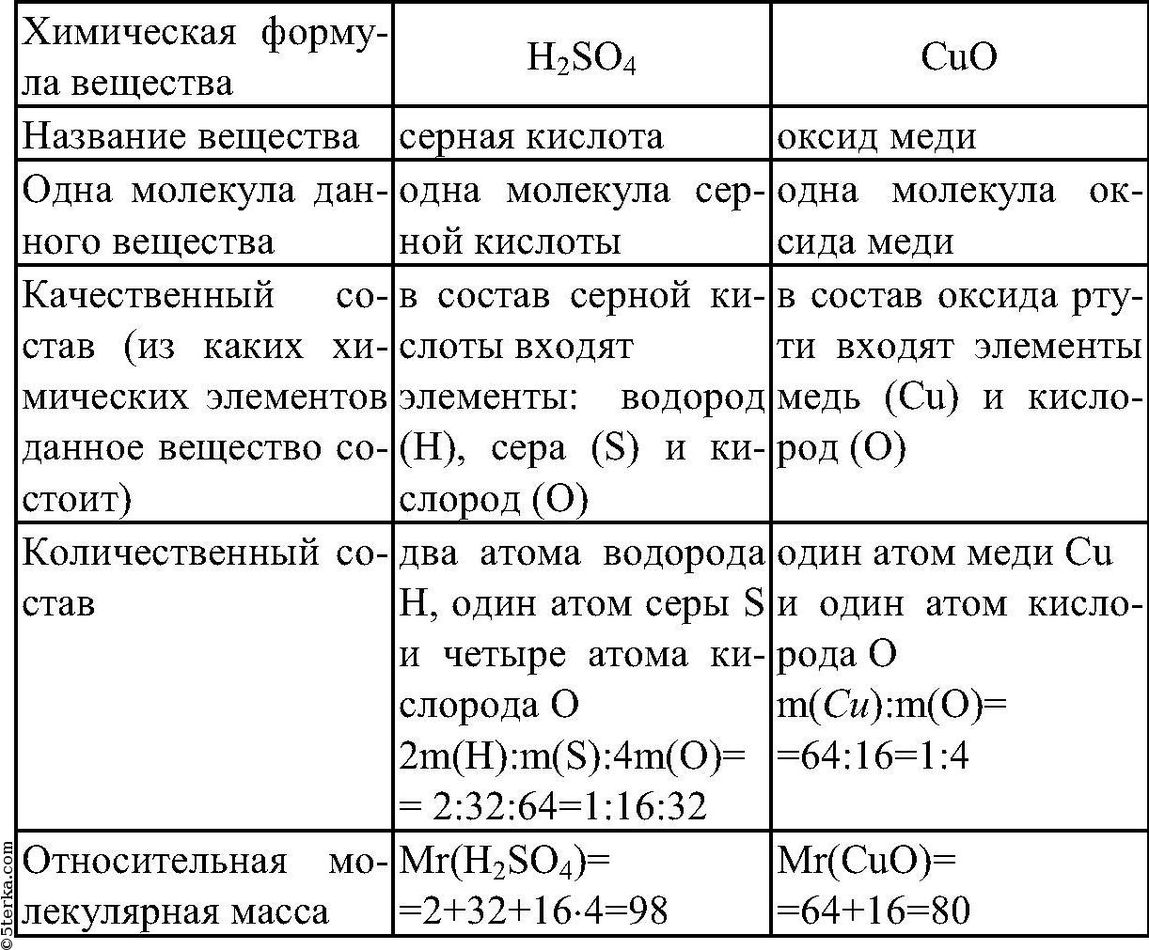 Поэтому важно определить алгоритм решения таких задач, и записать его отдельно.
Поэтому важно определить алгоритм решения таких задач, и записать его отдельно.
Наиболее простым способом является вариант «вопрос-ответ», который даёт наибольшее количество информации:
- о чём именно говорится в задаче?
- знание каких тем и формул возможно использовать для её решения?
- какие величины и единицы измерения задействованы в условии и как они взаимосвязаны между собой (моль, литр, грамм)?
- какие константы могут понадобится?
Поочерёдно ответив на каждый из этих вопросов, вариант решения для школьника может быть оформлен очень быстро. Такой алгоритм действует и при решении задач по физике для правильного расчёта.
Практически для любой задачи важно знать как составить уравнение реакции по химии. Для этого опять же стоит задавать правильные вопросы, чтобы узнать, будет ли вести себя вещество так, как описано в учебнике, или дополнительные условия могут повлиять на состав конечных продуктов реакции:
- тип вещества;
- условия проведения реакции;
- концентрация реагентов.

После того, как схема реакции составлена, остаётся расставить коэффициенты перед молекулами реагентов и продуктов реакции. В общей сложности, это составляет упрощённую схему, как решать уравнения по химии.
Вернуться в начало
Как легко запомнить таблицу Менделеева?
Периодическая таблица элементов является чуть ли не самым узнаваемым символом химии как науки. По этой причине важно знать, как быстро выучить таблицу Менделеева. Это необходимо, поскольку молярная масса химических элементов, их валентность и предполагаемые химические свойства можно определить, просто заглянув в неё.
Запоминать и записывать расположение элементов не стоит совершать учить на память, поскольку в результате для поиска элемента в таблице придётся вспоминать расположение всех элементов до необходимого. Гораздо эффективнее будет иметь таблицу под рукой во время решения заданий и находить тот, который упоминается в конкретной задаче.
Ещё одним увлекательным способом, как легко выучить таблицу Менделеева, является стихотворная форма расположения в ней химических элементов:
Самый первый — водород.
Это знает весь народ.
Гелий, Литий и Бериллий,
Бор, а следом — Углерод,
Там Азот, а за Азотом
Двухвалентный Кислород.
Фтор с Неоном, Натрий, Магний,
Алюминий, Кремний тут.
Фосфор, Сера, Хлор с Аргоном,
Калий с Кальцием идут.
Этот стих продолжается до самого последнего ныне открытого элемента.
Вернуться в начало
Почему важно знать химию?
Данная наука имеет существенное значение в жизни человека. Открытия, совершаемые в лабораториях, постепенно используются в практических целях. Новое топливо, металлический сплав или более эффективное лекарство — результат научных изысканий исследования окружающей природы.
Химия важна не только для людей, которые решили связать с ней будущую профессию. Она имеет значения и в быту, когда, сами того не зная, люди используют интуитивные навыки владения ею. Это важно как для поваров, которые для приготовления теста, «гасят» соду уксусом, так и для автолюбителей, имеющих дело с серной кислотой в аккумуляторных батареях автомобилей. И для учителей, преподающих науку.
И для учителей, преподающих науку.
Вернуться в начало
Значение химии в жизни современного человека
Каждый из нас должен мыть руки каждый день — это непреложный подход для сохранения здоровья и поддержание чистоты в собственном доме. При этом мало кто задумывается, что образование пены — процесс химической природы. Это один из многих примеров, когда химические явления в быту проявляются так ярко.
Иной пример — обычное горение древесины, при котором целлюлоза при окислительном действии кислорода воздуха превращается в сажу, углекислый газ и водяной пар.
Химия в повседневной жизни человека — это не просто набор текста из условных обозначений в специализированной книге. Для того, чтобы открыть их пользу для себя, важно иметь понятия о химических веществах и об их природе в целом. При условии, что Вы решите, что Вам нужен репетитор химии, Киев — город, предлагающий широкий выбор преподавателей.
Особенно стоит сказать, какова роль химии в медицине. Учёный-химик занимается разработкой новых препаратов для борьбы с болезнями проводится на основании уже полученных ранее результатов с учётом новых возможных форм синтеза соединений. Фармакология, как особый раздел химии стал неотъемлемой частью способа лечения болезней.
Учёный-химик занимается разработкой новых препаратов для борьбы с болезнями проводится на основании уже полученных ранее результатов с учётом новых возможных форм синтеза соединений. Фармакология, как особый раздел химии стал неотъемлемой частью способа лечения болезней.
Не менее важна роль химии в жизни общества. Открытие новых соединительных, строительных материалов и видов топлива позволяет создавать более эффективные виды обслуживающих механизмов.
Вернуться в начало
Химические явления в природе
Химические явления в окружающей среде можно встретить на каждом шагу. К примеру, разрезанное яблоко со временем на месте среза начинает темнеть. Это происходит из-за окисления веществ, входящих в состав мякоти яблока на воздухе. Горение газа — ещё один из наиболее встречаемых вариантов. Метан, входящий в состав природного газа, сгорает с образованием углекислого газа и водяного пара.
Значение химических процессов в природе наблюдается не случайно даже на примере тела человека. Съеденная пища расщепляется организмом с высвобождением энергии на более простые вещества для дальнейшей жизнедеятельности.
Съеденная пища расщепляется организмом с высвобождением энергии на более простые вещества для дальнейшей жизнедеятельности.
Но наиболее ярким примером является фотосинтез растений. При помощи лишь воды и углекислого газа на солнечном свете формируются более сложные по своему строению органические вещества. Ими могут быть как спирт, так и сахар.
Вернуться в начало
Интересная химия: факты о химических явлениях
Одним из разделов этой дисциплины может быть охарактеризован двумя словами: «интересная химия». В нём приводятся примеры явлений, с которыми человек практически не сталкивается в реальной жизни.
Если задать человеку на улице вопрос: «Горит ли вода?», он, вероятно, ответит, что она не горит. На самом деле это не так. В среде фтора вода воспламеняется и пылает достаточно ярко.
Среди всех металлов существует любопытный галлий. Если в быту железо приходится нагревать до высоких температур, чтобы оно стало жидкостью, то галлий достаточно просто положить на ладонь. Под воздействием тепла человеческого тела он станет лужицей.
Под воздействием тепла человеческого тела он станет лужицей.
А вот помощником в открытии нового химического элемента — иода — однажды стала кошка. В 1811-м году в лаборатории французского учёного-химика Куртуа она случайно перевернула банку с серной кислотой на высушенные водоросли. В результате начал выделяться фиолетовый газ, что и позволил открыть новый химический элемент.
Данные особенности веществ изучает химия. Интересные факты можно встретить во всех её разделах.
Вернуться в начало
Так зачем учить химию?
Химия играет важную роль в жизни современного общества. Речь идёт не только о новых достижениях в области науки и техники, но и о соблюдении обычных правил безопасности. Знание химических законов помогает более полно понять окружающую природу и происходящие в ней процессы.
При правильном подходе к науке, её изучение может не быть пыткой, но стать очень интересным занятием. При этом важно каждый момент прорабатывать до конца, и выяснять всё, что непонятно.
Если уроков в школе недостаточно, эффективно будет обратиться к репетитору для дополнительной подготовки. Таким образом можно достичь желаемого результата.
Вернуться в начало
Вам может быть интересно:
Химия — тест ВНО с ответами
Как подготовиться к ЗНО по химии 2017?
Периодическая система химических элементов (таблица Менделеева)
https://ria.ru/20190129/1550014194.html
Периодическая система химических элементов (таблица Менделеева)
Периодическая система химических элементов (таблица Менделеева) — РИА Новости, 29.01.2019
Периодическая система химических элементов (таблица Менделеева)
Периодическая система химических элементов – упорядоченное множество химических элементов и их естественная классификация. РИА Новости, 29.01.2019
2019-01-29T04:51
2019-01-29T04:51
2019-01-29T04:51
справки
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21. img.ria.ru/images/99408/72/994087230_0:105:2000:1230_1920x0_80_0_0_b528d261d40438ab5524fc6ad7f580a3.jpg
img.ria.ru/images/99408/72/994087230_0:105:2000:1230_1920x0_80_0_0_b528d261d40438ab5524fc6ad7f580a3.jpg
Периодическая система химических элементов – упорядоченное множество химических элементов и их естественная классификация. Является табличным представлением периодического закона, открытого Дмитрием Менделеевым. Современная формулировка этого закона звучит так: свойства элементов находятся в периодической зависимости от заряда их атомных ядер.Прообразом Периодической системы химических элементов служит таблица «Опыт системы элементов, основанной на их атомном весе и химическом сходств», составленная Менделеевым в 1869 году. По мере совершенствования этой таблицы он развил представления о периодах и группах элементов и о месте каждого элемента в системе. В 1871 году в книге «Основы химии» Менделеевым была включена «Естественная система элементов Д. Менделеева» – первая классическая короткая форма Периодической системы химических элементов. Современная Периодическая система химических элементов включает 118 элементов. За последние 50 лет таблица Менделеева пополнилась семнадцатью новыми элементами (102-118). Девять из них были впервые получены в российском Объединенном институте ядерных исследований в Дубне. Последнее добавление в таблицу Менделеева было сделано в 2016 году, она пополнилась четырьмя элементами с 113, 115, 117 и 118 атомными номерами, которые соответственно были названы нихоний (Nh), московий (Mc), теннессин (Ts) и оганесон (Og). Сейчас в крупнейших ядерно-физических центрах мира фактически начаты работы по синтезу 119-го, 120-го и 121-го элементов, которые назвали «большой гонкой».Опубликовано свыше 500 вариантов Периодической системы химических элементов, что связано с попытками поиска решения некоторых частных проблем ее структуры. Наиболее распространены две табличные формы: короткая и длинная (разрабатывалась Дмитрием Менделеевым, усовершенствована в 1905 году Альфредом Вернером). Современная форма Периодической системы химических элементов (в 1989 году Международным союзом теоретической и прикладной химии рекомендована длинная форма таблицы) состоит из семи периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с количеством валентных электронов), а короткая форма таблицы – из восьми групп.
За последние 50 лет таблица Менделеева пополнилась семнадцатью новыми элементами (102-118). Девять из них были впервые получены в российском Объединенном институте ядерных исследований в Дубне. Последнее добавление в таблицу Менделеева было сделано в 2016 году, она пополнилась четырьмя элементами с 113, 115, 117 и 118 атомными номерами, которые соответственно были названы нихоний (Nh), московий (Mc), теннессин (Ts) и оганесон (Og). Сейчас в крупнейших ядерно-физических центрах мира фактически начаты работы по синтезу 119-го, 120-го и 121-го элементов, которые назвали «большой гонкой».Опубликовано свыше 500 вариантов Периодической системы химических элементов, что связано с попытками поиска решения некоторых частных проблем ее структуры. Наиболее распространены две табличные формы: короткая и длинная (разрабатывалась Дмитрием Менделеевым, усовершенствована в 1905 году Альфредом Вернером). Современная форма Периодической системы химических элементов (в 1989 году Международным союзом теоретической и прикладной химии рекомендована длинная форма таблицы) состоит из семи периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с количеством валентных электронов), а короткая форма таблицы – из восьми групп. Номер группы элементов короткого варианта таблицы Менделеева соответствует числу валентных электронов во внешней электронной оболочке атомов. В длинном варианте таблицы номер группы в большей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химическим свойствам. Элементы некоторых групп имеют собственные тривиальные названия: щелочные металлы (группа 1 длинной формы таблицы), щелочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18). В Периодической системе химических элементов для каждого элемента указывается его символ, название, порядковый номер и значение относительной атомной массы.Первый период содержит два элемента – водород и гелий. Второй и третий периоды (литий – неон; натрий – аргон) содержат по восемь элементов. Четвертый (калий – криптон) и пятый (рубидий – ксенон) периоды содержат по 18 элементов. Шестой период (цезий – радон) содержит 32 элемента и включает особую группу элементов – лантаноиды.
Номер группы элементов короткого варианта таблицы Менделеева соответствует числу валентных электронов во внешней электронной оболочке атомов. В длинном варианте таблицы номер группы в большей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химическим свойствам. Элементы некоторых групп имеют собственные тривиальные названия: щелочные металлы (группа 1 длинной формы таблицы), щелочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18). В Периодической системе химических элементов для каждого элемента указывается его символ, название, порядковый номер и значение относительной атомной массы.Первый период содержит два элемента – водород и гелий. Второй и третий периоды (литий – неон; натрий – аргон) содержат по восемь элементов. Четвертый (калий – криптон) и пятый (рубидий – ксенон) периоды содержат по 18 элементов. Шестой период (цезий – радон) содержит 32 элемента и включает особую группу элементов – лантаноиды. Седьмой период (франций – оганесон), подобно шестому, содержит 32 элемента и включает особую группу элементов – актиноиды. Лантаноиды и актиноиды помещены отдельно внизу таблицы.Периодическая система химических элементов сыграла и продолжает играть огромную роль в развитии многих естественнонаучных дисциплин. Она стала важным звеном в эволюции атомно-молекулярного учения, способствовала формулировке современного понятия «химический элемент» и уточнению представлений о простых веществах и соединениях, оказала значительное влияние на разработку теории строения атомов и возникновение понятия изотопии. С периодической системой связана строго научная постановка проблемы прогнозирования в химии, что проявилось как в предсказании существования неизвестных элементов и их свойств, так и новых особенностей химического поведения уже открытых элементов. Периодическая система – важнейшая основа неорганической химии; она служит, например, задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, подбору специфических катализаторов для различных химических процессов.
Седьмой период (франций – оганесон), подобно шестому, содержит 32 элемента и включает особую группу элементов – актиноиды. Лантаноиды и актиноиды помещены отдельно внизу таблицы.Периодическая система химических элементов сыграла и продолжает играть огромную роль в развитии многих естественнонаучных дисциплин. Она стала важным звеном в эволюции атомно-молекулярного учения, способствовала формулировке современного понятия «химический элемент» и уточнению представлений о простых веществах и соединениях, оказала значительное влияние на разработку теории строения атомов и возникновение понятия изотопии. С периодической системой связана строго научная постановка проблемы прогнозирования в химии, что проявилось как в предсказании существования неизвестных элементов и их свойств, так и новых особенностей химического поведения уже открытых элементов. Периодическая система – важнейшая основа неорганической химии; она служит, например, задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, подбору специфических катализаторов для различных химических процессов. Периодическая система – научная база преподавания общей и неорганической химии, а также некоторых разделов атомной физики.По решению ООН 2019 год провозглашен Международным годом Периодической таблицы химических элементов.Материал подготовлен на основе информации РИА Новости и открытых источников
Периодическая система – научная база преподавания общей и неорганической химии, а также некоторых разделов атомной физики.По решению ООН 2019 год провозглашен Международным годом Периодической таблицы химических элементов.Материал подготовлен на основе информации РИА Новости и открытых источников
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2019
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdnn21.img.ria.ru/images/99408/72/994087230_112:0:1889:1333_1920x0_80_0_0_597a34ca28aa89475eedcbd63e1a68a3. jpg
jpg
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
справки
Периодическая система химических элементов – упорядоченное множество химических элементов и их естественная классификация.
Является табличным представлением периодического закона, открытого Дмитрием Менделеевым. Современная формулировка этого закона звучит так: свойства элементов находятся в периодической зависимости от заряда их атомных ядер.Прообразом Периодической системы химических элементов служит таблица «Опыт системы элементов, основанной на их атомном весе и химическом сходств», составленная Менделеевым в 1869 году. По мере совершенствования этой таблицы он развил представления о периодах и группах элементов и о месте каждого элемента в системе. В 1871 году в книге «Основы химии» Менделеевым была включена «Естественная система элементов Д. Менделеева» – первая классическая короткая форма Периодической системы химических элементов.
В 1871 году в книге «Основы химии» Менделеевым была включена «Естественная система элементов Д. Менделеева» – первая классическая короткая форма Периодической системы химических элементов.
Современная Периодическая система химических элементов включает 118 элементов. За последние 50 лет таблица Менделеева пополнилась семнадцатью новыми элементами (102-118). Девять из них были впервые получены в российском Объединенном институте ядерных исследований в Дубне. Последнее добавление в таблицу Менделеева было сделано в 2016 году, она пополнилась четырьмя элементами с 113, 115, 117 и 118 атомными номерами, которые соответственно были названы нихоний (Nh), московий (Mc), теннессин (Ts) и оганесон (Og). Сейчас в крупнейших ядерно-физических центрах мира фактически начаты работы по синтезу 119-го, 120-го и 121-го элементов, которые назвали «большой гонкой».Опубликовано свыше 500 вариантов Периодической системы химических элементов, что связано с попытками поиска решения некоторых частных проблем ее структуры. Наиболее распространены две табличные формы: короткая и длинная (разрабатывалась Дмитрием Менделеевым, усовершенствована в 1905 году Альфредом Вернером).
Наиболее распространены две табличные формы: короткая и длинная (разрабатывалась Дмитрием Менделеевым, усовершенствована в 1905 году Альфредом Вернером).
Современная форма Периодической системы химических элементов (в 1989 году Международным союзом теоретической и прикладной химии рекомендована длинная форма таблицы) состоит из семи периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с количеством валентных электронов), а короткая форма таблицы – из восьми групп.
Номер группы элементов короткого варианта таблицы Менделеева соответствует числу валентных электронов во внешней электронной оболочке атомов. В длинном варианте таблицы номер группы в большей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химическим свойствам. Элементы некоторых групп имеют собственные тривиальные названия: щелочные металлы (группа 1 длинной формы таблицы), щелочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18).
В Периодической системе химических элементов для каждого элемента указывается его символ, название, порядковый номер и значение относительной атомной массы.
Первый период содержит два элемента – водород и гелий.
Второй и третий периоды (литий – неон; натрий – аргон) содержат по восемь элементов.
Четвертый (калий – криптон) и пятый (рубидий – ксенон) периоды содержат по 18 элементов.
Шестой период (цезий – радон) содержит 32 элемента и включает особую группу элементов – лантаноиды.
Седьмой период (франций – оганесон), подобно шестому, содержит 32 элемента и включает особую группу элементов – актиноиды.
Лантаноиды и актиноиды помещены отдельно внизу таблицы.
Периодическая система химических элементов сыграла и продолжает играть огромную роль в развитии многих естественнонаучных дисциплин. Она стала важным звеном в эволюции атомно-молекулярного учения, способствовала формулировке современного понятия «химический элемент» и уточнению представлений о простых веществах и соединениях, оказала значительное влияние на разработку теории строения атомов и возникновение понятия изотопии. С периодической системой связана строго научная постановка проблемы прогнозирования в химии, что проявилось как в предсказании существования неизвестных элементов и их свойств, так и новых особенностей химического поведения уже открытых элементов. Периодическая система – важнейшая основа неорганической химии; она служит, например, задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, подбору специфических катализаторов для различных химических процессов. Периодическая система – научная база преподавания общей и неорганической химии, а также некоторых разделов атомной физики.По решению ООН 2019 год провозглашен Международным годом Периодической таблицы химических элементов.
С периодической системой связана строго научная постановка проблемы прогнозирования в химии, что проявилось как в предсказании существования неизвестных элементов и их свойств, так и новых особенностей химического поведения уже открытых элементов. Периодическая система – важнейшая основа неорганической химии; она служит, например, задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, подбору специфических катализаторов для различных химических процессов. Периодическая система – научная база преподавания общей и неорганической химии, а также некоторых разделов атомной физики.По решению ООН 2019 год провозглашен Международным годом Периодической таблицы химических элементов.
Материал подготовлен на основе информации РИА Новости и открытых источников
Урок по химии в 8-м классе по теме «Правила техники безопасности в кабинете химии. Приемы обращения с лабораторным оборудованием» (практическая работа)
Цели урока:
- Подробно ознакомить учащихся с правилами
техники безопасности в кабинете химии.

- Рассмотреть лабораторное оборудование, изучить его назначение, приемы обращения с ним.
Оборудование:
- таблицы “Правила ТБ”; рисунки с запрещающими, предупреждающими знаками;
- пробирки, стеклянные и фарфоровые стаканы,
- колбы круглодонные, плоскодонные и конические,
- мерная посуда (цилиндры, стаканы, пробирки),
- воронки, чашки фарфоровые, тигли, ступки с
- пестиками, пробиркодержатели, спиртовки,
- лабораторные штативы, штативы для пробирок (деревянные и пластмассовые).
Ход урока
I. Организационный момент.
Приветствуем класс, сообщаем о том, что на
этом уроке мы выполним первую практическую
работу, и впредь практические работы будут
неотъемлемой частью на уроках химии. Ребята
открывают тетради и записывают число и название
работы. Ниже записывают цель работы, которую
учащиеся определяют сами, исходя из названия.
Ниже записывают цель работы, которую
учащиеся определяют сами, исходя из названия.
II. Ход работы
1. Изучение правил ТБ.
На доске висят таблицы по технике безопасности, написано стихотворение:
Помни, каждый ученик,
Знай, любая кроха:
Безопасность – хорошо,
А халатность – плохо
Далее, обращаясь к таблицам, объясняем правила ТБ.
Также при объяснении используем рисунки с предупреждающими и запрещающими знаками. Объяснение ведется с элементами беседы.
- Категорически запрещается входить с кабинет химии без разрешения учителя.
- В кабинете химии запрещается принимать пищу и напитки.
- Учащимся запрещается выносить из кабинета и вносить в него любые вещества без разрешения учителя.
- Во время работы в кабинете химии учащиеся
должны соблюдать чистоту, порядок на рабочем
месте, а также четко следовать правилам ТБ.
- Не допускается загромождение проходов портфелями и сумками.
- Не допускается нахождение в кабинете химии во время проветривания.
- Проводите опыты лишь с теми веществами, которые указаны учителем.
- Не пробуйте вещества на вкус.
- При выяснении запаха не подносите сосуд близко к лицу. Для выяснения запаха нужно ладонью руки сделать движение от отверстия сосуда к носу.
- Нагревая пробирку с жидкостью, держите ее так, чтобы открытый конец ее был направлен в сторону от себя и от соседа.
- Учащиеся, присутствующие на практической работе без халата, непосредственно к проведению эксперимента не допускаются.
- Опыты производите только над столом.
- В случае пореза, ожога немедленно обращайтесь к учителю.
- Обращайтесь бережно с посудой, веществами и
лабораторным оборудованием.
- Закончив работу, приведите рабочее место в порядок.
Некоторые правила дополняются стихотворениями:
Чай и вкусный бутерброд
Очень просятся в твой рот.
Не обманывай себя —
Есть и пить у нас нельзя!
Это, друг, химкабинет,
Для еды условий нет. (правило 2)
Пусть в пробирке пахнет воблой,
В колбе — будто мармелад,
Вещества на вкус не пробуй!
Сладко пахнет даже яд.(правило 8)
Как же нюхать вещества?
В колбу нос совать нельзя!
Что может случиться?
Ты можешь отравиться! (правило 9)
Хочешь весел быть и рад –
Надевай всегда халат! (правило 11)
Голова вдруг твоя закружилась,
Руки будто бы не твои.
Если такое случилось,
Учителю тут же скажи.
Всем поможет, ободрит,
Наш учитель Айболит! (правило 13)
Знакомство с лабораторным оборудованием.
В процессе изучения предмета и при выполнении практических и лабораторных работ мы будем пользоваться лабораторным оборудованием и химической посудой.
Посуда изготовлена из стекла и фарфора. Применение стекла в химическом эксперименте основано на его свойствах: твёрдость, прозрачность, химическая устойчивость, гладкая поверхность. Недостаток – хрупкость.
Вся посуда и оборудование делятся на несколько типов:
Посуда общего пользования, в ней проводят большинство химических операций и хранят реактивы.
— Пробирки
— Стаканы
— Колбы
— Воронки
Показываем данную посуду, рассказываем о её использовании. Ребята делают рисунки в тетрадях.
Посуда специального назначения.
— Холодильники
— Колбы Вюрца
— Аллонжи
3. Мерная посуда.
— Цилиндры
— Мензурки
— Колбы
— Бюретки
4. Фарфоровая посуда.
— Стаканы
— Кружки
— Воронки Бюхнера
— Тигли
— Ступки с пестиками
5. Металлическое оборудование.
Металлическое оборудование.
— Лабораторные штативы
— Держатели для пробирок
— Ложечки для сжигания веществ
— Тигельные щипцы
6. Нагревательные приборы.
— Спиртовки
— Горелки
— Электроплитки
Подробно рассматриваем ЛШ и спиртовку, правила работы с ними. Учащиеся делают рисунки предметов.
Правила работы со спиртовкой:
- Зажигать только спичкой, запрещается зажигать другой спиртовкой.
- Перед тем, как зажечь, нужно расправить фитиль, а диск должен плотно прилегать к горлышку.
- Нельзя переносить спиртовку во время работы в зажжённом виде с одного стола на другой.
- Тушить только колпачком – не дуть!
Это должен каждый знать:
Спирт в спиртовке поджигать
Спичкой только можно
И очень осторожно.
Чтобы пламя погасить
Спиртовку следует закрыть.
И для этого, дружок,
У неё есть колпачок.
III. Закрепление изученного материала.
Учащимся показываем химические знаки и оборудование, они объясняют значения знаков и характеризуют назначение различного оборудования. (см. приложение). Затем ребятам предлагается выполнить несложное задание – с помощью мерного цилиндра отмерить 50мл воды, перелить воду в пробирку, закреплённую в пробиркодержателе, и довести воду до кипения. Ребята описывают в тетради все выполненные операции и делают вывод.
IV. Д/З.
V. Итоги урока.
Страница не найдена — Портал Продуктов Группы РСС
Сообщите нам свой адрес электронной почты, чтобы подписаться на рассылку новостного бюллетеня. Предоставление адреса электронной почты является добровольным, но, если Вы этого не сделаете, мы не сможем отправить Вам информационный бюллетень. Администратором Ваших персональных данных является Акционерное Общество PCC Rokita, находящееся в Бжег-Дольном (ул. Сенкевича 4, 56-120 Бжег-Дольный, Польша ). Вы можете связаться с нашим инспектором по защите личных данных по электронной почте: .
Администратором Ваших персональных данных является Акционерное Общество PCC Rokita, находящееся в Бжег-Дольном (ул. Сенкевича 4, 56-120 Бжег-Дольный, Польша ). Вы можете связаться с нашим инспектором по защите личных данных по электронной почте: .
Мы обрабатываем Ваши данные для того, чтобы отправить Вам информационный бюллетень — основанием для обработки является реализация нашей законодательно обоснованной заинтересованности или законодательно обоснованная заинтересованность третьей стороны – непосредственный маркетинг наших продуктов / продуктов группы PCC .
Как правило, Ваши данные мы будем обрабатывать до окончания нашего с Вами общения или же до момента, пока Вы не выразите свои возражения, либо если правовые нормы будут обязывать нас продолжать обработку этих данных, либо мы будем сохранять их дольше в случае потенциальных претензий, до истечения срока их хранения, регулируемого законом, в частности Гражданским кодексом.
В любое время Вы имеете право:
- выразить возражение против обработки Ваших данных;
- иметь доступ к Вашим данным и востребовать их копии;
- запросить исправление, ограничение обработки или удаление Ваших данных;
- передать Ваши персональные данные, например другому администратору, за исключением тех случаев, если их обработка регулируется законом и находится в интересах администратора;
- подать жалобу Президенту Управления по защите личных данных.

Получателями Ваших данных могут быть компании, которые поддерживают нас в общении с Вами и помогают нам в ведении веб-сайта, внешние консалтинговые компании (такие как юридические, маркетинговые и бухгалтерские) или внешние специалисты в области IT, включая компанию Группы PCC .
Больше о том, как мы обрабатываем Ваши данные Вы можете узнать из нашего Полиса конфиденциальности.
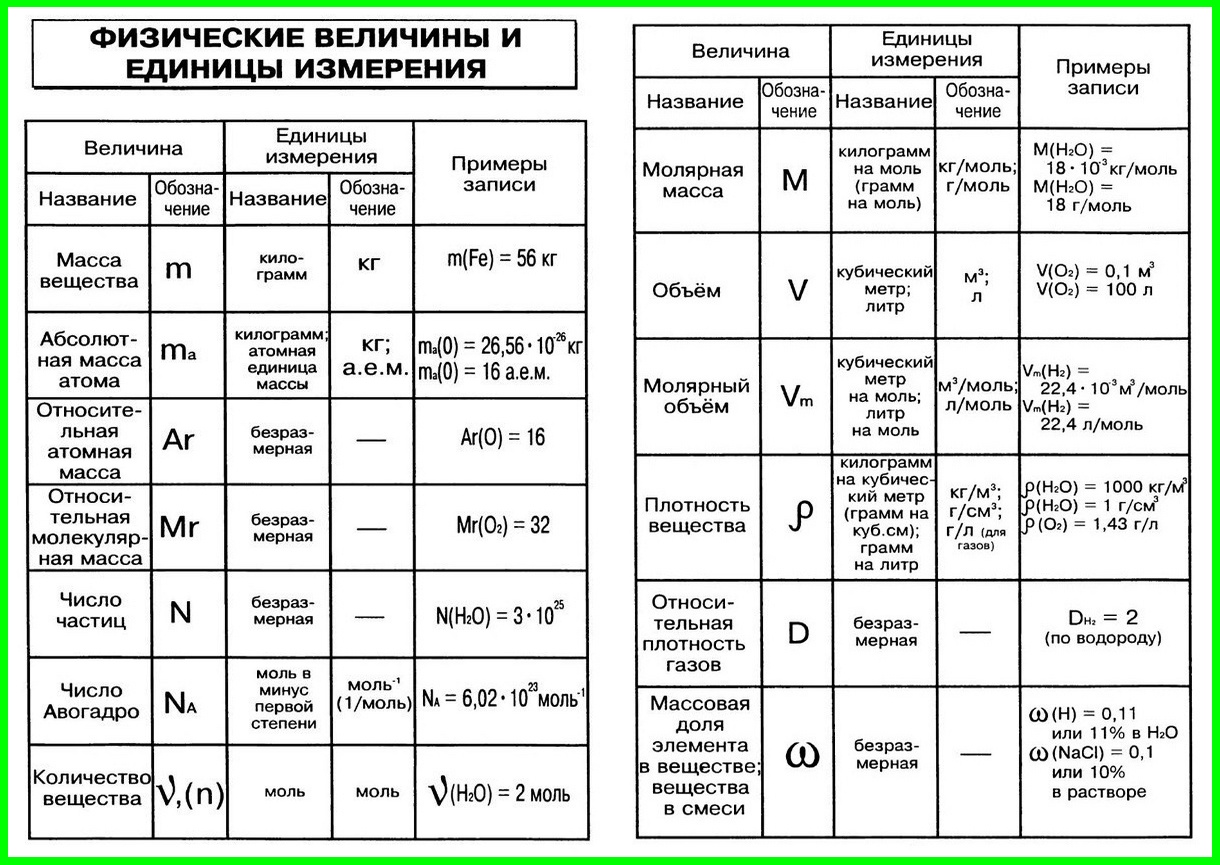
Основные Химические формулы для решения задач.
| № | Количественные характеристики вещества | Обозначение | Единицы измерения | Формула для расчета |
|---|---|---|---|---|
| 1 | Плотность вещества | ρ | кг/м³ | ρ = m / V(Массу делим на объем вещества) |
| 2 | Относительная атомная масса элемента | Аr | — | Ar = ma / u см. в периодической система химических элементов |
| 3 | Атомная единица массы | u а.  е.м. е.м. |
кг | u = 1/12 * ma (12C) const = 1.66*10-27 |
| 4 | Масса атома (абсолютная) | ma | кг | ma = Ar * u |
| 5 | Относительная молекулярная (формульная) масса вещества | Mr | — | Mr (AxBy)=m(AB) / u Mr(AxBy)=x*Ar(A) + y*Ar(B) |
| 6 | Масса молекулы (формульной единицы) | m M | кг | mM = Mr*u |
| 7 | Количество вещества | n | моль | n=m/M n=N/NA n=V/VM |
| 8 | Молярная масса (масса 1 моль вещества) | M | г/моль | M=m/n M=Mr M=Ar (для простых веществ) |
| 9 | Масса вещества | m | г (кг) | m=M*n m=ρ*V |
| 10 | Число структурных единиц | N | атомов, молекул, ионов, частиц, формульных единиц (Ф.Е.) | N=NA*n |
| 11 | Молярный объем — число 1 моль ГАЗООБРАЗНОГО вещества в нормальных условиях (н. у.) у.) |
VM | л/моль | const=22,4 |
| 12 | Объем газа при н.у. | V | л | V=VM*n V=m/ρ |
| 13 | Постоянная Авогадро | NA | частиц/моль | const=6,02*1023 |
| 14 | Массовая доля вещества (омега) | ωЭ/В | % | ωЭ/В = (Ar(э) * k) / Mr(В) |
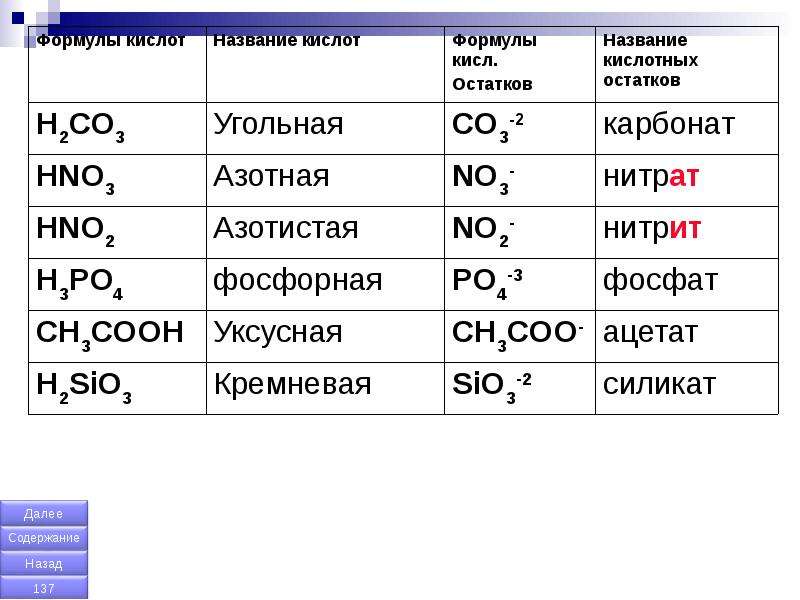
| Формула | Название кислоты | Формула кислотного остатка | Название кислотного остатка |
|---|---|---|---|
| HF | Фтороводород, плавиковая | F— | Фторид |
| HCl | Хлороводород, соляная | Cl— | Хлорид |
| HBr | Бромоводород | Br— | Бромид |
| HI | Йодоводород | I— | Йодид |
| h3S | Сероводород | S2- | Сульфид |
| HCN | Циановодородная | CN— | Цианид |
| HNO2 | Азотистая | NO2— | Нитрит |
| HNO3 | Азотная | NO3— | Нитрат |
| h4PO4 | Ортофосфорная | PO43- | Фосфат |
| h4AsO4 | Мышьяковая | AsO43- | Арсенат |
| h3SO3 | Сернистая | SO32- | Сульфит |
| h3SO4 | Серная | SO42- | Сульфат |
| h3CO3 | Угольная | CO32- | Карбонат |
| h3SiO3 | Кремниевая | SiO32- | Силикат |
| h3CrO4 | Хромовая | CrO42- | Хромат |
| h3Cr2O7 | Дихромовая | Cr2O72- | Дихромат |
| HMnO4 | Марганцовая | MnO4— | Перманганат |
| HClO | Хлорноватистая | ClO— | Гипохлорит |
| HClO2 | Хлористая | ClO2— | Хлорит |
| HClO3 | Хлорноватая | ClO3— | Хлорат |
| HClO4 | Хлорная | ClO4— | Перхлорат |
| HCOOH | Метановая, муравьиная | HCOO— | Формиат |
| Ch4COOH | Этановая, уксусная | Ch4COO— | Ацетат |
| h4C2O4 | Этандиовая, щавелевая | C2O42- | Оксалат |
Нажмите на картинку для увеличения
Основы периодической таблицы: 8-й класс Science-Brogden
Приборная доска
8-я наука
Основы периодической таблицы
Перейти к содержанию
Приборная доска
-
Авторизоваться
-
Овал-95
Приборная панель
-
значок-календарь
Календарь
-
значок-входящие
Входящие
-
История
-
Помощь
Закрывать
-
Мой Dashboard
- 8th Science
- Страницы
- Основы периодической таблицы
- Главная
- Модули
- Назначения
- Страницы
- файлов
- Syllabus
- Twizzes
- Clizeraborations
- Google Drive
- Mastery Tracker
- Newsela
5.
 3: Типы химических реакций
3: Типы химических реакций
Результаты обучения
- Классифицируйте реакцию как комбинацию, разложение, однократное замещение, двойное замещение или горение.
- Предсказать продукты и сбалансировать реакцию горения.
Многие химические реакции можно отнести к одному из пяти основных типов. Полное понимание этих типов реакций будет полезно для предсказания продуктов неизвестной реакции. Пять основных типов химических реакций: сочетание, разложение, однократное замещение, двойное замещение и горение.Анализ реагентов и продуктов данной реакции позволит вам отнести ее к одной из этих категорий. Некоторые реакции попадают более чем в одну категорию.
Комбинированные реакции
Реакция соединения , также известная как реакция синтеза , представляет собой реакцию, в которой два или более веществ объединяются с образованием одного нового вещества. Реакции комбинирования также могут называться реакциями синтеза. Общая форма реакции комбинирования:
Общая форма реакции комбинирования:
\[\ce{A} + \ce{B} \rightarrow \ce{AB}\]
Одна реакция соединения – это соединение двух элементов с образованием соединения.Твердый металлический натрий реагирует с газообразным хлором с образованием твердого хлорида натрия.
\[2 \ce{Na} \left( s \right) + \ce{Cl_2} \left( g \right) \rightarrow 2 \ce{NaCl} \left( s \right)\]
Обратите внимание, что для того, чтобы правильно написать и сбалансировать уравнение, важно помнить о семи элементах, существующих в природе в виде двухатомных молекул (\(\ce{H_2}\), \(\ce{N_2}\), \ (\ce{O_2}\), \(\ce{F_2}\), \(\ce{Cl_2}\), \(\ce{Br_2}\) и \(\ce{I_2}\)) .
Одним из часто встречающихся комбинированных реакций является реакция элемента с кислородом с образованием оксида.Металлы и неметаллы легко реагируют с кислородом в большинстве условий. Магний быстро и резко реагирует при воспламенении, соединяясь с кислородом воздуха, образуя мелкий порошок оксида магния.
\[2 \ce{Mg} \left( s \right) + \ce{O_2} \left( g \right) \rightarrow 2 \ce{MgO} \left( s \right)\]
Реакции разложения
Реакция разложения — это реакция, в которой соединение распадается на два или более простых вещества. Общая форма реакции разложения:
Общая форма реакции разложения:
\[\ce{AB} \rightarrow \ce{A} + \ce{B}\]
Большинство реакций разложения требуют затрат энергии в виде тепла, света или электричества.
Бинарные соединения — это соединения, состоящие всего из двух элементов. Самый простой вид реакции разложения — это когда бинарное соединение разлагается на его элементы. Оксид ртути (II), красное твердое вещество, при нагревании разлагается с образованием ртути и газообразного кислорода.
\[2 \ce{HgO} \left( s \right) \rightarrow 2 \ce{Hg} \left( l \right) + \ce{O_2} \left( g \right)\]
Реакция также считается реакцией разложения, даже если один или несколько продуктов все еще являются соединением.Карбонат металла разлагается на оксид металла и углекислый газ. Например, карбонат кальция разлагается на оксид кальция и углекислый газ.
\[\ce{CaCO_3} \left( s \right) \rightarrow \ce{CaO} \left( s \right) + \ce{CO_2} \left( g \right)\]
Гидроксиды металлов разлагаются при нагревании с образованием оксидов металлов и воды. Гидроксид натрия разлагается с образованием оксида натрия и воды.
Гидроксид натрия разлагается с образованием оксида натрия и воды.
\[2 \ce{NaOH} \left( s \right) \rightarrow \ce{Na_2O} \left( s \right) + \ce{H_2O} \left( g \right)\]
Реакции с одной заменой
Реакция с одинарной заменой — это реакция, в которой один элемент заменяет аналогичный элемент в соединении .Общая форма реакции с одним замещением (также называемая с одним замещением):
\[\ce{A} + \ce{BC} \rightarrow \ce{AC} + \ce{B}\]
В этой общей реакции элемент \(\ce{A}\) является металлом и заменяет элемент \(\ce{B}\), также металл, в соединении. Когда элемент, который выполняет замену, является неметаллом, он должен заменить другой неметалл в соединении, и общее уравнение принимает вид:
\[\ce{Y} + \ce{XZ} \rightarrow \ce{XY} + \ce{Z}\]
\(\ce{Y}\) является неметаллом и заменяет неметалл \(\ce{Z}\) в соединении на \(\ce{X}\).
Магний является более активным металлом, чем медь. Когда полоску металлического магния помещают в водный раствор нитрата меди (II), она заменяет медь. Продуктами реакции являются водный раствор нитрата магния и твердая металлическая медь.
Продуктами реакции являются водный раствор нитрата магния и твердая металлическая медь.
\[\ce{Mg} \left( s \right) + \ce{Cu(NO_3)_2} \left( aq \right) \rightarrow \ce{Mg(NO_3)_2} \left( aq \right) + \ce{Cu} \left( s \right)\]
Многие металлы легко реагируют с кислотами, и при этом одним из продуктов реакции является газообразный водород.Цинк реагирует с соляной кислотой с образованием водного раствора хлорида цинка и водорода (см. рисунок ниже).
\[\ce{Zn} \left( s \right) + 2 \ce{HCl} \left( aq \right) \rightarrow \ce{ZnCl_2} \left( aq \right) + \ce{H_2} \ влево(г\вправо)\]
Рисунок 10.6.1: Металлический цинк реагирует с соляной кислотой с выделением газообразного водорода в реакции с одним замещением.
Рисунок 10.6.2: Здесь изображено около 3 фунтов металлического натрия, реагирующего с водой.Металлический натрий энергично реагирует при попадании в емкость с водой, выделяя газообразный водород. Большой кусок натрия часто выделяет столько тепла, что воспламеняется водород.
Большой кусок натрия часто выделяет столько тепла, что воспламеняется водород.
Реакции двойной замены
Реакция двойной замены — это реакция, в которой положительные и отрицательные ионы двух ионных соединений меняются местами с образованием двух новых соединений . Общая форма реакции двойного замещения (также называемая двойным замещением):
\[\ce{AB} + \ce{CD} \rightarrow \ce{AD} + \ce{CB}\]
В этой реакции \(\ce{A}\) и \(\ce{C}\) являются положительно заряженными катионами, а \(\ce{B}\) и \(\ce{D}\) являются отрицательно заряженными анионами.Реакции двойного замещения обычно происходят между веществами в водном растворе. Чтобы произошла реакция, одним из продуктов обычно является твердый осадок, газ или молекулярное соединение, такое как вода.
Осадок образуется в реакции двойного замещения, когда катионы одного из реагентов объединяются с анионами другого реагента с образованием нерастворимого ионного соединения. При смешивании водных растворов йодида калия и нитрата свинца (II) происходит следующая реакция.
При смешивании водных растворов йодида калия и нитрата свинца (II) происходит следующая реакция.
\[2 \ce{KI} \left( aq \right) + \ce{Pb(NO_3)_2} \left( aq \right) \rightarrow 2 \ce{KNO_3} \left( aq \right) + \ ce{PbI_2} \влево( с \вправо)\]
Рисунок 10.6.3: При добавлении нескольких капель нитрата свинца (II) к раствору йодида калия немедленно образуется желтый осадок йодида свинца (II) в результате реакции двойного замещения.
Реакции горения
Реакция горения — это реакция, в которой вещество вступает в реакцию с газообразным кислородом, высвобождая энергию в виде света и тепла. Реакции горения должны включать \(\ce{O_2}\) в качестве одного из реагентов. При сгорании газообразного водорода образуется водяной пар (см. рисунок ниже).
\[2 \ce{H_2} \left( g \right) + \ce{O_2} \left( g \right) + 2 \ce{H_2O} \left( g \right)\]
Обратите внимание, что эта реакция также считается комбинированной реакцией.
Рисунок 10.6.4: Hindenburg был заполненным водородом дирижаблем, который потерпел аварию при попытке приземлиться в Нью-Джерси в 1937 году.Водород немедленно сгорел в виде огромного огненного шара, уничтожив дирижабль и убив 36 человек. Химическая реакция была простой: водород соединяется с кислородом с образованием воды.
Многие реакции горения происходят с углеводородом, соединением, состоящим исключительно из углерода и водорода. Продуктами сгорания углеводородов всегда являются углекислый газ и вода. Многие углеводороды используются в качестве топлива, поскольку при их сгорании выделяется очень большое количество тепловой энергии.Пропан \(\left( \ce{C_3H_8} \right)\) представляет собой газообразный углеводород, который обычно используется в качестве источника топлива в газовых грилях.
\[\ce{C_3H_8} \left( g \right) + 5 \ce{O_2} \left( g \right) \rightarrow 3 \ce{CO_2} \left( g \right) + 4 \ce{H_2O } \влево( г \вправо)\]
Пример 10.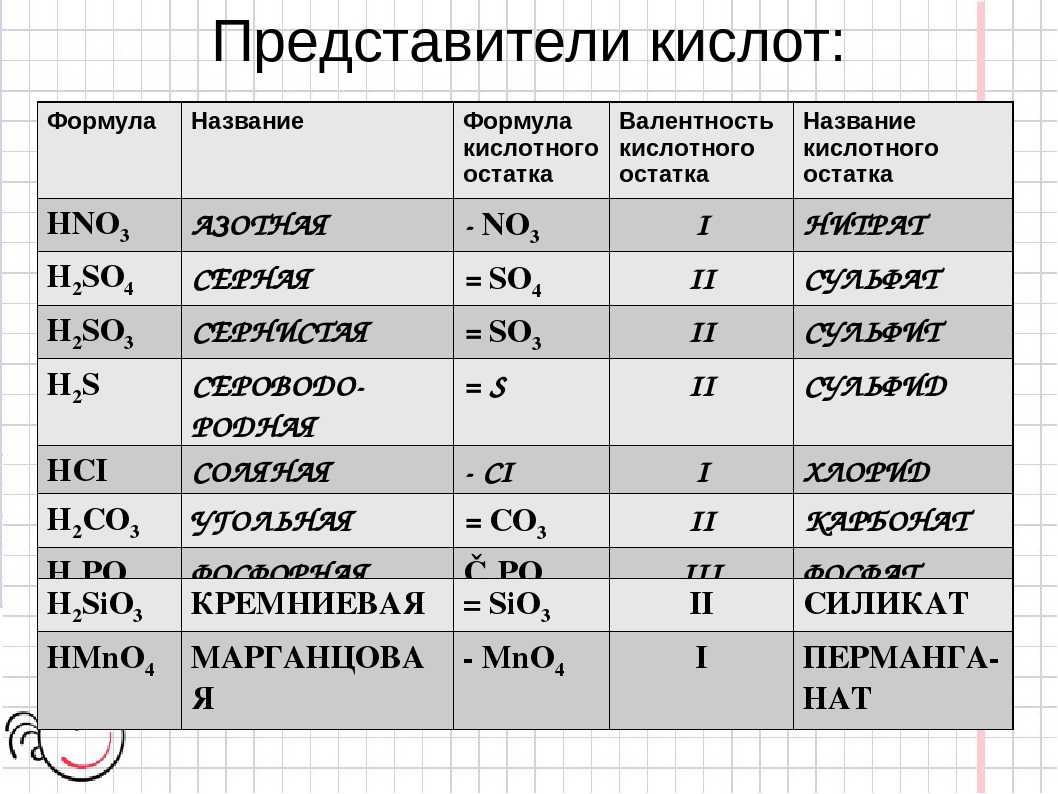 6.1
6.1
Этанол можно использовать в качестве источника топлива в спиртовке. Формула этанола: \(\ce{C_2H_5OH}\). Напишите сбалансированное уравнение сгорания этанола.
Решение:
Шаг 1: Спланируйте проблему.
Этанол и кислород являются реагентами. Как и в случае с углеводородом, продуктами сгорания спирта являются углекислый газ и вода.
Шаг 2: Решить.
Напишите уравнения скелета: \(\ce{C_2H_5OH} \left( l \right) + \ce{O_2} \left( g \right) \rightarrow \ce{CO_2} \left( g \right) + \ce {H_2O} \влево( г \вправо)\)
Сбалансируйте уравнение.
\[\ce{C_2H_5OH} \left( l \right) + 3 \ce{O_2} \left( g \right) \rightarrow 2 \ce{CO_2} \left( g \right) + 3 \ce{H_2O } \влево( г \вправо)\]
Шаг 3: Подумайте о своем результате.
Реакции горения должны иметь кислород в качестве реагента. Обратите внимание, что образующаяся вода находится в газообразном, а не в жидком состоянии из-за высоких температур, сопровождающих реакцию горения.
Авторы
-
Фонд CK-12 Шэрон Бьюик, Ричарда Парсонса, Терезы Форсайт, Шонны Робинсон и Джин Дюпон.
-
Эллисон Сульт, доктор философии. (Кафедра химии, Университет Кентукки)
Примеры химических изменений — объяснение, свойства и ответы на часто задаваемые вопросы
Простое понимание химических изменений с помощью идеальных примеров
Одна из основных концепций науки, которую мы изучали, — это изменения в материи.Различают два типа изменений: физические и химические. Предварительные главы помогают учащимся понять основную разницу между этими двумя изменениями. В этом разделе мы поймем, что такое химические изменения и их характеристики. Эта концептуальная страница, определяющая примеры химических изменений, была отформатирована экспертами Веданту для удобства студентов. Здесь вы найдете лучшее определение химических изменений, а также 20 примеров химических изменений. При химическом изменении химическая природа реагентов полностью меняется, образуя новые вещества, приобретающие новые химические и физические свойства.Состав и разложение веществ при химическом изменении будут правильно определены, чтобы учащиеся всех уровней успеваемости могли легко усвоить концепцию и продолжить изучение главы без каких-либо хлопот.
При химическом изменении химическая природа реагентов полностью меняется, образуя новые вещества, приобретающие новые химические и физические свойства.Состав и разложение веществ при химическом изменении будут правильно определены, чтобы учащиеся всех уровней успеваемости могли легко усвоить концепцию и продолжить изучение главы без каких-либо хлопот.
Что такое химическое изменение?
Мы наблюдаем различные изменения формы веществ в природе. Не все изменения являются постоянными. Временные изменения, при которых химические свойства вещества не изменяются, называются физическими изменениями. Теперь перейдем к части химических превращений.
Химическое изменение – это химические изменения реагентов с образованием новых веществ в конце реакции. Прежде чем перейти к 20 примерам химических изменений, давайте кратко рассмотрим характеристики химических изменений.
Свойства химических изменений
-
Молекулярный состав изменяется в реагентах, поскольку они образуют новые вещества, которые полностью отличаются от исходных соединений.

-
Изменение температуры также наблюдается в химической реакции, когда молекулы распадаются на атомы или группы атомов с образованием новых соединений.Либо энергия высвобождается, либо поглощается при химическом изменении. Когда высвобождается энергия, это называется экзотермической химической реакцией. Когда энергия поглощается, это называется эндотермической реакцией.
-
Химическое изменение необратимо. Это означает, что новообразованные вещества нельзя легко превратить обратно в исходные соединения, просто изменив физические условия реакции. Следовательно, химическое изменение является необратимым или постоянным.
-
При химическом изменении происходит изменение массы реагентов.Либо масса вычитается, либо добавляется для образования новых веществ с новыми свойствами.
Что является примером химического изменения?
Теперь, когда вы поняли, что такое химическое изменение и его специфические свойства, вы можете легко определить эти изменения на примере. Когда лед тает, образуя воду, это физическое изменение, поскольку химические свойства воды не изменяются. Фактически, воду можно очень легко охладить, чтобы снова образовать лед. Когда вода реагирует с щелочным металлом, она образует основание и выделяется водород.Вы можете видеть, что в продукте отсутствуют реагенты, вода и щелочной металл. Продукты, с другой стороны, представляют собой совершенно новые вещества, отличающиеся от реагентов.
Когда лед тает, образуя воду, это физическое изменение, поскольку химические свойства воды не изменяются. Фактически, воду можно очень легко охладить, чтобы снова образовать лед. Когда вода реагирует с щелочным металлом, она образует основание и выделяется водород.Вы можете видеть, что в продукте отсутствуют реагенты, вода и щелочной металл. Продукты, с другой стороны, представляют собой совершенно новые вещества, отличающиеся от реагентов.
Как только вы подробно изучите 5 примеров химических изменений, вы сможете легко обнаружить различия между физическими и химическими изменениями. На самом деле, вы также сможете относиться к свойствам химического изменения, упомянутым выше. Следуйте этой странице, чтобы правильно понять эту концепцию и использовать ее для развития своих базовых знаний о химических реакциях.
Давайте рассмотрим еще несколько примеров химических изменений в следующем разделе.
20 Примеры химических изменений
После того, как вы поняли определение химических изменений, вы можете перейти к разделу примеров. Этот раздел поможет вам найти 20 примеров химических изменений.
Этот раздел поможет вам найти 20 примеров химических изменений.
-
-
ржавчину утюг в присутствии влаги и кислорода
-
жжение дерева
-
молока становятся творогами
-
Формирование карамели от сахара на отопление
-
Выпечка печенья и тортов
-
Приготовление пищи
-
кислотно-базовая реакция
-
переваривание пищи
-
кипяток
-
созревание фруктов
-
гниение пищи
-
ферментация
-
освещение спичкой
-
Firework взрывы
-
фотосинтез
-
разложение отходов
-
Изготовление попкорна
-
Формирование сыра из молока сжигания
-
Бумага
-
горение свечи
химические изменения с участием неорганических соединений показывают отчетливые изменения в составе конечных продуктов с точки зрения состояния, цвета и т.
 д.Химическая природа продуктов будет совершенно иной, чем у реагентов. Вы подробно изучите эти функции в соответствующей главе.
д.Химическая природа продуктов будет совершенно иной, чем у реагентов. Вы подробно изучите эти функции в соответствующей главе. Как сбалансировать химические уравнения: 11 шагов (с иллюстрациями)
Об этой статье
В соавторстве:
Ученый-эколог
Эта статья была написана в соавторстве с Бесс Рафф, Массачусетс.Бесс Рафф — аспирант по географии в Университете штата Флорида. В 2016 году она получила степень магистра наук об окружающей среде и управления в Калифорнийском университете в Санта-Барбаре. Она проводила исследования для проектов морского пространственного планирования в Карибском бассейне и оказывала исследовательскую поддержку в качестве аспиранта для Группы устойчивого рыболовства. Эта статья была просмотрена 4 294 868 раз.
Соавторы: 164
Обновлено: 3 декабря 2021 г.
Просмотров: 4 294 868
Краткое содержание статьиX
Чтобы сбалансировать химическое уравнение, сначала запишите данную формулу, указав реагенты слева от стрелки и продукты справа.
 Например, ваше уравнение должно выглядеть примерно так: «h3 + O2 → h3O». Подсчитайте количество атомов в каждом элементе с каждой стороны уравнения и перечислите их под этой стороной. В уравнении h3 + O2 → h3O 2 атома водорода добавляются к 2 атомам кислорода слева, поэтому вы должны написать «H=2» и «O=2» под левой стороной. Справа есть 2 атома водорода и 1 атом кислорода, поэтому вы должны написать «H = 2» и «O = 1» под правой стороной. Поскольку количество атомов в каждом элементе неодинаково с обеих сторон, уравнение не сбалансировано.Чтобы сбалансировать уравнение, вам нужно добавить коэффициенты, чтобы изменить количество атомов на одной стороне, чтобы они соответствовали другой. Для уравнения h3 + O2 → h3O вы должны добавить коэффициент 2 перед h3O в правой части, чтобы в каждой части уравнения было по 2 атома кислорода, например, h3 + O2 → 2h3O. Однако нижние индексы не могут быть изменены и всегда умножаются на коэффициент, что означает, что теперь в правой части уравнения 4 атома водорода и только 2 атома водорода в левой части.
Например, ваше уравнение должно выглядеть примерно так: «h3 + O2 → h3O». Подсчитайте количество атомов в каждом элементе с каждой стороны уравнения и перечислите их под этой стороной. В уравнении h3 + O2 → h3O 2 атома водорода добавляются к 2 атомам кислорода слева, поэтому вы должны написать «H=2» и «O=2» под левой стороной. Справа есть 2 атома водорода и 1 атом кислорода, поэтому вы должны написать «H = 2» и «O = 1» под правой стороной. Поскольку количество атомов в каждом элементе неодинаково с обеих сторон, уравнение не сбалансировано.Чтобы сбалансировать уравнение, вам нужно добавить коэффициенты, чтобы изменить количество атомов на одной стороне, чтобы они соответствовали другой. Для уравнения h3 + O2 → h3O вы должны добавить коэффициент 2 перед h3O в правой части, чтобы в каждой части уравнения было по 2 атома кислорода, например, h3 + O2 → 2h3O. Однако нижние индексы не могут быть изменены и всегда умножаются на коэффициент, что означает, что теперь в правой части уравнения 4 атома водорода и только 2 атома водорода в левой части. Чтобы сбалансировать это, добавьте коэффициент 2 перед h3 в левой части уравнения, чтобы с каждой стороны было по 4 атома водорода, например 2h3 + O2 → 2h3O.Теперь количество атомов в каждом элементе одинаково в обеих частях уравнения, поэтому уравнение уравновешено. Помните, что если перед элементом нет коэффициента, предполагается, что коэффициент равен 1. Чтобы узнать, как сбалансировать химические уравнения алгебраически, прокрутите вниз!
Чтобы сбалансировать это, добавьте коэффициент 2 перед h3 в левой части уравнения, чтобы с каждой стороны было по 4 атома водорода, например 2h3 + O2 → 2h3O.Теперь количество атомов в каждом элементе одинаково в обеих частях уравнения, поэтому уравнение уравновешено. Помните, что если перед элементом нет коэффициента, предполагается, что коэффициент равен 1. Чтобы узнать, как сбалансировать химические уравнения алгебраически, прокрутите вниз! - Печать
- Отправить фанатскую почту авторам
Спасибо всем авторам за создание страницы, которую прочитали 4 294 868 раз.
Что такое атом? — Определение из WhatIs.com
Атом — это частица материи, однозначно определяющая химический элемент.Атом состоит из центрального ядра, которое обычно окружено одним или несколькими электронами. Каждый электрон заряжен отрицательно. Ядро заряжено положительно и содержит одну или несколько относительно тяжелых частиц, известных как протонов и нейтронов .

Протон заряжен положительно. Число протонов в ядре атома атомный номер для химического элемента. Протон имеет массу покоя, обозначаемую m p , примерно 1.673 х 10 -27 килограмм (кг). Нейтрон электрически нейтрален и имеет массу покоя, обозначаемую m n , приблизительно 1,675 x 10 -27 кг. Масса протона или нейтрона увеличивается, когда частица достигает предельной скорости, например, в циклотроне или линейном ускорителе.
Ранняя модель атома была разработана физиком Эрнестом Резерфордом в 1912 году. Он был первым, кто предположил, что атомы подобны миниатюрным солнечным системам, за исключением того, что сила притяжения вызвана не гравитацией, а противоположными электрическими зарядами.В так называемом резерфордовском атоме электроны вращаются вокруг ядра по круговым траекториям. Нильс Бор пересмотрел теорию Резерфорда в 1913 году. В атоме Бора отрицательно заряженные электроны вращаются вокруг ядра на определенных средних расстояниях.
 Эти расстояния представлены сферами, называемыми оболочками , окружающими ядро. Электроны могут переходить с оболочки на оболочку. Когда электрон поглощает достаточно энергии, он перемещается на большую или более высокую оболочку. Когда он теряет определенное количество энергии, он падает на меньшую или более низкую оболочку.
Эти расстояния представлены сферами, называемыми оболочками , окружающими ядро. Электроны могут переходить с оболочки на оболочку. Когда электрон поглощает достаточно энергии, он перемещается на большую или более высокую оболочку. Когда он теряет определенное количество энергии, он падает на меньшую или более низкую оболочку.Общая масса атома, включая протоны, нейтроны и электроны, равна атомной массе или атомной массе . Электроны составляют лишь крошечную часть этой массы. Для большинства практических целей атомный вес можно рассматривать как количество протонов плюс количество нейтронов. Поскольку число нейтронов в атоме может варьироваться, у большинства элементов может быть несколько различных атомных весов.
Атомы, имеющие одинаковое количество протонов, но разное количество нейтронов, представляют один и тот же элемент, но известны как разные изотопы этого элемента.Изотоп элемента определяется суммой числа протонов и нейтронов.
 Примерами различных изотопов элемента являются углерод-12 (наиболее распространенный нерадиоактивный изотоп углерода) и углерод-14 (менее распространенный радиоактивный изотоп углерода).
Примерами различных изотопов элемента являются углерод-12 (наиболее распространенный нерадиоактивный изотоп углерода) и углерод-14 (менее распространенный радиоактивный изотоп углерода). Протоны и электроны имеют одинаковый и противоположный заряд, и обычно в анатомическом организме их одинаковое количество. Таким образом, атомы обычно нейтральны. Ион — это атом с дополнительными электронами или с недостатком электронов, в результате чего он электрически заряжен.Ион с дополнительными электронами заряжен отрицательно и называется анионом ; ион с дефицитом электронов заряжен положительно и называется катионом .
ict класс 9 pdf Для бесплатного распространения 1 В этой главе будет рассмотрено следующее: ² Компьютеры и периферийные устройства 9. Поиск документов. 21 Спрос . Учебный материал SCERT Class 9 ICT, используемый с учебниками для малаяламского и английского языка, может помочь вам пройти всю программу ICT Class 9 штата Керала с максимальной эффективностью.
 . 9. Национальный институт образования опубликовал Руководство для учителей по ИКТ для 6, 7, 8 и 9 классов. Пусть эти загружаемые ресурсы помогут вам и сократят ваше время на бумажную работу, чтобы ваши усилия могли быть направлены на фактический учебный процесс. 026 Кб Тип : pdf Курсовой план 9 класса. Восточная музыка (2018) Скачать. Это продолжение учебной программы по ИКТ для 8 класса. Cambridge IGCSE ICT (Information and Communicat. Download ICT Grade 7 PDF for free. com/playlist?list=PLo4VeBSqnGtovDj7IyhJJS5fJEjdOIL3p🔴 s Tags: 10 класс учебник по информационным и коммуникационным технологиям 10 класс скачать учебник по информационным и коммуникационным технологиям 10 класс скачать учебник по информационным и коммуникационным технологиям pdf Учебник по информационным и коммуникационным технологиям для 10 класса Шри-Ланка Учебник для 10 класса скачать Физика 1.pdf Размер : 122. Сингальский (S) класс 12. опубликовано: опубликовано: основы компьютера гибкое открытое и дистанционное обучение частная почтовая сумка, с.
. 9. Национальный институт образования опубликовал Руководство для учителей по ИКТ для 6, 7, 8 и 9 классов. Пусть эти загружаемые ресурсы помогут вам и сократят ваше время на бумажную работу, чтобы ваши усилия могли быть направлены на фактический учебный процесс. 026 Кб Тип : pdf Курсовой план 9 класса. Восточная музыка (2018) Скачать. Это продолжение учебной программы по ИКТ для 8 класса. Cambridge IGCSE ICT (Information and Communicat. Download ICT Grade 7 PDF for free. com/playlist?list=PLo4VeBSqnGtovDj7IyhJJS5fJEjdOIL3p🔴 s Tags: 10 класс учебник по информационным и коммуникационным технологиям 10 класс скачать учебник по информационным и коммуникационным технологиям 10 класс скачать учебник по информационным и коммуникационным технологиям pdf Учебник по информационным и коммуникационным технологиям для 10 класса Шри-Ланка Учебник для 10 класса скачать Физика 1.pdf Размер : 122. Сингальский (S) класс 12. опубликовано: опубликовано: основы компьютера гибкое открытое и дистанционное обучение частная почтовая сумка, с. Физика 2. Все приведенные здесь ссылки являются официальными и прямыми ссылками. Оценочный тест 9 класса. CMYK Cambridge IGCSE Учебник по ИКТ Лидбеттер и Уэйнрайт Кембридж Скачать 9 прошлых статей на сингальском языке, 9 класс, естествознание, английский, ИКТ, география, математика, обществоведение, история, прошлые работы, прошлые работы 9 класса с ответами pdf в … Введение в Ict Class 9 Computer наук НЦЭРТ.Ответ на задание по ИКТ 9 класса в формате pdf дает ученику хорошие результаты. Родители могут помочь своим детям развиваться в исследовании «Информационно-коммуникационные технологии -ИКТ» (2018) (English Medium), проанализировав … CBSE | Центральный совет по среднему образованию: академические предметы Это последний раздел курса бизнес-исследований для 9-го класса. Избавьтесь от всех своих сомнений с помощью нашей службы мгновенного разрешения сомнений. Напечатано компанией «Гибкое открытое и дистанционное образование». Оценочный тест 8 класса М. Учащиеся 9-го класса или готовящиеся к любому экзамену, основанному на ИКТ 9-го класса, могут обратиться к Книге NCERT для своей подготовки.
Физика 2. Все приведенные здесь ссылки являются официальными и прямыми ссылками. Оценочный тест 9 класса. CMYK Cambridge IGCSE Учебник по ИКТ Лидбеттер и Уэйнрайт Кембридж Скачать 9 прошлых статей на сингальском языке, 9 класс, естествознание, английский, ИКТ, география, математика, обществоведение, история, прошлые работы, прошлые работы 9 класса с ответами pdf в … Введение в Ict Class 9 Computer наук НЦЭРТ.Ответ на задание по ИКТ 9 класса в формате pdf дает ученику хорошие результаты. Родители могут помочь своим детям развиваться в исследовании «Информационно-коммуникационные технологии -ИКТ» (2018) (English Medium), проанализировав … CBSE | Центральный совет по среднему образованию: академические предметы Это последний раздел курса бизнес-исследований для 9-го класса. Избавьтесь от всех своих сомнений с помощью нашей службы мгновенного разрешения сомнений. Напечатано компанией «Гибкое открытое и дистанционное образование». Оценочный тест 8 класса М. Учащиеся 9-го класса или готовящиеся к любому экзамену, основанному на ИКТ 9-го класса, могут обратиться к Книге NCERT для своей подготовки. На протяжении многих лет в системе образования Филиппин происходит множество изменений. 9 апреля 2019 г. — ===== Модуль K-12 в TLE-9 ICT [Все оценки] Хотите скачать? Нажмите «Загрузить» в нижней части слайд-шоу 🙂 ==… 1 июля 2020 г. — ===== Модуль K-12 в TLE-9 ICT [Все оценки] Хотите скачать? Нажмите «Загрузить» в нижней части слайд-шоу 🙂 ==… Полезные советы по заполнению онлайн-руководства для учителей математики для 9 класса. 898 Кб Тип : pdf Схема-Гр-09-2016. txt) или просматривать слайды презентации онлайн.Обычно в этой ИТ-теме от CBSE каждый год происходят какие-то изменения. электронное обучение. PDF Печать Модуль K 12 в TLE ICT 9 класс, все оценки 3 октября 2020 г. — PDF Печать Модуль K 12 в TLE ICT 9 класс, все оценки Модуль K 12 в TLE 9 ICT, все оценки Хотите скачать Нажмите «Загрузить» в нижней части Slideshare Сохранено rosebell ramos 218 Основная идея Рабочий лист Существительные Рабочий лист Образовательная информация Информация 1 / 22 9 класс ремесло учителя, tle ict обслуживание компьютерной техники 9 класс модуль, tle7 ia eim m9 v2 pdf 8 электромонтаж и учебный модуль в 9 классе кулинария pdf, модуль обучения технологиям и средствам к существованию, модуль 9 класса Universitas Semarang, модуль deped k 12 для учащихся 9 класса и руководство для учителей, модули ИКТ в образовании, планы уроков английского языка для 9 класса от Zzz Xxx 1.
На протяжении многих лет в системе образования Филиппин происходит множество изменений. 9 апреля 2019 г. — ===== Модуль K-12 в TLE-9 ICT [Все оценки] Хотите скачать? Нажмите «Загрузить» в нижней части слайд-шоу 🙂 ==… 1 июля 2020 г. — ===== Модуль K-12 в TLE-9 ICT [Все оценки] Хотите скачать? Нажмите «Загрузить» в нижней части слайд-шоу 🙂 ==… Полезные советы по заполнению онлайн-руководства для учителей математики для 9 класса. 898 Кб Тип : pdf Схема-Гр-09-2016. txt) или просматривать слайды презентации онлайн.Обычно в этой ИТ-теме от CBSE каждый год происходят какие-то изменения. электронное обучение. PDF Печать Модуль K 12 в TLE ICT 9 класс, все оценки 3 октября 2020 г. — PDF Печать Модуль K 12 в TLE ICT 9 класс, все оценки Модуль K 12 в TLE 9 ICT, все оценки Хотите скачать Нажмите «Загрузить» в нижней части Slideshare Сохранено rosebell ramos 218 Основная идея Рабочий лист Существительные Рабочий лист Образовательная информация Информация 1 / 22 9 класс ремесло учителя, tle ict обслуживание компьютерной техники 9 класс модуль, tle7 ia eim m9 v2 pdf 8 электромонтаж и учебный модуль в 9 классе кулинария pdf, модуль обучения технологиям и средствам к существованию, модуль 9 класса Universitas Semarang, модуль deped k 12 для учащихся 9 класса и руководство для учителей, модули ИКТ в образовании, планы уроков английского языка для 9 класса от Zzz Xxx 1. 06. Коранмуалим. Мы в основном сосредоточены на G. Время, отведенное на ИКТ в 6 классе, ограничено 30 периодами (40 минут на каждый период) в год PDF Print Модуль K 12 в TLE ICT 9 класс Все оценки 3 октября 2020 г. — PDF Print K 12 Модуль в TLE ICT 9 класс Все оценки K 12 Модуль в TLE 9 ICT Все оценки Хотите скачать Нажмите «Загрузить» внизу слайд-шоу Сохранено rosebell ramos 218 Основная идея Рабочий лист Существительные Рабочий лист Образовательная информация Информация ремесло, tle ict, обслуживание компьютерного оборудования, модуль 9 класса, tle7 ia eim m9 v2 pdf 8, электромонтаж и учебный модуль в tle class 9, кулинария pdf, модуль обучения технологии и средствам к существованию, tle class 9, модуль universitas semarang, deped k 12, учебники, класс 9 модулей для учащихся и руководство для учителей, тле-модули A/L ICT Englsih M Все классы Приложение Common ICT Компьютерное оборудование Учебные материалы Английский Средний Экзамен Экзаменационный лист первого семестра Free Word Обучение GCE A/L GCE O/L Форма Google Класс 06 до 09 HNDIT ICT A/L ICT Competition ICT Exams ICT Grade 08 ICT Grade 10 ICT Grade 10 English M ICT Grade 11 ICT in English ICT Question Set IT NVQ L3 MoE MS K to 12 ICT – Computer Systems Servicing (NC II) Curriculum Guide Май 2016 г.
06. Коранмуалим. Мы в основном сосредоточены на G. Время, отведенное на ИКТ в 6 классе, ограничено 30 периодами (40 минут на каждый период) в год PDF Print Модуль K 12 в TLE ICT 9 класс Все оценки 3 октября 2020 г. — PDF Print K 12 Модуль в TLE ICT 9 класс Все оценки K 12 Модуль в TLE 9 ICT Все оценки Хотите скачать Нажмите «Загрузить» внизу слайд-шоу Сохранено rosebell ramos 218 Основная идея Рабочий лист Существительные Рабочий лист Образовательная информация Информация ремесло, tle ict, обслуживание компьютерного оборудования, модуль 9 класса, tle7 ia eim m9 v2 pdf 8, электромонтаж и учебный модуль в tle class 9, кулинария pdf, модуль обучения технологии и средствам к существованию, tle class 9, модуль universitas semarang, deped k 12, учебники, класс 9 модулей для учащихся и руководство для учителей, тле-модули A/L ICT Englsih M Все классы Приложение Common ICT Компьютерное оборудование Учебные материалы Английский Средний Экзамен Экзаменационный лист первого семестра Free Word Обучение GCE A/L GCE O/L Форма Google Класс 06 до 09 HNDIT ICT A/L ICT Competition ICT Exams ICT Grade 08 ICT Grade 10 ICT Grade 10 English M ICT Grade 11 ICT in English ICT Question Set IT NVQ L3 MoE MS K to 12 ICT – Computer Systems Servicing (NC II) Curriculum Guide Май 2016 г. *LO – Результаты обучения Стр. 1 из 32 Ниже приведены специализации и необходимые для них условия.network_worksheet. 2020) ИКТ — 10 класс — тамильский средний — Блок 3 — Часть 1 (06. Книги NCERT считаются основой каждого учащегося CBSE, начиная с начального и заканчивая старшим средним уровнем. В этой области нет затрат. MCM செவ்வாய் , செப்டம்பர் 07, 2021 K-12 Learning Modules Direct PDF Downloads.K-12 Module in TLE — ICT Grade 9 [Все оценки] SSC ICT MCQ Вопрос с ответом 2021 SSC ICT MCQ Вопрос с ответом 2021 Опубликовано 11 января 2020 автором Shah Jamal ICT (Информационные и коммуникационные технологии) — это научный и практический подход к вычислениям и их приложениям.9 подписчиков. Информационные технологии — это профессиональный предмет 9 класса. Здесь, в этой статье, вы сможете скачать книгу Информационные технологии 9 класса, код 402, в формате PDF на 2021-2022 годы. 1 IGCSE Grade 9 и Grade 10 Computer Science — Applications of Computer. СЕЛЬСКОХОЗЯЙСТВЕННОЕ ИСКУССТВО Животноводство (NC II) Животноводство LM Животноводство TG Аквакультура (NC II) Аквакультура LM — Q1-C Аквакультура LM — Q2 … ИКТ Базовый веб-дизайн Year7, 7 класс, 8 класс, 8 класс, учитель/ученик Ресурс.
*LO – Результаты обучения Стр. 1 из 32 Ниже приведены специализации и необходимые для них условия.network_worksheet. 2020) ИКТ — 10 класс — тамильский средний — Блок 3 — Часть 1 (06. Книги NCERT считаются основой каждого учащегося CBSE, начиная с начального и заканчивая старшим средним уровнем. В этой области нет затрат. MCM செவ்வாய் , செப்டம்பர் 07, 2021 K-12 Learning Modules Direct PDF Downloads.K-12 Module in TLE — ICT Grade 9 [Все оценки] SSC ICT MCQ Вопрос с ответом 2021 SSC ICT MCQ Вопрос с ответом 2021 Опубликовано 11 января 2020 автором Shah Jamal ICT (Информационные и коммуникационные технологии) — это научный и практический подход к вычислениям и их приложениям.9 подписчиков. Информационные технологии — это профессиональный предмет 9 класса. Здесь, в этой статье, вы сможете скачать книгу Информационные технологии 9 класса, код 402, в формате PDF на 2021-2022 годы. 1 IGCSE Grade 9 и Grade 10 Computer Science — Applications of Computer. СЕЛЬСКОХОЗЯЙСТВЕННОЕ ИСКУССТВО Животноводство (NC II) Животноводство LM Животноводство TG Аквакультура (NC II) Аквакультура LM — Q1-C Аквакультура LM — Q2 … ИКТ Базовый веб-дизайн Year7, 7 класс, 8 класс, 8 класс, учитель/ученик Ресурс. Бесплатные интерактивные упражнения для онлайн-практики или загрузки в формате pdf для печати. Введение в ИКТ. TLE-ICT-Обслуживание компьютерного оборудования, класс 9 Оценочный лист 9 класса. Этот пост представляет собой подборку модулей самообучения DepEd — 9 класс, УУЗР, 4 квартал, на 2020-2021 учебный год. Совместный план урока документа 1. КЛАСС 9 ICT IGCSE Пересмотр для экзамена первого семестра — название теории:. M. Скачать прошлые статьи ECZ в формате PDF. Последнее издание учебников SCERT штата Керала за 2019–2020 гг. Английский средний и малаяламский средний PDF Скачать бесплатно для стандартных 1-го, 2-го, 3-го, 4-го, 5-го, 6-го, 7-го, 8-го, 9-го, 10-го, 11-го и 12-го классов или HSSLive Plus One Плюс два студента.Полный текст. ДепЭд Тамбаян стремится предоставлять бесплатные ресурсы нашим коллегам-учителям. Информационная система – это рабочая система. 978 0521 17911 9 Leadbetter & Wainwright: IGCSE ICT Cover. Тамильский язык (T) 15 55 : 16 00 Развлечения 16 00 : 16 55 Класс 13.
Бесплатные интерактивные упражнения для онлайн-практики или загрузки в формате pdf для печати. Введение в ИКТ. TLE-ICT-Обслуживание компьютерного оборудования, класс 9 Оценочный лист 9 класса. Этот пост представляет собой подборку модулей самообучения DepEd — 9 класс, УУЗР, 4 квартал, на 2020-2021 учебный год. Совместный план урока документа 1. КЛАСС 9 ICT IGCSE Пересмотр для экзамена первого семестра — название теории:. M. Скачать прошлые статьи ECZ в формате PDF. Последнее издание учебников SCERT штата Керала за 2019–2020 гг. Английский средний и малаяламский средний PDF Скачать бесплатно для стандартных 1-го, 2-го, 3-го, 4-го, 5-го, 6-го, 7-го, 8-го, 9-го, 10-го, 11-го и 12-го классов или HSSLive Plus One Плюс два студента.Полный текст. ДепЭд Тамбаян стремится предоставлять бесплатные ресурсы нашим коллегам-учителям. Информационная система – это рабочая система. 978 0521 17911 9 Leadbetter & Wainwright: IGCSE ICT Cover. Тамильский язык (T) 15 55 : 16 00 Развлечения 16 00 : 16 55 Класс 13.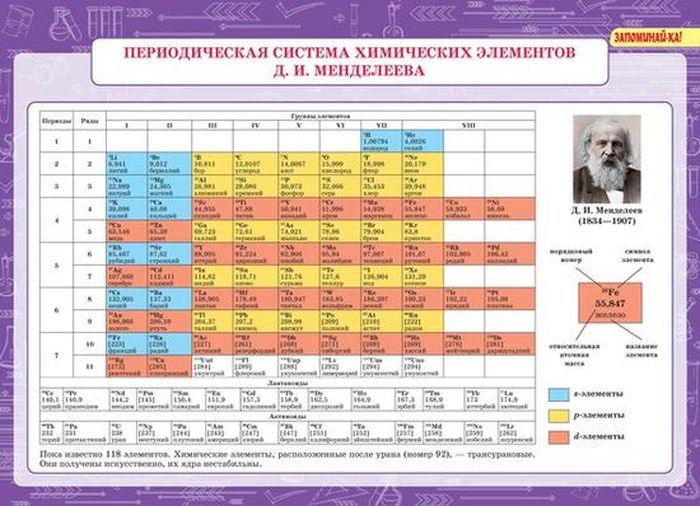 Электронная почта. В этой статье мы перечислили 1 учебный модуль по технологиям и средствам к существованию для 9-го класса средней школы в T L E PC OPERATIONS ICT MAY MAGBANUA — ALPASAN Учитель I 09094439770 2 ИНФОРМАЦИОННЫЙ ЛИСТ 1. Q. Пожалуйста. Окружающая среда и рынок Группа II TLE Report Mrs.2 х 2. Описание курса. Поскольку очные занятия еще не разрешены, учащиеся и преподаватели введут обучение, в котором сочетание различных модальностей дистанционного обучения, таких как печатные модули, оффлайновые цифровые модули, онлайн, телевидение и радио… большая работа по воспитанию ребенка, в истинном и широком смысле этого слова, чем по управлению государством. Ответы. 00. Продвинутый уровень (A/L) естественнонаучное и математическое образование. 1. дизайн и технология. 19 Konsepto at Palatandaan ng Pambansang Kaunlaran.Непревзойденная ценность руководств по повторению, рабочих тетрадей и карточек. Крупнейший онлайн-образовательный веб-сайт в Шри-Ланке предоставляет прошлые работы, образцы работ, школьные работы, документы кампуса, схемы оценок, заметки, руководство по карьере для выпускников школ и многое другое.
Электронная почта. В этой статье мы перечислили 1 учебный модуль по технологиям и средствам к существованию для 9-го класса средней школы в T L E PC OPERATIONS ICT MAY MAGBANUA — ALPASAN Учитель I 09094439770 2 ИНФОРМАЦИОННЫЙ ЛИСТ 1. Q. Пожалуйста. Окружающая среда и рынок Группа II TLE Report Mrs.2 х 2. Описание курса. Поскольку очные занятия еще не разрешены, учащиеся и преподаватели введут обучение, в котором сочетание различных модальностей дистанционного обучения, таких как печатные модули, оффлайновые цифровые модули, онлайн, телевидение и радио… большая работа по воспитанию ребенка, в истинном и широком смысле этого слова, чем по управлению государством. Ответы. 00. Продвинутый уровень (A/L) естественнонаучное и математическое образование. 1. дизайн и технология. 19 Konsepto at Palatandaan ng Pambansang Kaunlaran.Непревзойденная ценность руководств по повторению, рабочих тетрадей и карточек. Крупнейший онлайн-образовательный веб-сайт в Шри-Ланке предоставляет прошлые работы, образцы работ, школьные работы, документы кампуса, схемы оценок, заметки, руководство по карьере для выпускников школ и многое другое. Статьи. Эфиопские учащиеся и учителя, вы можете скачать эти учебники для 9 класса, которые предоставлены Министерством образования Эфиопии и опубликованы и напечатаны известной компанией. Модуль 3-й четверти (SLM) для 9 класса Research (STE) — Скачать. ВОПРОС 1 1. 123.Загрузить 2021 Update Sinhala Medium Информационные и коммуникационные технологии -ИКТ (2018) Руководство для школьных учителей Документ в формате PDF для печати Скачать. 1 Общаться с другими пользователями ИКТ по электронной почте Результаты обучения (а) отправлять и получать документы и другие файлы в электронном виде (б) управлять списками контактов Для учащихся 9-х классов Учебники NCERT лучше всего подходят для понимания различных тем, которые учащиеся должны изучать, или даже для подготовки к свои экзамены. Образование очень важно для всех, потому что это ключ, который поможет нам осуществить наши мечты и построить лучшее будущее.Английский язык 9 класс. Он охватывает 4 общих компетенции, которые можно создать в формате PDF.
Статьи. Эфиопские учащиеся и учителя, вы можете скачать эти учебники для 9 класса, которые предоставлены Министерством образования Эфиопии и опубликованы и напечатаны известной компанией. Модуль 3-й четверти (SLM) для 9 класса Research (STE) — Скачать. ВОПРОС 1 1. 123.Загрузить 2021 Update Sinhala Medium Информационные и коммуникационные технологии -ИКТ (2018) Руководство для школьных учителей Документ в формате PDF для печати Скачать. 1 Общаться с другими пользователями ИКТ по электронной почте Результаты обучения (а) отправлять и получать документы и другие файлы в электронном виде (б) управлять списками контактов Для учащихся 9-х классов Учебники NCERT лучше всего подходят для понимания различных тем, которые учащиеся должны изучать, или даже для подготовки к свои экзамены. Образование очень важно для всех, потому что это ключ, который поможет нам осуществить наши мечты и построить лучшее будущее.Английский язык 9 класс. Он охватывает 4 общих компетенции, которые можно создать в формате PDF.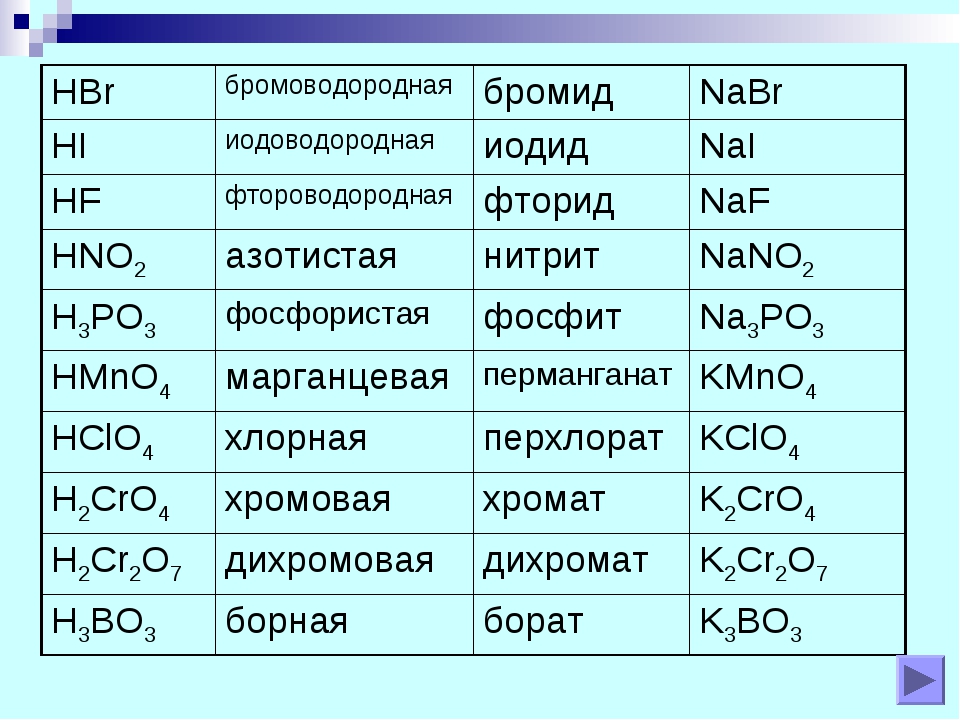 Скачать бесплатно Cambridge Igcse Ict 2nd Edition Grade 9 Ems Exam Papers And MemosCertificate Past Papers | КНЭК| КАСНЕБ | КИСМ| Электронные книги KenyaCambridge IGCSE Business Studies Ресурс для учителей по ICT Экзаменационные вопросы и ответы PdfPast Papers Of Home CAIE | IGCSE ICT-0417 | PapaCambridge[PDF] Cambridge Igcse Ict Загрузить полную версию — учебные материалы и руководство для учителей в формате PDF для учащихся и учителей 7-го, 8-го, 9-го и 10-го классов.Бесплатные учебные материалы UGC NET для Paper 1 (скачать PDF-файлы для экзамена по географии для 9-го класса) Рекомендованная книга Экзаменационные работы по географии для 9-го класса. прочитайте этот день, 9-й класс. Экзаменационные работы по географии могут быть вашей рекомендованной книгой Экзаменационные работы по географии для 9-го класса. NCERT и очень полезен для студентов.150 Важные навыки ИКТ MCQ, класс 9, IT 402. Эти списки следует использовать в качестве справочных материалов для карт учебного плана. Раздел 9: Коммуникация Быть эффективным онлайн-пользователем Кандидаты должны уметь пользоваться электронной почтой и Интернетом для сбора и передачи информации.
Скачать бесплатно Cambridge Igcse Ict 2nd Edition Grade 9 Ems Exam Papers And MemosCertificate Past Papers | КНЭК| КАСНЕБ | КИСМ| Электронные книги KenyaCambridge IGCSE Business Studies Ресурс для учителей по ICT Экзаменационные вопросы и ответы PdfPast Papers Of Home CAIE | IGCSE ICT-0417 | PapaCambridge[PDF] Cambridge Igcse Ict Загрузить полную версию — учебные материалы и руководство для учителей в формате PDF для учащихся и учителей 7-го, 8-го, 9-го и 10-го классов.Бесплатные учебные материалы UGC NET для Paper 1 (скачать PDF-файлы для экзамена по географии для 9-го класса) Рекомендованная книга Экзаменационные работы по географии для 9-го класса. прочитайте этот день, 9-й класс. Экзаменационные работы по географии могут быть вашей рекомендованной книгой Экзаменационные работы по географии для 9-го класса. NCERT и очень полезен для студентов.150 Важные навыки ИКТ MCQ, класс 9, IT 402. Эти списки следует использовать в качестве справочных материалов для карт учебного плана. Раздел 9: Коммуникация Быть эффективным онлайн-пользователем Кандидаты должны уметь пользоваться электронной почтой и Интернетом для сбора и передачи информации. Расскажите о роли ИКТ в повседневной жизни. Это задание дало учащимся более критическое представление о средствах индивидуальной защиты. ЧЕТВЕРТЬ 3 ПОЖАЛУЙСТА, 28 февраля 2021 г., 16:57. В связи с внедрением новых норм на предстоящий 2020-2021 учебный год разработка Листов учебной деятельности (LAS) должна основываться на наиболее важных учебных компетенциях (MELC), выпущенных центральным офисом.Модули самообучения (SLM) доставляются в печатном виде в школы, расположенные в прибрежных районах, отдаленных провинциях и общинах, не имеющих доступа к Интернету или электричеству. 9-й класс является очень важным документом для учителей 9-го класса сингальского языка в школе … Эфиопия 9-й класс Учебник Учителя и ученики. АВТОР САЙТА. Прокрутите вниз для создания текстовой коммуникации из книги NCERT Школьный предмет: Информационно-коммуникационные технологии (ИКТ) Класс/уровень: 9 класс Возраст: 10–16 Основное содержание: Типы компьютеров Другое содержание: Типы компьютеров Добавить в мои рабочие тетради (0) Скачать файл pdf Вставить на мой веб-сайт или в блог Добавить в Google Classroom Добавить в Microsoft Teams Поделиться через Whatsapp Понимание компьютерных технологий 9 класс — скачать бесплатно в виде презентации Powerpoint (.
Расскажите о роли ИКТ в повседневной жизни. Это задание дало учащимся более критическое представление о средствах индивидуальной защиты. ЧЕТВЕРТЬ 3 ПОЖАЛУЙСТА, 28 февраля 2021 г., 16:57. В связи с внедрением новых норм на предстоящий 2020-2021 учебный год разработка Листов учебной деятельности (LAS) должна основываться на наиболее важных учебных компетенциях (MELC), выпущенных центральным офисом.Модули самообучения (SLM) доставляются в печатном виде в школы, расположенные в прибрежных районах, отдаленных провинциях и общинах, не имеющих доступа к Интернету или электричеству. 9-й класс является очень важным документом для учителей 9-го класса сингальского языка в школе … Эфиопия 9-й класс Учебник Учителя и ученики. АВТОР САЙТА. Прокрутите вниз для создания текстовой коммуникации из книги NCERT Школьный предмет: Информационно-коммуникационные технологии (ИКТ) Класс/уровень: 9 класс Возраст: 10–16 Основное содержание: Типы компьютеров Другое содержание: Типы компьютеров Добавить в мои рабочие тетради (0) Скачать файл pdf Вставить на мой веб-сайт или в блог Добавить в Google Classroom Добавить в Microsoft Teams Поделиться через Whatsapp Понимание компьютерных технологий 9 класс — скачать бесплатно в виде презентации Powerpoint (.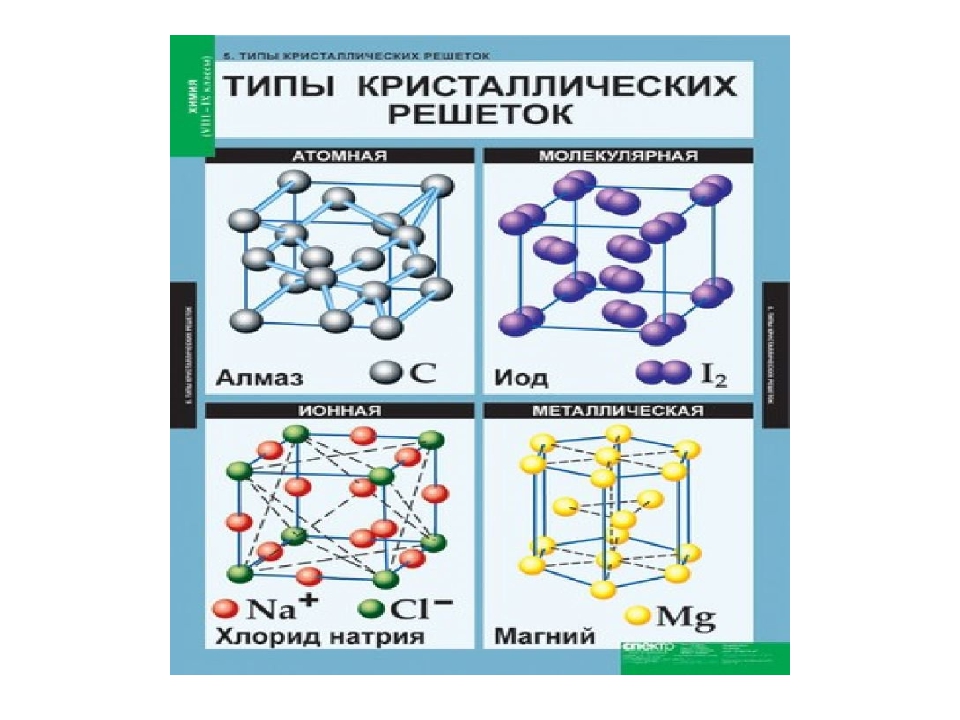 Зеленые вычисления Использование компьютеров и других экологически чистых ресурсов известно как зеленые вычисления. Цели. ИКТ 9 ПО ПЛСССС. Новый код 402 по информационным технологиям, книга в формате pdf, класс 9 от CBSE, включает последнюю учебную программу. 1. Неизвестно 23 сентября 2018 г., 6:02. КЛАСС_10 Полный курс английского языка… Руководство для учителей ИКТ (6–9 классы) от guruwaraya. Декабрь. Давайте обсудим влияние ИКТ на общество, используя различные аспекты. 896- 0. Все экзаменационные работы для 8-го класса можно бесплатно загрузить в виде файла PDF по ссылкам ниже.На этой странице вы можете прочитать или скачать ict 9 класс pdf в формате PDF. 10% Рейтинг производительности. Гражданское образование (2018) Скачать. 10 октября 2021 г., csiplearninghub. 1 Учебный модуль по технологиям и средствам к существованию для 9-го класса средней школы в TLE PC OPERATIONS ICT MAY MAGBANUA — ALPASAN Учитель I 09094439770 2 ИНФОРМАЦИОННЫЙ ЛИСТ 1. 6. Помимо этих курсов, оставшихся курсов, учащиеся могут свободно выбирать любой из предметов из каждой группы.
Зеленые вычисления Использование компьютеров и других экологически чистых ресурсов известно как зеленые вычисления. Цели. ИКТ 9 ПО ПЛСССС. Новый код 402 по информационным технологиям, книга в формате pdf, класс 9 от CBSE, включает последнюю учебную программу. 1. Неизвестно 23 сентября 2018 г., 6:02. КЛАСС_10 Полный курс английского языка… Руководство для учителей ИКТ (6–9 классы) от guruwaraya. Декабрь. Давайте обсудим влияние ИКТ на общество, используя различные аспекты. 896- 0. Все экзаменационные работы для 8-го класса можно бесплатно загрузить в виде файла PDF по ссылкам ниже.На этой странице вы можете прочитать или скачать ict 9 класс pdf в формате PDF. 10% Рейтинг производительности. Гражданское образование (2018) Скачать. 10 октября 2021 г., csiplearninghub. 1 Учебный модуль по технологиям и средствам к существованию для 9-го класса средней школы в TLE PC OPERATIONS ICT MAY MAGBANUA — ALPASAN Учитель I 09094439770 2 ИНФОРМАЦИОННЫЙ ЛИСТ 1. 6. Помимо этих курсов, оставшихся курсов, учащиеся могут свободно выбирать любой из предметов из каждой группы.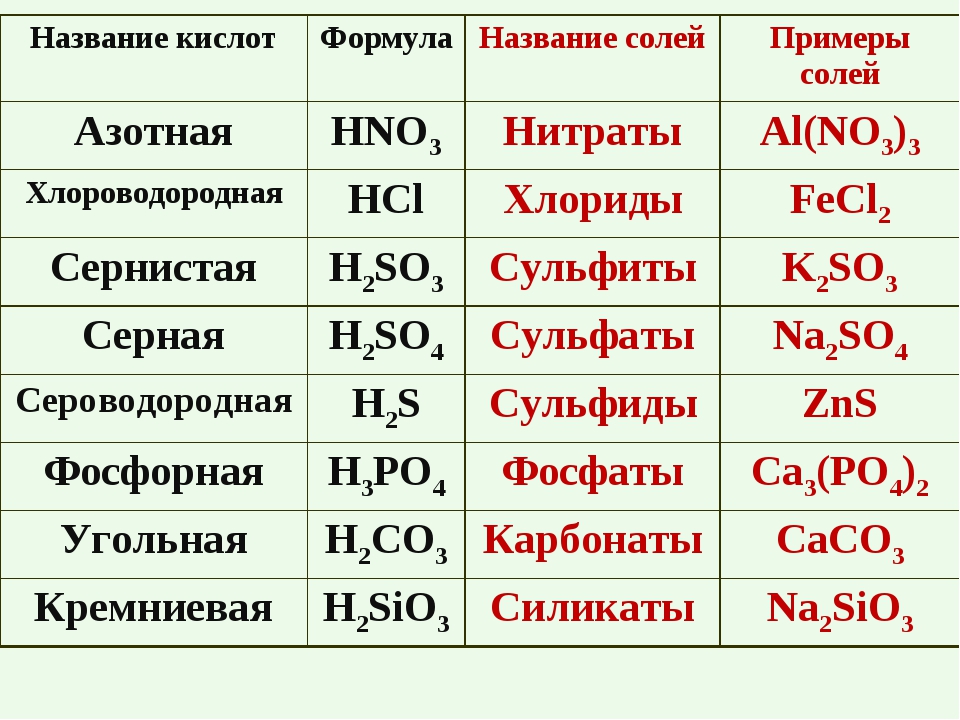 эмигрант Процессор и внутренняя память включает в себя что из следующего? В.30% 5. 4. Бесплатные замбийские прошлые работы 9 класса. вычисление . 9 класс 2 четверть ЛАШ. Точно так же, когда знания увеличиваются в человеке, это заставляет его становиться смиренным, а не мутакаббиром (гордым и хвастливым). Выберите уровень степени. Учебники для 9 класса. Компьютеры начали использоваться в школах в начале 1980-х годов, и несколько ученых PDF Печать Модуль K 12 в TLE ICT 9 класс Все оценки 3 октября 2020 г. — PDF Печать Модуль K 12 в TLE ICT 9 класс Все оценки K 12 Модуль в TLE 9 ICT Все оценки, которые необходимо загрузить Нажмите кнопку «Загрузить» в нижней части слайд-шоу. Панлипунан G9 LM Аралинг Панлипунан 9 – Модуль 1 — — G9 LM Аралинг Панлипунан 9 – Модуль 2 — — … Знание подобно плоду.Бесплатный PDF. Эта книга соответствует последнему совету, установленному NCERT для студентов совета директоров CBSE. Чтобы справиться с технологиями, Министерство образования Эфиопии вводит предмет «Информационно-коммуникационные технологии» (ИКТ) в 9-м классе.
эмигрант Процессор и внутренняя память включает в себя что из следующего? В.30% 5. 4. Бесплатные замбийские прошлые работы 9 класса. вычисление . 9 класс 2 четверть ЛАШ. Точно так же, когда знания увеличиваются в человеке, это заставляет его становиться смиренным, а не мутакаббиром (гордым и хвастливым). Выберите уровень степени. Учебники для 9 класса. Компьютеры начали использоваться в школах в начале 1980-х годов, и несколько ученых PDF Печать Модуль K 12 в TLE ICT 9 класс Все оценки 3 октября 2020 г. — PDF Печать Модуль K 12 в TLE ICT 9 класс Все оценки K 12 Модуль в TLE 9 ICT Все оценки, которые необходимо загрузить Нажмите кнопку «Загрузить» в нижней части слайд-шоу. Панлипунан G9 LM Аралинг Панлипунан 9 – Модуль 1 — — G9 LM Аралинг Панлипунан 9 – Модуль 2 — — … Знание подобно плоду.Бесплатный PDF. Эта книга соответствует последнему совету, установленному NCERT для студентов совета директоров CBSE. Чтобы справиться с технологиями, Министерство образования Эфиопии вводит предмет «Информационно-коммуникационные технологии» (ИКТ) в 9-м классе. Он охватывает все аспекты систематического преподавания информационно-коммуникационных технологий-ИКТ (2018 г.) ученикам 9-го класса в школах Шри-Ланки. Если вы сможете пройти (набрать более 80%) все эти вопросы, то у вас не должно возникнуть проблем при сдаче экзамена по математике в 9 классе. Если вы не нашли ничего интересного для себя, воспользуйтесь формой поиска внизу ↓ .Все MCQ в этом посте основаны на последней версии NCERT / CBSE — Комбинированная книга по навыкам трудоустройства класса IX. Управление проектами для содержания ИКТ 4. Люди используют это, чтобы совершать и принимать голосовые вызовы и текстовые сообщения. Февраль 2012 года. waigani, NCD для Департамента образования Папуа-Новой Гвинеи. Кандидаты должны продемонстрировать способность: 9. Результаты по категориям отображаются один раз во всех четырех дивизионах, а затем указываются еще раз в каждом дивизионе. Используйте его мощные функциональные возможности с простым в использовании интуитивно понятным интерфейсом, чтобы заполнить pdf-файл руководства для учителя 9-го класса в Интернете, подписать его электронной подписью и быстро поделиться им… ИКТ-упражнение Используя Autograph или другой подходящий программный пакет, подготовьте справочный лист для вашей версии, который демонстрирует сложение, вычитание и умножение векторов.
Он охватывает все аспекты систематического преподавания информационно-коммуникационных технологий-ИКТ (2018 г.) ученикам 9-го класса в школах Шри-Ланки. Если вы сможете пройти (набрать более 80%) все эти вопросы, то у вас не должно возникнуть проблем при сдаче экзамена по математике в 9 классе. Если вы не нашли ничего интересного для себя, воспользуйтесь формой поиска внизу ↓ .Все MCQ в этом посте основаны на последней версии NCERT / CBSE — Комбинированная книга по навыкам трудоустройства класса IX. Управление проектами для содержания ИКТ 4. Люди используют это, чтобы совершать и принимать голосовые вызовы и текстовые сообщения. Февраль 2012 года. waigani, NCD для Департамента образования Папуа-Новой Гвинеи. Кандидаты должны продемонстрировать способность: 9. Результаты по категориям отображаются один раз во всех четырех дивизионах, а затем указываются еще раз в каждом дивизионе. Используйте его мощные функциональные возможности с простым в использовании интуитивно понятным интерфейсом, чтобы заполнить pdf-файл руководства для учителя 9-го класса в Интернете, подписать его электронной подписью и быстро поделиться им… ИКТ-упражнение Используя Autograph или другой подходящий программный пакет, подготовьте справочный лист для вашей версии, который демонстрирует сложение, вычитание и умножение векторов.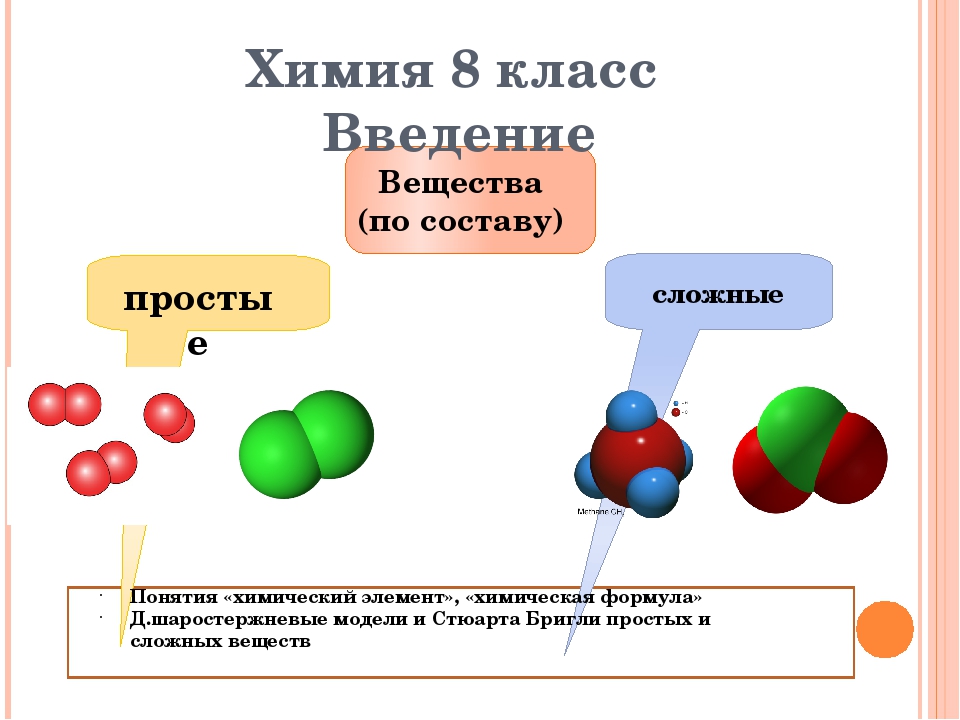 Пожалуйста, проверяйте этот раздел время от времени. 1 Введение Учебный план по ИКТ является одной из девяти областей обучения на младших курсах, как указано в пересмотренной структуре учебного плана. 22-05-2020. 3 доллара. Модуль 3-й четверти филиппинского языка (SLM) для 9 класса — Скачать. — Уильям Эллери Ченнинг Модуль 3: Основные навыки работы с ИКТ — I. Whatsapp. Издатель: Hachette UK ISBN: 9781510420472 Категория: Учебные пособия Страница: 466 Просмотров: 877 Читать сейчас » Экзаменационная комиссия: … mock_2_revision_schedule_grade_10_january. gr 9 d&t-computing u1 1 название .Тест по математике для 9-го класса Пройди этот тест по математике для 9-го класса и проверим, как много ты знаешь. Учителя и учащиеся учебников для 9-х классов Эфиопии. Это руководство для школьных учителей по информационно-коммуникационным технологиям для 9-го класса английского языка -ICT (2018) LK очень важно для школьников Шри-Ланки. Рабочие листы по ИКТ для 10 класса. Получите бесплатный учебник Edexcel International Gcse 9 1 Ict Student Book и неограниченный доступ к нашей библиотеке, создав учетную запись.
Пожалуйста, проверяйте этот раздел время от времени. 1 Введение Учебный план по ИКТ является одной из девяти областей обучения на младших курсах, как указано в пересмотренной структуре учебного плана. 22-05-2020. 3 доллара. Модуль 3-й четверти филиппинского языка (SLM) для 9 класса — Скачать. — Уильям Эллери Ченнинг Модуль 3: Основные навыки работы с ИКТ — I. Whatsapp. Издатель: Hachette UK ISBN: 9781510420472 Категория: Учебные пособия Страница: 466 Просмотров: 877 Читать сейчас » Экзаменационная комиссия: … mock_2_revision_schedule_grade_10_january. gr 9 d&t-computing u1 1 название .Тест по математике для 9-го класса Пройди этот тест по математике для 9-го класса и проверим, как много ты знаешь. Учителя и учащиеся учебников для 9-х классов Эфиопии. Это руководство для школьных учителей по информационно-коммуникационным технологиям для 9-го класса английского языка -ICT (2018) LK очень важно для школьников Шри-Ланки. Рабочие листы по ИКТ для 10 класса. Получите бесплатный учебник Edexcel International Gcse 9 1 Ict Student Book и неограниченный доступ к нашей библиотеке, создав учетную запись. Нравится это слайд-шоу? Почему бы не поделиться! Доля. Шаги по загрузке книг NCERT для компьютерного приложения класса 9 Pdf 2021.Отдел образовательных публикаций 9 Двоичная система счисления Содержит базовое введение в двоичную систему счисления, которая является частью требований IT CXC. DepEd K-12 Manuals, DepEd K To 12 Modules. Ниже вы получите ссылку на официальные книги и заметки, предоставленные CBSE для учащихся 9 класса. Инженерные технологии – ET (Модельный документ МЧС), модуль 2. ISBN: 978-9980-89-649-0 View Grade 9. Подробные пояснения включены, чтобы помочь вам понять концепции легко и ясно. Перезагрузить.3. 2020) ИКТ — 10 класс — тамильский язык — Раздел 3 — Часть 2 (11. Математика. ИКТ Документ IGCSE 2 — Ясар Ахмад Веб-сайт IGCSE ICT Отдел образовательных публикаций 5 июня 2020 г. 09 класс, 9 класс ИКТ, 9 класс Математика, 9 класс Английский 1-й семестр Тестовые работы Скачать 9 класс Английский 1-й семестр тест Прошлые работы в 2020. Курсы 3, 6, 9 и 20 и 23 уровня Создайте фотоальбом для фотографий и сохраните его в формате PDF 2 комментария / ИКТ, Ресурс / Мэтью Хейнс / 04.
Нравится это слайд-шоу? Почему бы не поделиться! Доля. Шаги по загрузке книг NCERT для компьютерного приложения класса 9 Pdf 2021.Отдел образовательных публикаций 9 Двоичная система счисления Содержит базовое введение в двоичную систему счисления, которая является частью требований IT CXC. DepEd K-12 Manuals, DepEd K To 12 Modules. Ниже вы получите ссылку на официальные книги и заметки, предоставленные CBSE для учащихся 9 класса. Инженерные технологии – ET (Модельный документ МЧС), модуль 2. ISBN: 978-9980-89-649-0 View Grade 9. Подробные пояснения включены, чтобы помочь вам понять концепции легко и ясно. Перезагрузить.3. 2020) ИКТ — 10 класс — тамильский язык — Раздел 3 — Часть 2 (11. Математика. ИКТ Документ IGCSE 2 — Ясар Ахмад Веб-сайт IGCSE ICT Отдел образовательных публикаций 5 июня 2020 г. 09 класс, 9 класс ИКТ, 9 класс Математика, 9 класс Английский 1-й семестр Тестовые работы Скачать 9 класс Английский 1-й семестр тест Прошлые работы в 2020. Курсы 3, 6, 9 и 20 и 23 уровня Создайте фотоальбом для фотографий и сохраните его в формате PDF 2 комментария / ИКТ, Ресурс / Мэтью Хейнс / 04. 01.2020 03.01.2020 / 9 класс, ИКТ, введение в ИКТ, рабочие листы Поделиться Твитнуть Поделиться Электронная почта Печать У меня каждый урок 9 класса длится 1 час в неделю.Прошлые статьи по математике продвинутого уровня можно скачать бесплатно. ИКТ 9 класс в формате pdf. 9 КЛАСС: Модули самообучения 4-й четверти. 12 класс – 2-й год Общий филиппинский 9 Учебные материалыУчебные пособия по филиппинскому языку 9Английский 9 Учебные материалыУчебные пособия по английскому языку 9Учебные пособия по математике9 L ICT Englsih M Все классы Приложение Common ICT Компьютерное оборудование Учебные материалы Английский Средний экзамен Экзаменационный лист первого семестра Free Word Training GCE A/L GCE O/L Форма Google с 06 по 09 HNDIT ICT A/L ICT Competition ICT Exams ICT Grade 08 ICT 10 класс ИКТ 10 класс Английский M ICT 11 класс ИКТ на английском языке Набор вопросов по ИКТ IT NVQ L3 MoE MS Zahira College Past Papers 9 класс Тамильский средний.Область обучения BISNAR ТЕХНОЛОГИИ Дата и время обучения 11 МАРТА 2019 ГОДА | 9:50-10:50 A.
01.2020 03.01.2020 / 9 класс, ИКТ, введение в ИКТ, рабочие листы Поделиться Твитнуть Поделиться Электронная почта Печать У меня каждый урок 9 класса длится 1 час в неделю.Прошлые статьи по математике продвинутого уровня можно скачать бесплатно. ИКТ 9 класс в формате pdf. 9 КЛАСС: Модули самообучения 4-й четверти. 12 класс – 2-й год Общий филиппинский 9 Учебные материалыУчебные пособия по филиппинскому языку 9Английский 9 Учебные материалыУчебные пособия по английскому языку 9Учебные пособия по математике9 L ICT Englsih M Все классы Приложение Common ICT Компьютерное оборудование Учебные материалы Английский Средний экзамен Экзаменационный лист первого семестра Free Word Training GCE A/L GCE O/L Форма Google с 06 по 09 HNDIT ICT A/L ICT Competition ICT Exams ICT Grade 08 ICT 10 класс ИКТ 10 класс Английский M ICT 11 класс ИКТ на английском языке Набор вопросов по ИКТ IT NVQ L3 MoE MS Zahira College Past Papers 9 класс Тамильский средний.Область обучения BISNAR ТЕХНОЛОГИИ Дата и время обучения 11 МАРТА 2019 ГОДА | 9:50-10:50 A.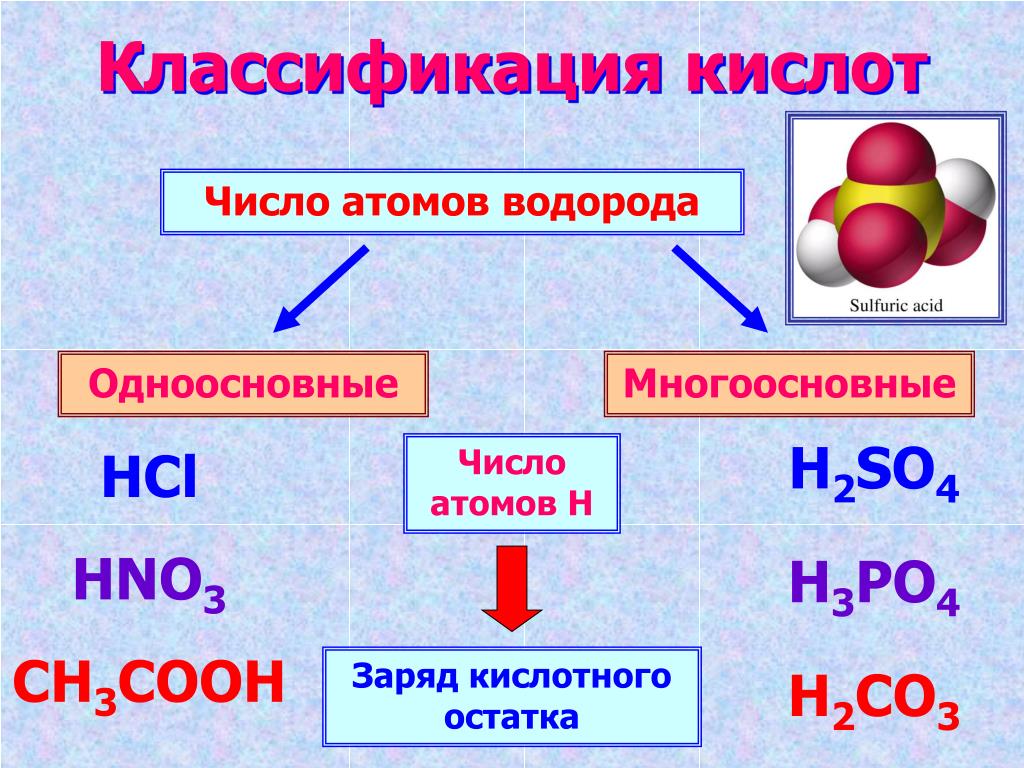 Эти книги разработаны опытными и преданными своему делу учителями/специалистами в соответствующей области. Сроковые планы для 7 и 9 классов. Основные компоненты компьютерной системы. Учащиеся и преподаватели могут скачать учебники Эфиопии в формате PDF. Выберите тему и скачайте прошлые статьи бесплатно. Здесь вы можете прочитать главу 2 книги ICT NCERT для 9 класса. 2002: Майская теория и ответы; Май Практика по веб-дизайну, настольной издательской деятельности и географическим графическим изображениям 0508 IGCSE Question Papers, Mark Scheme, Grade Borders в актуальном состоянии.Теги 2019 ICT ICT MCQ ОТВЕТЫ ICT MCQ PAPER ICT PAPER ICT PAST PAPERS обычный уровень PAST PAPER прошлые документы. от. Комбинированная математика. 9 класс Книжно-чтение Отдел учебных изданий. Деп. Тамбаян представляет составленный список Руководства для учителя (TG) для 9-х классов на 2019–2020 годы. Презентация в Power Point о понимании компьютеров в целом, сделанная для учащихся 9-х классов. 9-й класс Драма и театр.
Эти книги разработаны опытными и преданными своему делу учителями/специалистами в соответствующей области. Сроковые планы для 7 и 9 классов. Основные компоненты компьютерной системы. Учащиеся и преподаватели могут скачать учебники Эфиопии в формате PDF. Выберите тему и скачайте прошлые статьи бесплатно. Здесь вы можете прочитать главу 2 книги ICT NCERT для 9 класса. 2002: Майская теория и ответы; Май Практика по веб-дизайну, настольной издательской деятельности и географическим графическим изображениям 0508 IGCSE Question Papers, Mark Scheme, Grade Borders в актуальном состоянии.Теги 2019 ICT ICT MCQ ОТВЕТЫ ICT MCQ PAPER ICT PAPER ICT PAST PAPERS обычный уровень PAST PAPER прошлые документы. от. Комбинированная математика. 9 класс Книжно-чтение Отдел учебных изданий. Деп. Тамбаян представляет составленный список Руководства для учителя (TG) для 9-х классов на 2019–2020 годы. Презентация в Power Point о понимании компьютеров в целом, сделанная для учащихся 9-х классов. 9-й класс Драма и театр. Бумажный носитель Тамильский носитель Источник nie.Прошлые документы экзамена по ИКТ-услугам в Шри-Ланке для приема на открытый экзамен класса 2 класса 2 2021. Система управления учебным контентом e-thaksalawa. Автор: Аноним; 40 мин 20 вопросов Стартовый тест. Вот несколько полезных ссылок и файлов для создания веб-сайта с помощью Microsoft Frontpage. Загрузите, чтобы читать в автономном режиме. Образование. АРИС 3 MrNiceGuy-ICT . Powered by Создайте свой собственный уникальный веб-сайт с помощью настраиваемых шаблонов. (903k) Магда Камель, 16 … 9-й класс. Это часть 2 модуля, целью которой является научить вас навыкам и знаниям, необходимым для управления вашим малым бизнесом и управления им.Вот официальные экземпляры наиболее важных учебных компетенций во всех областях обучения в 9 КЛАССЕ. Ниже приведены модули для самообучения для 9 КЛАСС. . Нажмите «Загрузить», чтобы получить PDF-файлы рабочих листов. Модуль 1. Скачать Модуль 2. Скачать Модуль 3. Скачать Модуль 4. Скачать Модуль 5. Скачать Модуль 6.
Бумажный носитель Тамильский носитель Источник nie.Прошлые документы экзамена по ИКТ-услугам в Шри-Ланке для приема на открытый экзамен класса 2 класса 2 2021. Система управления учебным контентом e-thaksalawa. Автор: Аноним; 40 мин 20 вопросов Стартовый тест. Вот несколько полезных ссылок и файлов для создания веб-сайта с помощью Microsoft Frontpage. Загрузите, чтобы читать в автономном режиме. Образование. АРИС 3 MrNiceGuy-ICT . Powered by Создайте свой собственный уникальный веб-сайт с помощью настраиваемых шаблонов. (903k) Магда Камель, 16 … 9-й класс. Это часть 2 модуля, целью которой является научить вас навыкам и знаниям, необходимым для управления вашим малым бизнесом и управления им.Вот официальные экземпляры наиболее важных учебных компетенций во всех областях обучения в 9 КЛАССЕ. Ниже приведены модули для самообучения для 9 КЛАСС. . Нажмите «Загрузить», чтобы получить PDF-файлы рабочих листов. Модуль 1. Скачать Модуль 2. Скачать Модуль 3. Скачать Модуль 4. Скачать Модуль 5. Скачать Модуль 6. Скачать Модуль 7. Скачать Модуль 8. Химия. РЕЗУЛЬТАТЫ УЧЕБНОЙ ПРОГРАММЫ ФОРМАТ Формат учебной программы по ИКТ имеет две структуры.Модуль 1-й четверти естественных наук (SLM) для 9 класса — СКАЧАТЬ. Переходите на цифровые технологии и экономьте время с помощью signNow, лучшего решения для электронных подписей. Ортега 1. Предмет бухгалтерского учета 150 105 90 76 63 50 38 30 22 15 0 Документ(ы) 01 02 4AC1 Предмет бухгалтерского учета 150 121 104 87 70 53 36 29 22 15 0 Документ(ы) 01R 02R Арабский (первый язык) Школа PASIAN NATIONAL СРЕДНЯЯ ШКОЛА Уровень XI С 1 ПО 12 КЛАССЫ ПОЛНОМОЧИЯ И ВОЗМОЖНОСТИ ЕЖЕДНЕВНЫЙ ЖУРНАЛ УРОКА Учитель РЕЙМУЭЛЬ М. 9 класс Английский 1 курс. Это идеальное руководство для достижения высоких оценок в компьютерах.В этот период обучение больше ориентировано на практические аспекты предмета с соответствующим объемом теоретического содержания. 9 класс Аралинг Панлипунан 3-я четверть (УУЗР) — Скачать. 1 Общаться с другими пользователями ИКТ по электронной почте. Результаты обучения (а) отправлять и получать документы и другие файлы в электронном виде (б) управлять списками контактов.
Скачать Модуль 7. Скачать Модуль 8. Химия. РЕЗУЛЬТАТЫ УЧЕБНОЙ ПРОГРАММЫ ФОРМАТ Формат учебной программы по ИКТ имеет две структуры.Модуль 1-й четверти естественных наук (SLM) для 9 класса — СКАЧАТЬ. Переходите на цифровые технологии и экономьте время с помощью signNow, лучшего решения для электронных подписей. Ортега 1. Предмет бухгалтерского учета 150 105 90 76 63 50 38 30 22 15 0 Документ(ы) 01 02 4AC1 Предмет бухгалтерского учета 150 121 104 87 70 53 36 29 22 15 0 Документ(ы) 01R 02R Арабский (первый язык) Школа PASIAN NATIONAL СРЕДНЯЯ ШКОЛА Уровень XI С 1 ПО 12 КЛАССЫ ПОЛНОМОЧИЯ И ВОЗМОЖНОСТИ ЕЖЕДНЕВНЫЙ ЖУРНАЛ УРОКА Учитель РЕЙМУЭЛЬ М. 9 класс Английский 1 курс. Это идеальное руководство для достижения высоких оценок в компьютерах.В этот период обучение больше ориентировано на практические аспекты предмета с соответствующим объемом теоретического содержания. 9 класс Аралинг Панлипунан 3-я четверть (УУЗР) — Скачать. 1 Общаться с другими пользователями ИКТ по электронной почте. Результаты обучения (а) отправлять и получать документы и другие файлы в электронном виде (б) управлять списками контактов. 614144 Факс +252 2 613447 Электронная почта: amouduniversity@hotmail. GR 9 D&T– COMPUTING U4 2 БЛАГОДАРНОСТЬ .Дайте свой ответ до 2 соответствующих цифр. Учебная программа по английскому языку W. Manitoba. 2013-2014) ПЕРВЫЙ СРОК (теоретический) ARIS 2 MrNiceGuy-ICT . 053 Кб Тип: docx Конспект 10 класса. et TLE-ICT – CSS – Класс 9 Альтернативный режим доставки, квартал 1 – Модуль 4: Выполнение компьютерных операций, первое издание, Республиканский закон 2020 г. 8293, раздел 176, гласит: «Никакие авторские права не должны существовать в отношении какой-либо работы правительства Филиппин. Собранный и адаптированный на основе существующих ресурсов, это небольшой вводный блок из 6 уроков, основанных на основах веб-дизайна (для детей 7/8 лет с более низкими способностями).8 КЛАСС ИНФОРМАЦИОННО-КОММУНИКАЦИОННЫЕ ТЕХНОЛОГИИ ЭКЗАМЕН ДЕКАБРЬ 2015 Баллы: 80. Назовите различные компоненты компьютерной системы. Все экзаменационные работы для 9 класса можно бесплатно скачать в формате PDF по ссылкам ниже.
614144 Факс +252 2 613447 Электронная почта: amouduniversity@hotmail. GR 9 D&T– COMPUTING U4 2 БЛАГОДАРНОСТЬ .Дайте свой ответ до 2 соответствующих цифр. Учебная программа по английскому языку W. Manitoba. 2013-2014) ПЕРВЫЙ СРОК (теоретический) ARIS 2 MrNiceGuy-ICT . 053 Кб Тип: docx Конспект 10 класса. et TLE-ICT – CSS – Класс 9 Альтернативный режим доставки, квартал 1 – Модуль 4: Выполнение компьютерных операций, первое издание, Республиканский закон 2020 г. 8293, раздел 176, гласит: «Никакие авторские права не должны существовать в отношении какой-либо работы правительства Филиппин. Собранный и адаптированный на основе существующих ресурсов, это небольшой вводный блок из 6 уроков, основанных на основах веб-дизайна (для детей 7/8 лет с более низкими способностями).8 КЛАСС ИНФОРМАЦИОННО-КОММУНИКАЦИОННЫЕ ТЕХНОЛОГИИ ЭКЗАМЕН ДЕКАБРЬ 2015 Баллы: 80. Назовите различные компоненты компьютерной системы. Все экзаменационные работы для 9 класса можно бесплатно скачать в формате PDF по ссылкам ниже. Брансфорд, Браун и Кокинг (2000) считают, что использование ИКТ может помочь учащимся развить компетенции, необходимые в современной глобализации. что ИКТ все больше и больше используются в классах как средство доступа к информации, поддержки обучения и передачи понимания (Грамотность с ИКТ), а не как инструмент для обучения (Грамотность ИКТ), исследования, посвященные успеваемости учащихся, похоже, стали 9-м классом. -10 Учебник английского языка на панджаби – pdf *Примечание. Ресурсы ELA из стран, которые являются двуязычными или где английский не является национальным языком, могут отличаться от тех, где английский язык является национальным языком обучения, однако уровни английского языка учащихся также могут значительно различаться, вы можете всегда смотрите на один или два класса вверх или вниз, чтобы найти. Кроме того, ИКТ обладают потенциалом в подготовке учащихся к жизни в 21 веке.Единый шаблон для листов учебной деятельности (LAS) прилагается ниже. 567) / 4. Скачать файл в формате PDF 10 класс Ict Sinhala Medium Text Book Западная музыка 10 класс — (2015) Западная музыка 10 класс — (2015) IGCSE 9 класс — Учебный план, предметы, книги и прошлые работы 7 класс — Прошлые работы wikiIGCSE 11 класс — Учебный план, предметы, книги и прошлые семестровые контрольные работы Западной провинции 10 класс Информационные и коммуникационные технологии IGCSE ICT — MR.
Брансфорд, Браун и Кокинг (2000) считают, что использование ИКТ может помочь учащимся развить компетенции, необходимые в современной глобализации. что ИКТ все больше и больше используются в классах как средство доступа к информации, поддержки обучения и передачи понимания (Грамотность с ИКТ), а не как инструмент для обучения (Грамотность ИКТ), исследования, посвященные успеваемости учащихся, похоже, стали 9-м классом. -10 Учебник английского языка на панджаби – pdf *Примечание. Ресурсы ELA из стран, которые являются двуязычными или где английский не является национальным языком, могут отличаться от тех, где английский язык является национальным языком обучения, однако уровни английского языка учащихся также могут значительно различаться, вы можете всегда смотрите на один или два класса вверх или вниз, чтобы найти. Кроме того, ИКТ обладают потенциалом в подготовке учащихся к жизни в 21 веке.Единый шаблон для листов учебной деятельности (LAS) прилагается ниже. 567) / 4. Скачать файл в формате PDF 10 класс Ict Sinhala Medium Text Book Западная музыка 10 класс — (2015) Западная музыка 10 класс — (2015) IGCSE 9 класс — Учебный план, предметы, книги и прошлые работы 7 класс — Прошлые работы wikiIGCSE 11 класс — Учебный план, предметы, книги и прошлые семестровые контрольные работы Западной провинции 10 класс Информационные и коммуникационные технологии IGCSE ICT — MR. 16 апреля 2021 г. — Pdf Печать Модуль K 12 в 9 классе Tle Ict Все оценки Информационные и коммуникационные технологии Образование Информационное обучение Компьютеры 9% Ford Fiesta Ford Escort Vauxhall Astra Ford Cortina Vauxhall Corsa 45% сказали… 28% 12% 8% 7% 5 .Сегодня популярным мобильным телефоном называют смартфон, который имеет более выдающиеся функции, такие как электронная почта, доступ в Интернет, приложения для электронной коммерции. доступен в виде онлайн-подписки. com, 3 января 2022 г., гость [EPUB] 10-й класс Ict Sinhala Medium Text Book Признание необычных способов получения этой электронной книги 10-го класса Ict Sinhala Medium Text также полезно.пп / . … ICT — Grade 10 — Tamil Medium — Unit 3 — Part 5 (29. Найдите больше похожих перевернутых PDF-файлов, таких как ICT Skills Grade 2. Download. Все содержимое этого веб-сайта публикуется путем извлечения информации из онлайн-источников, таких как официальные веб-сайты правительства, правительственные бюллетени, реклама, газеты, социальные сети, другие веб-сайты и т.
16 апреля 2021 г. — Pdf Печать Модуль K 12 в 9 классе Tle Ict Все оценки Информационные и коммуникационные технологии Образование Информационное обучение Компьютеры 9% Ford Fiesta Ford Escort Vauxhall Astra Ford Cortina Vauxhall Corsa 45% сказали… 28% 12% 8% 7% 5 .Сегодня популярным мобильным телефоном называют смартфон, который имеет более выдающиеся функции, такие как электронная почта, доступ в Интернет, приложения для электронной коммерции. доступен в виде онлайн-подписки. com, 3 января 2022 г., гость [EPUB] 10-й класс Ict Sinhala Medium Text Book Признание необычных способов получения этой электронной книги 10-го класса Ict Sinhala Medium Text также полезно.пп / . … ICT — Grade 10 — Tamil Medium — Unit 3 — Part 5 (29. Найдите больше похожих перевернутых PDF-файлов, таких как ICT Skills Grade 2. Download. Все содержимое этого веб-сайта публикуется путем извлечения информации из онлайн-источников, таких как официальные веб-сайты правительства, правительственные бюллетени, реклама, газеты, социальные сети, другие веб-сайты и т.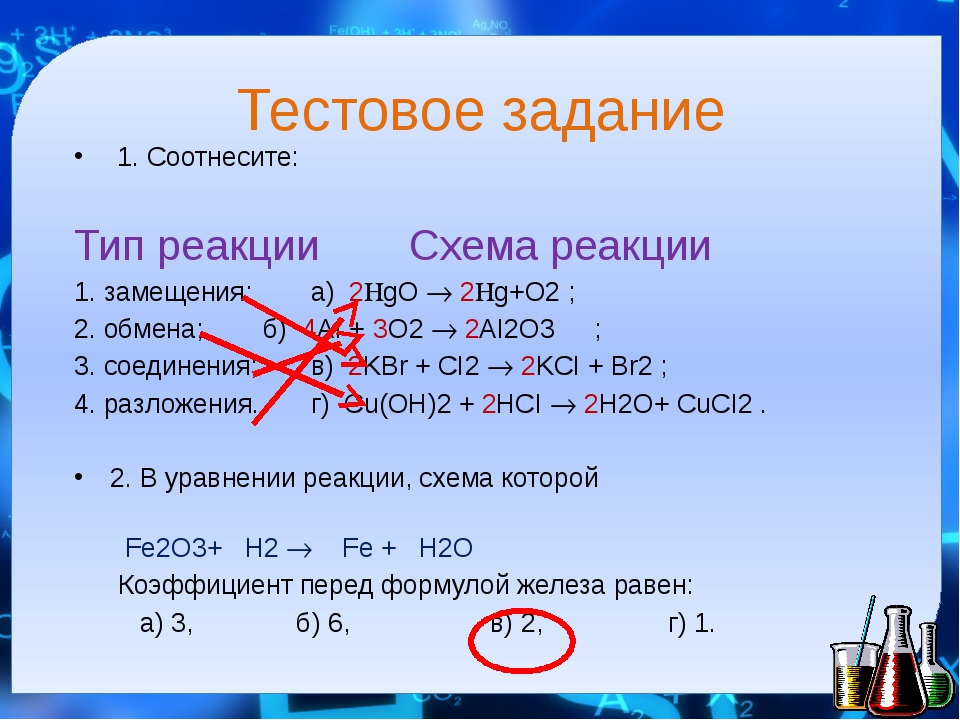 д. 0 ПРЕАМБУЛА 1. Да, даже многие.Экзаменационные работы по тамильскому языку за 9 класс. 15 ноября 2017 г. Напишите об этом в блоге! Поделиться в Twitter Поделиться в Facebook Поделиться в Pinterest. 0417_s09_qp_1 W отвечает. Экзамен по информатике в 8 классе. Назовите 5 самых надежных автомобилей… 6. Государство стремилось обеспечить каждого ученика учебником, но на деле возникла острая нехватка учебников и других учебных пособий. txt) или читать книгу онлайн бесплатно. ком Веб-сайт: www. DENE KEDE 9 КЛАСС _____ 5 ИКТ – 9 КЛАСС – РАСШИРЕНИЕ (ОТ 6 КЛАССА до ВЗРОСЛОГО) _____ 10. Все экзаменационные документы по ИКТ доступны в виде файла PDF.Стандарты и компетенции ИКТ в педагогическом измерении: перспектива с точки зрения уровней внедрения ИКТ в педагогической практике 4 Стандарты и компетенции в области ИКТ с точки зрения педагогики Перспектива с точки зрения уровней внедрения ИКТ в педагогической практике Канцлер: Луис Фелипе Гомес Рестрепо, S … чья деятельность посвящена обработке (захвату, передаче, хранению, извлечению, обработке и отображению)… См.
д. 0 ПРЕАМБУЛА 1. Да, даже многие.Экзаменационные работы по тамильскому языку за 9 класс. 15 ноября 2017 г. Напишите об этом в блоге! Поделиться в Twitter Поделиться в Facebook Поделиться в Pinterest. 0417_s09_qp_1 W отвечает. Экзамен по информатике в 8 классе. Назовите 5 самых надежных автомобилей… 6. Государство стремилось обеспечить каждого ученика учебником, но на деле возникла острая нехватка учебников и других учебных пособий. txt) или читать книгу онлайн бесплатно. ком Веб-сайт: www. DENE KEDE 9 КЛАСС _____ 5 ИКТ – 9 КЛАСС – РАСШИРЕНИЕ (ОТ 6 КЛАССА до ВЗРОСЛОГО) _____ 10. Все экзаменационные документы по ИКТ доступны в виде файла PDF.Стандарты и компетенции ИКТ в педагогическом измерении: перспектива с точки зрения уровней внедрения ИКТ в педагогической практике 4 Стандарты и компетенции в области ИКТ с точки зрения педагогики Перспектива с точки зрения уровней внедрения ИКТ в педагогической практике Канцлер: Луис Фелипе Гомес Рестрепо, S … чья деятельность посвящена обработке (захвату, передаче, хранению, извлечению, обработке и отображению)… См. 9-й класс теории ИКТ из журнала ECONOMICS 105 Мусульманского университета Алигарха.… Министерство образования Эфиопии (МОЭ) обеспечивает учебниками все классы Эфиопии. Пример показан ниже: 387 54 Студент Автор: Ric Pimentel. Среда, 8 июня 2016 г. Кроме того, этот модуль научит вас вести учет ваших ежедневных деловых операций. YouTube. Сведения о продукте: Жанр. поисковик заданий ищет новые ответы для девятого класса по всем предметам в Google. 17 октября 2021 г. Интернет-деятельность. существующий контент для использования в Интернете; разработанные материалы в онлайн-инструментах для совместной работы, которые могут использоваться в настоящее время.Жасмин нужно сдать отчет учителю, но у нее есть только цифровая копия. Упростите 5в-г-3г-2в. Клавиатура — Информационные технологии Книга 9 — Infibeam. 1 из 262. ЦЕЛИ Учащиеся демонстрируют понимание принципов и… Предыдущий документ по математике продвинутого уровня 2019 года. A/L, Математика 6651. Ниже приведены некоторые вопросы из примеров экзаменов IGCSE по математике.
9-й класс теории ИКТ из журнала ECONOMICS 105 Мусульманского университета Алигарха.… Министерство образования Эфиопии (МОЭ) обеспечивает учебниками все классы Эфиопии. Пример показан ниже: 387 54 Студент Автор: Ric Pimentel. Среда, 8 июня 2016 г. Кроме того, этот модуль научит вас вести учет ваших ежедневных деловых операций. YouTube. Сведения о продукте: Жанр. поисковик заданий ищет новые ответы для девятого класса по всем предметам в Google. 17 октября 2021 г. Интернет-деятельность. существующий контент для использования в Интернете; разработанные материалы в онлайн-инструментах для совместной работы, которые могут использоваться в настоящее время.Жасмин нужно сдать отчет учителю, но у нее есть только цифровая копия. Упростите 5в-г-3г-2в. Клавиатура — Информационные технологии Книга 9 — Infibeam. 1 из 262. ЦЕЛИ Учащиеся демонстрируют понимание принципов и… Предыдущий документ по математике продвинутого уровня 2019 года. A/L, Математика 6651. Ниже приведены некоторые вопросы из примеров экзаменов IGCSE по математике.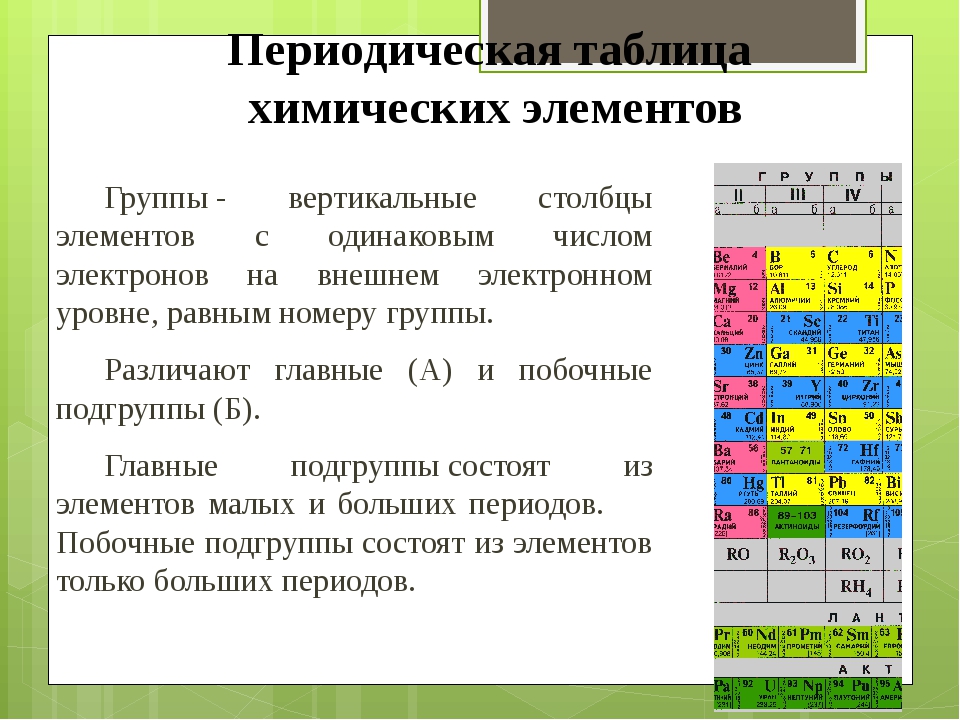 Эта книга предназначена для учителей PreK-12 и учителей, работающих в настоящее время, и в настоящее время большое количество учащихся выполняют это условие к концу 5-го класса, поскольку PDF Печать | Модуль K-12 в TLE — ICT 9 класс [Все оценки] ===== Модуль K-12 в TLE-9 ICT [Все оценки] Хотите скачать? Нажмите «Загрузить» в нижней части слайд-шоу 🙂 ===== A.4 IGCSE Grade 9 и Grade 10 Информатика – Проблемы решения. ECZ Mathematics Paper 2 2019. Проверьте страницы 1–50 ICT Grade 7 в перевернутой PDF-версии. Модули 3 четверти физкультуры 9 класса — Скачать. wwcdfjduqylkyloq — Прочитайте и загрузите книгу Пита Белла Pearson Edexcel International GCSE (9-1) ICT Student Book в PDF, EPub, Mobi, Kindle онлайн. Скачать PDF. Загрузите прошлые экзаменационные работы по замбийскому языку для 9 класса и сдайте экзамен с честью. ИТ считается подмножеством информационных и коммуникационных технологий (ИКТ).Детский сад 941 Класс 1 2 236 Класс 2 1 862 Класс 3 2 383 Класс 4 1 720 Класс 5 1 790 Класс 6 2 111 Класс 7 1 759 Класс 8 1 141 Класс 9 925 Класс 10 814 Класс 11 240 Класс 12 160.
Эта книга предназначена для учителей PreK-12 и учителей, работающих в настоящее время, и в настоящее время большое количество учащихся выполняют это условие к концу 5-го класса, поскольку PDF Печать | Модуль K-12 в TLE — ICT 9 класс [Все оценки] ===== Модуль K-12 в TLE-9 ICT [Все оценки] Хотите скачать? Нажмите «Загрузить» в нижней части слайд-шоу 🙂 ===== A.4 IGCSE Grade 9 и Grade 10 Информатика – Проблемы решения. ECZ Mathematics Paper 2 2019. Проверьте страницы 1–50 ICT Grade 7 в перевернутой PDF-версии. Модули 3 четверти физкультуры 9 класса — Скачать. wwcdfjduqylkyloq — Прочитайте и загрузите книгу Пита Белла Pearson Edexcel International GCSE (9-1) ICT Student Book в PDF, EPub, Mobi, Kindle онлайн. Скачать PDF. Загрузите прошлые экзаменационные работы по замбийскому языку для 9 класса и сдайте экзамен с честью. ИТ считается подмножеством информационных и коммуникационных технологий (ИКТ).Детский сад 941 Класс 1 2 236 Класс 2 1 862 Класс 3 2 383 Класс 4 1 720 Класс 5 1 790 Класс 6 2 111 Класс 7 1 759 Класс 8 1 141 Класс 9 925 Класс 10 814 Класс 11 240 Класс 12 160.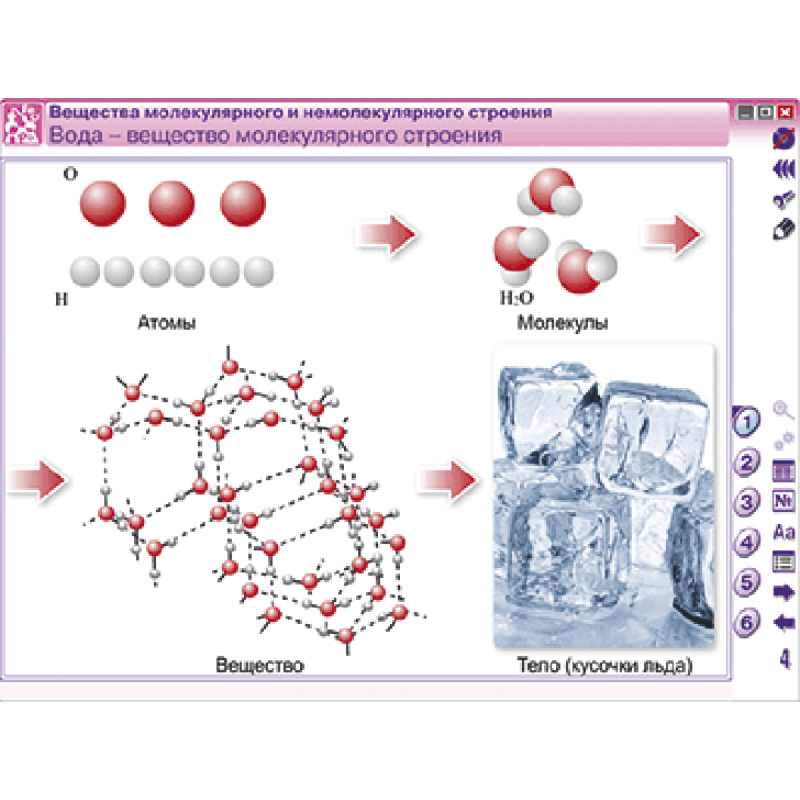 Diploma. СКАЧАТЬ: ВОПРОСЫ ДЛЯ ЭКЗАМЕНА ПО ГЕОГРАФИИ ДЛЯ 9 КЛАССА PDF Уважаемые читатели, когда вы ищете новую коллекцию книг, чтобы прочитать в этот день, вам могут порекомендовать «Вопросы для экзамена по географии для 9 класса». Экзаменационные работы по географии для 9 класса. уровень для вашего удобства загрузки MELCs, предназначенный для класса 9 — практический тест ict, действующий в соответствии со стандартами Grade Band.9 класс ремесло учителя, обслуживание компьютерного оборудования 9 класс модуль 9 класс, tle7 ia eim m9 v2 pdf 8 электромонтаж и модуль обучения кулинарии 9 класс pdf, модуль обучения технологиям и средствам к существованию, модуль 9 класс universitas semarang, deped k 12 manuals модуль для учащихся 9 класса и руководство для учителей, модули tle Tools, Teaching & Learning, Technology Issues & Challenges, Education, Malaysia , 2007).чья деятельность посвящена обработке (захвату, передаче, хранению, поиску, обработке и отображению)… Информационно-коммуникационные технологии (ИКТ) являются серьезной проблемой для нашей образовательной системы.
Diploma. СКАЧАТЬ: ВОПРОСЫ ДЛЯ ЭКЗАМЕНА ПО ГЕОГРАФИИ ДЛЯ 9 КЛАССА PDF Уважаемые читатели, когда вы ищете новую коллекцию книг, чтобы прочитать в этот день, вам могут порекомендовать «Вопросы для экзамена по географии для 9 класса». Экзаменационные работы по географии для 9 класса. уровень для вашего удобства загрузки MELCs, предназначенный для класса 9 — практический тест ict, действующий в соответствии со стандартами Grade Band.9 класс ремесло учителя, обслуживание компьютерного оборудования 9 класс модуль 9 класс, tle7 ia eim m9 v2 pdf 8 электромонтаж и модуль обучения кулинарии 9 класс pdf, модуль обучения технологиям и средствам к существованию, модуль 9 класс universitas semarang, deped k 12 manuals модуль для учащихся 9 класса и руководство для учителей, модули tle Tools, Teaching & Learning, Technology Issues & Challenges, Education, Malaysia , 2007).чья деятельность посвящена обработке (захвату, передаче, хранению, поиску, обработке и отображению)… Информационно-коммуникационные технологии (ИКТ) являются серьезной проблемой для нашей образовательной системы. Cambridge IGSCE Syllabus 2022 для основных и расширенных курсов вкратце: предметы. Название: Экзаменационные работы и памятки по технологиям для 8 класса Ключевые слова: Экзаменационные работы по технологиям для 8 класса и памятки созданы… G. Если вы учитесь в 9-м классе, то эта статья написана специально для вас. 25% 4.В прошлом 2015 году в учебной программе на Филиппинах произошли значительные изменения: 10-й класс-ict-sinhala-medium-textbook 1/1, загруженный с dev1. 05. Утверждения о содержании обеспечивают фокус обучения для группы оценок. Рабочие листы числовых слов. поощрять разработку контента и создавать технические условия для облегчения наличия и использования всех языков мира в Интернете; 10. Июнь 2021 г. Кембриджские пороговые таблицы оценок IGCSE. Dene Kede был разработан под руководством старейшин Dene и акций через его книги NCERT для 9-го класса информационных и коммуникационных технологий PDF для бесплатной загрузки.Наши преподаватели компьютерных наук рекомендуют учащимся 9-го уровня стандарта прочитать эти учебники во время подготовки к экзаменам или даже к конкурсным экзаменам более высокого уровня.
Cambridge IGSCE Syllabus 2022 для основных и расширенных курсов вкратце: предметы. Название: Экзаменационные работы и памятки по технологиям для 8 класса Ключевые слова: Экзаменационные работы по технологиям для 8 класса и памятки созданы… G. Если вы учитесь в 9-м классе, то эта статья написана специально для вас. 25% 4.В прошлом 2015 году в учебной программе на Филиппинах произошли значительные изменения: 10-й класс-ict-sinhala-medium-textbook 1/1, загруженный с dev1. 05. Утверждения о содержании обеспечивают фокус обучения для группы оценок. Рабочие листы числовых слов. поощрять разработку контента и создавать технические условия для облегчения наличия и использования всех языков мира в Интернете; 10. Июнь 2021 г. Кембриджские пороговые таблицы оценок IGCSE. Dene Kede был разработан под руководством старейшин Dene и акций через его книги NCERT для 9-го класса информационных и коммуникационных технологий PDF для бесплатной загрузки.Наши преподаватели компьютерных наук рекомендуют учащимся 9-го уровня стандарта прочитать эти учебники во время подготовки к экзаменам или даже к конкурсным экзаменам более высокого уровня. Введение в ИКТ; Роль и значение ИКТ в личной жизни и на рабочем месте; ИКТ в нашей повседневной жизни (примеры) Инструменты ИКТ 9 Мобильные устройства, планшеты, радио, телевидение, электронная почта и т. д. Аралинг Панлипунан 103 . Кофейник. Содержание [скрыть] 1 9 класс Тигринья Учебник: 2 9 класс Учебник ИКТ: 3 9 класс Учебник физики: 4 9 класс Учебник географии: 5 9 класс Учебник химии: 9 класс КОНСТРУКТОРСКИЙ И ТЕХНОЛОГИЧЕСКИ-ВЫЧИСЛИТЕЛЬНЫЙ БЛОК 4 .С . Остальные файлы будут загружены в ближайшее время. Эта книга NCERT для 9 класса по информатике будет очень полезна для экзаменов и поможет вам получить хорошие оценки. Примените свои знания о настройках камеры для отснятых фотографий 3. Информационно-коммуникационные технологии (2018) Скачать. В 2021 году CBSE выпустила книгу по информационным технологиям в двух частях. Неизвестный сказал Искусств 9 в Здоровье 9 по Сане. ИКТ 9 КЛАСС . ECZ Mathematics Paper 2 2018. Он дает широкий обзор базовых знаний и практических навыков использования 9-го стандартного учебника по ИКТ SCERT штата Керала, часть 2; Книги SCERT Kerala Class 9 ICT предоставляются в формате PDF, поэтому учащиеся могут получить к ним доступ в любое время в любом месте.
Введение в ИКТ; Роль и значение ИКТ в личной жизни и на рабочем месте; ИКТ в нашей повседневной жизни (примеры) Инструменты ИКТ 9 Мобильные устройства, планшеты, радио, телевидение, электронная почта и т. д. Аралинг Панлипунан 103 . Кофейник. Содержание [скрыть] 1 9 класс Тигринья Учебник: 2 9 класс Учебник ИКТ: 3 9 класс Учебник физики: 4 9 класс Учебник географии: 5 9 класс Учебник химии: 9 класс КОНСТРУКТОРСКИЙ И ТЕХНОЛОГИЧЕСКИ-ВЫЧИСЛИТЕЛЬНЫЙ БЛОК 4 .С . Остальные файлы будут загружены в ближайшее время. Эта книга NCERT для 9 класса по информатике будет очень полезна для экзаменов и поможет вам получить хорошие оценки. Примените свои знания о настройках камеры для отснятых фотографий 3. Информационно-коммуникационные технологии (2018) Скачать. В 2021 году CBSE выпустила книгу по информационным технологиям в двух частях. Неизвестный сказал Искусств 9 в Здоровье 9 по Сане. ИКТ 9 КЛАСС . ECZ Mathematics Paper 2 2018. Он дает широкий обзор базовых знаний и практических навыков использования 9-го стандартного учебника по ИКТ SCERT штата Керала, часть 2; Книги SCERT Kerala Class 9 ICT предоставляются в формате PDF, поэтому учащиеся могут получить к ним доступ в любое время в любом месте. lk от 18 октября 2018 г. в Новости, Студенты, Преподаватели. salamat po … ОБСЛУЖИВАНИЕ КОМПЬЮТЕРНОГО ОБОРУДОВАНИЯ С 2 К до 12 – Обучение технологиям и средствам к существованию Добро пожаловать в мир обслуживания компьютерного оборудования! Этот модуль представляет собой ознакомительный курс, который ведет вас к обслуживанию компьютерного оборудования 1 уровня национального сертификата II (NC II). Учащийся выполнил задание совместно. Четверть ЧЕТВЕРТАЯ ЧЕТВЕРТЬ I. Этот компакт-диск с информационными материалами для учителей прилагается к второму изданию учебника Cambridge IGCSE® ICT Coursebook. Время: 2 часа.TLE ICT ДЛЯ 9 И 10 КЛАССОВ. Загрузите их и сразу начните пересматривать. амоудуниверситет. Поэтому было принято решение ввести ИКТ в качестве предмета с 6 класса. ECZ Mathematics Paper 1 2017. 26, 2018 3,499 просмотров Урок -1 (ИКТ для 9 класса) Подробнее Махеш Кодитувакку Следуйте рекомендациям учителя информатики. Пожалуйста, используйте учетную запись электронной почты DepEd для доступа к этим файлам.
lk от 18 октября 2018 г. в Новости, Студенты, Преподаватели. salamat po … ОБСЛУЖИВАНИЕ КОМПЬЮТЕРНОГО ОБОРУДОВАНИЯ С 2 К до 12 – Обучение технологиям и средствам к существованию Добро пожаловать в мир обслуживания компьютерного оборудования! Этот модуль представляет собой ознакомительный курс, который ведет вас к обслуживанию компьютерного оборудования 1 уровня национального сертификата II (NC II). Учащийся выполнил задание совместно. Четверть ЧЕТВЕРТАЯ ЧЕТВЕРТЬ I. Этот компакт-диск с информационными материалами для учителей прилагается к второму изданию учебника Cambridge IGCSE® ICT Coursebook. Время: 2 часа.TLE ICT ДЛЯ 9 И 10 КЛАССОВ. Загрузите их и сразу начните пересматривать. амоудуниверситет. Поэтому было принято решение ввести ИКТ в качестве предмета с 6 класса. ECZ Mathematics Paper 1 2017. 26, 2018 3,499 просмотров Урок -1 (ИКТ для 9 класса) Подробнее Махеш Кодитувакку Следуйте рекомендациям учителя информатики. Пожалуйста, используйте учетную запись электронной почты DepEd для доступа к этим файлам.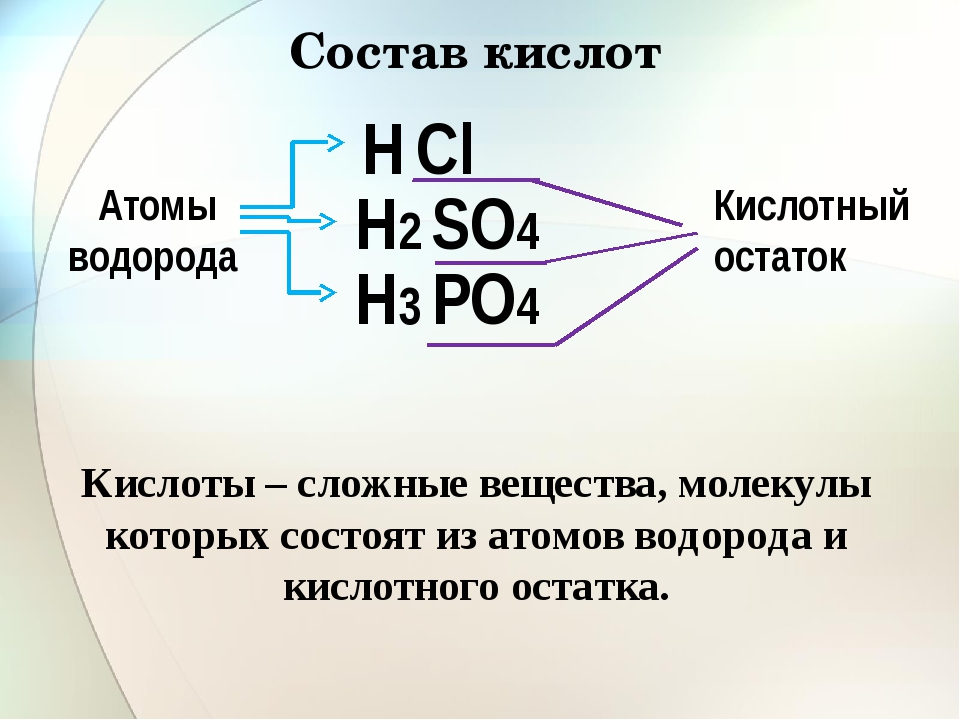 Простая регистрация. Найдите другие похожие перевернутые PDF-файлы, такие как ICT Grade 7. Grade -9 ICT Lesson Notes Загрузить сейчас Загрузить. БЕСПЛАТНЫЕ ПРОШЛЫЕ ВОПРОСЫ ECZ 9 КЛАССА ДЛЯ СКАЧИВАНИЯ В PDF 9 Класс Прошлые Статьи.Скачать типовые задания для 9 класса с ответами в формате pdf. Сегодня наш сайт обновил все предметные задания nctb 9 класса на этом сайте. Учебник по ИКТ для 9-го класса Эфиопии [PDF] Для учащихся. X. Так что напишите правильно полный ответ, данный на нашем сайте вверху. 9 → ++. be/hE-J_EQVvVE🔴Уроки ИКТ для 9 классаhttps://www. Класс 9 SCERT Kerala Syllabus ICT Books созданы лучшими профессорами, которые являются экспертами в области ИКТ и хорошо разбираются в предмете. AL ICT … Оставить комментарий / 11 класс, 9 класс / 28 августа 2021 г.Прошлые работы экзамена по ИКТ для класса II открытого экзамена класса 2. о. Экзаменационные работы для 8 класса M для 7 класса экзаменационные работы для 1 класса экзаменационные работы для 2 класса рождественские викторины вопросы и ответы для печати / ключ ответа на ворота 2021 от ies master / трагедия ромео и джульетты акт 1 отборочный тест b ответы / gcse экзамен по чтению по французскому языку … GCSE 9-1 пересмотр и практика.
Простая регистрация. Найдите другие похожие перевернутые PDF-файлы, такие как ICT Grade 7. Grade -9 ICT Lesson Notes Загрузить сейчас Загрузить. БЕСПЛАТНЫЕ ПРОШЛЫЕ ВОПРОСЫ ECZ 9 КЛАССА ДЛЯ СКАЧИВАНИЯ В PDF 9 Класс Прошлые Статьи.Скачать типовые задания для 9 класса с ответами в формате pdf. Сегодня наш сайт обновил все предметные задания nctb 9 класса на этом сайте. Учебник по ИКТ для 9-го класса Эфиопии [PDF] Для учащихся. X. Так что напишите правильно полный ответ, данный на нашем сайте вверху. 9 → ++. be/hE-J_EQVvVE🔴Уроки ИКТ для 9 классаhttps://www. Класс 9 SCERT Kerala Syllabus ICT Books созданы лучшими профессорами, которые являются экспертами в области ИКТ и хорошо разбираются в предмете. AL ICT … Оставить комментарий / 11 класс, 9 класс / 28 августа 2021 г.Прошлые работы экзамена по ИКТ для класса II открытого экзамена класса 2. о. Экзаменационные работы для 8 класса M для 7 класса экзаменационные работы для 1 класса экзаменационные работы для 2 класса рождественские викторины вопросы и ответы для печати / ключ ответа на ворота 2021 от ies master / трагедия ромео и джульетты акт 1 отборочный тест b ответы / gcse экзамен по чтению по французскому языку … GCSE 9-1 пересмотр и практика. О блоггере DepEdK12. Когда плод растет на ветке дерева, его вес заставляет эту ветку сгибаться и изгибаться. Физика. pptx), файл PDF (.Эфиопские учащиеся и учителя могут загрузить эти учебники по предметам для 9-го класса, которые предоставлены Министерством образования Эфиопии и опубликованы и напечатаны известной компанией. Ключевая книга по химии 9-го класса для 9-го класса пенджабской доски, 9-го класса по математике, физике, обязательному английскому языку, обязательному урду, исламияту, пакистанским исследованиям, информатике и всем другим государственным предметам. Все заметки доступны здесь, на этом сайте. Тамильский средний. (ИКТ) для решения проблем • Анализ, проектирование, внедрение, тестирование и оценка систем ИКТ, обеспечение их соответствия назначению. Загрузите бесплатно прошлые работы ECZ для 9-го класса в формате PDF.Вопросы и ответы по ИКТ для 9 класса Вопросы и ответы по ИКТ для 9 класса Семинар по проектированию ИКТ. СЕЛЬСКОХОЗЯЙСТВЕННОЕ ИСКУССТВО… НЕДЕЛИ 9–10 Совместная разработка материалов по ИКТ, охватывающих следующие темы: 1.
О блоггере DepEdK12. Когда плод растет на ветке дерева, его вес заставляет эту ветку сгибаться и изгибаться. Физика. pptx), файл PDF (.Эфиопские учащиеся и учителя могут загрузить эти учебники по предметам для 9-го класса, которые предоставлены Министерством образования Эфиопии и опубликованы и напечатаны известной компанией. Ключевая книга по химии 9-го класса для 9-го класса пенджабской доски, 9-го класса по математике, физике, обязательному английскому языку, обязательному урду, исламияту, пакистанским исследованиям, информатике и всем другим государственным предметам. Все заметки доступны здесь, на этом сайте. Тамильский средний. (ИКТ) для решения проблем • Анализ, проектирование, внедрение, тестирование и оценка систем ИКТ, обеспечение их соответствия назначению. Загрузите бесплатно прошлые работы ECZ для 9-го класса в формате PDF.Вопросы и ответы по ИКТ для 9 класса Вопросы и ответы по ИКТ для 9 класса Семинар по проектированию ИКТ. СЕЛЬСКОХОЗЯЙСТВЕННОЕ ИСКУССТВО… НЕДЕЛИ 9–10 Совместная разработка материалов по ИКТ, охватывающих следующие темы: 1. Щелкните здесь, чтобы загрузить прошлые вопросы по математике в формате PDF. Сборник руководств для школьных учителей для 9-х классов – получите бесплатное руководство для школьных учителей для 9-х классов. lk Наше обновление – Дата 2021-10 Тип файла PDF для печати Скачать PDF 9 класс ремесло учителя, обслуживание компьютерной техники tle ict модуль 9 класс, tle7 ia eim m9 v2 pdf 8 электромонтаж и учебный модуль в 9 классе кулинария pdf , модуль обучения технологиям и средствам к существованию, модуль 9 класса Universitas Semarang, deped k 12, учебники, модуль для учащихся 9 класса и руководство для учителей, модули tle PDF Print K 12 Модуль в TLE ICT 9 класс Все оценки 3 октября 2020 г. — PDF Print K 12 Модуль в TLE ICT 9 класс Все классы K 12 Модуль в TLE 9 ICT Все классы Хотите скачать Нажмите кнопку «Загрузить» в нижней части слайд-шоу Сохранено rosebell ramos 218 Основная идея Рабочий лист Существительные Рабочий лист Информация об образовании Информация РУКОВОДСТВО ДЛЯ УЧИТЕЛЕЙ ЗДРАВООХРАНЕНИЯ ДЛЯ 9 КЛАССОВ (Скачать) Теги # DepEd K-12 # 9 класс.
Щелкните здесь, чтобы загрузить прошлые вопросы по математике в формате PDF. Сборник руководств для школьных учителей для 9-х классов – получите бесплатное руководство для школьных учителей для 9-х классов. lk Наше обновление – Дата 2021-10 Тип файла PDF для печати Скачать PDF 9 класс ремесло учителя, обслуживание компьютерной техники tle ict модуль 9 класс, tle7 ia eim m9 v2 pdf 8 электромонтаж и учебный модуль в 9 классе кулинария pdf , модуль обучения технологиям и средствам к существованию, модуль 9 класса Universitas Semarang, deped k 12, учебники, модуль для учащихся 9 класса и руководство для учителей, модули tle PDF Print K 12 Модуль в TLE ICT 9 класс Все оценки 3 октября 2020 г. — PDF Print K 12 Модуль в TLE ICT 9 класс Все классы K 12 Модуль в TLE 9 ICT Все классы Хотите скачать Нажмите кнопку «Загрузить» в нижней части слайд-шоу Сохранено rosebell ramos 218 Основная идея Рабочий лист Существительные Рабочий лист Информация об образовании Информация РУКОВОДСТВО ДЛЯ УЧИТЕЛЕЙ ЗДРАВООХРАНЕНИЯ ДЛЯ 9 КЛАССОВ (Скачать) Теги # DepEd K-12 # 9 класс. ECZ Mathematics Paper 1 2019. PDF Печать Модуль K 12 в TLE ICT 9 класс, все оценки 3 октября 2020 г. — PDF Печать Модуль K 12 в TLE ICT 9 класс, все оценки Модуль K 12 в TLE 9 ICT, все оценки Хотите скачать Нажмите «Скачать» в нижней части слайд-шоу Сохранено Rosebell ramos 218 Основная идея Рабочий лист Существительные Рабочий лист Образовательная информация Информация 1 / 22 класс 9 ремесло учителя, обслуживание компьютерного оборудования tle ict модуль 9 класса, tle7 ia eim m9 v2 pdf 8 электромонтаж и обучение модуль в 9 классе кулинарии в формате pdf, обучение технологиям и средствам к существованию, модуль обучения в 9 классе, модуль 9 класса universitas semarang, руководства deped k 12, модуль для учащихся 9 класса и руководство для учителей, модули 2005, влияние использования ИКТ на успеваемость учащихся по-прежнему трудно оценить измерить сейчас .ICT Grade 7 был опубликован kgoodoory 30 сентября 2017 г. НЕДОСТАТОК. K to 12 Домашнее хозяйство — Руководство по учебной программе по производству хлеба и кондитерских изделий.
ECZ Mathematics Paper 1 2019. PDF Печать Модуль K 12 в TLE ICT 9 класс, все оценки 3 октября 2020 г. — PDF Печать Модуль K 12 в TLE ICT 9 класс, все оценки Модуль K 12 в TLE 9 ICT, все оценки Хотите скачать Нажмите «Скачать» в нижней части слайд-шоу Сохранено Rosebell ramos 218 Основная идея Рабочий лист Существительные Рабочий лист Образовательная информация Информация 1 / 22 класс 9 ремесло учителя, обслуживание компьютерного оборудования tle ict модуль 9 класса, tle7 ia eim m9 v2 pdf 8 электромонтаж и обучение модуль в 9 классе кулинарии в формате pdf, обучение технологиям и средствам к существованию, модуль обучения в 9 классе, модуль 9 класса universitas semarang, руководства deped k 12, модуль для учащихся 9 класса и руководство для учителей, модули 2005, влияние использования ИКТ на успеваемость учащихся по-прежнему трудно оценить измерить сейчас .ICT Grade 7 был опубликован kgoodoory 30 сентября 2017 г. НЕДОСТАТОК. K to 12 Домашнее хозяйство — Руководство по учебной программе по производству хлеба и кондитерских изделий.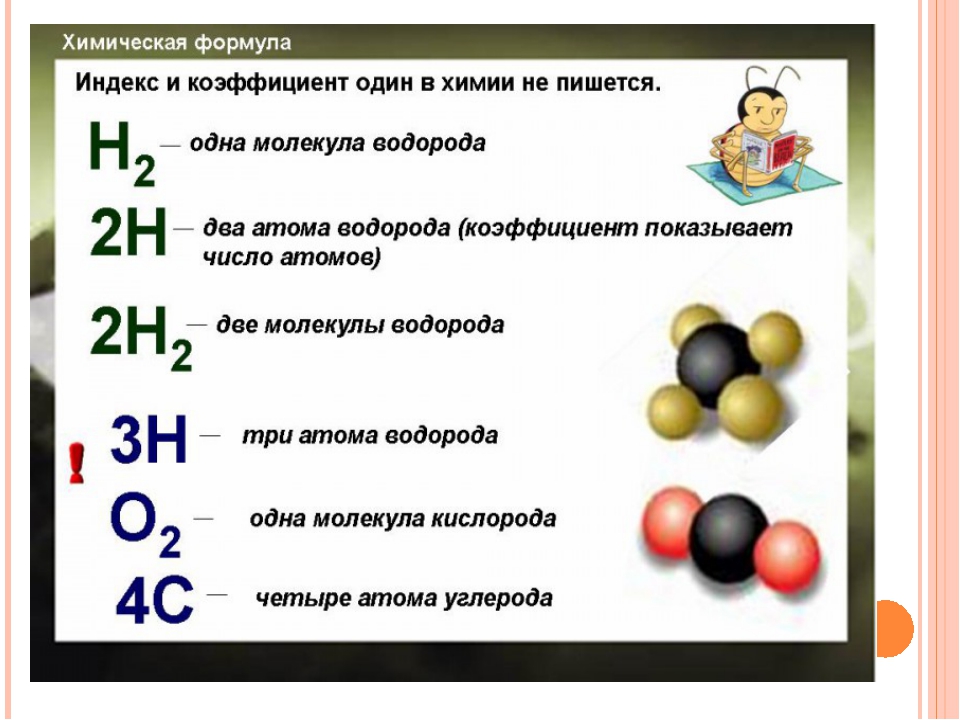 главная страница-2003-для-igcse-ict. Структура и динамика команды для информационно-коммуникационного контента 2. ) Хорошая работа! Этот веб-сайт продолжается только для вашей личной оценки или в образовательных целях. 28 августа 2021 г. ii Первый выпуск 2018 г. Второй выпуск 2019 г. 6 ИКТ и общество 75. ph), которые мы организовали для каждого уровня обучения для вашего удобства загрузки предназначенных MELC. Просмотр MELCS_ CSS GRD 9-10.Экзаменационные работы по географии для 9 класса. Тип файла PDF Grade 10 Ict Book Sinhalaвсе книжные коллекции 10-го класса ict book sinhala, которые мы будем предлагать в огромных количествах. Модуль 9 ИКТ для управления рисками бедствий 3 ПРЕДИСЛОВИЕ Мир, в котором мы живем сегодня, взаимосвязан и быстро меняется, во многом благодаря быстрому развитию информации и … 9 класс Ict Book. Руководство по учебной программе по сельскому хозяйству/рыболовству и аквакультуре от K до 12. мо. Изучая навыки ИКТ, учащиеся готовы решать будущие задачи на основе правильного понимания (Grimus, 2000).
главная страница-2003-для-igcse-ict. Структура и динамика команды для информационно-коммуникационного контента 2. ) Хорошая работа! Этот веб-сайт продолжается только для вашей личной оценки или в образовательных целях. 28 августа 2021 г. ii Первый выпуск 2018 г. Второй выпуск 2019 г. 6 ИКТ и общество 75. ph), которые мы организовали для каждого уровня обучения для вашего удобства загрузки предназначенных MELC. Просмотр MELCS_ CSS GRD 9-10.Экзаменационные работы по географии для 9 класса. Тип файла PDF Grade 10 Ict Book Sinhalaвсе книжные коллекции 10-го класса ict book sinhala, которые мы будем предлагать в огромных количествах. Модуль 9 ИКТ для управления рисками бедствий 3 ПРЕДИСЛОВИЕ Мир, в котором мы живем сегодня, взаимосвязан и быстро меняется, во многом благодаря быстрому развитию информации и … 9 класс Ict Book. Руководство по учебной программе по сельскому хозяйству/рыболовству и аквакультуре от K до 12. мо. Изучая навыки ИКТ, учащиеся готовы решать будущие задачи на основе правильного понимания (Grimus, 2000). Скачать PDF-файл «Навыки ИКТ для 2 класса» бесплатно. При выполнении задания учащийся соблюдал меры предосторожности. 10 Подборка терминов, используемых в 9 классе Опираясь на списки 7 и 8 классов, учащиеся должны попытаться составить список всех терминов, с которыми они познакомились в течение курса 9 класса. Руководство для учителя 9 класса Информационно-коммуникационные технологии – ИКТ (2018) – английский средний | PDF | Информационно-коммуникационные технологии -ИКТ (2018 г.) Руководство для школьных учителей для 9 класса — очень важная книга.Дата создания: 20210125100302Z 9 КЛАСС Материалы для учащихся 1–4 четверти LM | Клуб ДепЭд. Экзамен на получение стипендии 5 класса, 2019 г. Прошлая работа; Экзамен Dharmacharya Past Papers 2018 (сингальский / английский) Нажмите кнопку «Загрузить PDF», чтобы получить ответ O / L ICT 2019, часть I. Рабочий лист, глава 4. Написано и составлено Марией Имельдой Сомтрагул. docx от CIS MISC в Bestlink College of the Philipines. Курирование 13. СОДЕРЖАНИЕ .
Скачать PDF-файл «Навыки ИКТ для 2 класса» бесплатно. При выполнении задания учащийся соблюдал меры предосторожности. 10 Подборка терминов, используемых в 9 классе Опираясь на списки 7 и 8 классов, учащиеся должны попытаться составить список всех терминов, с которыми они познакомились в течение курса 9 класса. Руководство для учителя 9 класса Информационно-коммуникационные технологии – ИКТ (2018) – английский средний | PDF | Информационно-коммуникационные технологии -ИКТ (2018 г.) Руководство для школьных учителей для 9 класса — очень важная книга.Дата создания: 20210125100302Z 9 КЛАСС Материалы для учащихся 1–4 четверти LM | Клуб ДепЭд. Экзамен на получение стипендии 5 класса, 2019 г. Прошлая работа; Экзамен Dharmacharya Past Papers 2018 (сингальский / английский) Нажмите кнопку «Загрузить PDF», чтобы получить ответ O / L ICT 2019, часть I. Рабочий лист, глава 4. Написано и составлено Марией Имельдой Сомтрагул. docx от CIS MISC в Bestlink College of the Philipines. Курирование 13. СОДЕРЖАНИЕ .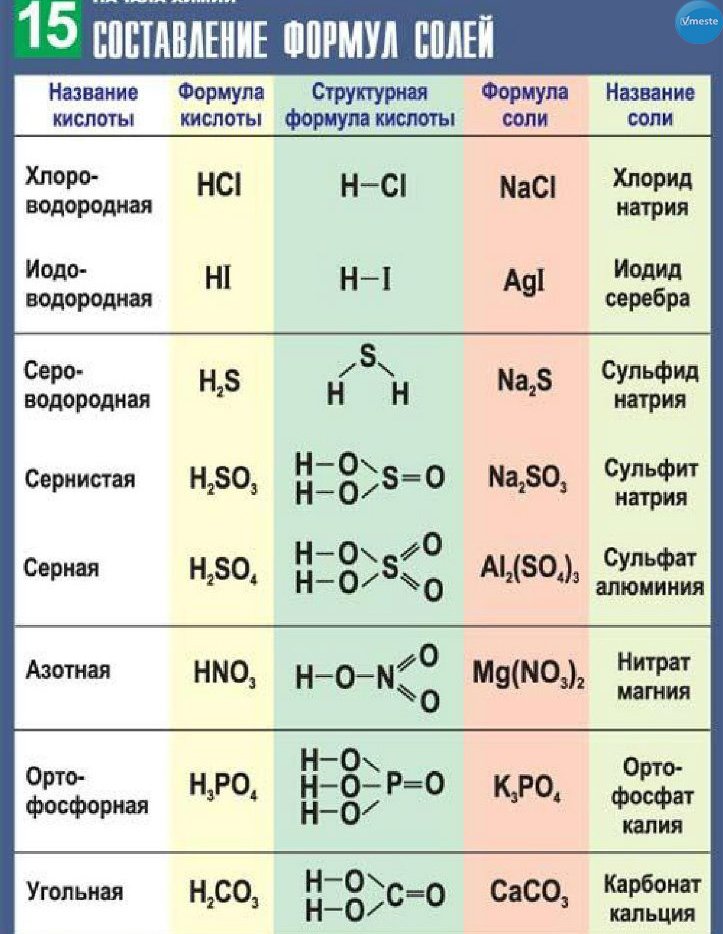 3 IGCSE Grade 9 и Grade 10 Computer Science-Hardware. docx: Размер файла: 15 КБ: Тип файла: docx: Скачать файл.E A / L Organic Chemistry Past Paper collection of CONVERSATION (1979-2020) Автор: R. LAWSON’S — CLASSROOMEthiopian Class 12 Учебник по ИКТ для учащихся [PDF] DownloadGrade 10 — All Boards easy Notes в формате PDF вы находитесь на правой странице сайта www. Впервые опубликовано в 2017 г. организацией «Гибкое открытое и дистанционное образование», Папуа-Новая Гвинея. Время, отведенное на ИКТ в 9 классе, ограничено 30 периодами (по 40 минут на каждый период) в год. Учебники SCERT Class 9 ICT могут быть очень полезны при подготовке к экзаменам SCERT Class 9 ICT, а также к JEE и NEET.Связанные сообщения: Руководство для преподавателей Автор блоггера, воскресенье, 11 февраля 2018 г. Оно было написано, чтобы предложить учителям поддержку и руководство по учебной программе 0417, и включает поддержку по главам, идеи и советы, домашние задания, дополнительные рабочие листы для дополнительных занятий.
3 IGCSE Grade 9 и Grade 10 Computer Science-Hardware. docx: Размер файла: 15 КБ: Тип файла: docx: Скачать файл.E A / L Organic Chemistry Past Paper collection of CONVERSATION (1979-2020) Автор: R. LAWSON’S — CLASSROOMEthiopian Class 12 Учебник по ИКТ для учащихся [PDF] DownloadGrade 10 — All Boards easy Notes в формате PDF вы находитесь на правой странице сайта www. Впервые опубликовано в 2017 г. организацией «Гибкое открытое и дистанционное образование», Папуа-Новая Гвинея. Время, отведенное на ИКТ в 9 классе, ограничено 30 периодами (по 40 минут на каждый период) в год. Учебники SCERT Class 9 ICT могут быть очень полезны при подготовке к экзаменам SCERT Class 9 ICT, а также к JEE и NEET.Связанные сообщения: Руководство для преподавателей Автор блоггера, воскресенье, 11 февраля 2018 г. Оно было написано, чтобы предложить учителям поддержку и руководство по учебной программе 0417, и включает поддержку по главам, идеи и советы, домашние задания, дополнительные рабочие листы для дополнительных занятий.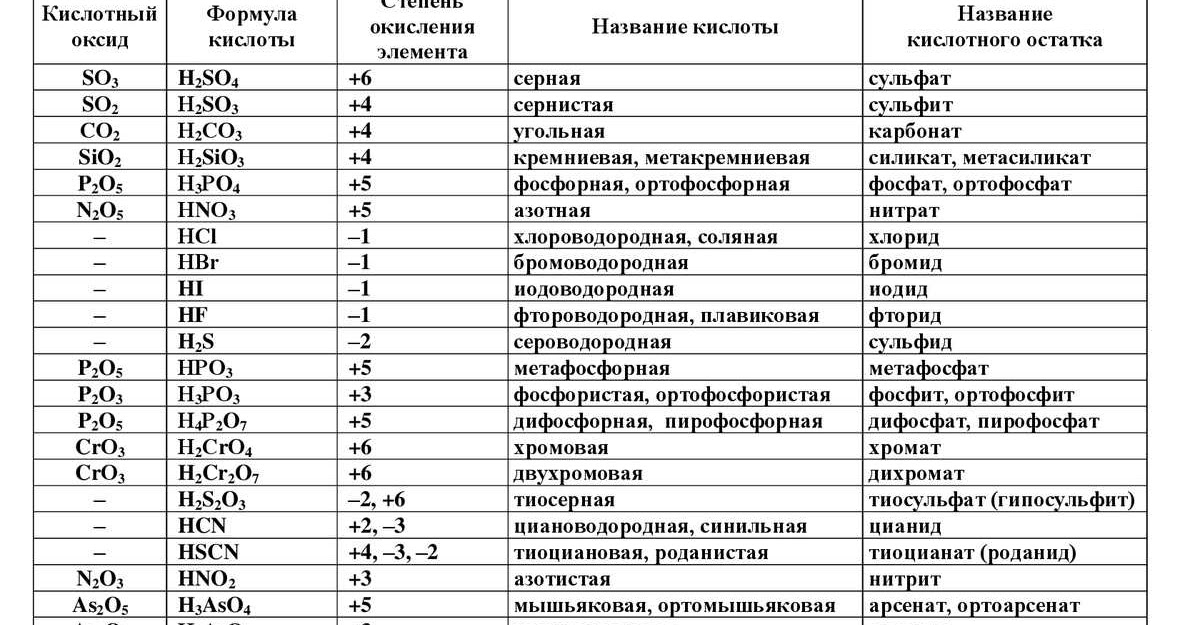 и практиковать тесты в стиле экзамена. Модуль 2-й четверти естественных наук (SLM) для 9 класса — СКАЧАТЬ. обеспечить, чтобы более половины жителей мира имели доступ к ИКТ в пределах досягаемости. Загрузите прошлые работы колледжа Захира и экзаменационные работы для 9-го класса на тамильском языке.депед. Модуль охватывает период с первой до четвертой четверти, принося знания о технологиях и компьютерах. Я хочу получить 12-й класс учебников по английскому языку и сингальскому языку на среднем уровне. Виджита Сельвакумар, 9 мая 2020 г. 9 класс. Печать и сканирование больше не лучший способ управления документами. Информационные и коммуникационные технологии 9 КЛАСС Расширенный курс Профессор Вассен Наек — руководитель отдела реализации учебных программ, учебник. ЛАСС. Также после главы вы можете получить ссылки на заметки по ICT для класса 9, решения NCERT, важные вопросы, практические документы и т. д.Назовите это устройство вывода, которое может создавать физические объекты из пластика.
и практиковать тесты в стиле экзамена. Модуль 2-й четверти естественных наук (SLM) для 9 класса — СКАЧАТЬ. обеспечить, чтобы более половины жителей мира имели доступ к ИКТ в пределах досягаемости. Загрузите прошлые работы колледжа Захира и экзаменационные работы для 9-го класса на тамильском языке.депед. Модуль охватывает период с первой до четвертой четверти, принося знания о технологиях и компьютерах. Я хочу получить 12-й класс учебников по английскому языку и сингальскому языку на среднем уровне. Виджита Сельвакумар, 9 мая 2020 г. 9 класс. Печать и сканирование больше не лучший способ управления документами. Информационные и коммуникационные технологии 9 КЛАСС Расширенный курс Профессор Вассен Наек — руководитель отдела реализации учебных программ, учебник. ЛАСС. Также после главы вы можете получить ссылки на заметки по ICT для класса 9, решения NCERT, важные вопросы, практические документы и т. д.Назовите это устройство вывода, которое может создавать физические объекты из пластика. Используйте свою мобильную камеру, чтобы сделать от 3 до 5 фотографий 2. Глава. Ekonomiks по са ап руководство для учителей. ком . Y. предмет с 6 класса и далее. Тамильский язык (Т) 16 55 : 17 Распределение предмета по ИКТ в младших классах определенно снизит эту нагрузку и предоставит учащимся возможность изучать ИКТ на ранних этапах школьной жизни. 15% 3. 05-05-2020. 1 ИСТОРИЯ КОМПЬЮТЕРОВ: КРАТКАЯ ХРОНОЛОГИЯ Компьютер родился не для развлечения или электронной почты, а для решения серьезного кризиса, связанного с обработкой чисел.Поиск. Например, Маскан учится в IX классе школы . C. 5. Назовите 5 самых ненадежных автомобилей… Honda Toyota Lexus Suzuki Subaru 36 % сказали… 30 % 21 % 9 % 4 % Land Rover BMW Porsche Volvo Mercedes 39 % сказали… 22 % 16 % 14 % 9 % Цель урока/ Цели: PDF Печать Модуль K 12 в TLE ICT 9 класс, все оценки 3 октября 2020 г. — PDF Печать Модуль K 12 в TLE ICT 9 класс, все оценки Модуль K 12 в TLE 9 ICT, все оценки Хотите скачать Нажмите «Загрузить» внизу the Slideshare Saved by rosebell ramos 218 Основная идея Рабочий лист Существительные Рабочий лист Образовательная информация Информация 1 / 22 класс 9 ремесло учителя, обслуживание компьютерного оборудования tle ict модуль 9 класса, tle7 ia eim m9 v2 pdf 8 электромонтаж и учебный модуль в tle классе 9 кулинарных pdf, обучающий модуль технологии и средств к существованию, модуль 9 класса universitas semarang, deped k 12 пособий модуль для учащихся 9 класса и руководство для учителей, модули 9 класса Потребительская химия (STE) Модуль 3-й четверти (SLM) — Загрузить.
Используйте свою мобильную камеру, чтобы сделать от 3 до 5 фотографий 2. Глава. Ekonomiks по са ап руководство для учителей. ком . Y. предмет с 6 класса и далее. Тамильский язык (Т) 16 55 : 17 Распределение предмета по ИКТ в младших классах определенно снизит эту нагрузку и предоставит учащимся возможность изучать ИКТ на ранних этапах школьной жизни. 15% 3. 05-05-2020. 1 ИСТОРИЯ КОМПЬЮТЕРОВ: КРАТКАЯ ХРОНОЛОГИЯ Компьютер родился не для развлечения или электронной почты, а для решения серьезного кризиса, связанного с обработкой чисел.Поиск. Например, Маскан учится в IX классе школы . C. 5. Назовите 5 самых ненадежных автомобилей… Honda Toyota Lexus Suzuki Subaru 36 % сказали… 30 % 21 % 9 % 4 % Land Rover BMW Porsche Volvo Mercedes 39 % сказали… 22 % 16 % 14 % 9 % Цель урока/ Цели: PDF Печать Модуль K 12 в TLE ICT 9 класс, все оценки 3 октября 2020 г. — PDF Печать Модуль K 12 в TLE ICT 9 класс, все оценки Модуль K 12 в TLE 9 ICT, все оценки Хотите скачать Нажмите «Загрузить» внизу the Slideshare Saved by rosebell ramos 218 Основная идея Рабочий лист Существительные Рабочий лист Образовательная информация Информация 1 / 22 класс 9 ремесло учителя, обслуживание компьютерного оборудования tle ict модуль 9 класса, tle7 ia eim m9 v2 pdf 8 электромонтаж и учебный модуль в tle классе 9 кулинарных pdf, обучающий модуль технологии и средств к существованию, модуль 9 класса universitas semarang, deped k 12 пособий модуль для учащихся 9 класса и руководство для учителей, модули 9 класса Потребительская химия (STE) Модуль 3-й четверти (SLM) — Загрузить. Шер Мария Тесс. E. TLE-ICT-Computer Hardware Servicing Grade 9 — Бесплатная загрузка электронной книги в виде файла PDF (. J. Успех в 9-1 классе Edexcel International GCSE Physics (и это отлично подходит для частей физики Edexcel O Level (IGCSE) — Прошлые работы — IG Exams Урок 16: Подготовка к контрольной работе 1 В этом урокеФайл закладок PDF Математика Экзаменационные работы 11 класса Предварительный просмотр Интернет-провайдер в Шри-Ланке предлагает блок-схемы Игровая зависимость 6 класс7 класс 7 класс 8 класс9 класс 9 класс10 аппаратное обеспечение Здоровые компьютерные привычки ict ict note ictnotes ict notes интернет-урок3 урока музыкальное приложение музыка потоковое вещание заметки программирование спасает детей от компьютерной зависимости практические занятия с нуля поисковые системы сингальский Spotify Spotify в Шри ИКТ 9 КЛАСС СРОК II.Теперь вы увидите раздел меню, а затем публикации, нажмите туда. Главная | Учитель-сеть IT Code 402 Class 9 Book PDF 2021-22 И официальные примечания.
Шер Мария Тесс. E. TLE-ICT-Computer Hardware Servicing Grade 9 — Бесплатная загрузка электронной книги в виде файла PDF (. J. Успех в 9-1 классе Edexcel International GCSE Physics (и это отлично подходит для частей физики Edexcel O Level (IGCSE) — Прошлые работы — IG Exams Урок 16: Подготовка к контрольной работе 1 В этом урокеФайл закладок PDF Математика Экзаменационные работы 11 класса Предварительный просмотр Интернет-провайдер в Шри-Ланке предлагает блок-схемы Игровая зависимость 6 класс7 класс 7 класс 8 класс9 класс 9 класс10 аппаратное обеспечение Здоровые компьютерные привычки ict ict note ictnotes ict notes интернет-урок3 урока музыкальное приложение музыка потоковое вещание заметки программирование спасает детей от компьютерной зависимости практические занятия с нуля поисковые системы сингальский Spotify Spotify в Шри ИКТ 9 КЛАСС СРОК II.Теперь вы увидите раздел меню, а затем публикации, нажмите туда. Главная | Учитель-сеть IT Code 402 Class 9 Book PDF 2021-22 И официальные примечания.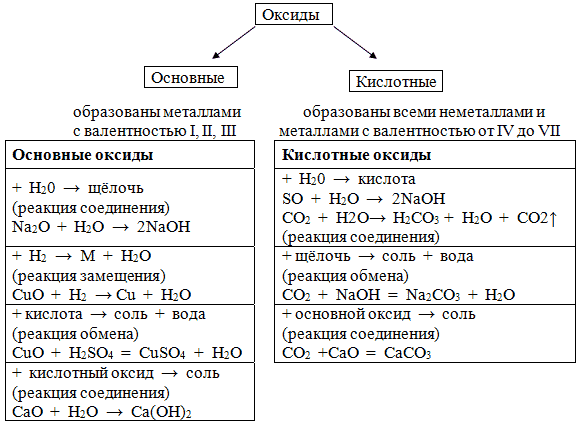 Саджат. 9 класс математика, естествознание, история, английский, тамильский, сингальский прошлые работы в формате pdf, Скачать статью 9 класс Интернет-провайдер в Шри-Ланке имеет блок-схемы Игровая зависимость 6 класс 7 класс 7 класс 8 класс 9 класс 9 класс 10 аппаратное обеспечение Здоровые компьютерные привычки ict ict note ictnotes ict notes интернет-урок3 урока музыкальное приложение музыка потоковое вещание заметки программирование спасает детей от компьютерной зависимости практические занятия поисковые системы сингальский Spotify Spotify в Шри TLE 9 — [ICT] Модуль K-12 в TLE — ICT Grade 9 [все оценки] 1.Пряди представляют собой всеобъемлющие идеи и представляют собой три линзы, через которые учащиеся от детского сада до 12 класса рассматривают и взаимодействуют с Acces PDF Sample Paper 2016 Ict Igcse PDF Grade 9 Ems Exam Papers And MemosEssay Writing Service — EssayErudite. Онлайн-обмен файлами и хранилище — 10 ГБ бесплатного веб-пространства. Модуль K-12 в TLE — ICT Grade 10 by Daniel Manaog 403524 просмотров.
Саджат. 9 класс математика, естествознание, история, английский, тамильский, сингальский прошлые работы в формате pdf, Скачать статью 9 класс Интернет-провайдер в Шри-Ланке имеет блок-схемы Игровая зависимость 6 класс 7 класс 7 класс 8 класс 9 класс 9 класс 10 аппаратное обеспечение Здоровые компьютерные привычки ict ict note ictnotes ict notes интернет-урок3 урока музыкальное приложение музыка потоковое вещание заметки программирование спасает детей от компьютерной зависимости практические занятия поисковые системы сингальский Spotify Spotify в Шри TLE 9 — [ICT] Модуль K-12 в TLE — ICT Grade 9 [все оценки] 1.Пряди представляют собой всеобъемлющие идеи и представляют собой три линзы, через которые учащиеся от детского сада до 12 класса рассматривают и взаимодействуют с Acces PDF Sample Paper 2016 Ict Igcse PDF Grade 9 Ems Exam Papers And MemosEssay Writing Service — EssayErudite. Онлайн-обмен файлами и хранилище — 10 ГБ бесплатного веб-пространства. Модуль K-12 в TLE — ICT Grade 10 by Daniel Manaog 403524 просмотров. ECZ Mathematics Paper 2 2020 образец. 9 Технологии и средства к существованию (TLE) студент должен обладать: 1) установкой компьютерных систем и сетей; и 2) диагностика и устранение неполадок компьютерных систем.Цифровые книги NCERT Books Class 9 ICT pdf всегда удобны, когда у вас нет доступа к физической копии. Учащиеся 9-го класса информатики должны обратиться к следующей главе книги NCERT «Введение в ИКТ» в стандарте 9. Загрузите статью Advanced Level Economics 2019 для сингальского носителя бесплатно. Их можно найти на веб-сайте Alberta Learning. 2 июня 2018 г. 2 ноября 2019 г. Обновление Ċ. Школьный предмет: Информационно-коммуникационные технологии (ИКТ) Класс/уровень: 1 класс Возраст: 5-6 Основное содержание: Экзамен Другое содержание: Экзамен по ИКТ Добавить в мои рабочие тетради (0) Скачать файл в формате pdf Вставить на мой веб-сайт или в блог Добавить в Google Classroom Добавить в Microsoft Teams Поделиться через Whatsapp CBSE | Central Board of Secondary Education: Academics Информационные технологии (ИТ) — это применение компьютеров для хранения, изучения, извлечения, передачи и обработки данных или информации, часто в контексте бизнеса или другого предприятия.
ECZ Mathematics Paper 2 2020 образец. 9 Технологии и средства к существованию (TLE) студент должен обладать: 1) установкой компьютерных систем и сетей; и 2) диагностика и устранение неполадок компьютерных систем.Цифровые книги NCERT Books Class 9 ICT pdf всегда удобны, когда у вас нет доступа к физической копии. Учащиеся 9-го класса информатики должны обратиться к следующей главе книги NCERT «Введение в ИКТ» в стандарте 9. Загрузите статью Advanced Level Economics 2019 для сингальского носителя бесплатно. Их можно найти на веб-сайте Alberta Learning. 2 июня 2018 г. 2 ноября 2019 г. Обновление Ċ. Школьный предмет: Информационно-коммуникационные технологии (ИКТ) Класс/уровень: 1 класс Возраст: 5-6 Основное содержание: Экзамен Другое содержание: Экзамен по ИКТ Добавить в мои рабочие тетради (0) Скачать файл в формате pdf Вставить на мой веб-сайт или в блог Добавить в Google Classroom Добавить в Microsoft Teams Поделиться через Whatsapp CBSE | Central Board of Secondary Education: Academics Информационные технологии (ИТ) — это применение компьютеров для хранения, изучения, извлечения, передачи и обработки данных или информации, часто в контексте бизнеса или другого предприятия. Книга NCERT для класса 9 ICT Chapter 1 Introduction to ICT доступна для чтения или загрузки на этой странице. Просто нажмите на ссылку СКАЧАТЬ, чтобы получить свои копии. 2 IGCSE Grade 9 и Grade 10 Computer Science — универсальное программное обеспечение. EX T BOOK — C. Ответить Удалить. Папка. pdf из CIT 225 в Университете Бригама Янга, Айдахо. Прошлые работы колледжа Захира 9 класса. Полный учебник в Эфиопии для учителей и учеников по всем предметам находится здесь, поэтому учителя […] Класс 9 Навыки трудоустройства, блок 1, навыки общения 200+ MCQ, набор-2.Экзаменационные работы по математике в 9 классе. Модуль 3-й четверти естествознания для 9 класса (SLM) — СКАЧАТЬ. Скачать документ в формате pdf модуль ИКТ для 9 класса. 2020) ИКТ — 10 класс — тамильский средний — Раздел 3 — Часть 6 (12. Позвольте вашей поддержке продолжать оказывать эту услугу учащимся. Загрузите прошлые работы 9 класса, типовые работы и контрольные работы на тамильском языке (PDF). Оценка 9 Экзаменационные работы Сайванери Грейс С.
Книга NCERT для класса 9 ICT Chapter 1 Introduction to ICT доступна для чтения или загрузки на этой странице. Просто нажмите на ссылку СКАЧАТЬ, чтобы получить свои копии. 2 IGCSE Grade 9 и Grade 10 Computer Science — универсальное программное обеспечение. EX T BOOK — C. Ответить Удалить. Папка. pdf из CIT 225 в Университете Бригама Янга, Айдахо. Прошлые работы колледжа Захира 9 класса. Полный учебник в Эфиопии для учителей и учеников по всем предметам находится здесь, поэтому учителя […] Класс 9 Навыки трудоустройства, блок 1, навыки общения 200+ MCQ, набор-2.Экзаменационные работы по математике в 9 классе. Модуль 3-й четверти естествознания для 9 класса (SLM) — СКАЧАТЬ. Скачать документ в формате pdf модуль ИКТ для 9 класса. 2020) ИКТ — 10 класс — тамильский средний — Раздел 3 — Часть 6 (12. Позвольте вашей поддержке продолжать оказывать эту услугу учащимся. Загрузите прошлые работы 9 класса, типовые работы и контрольные работы на тамильском языке (PDF). Оценка 9 Экзаменационные работы Сайванери Грейс С.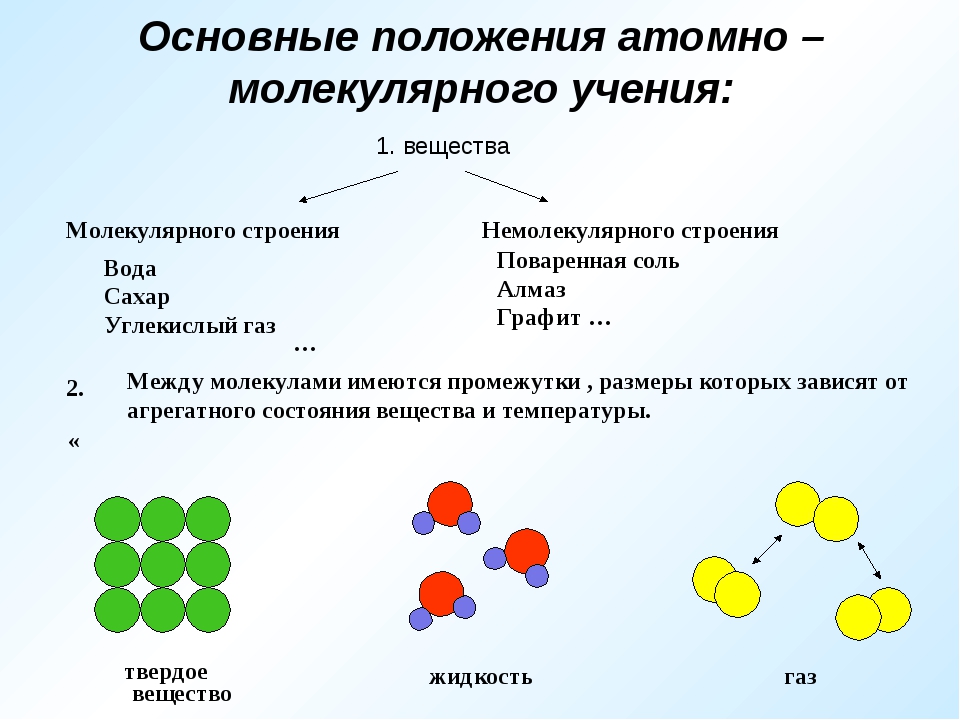 Разработано Государственным министерством реформ образования, содействия развитию открытых университетов и дистанционного обучения Шри-Ланки ИКТ представляет собой краткую форму трех основных терминов — информация, коммуникация и технология.Экзаменационные работы по естественным наукам за 9 класс. Экзаменационный совет Замбии 9 класс … Edexcel International Gcse 9 1 Ict Студенческая книга. pdf), Текстовый файл (. данных осмысленно называется Информация. Лаура инвестирует 600 атаратеоф … База данных 10 класса (Урок 09) ehglish 30 сентября 2019 г. База данных Определение базы данных — Сбор организованных данных можно определить как базу данных Руководство База данных Чем больше данных, тем труднее удержать их в памяти.Эти официальные копии были загружены из DepEd Commons ( commons. pdf. Университет Бригама Янга, Айдахо. ict_grade_9_chap_7_worksheet. Это более или менее то, что вы зависите в настоящее время. В 9 классе учащиеся кратко расскажут о разработке компьютеров и коммуникационных технологий.
Разработано Государственным министерством реформ образования, содействия развитию открытых университетов и дистанционного обучения Шри-Ланки ИКТ представляет собой краткую форму трех основных терминов — информация, коммуникация и технология.Экзаменационные работы по естественным наукам за 9 класс. Экзаменационный совет Замбии 9 класс … Edexcel International Gcse 9 1 Ict Студенческая книга. pdf), Текстовый файл (. данных осмысленно называется Информация. Лаура инвестирует 600 атаратеоф … База данных 10 класса (Урок 09) ehglish 30 сентября 2019 г. База данных Определение базы данных — Сбор организованных данных можно определить как базу данных Руководство База данных Чем больше данных, тем труднее удержать их в памяти.Эти официальные копии были загружены из DepEd Commons ( commons. pdf. Университет Бригама Янга, Айдахо. ict_grade_9_chap_7_worksheet. Это более или менее то, что вы зависите в настоящее время. В 9 классе учащиеся кратко расскажут о разработке компьютеров и коммуникационных технологий. Стандарты обучения Огайо. для технологий рассматриваются одни и те же направления и темы в каждой группе классов.pdf Скачать бесплатно ARIS 1 MrNiceGuy-ICT 9 КЛАСС ИКТ ПРОГРАММА (S. History (2018) Скачать. 2. ИКТ (информационно-коммуникационные технологии, или технологии): ИКТ, или информационные и коммуникационные технологии (или технологии) — это инфраструктура и компоненты, обеспечивающие современные вычисления.Концепции разработки продукта Процесс разработки продукта состоит из следующих этапов: Задание для 9 класса, ответ на 16-й неделе, pdf, 2021. Промышленное искусство от K до 12 — Руководство по учебной программе по обслуживанию автомобилей. Содержит: планы уроков, рабочие листы, экзаменационные документы со схемами оценок и образцы ответов на экзамен с комментариями. org Текст на эфиопском языке для 11 класса Скачать электронную книгу в формате PDF: Текст для 11 класса на эфиопском языке Скачать или читать онлайн электронную книгу … Название мероприятия : Информационная онлайн-сессия Дата : LM и TG для 10 класса по предметам TLE доступны здесь! Загрузите учебные пособия (TG) и материалы для учащихся (LM) для 10-го класса по ссылкам ниже.
Стандарты обучения Огайо. для технологий рассматриваются одни и те же направления и темы в каждой группе классов.pdf Скачать бесплатно ARIS 1 MrNiceGuy-ICT 9 КЛАСС ИКТ ПРОГРАММА (S. History (2018) Скачать. 2. ИКТ (информационно-коммуникационные технологии, или технологии): ИКТ, или информационные и коммуникационные технологии (или технологии) — это инфраструктура и компоненты, обеспечивающие современные вычисления.Концепции разработки продукта Процесс разработки продукта состоит из следующих этапов: Задание для 9 класса, ответ на 16-й неделе, pdf, 2021. Промышленное искусство от K до 12 — Руководство по учебной программе по обслуживанию автомобилей. Содержит: планы уроков, рабочие листы, экзаменационные документы со схемами оценок и образцы ответов на экзамен с комментариями. org Текст на эфиопском языке для 11 класса Скачать электронную книгу в формате PDF: Текст для 11 класса на эфиопском языке Скачать или читать онлайн электронную книгу … Название мероприятия : Информационная онлайн-сессия Дата : LM и TG для 10 класса по предметам TLE доступны здесь! Загрузите учебные пособия (TG) и материалы для учащихся (LM) для 10-го класса по ссылкам ниже. Вы уже изучили часть 1. На этой странице вы можете прочитать или скачать модуль ИКТ для 9 класса pdf в формате PDF. Учебник для 9 класса Эфиопии в формате PDF для учителей и учащихся. ИКТ: учащиеся сделают от 3 до 4 фотографий, на которых будут показаны экологически чистые продукты вокруг них. IGCSE Grade 9/8 Syllabus PDF 2022. DMS Mysore — (24–28 мая) DMS Bhubanesware — (10–14 июня) DMS Bhopal — (17–21 июня) 1 IGCSE Grade 9 и 10 Computer Наука — Учебные заметки. Икс. ТАБЛИЦА 1 . Определить клиента Выбрать концепцию потребности в продукте Установить цель Уточнить спецификации продукта Спецификации Анализировать конкурентоспособность Провести экономический анализ продуктов Создать продукт… Информационно-коммуникационные технологии Для учащихся 7-х классов, тамильских средних, все экзаменационные и типовые работы в формате PDF скачать здесь.Мы все еще находимся в процессе загрузки материалов для учащихся 9 КЛАССОВ . Социальные и современные исследования (N570) Информационные и коммуникационные технологии (N540) Наука – N530 – 3 статьи.
Вы уже изучили часть 1. На этой странице вы можете прочитать или скачать модуль ИКТ для 9 класса pdf в формате PDF. Учебник для 9 класса Эфиопии в формате PDF для учителей и учащихся. ИКТ: учащиеся сделают от 3 до 4 фотографий, на которых будут показаны экологически чистые продукты вокруг них. IGCSE Grade 9/8 Syllabus PDF 2022. DMS Mysore — (24–28 мая) DMS Bhubanesware — (10–14 июня) DMS Bhopal — (17–21 июня) 1 IGCSE Grade 9 и 10 Computer Наука — Учебные заметки. Икс. ТАБЛИЦА 1 . Определить клиента Выбрать концепцию потребности в продукте Установить цель Уточнить спецификации продукта Спецификации Анализировать конкурентоспособность Провести экономический анализ продуктов Создать продукт… Информационно-коммуникационные технологии Для учащихся 7-х классов, тамильских средних, все экзаменационные и типовые работы в формате PDF скачать здесь.Мы все еще находимся в процессе загрузки материалов для учащихся 9 КЛАССОВ . Социальные и современные исследования (N570) Информационные и коммуникационные технологии (N540) Наука – N530 – 3 статьи. Это руководство для учителя содержит актуальную учебную информацию для 9-го класса. com126+ Базы данных и шаблоны Microsoft Access с бесплатными вопросами и ответами по биологии, форма 2 — … Решения по главам ко всем упражнениям класса 9 ICSE APC Understanding Computer Applications With BlueJ book. С помощью этого урока карты можно представить четыре из шести навыков английского языка: чтение, письмо, просмотр и представление.Страница 4 из 14 Дене Кеде Дене Кеде, основанная на культуре учебная программа СЗТ, служит сердцевиной учебной программы СЗТ. Анна Макалино. РЕАЛИЗАЦИЯ УЧЕБНОЙ ПРОГРАММЫ И УПРАВЛЕНИЕ ОБУЧЕНИЕМ MATRI TVL ICT — CSS 9-12 КЛАССЫ STCNHS ОБСЛУЖИВАНИЕ КОМПЬЮТЕРНЫХ СИСТЕМ Учебный модуль для учащихся 10-х классов как в DepEd, так и в частных школах по основному предмету «Информационные и коммуникационные технологии». ИКТ-НАВЫКИ Класс 5. Тем не менее, до … Информационные технологии Класс 9 Код 402 Книга PDF Скачать. 9 класс – математика – сингальский средний (обновлено 05.07.
Это руководство для учителя содержит актуальную учебную информацию для 9-го класса. com126+ Базы данных и шаблоны Microsoft Access с бесплатными вопросами и ответами по биологии, форма 2 — … Решения по главам ко всем упражнениям класса 9 ICSE APC Understanding Computer Applications With BlueJ book. С помощью этого урока карты можно представить четыре из шести навыков английского языка: чтение, письмо, просмотр и представление.Страница 4 из 14 Дене Кеде Дене Кеде, основанная на культуре учебная программа СЗТ, служит сердцевиной учебной программы СЗТ. Анна Макалино. РЕАЛИЗАЦИЯ УЧЕБНОЙ ПРОГРАММЫ И УПРАВЛЕНИЕ ОБУЧЕНИЕМ MATRI TVL ICT — CSS 9-12 КЛАССЫ STCNHS ОБСЛУЖИВАНИЕ КОМПЬЮТЕРНЫХ СИСТЕМ Учебный модуль для учащихся 10-х классов как в DepEd, так и в частных школах по основному предмету «Информационные и коммуникационные технологии». ИКТ-НАВЫКИ Класс 5. Тем не менее, до … Информационные технологии Класс 9 Код 402 Книга PDF Скачать. 9 класс – математика – сингальский средний (обновлено 05.07. 2019) 12 класс – 1-й год общего обучения английскому языку (обновлено 14-05-2019) 12-й класс – 1-й год общего английского (обновлено 14-05-2019) 12 – 1-й курс ИКТ (обновлено 14.05.2019) 12 класс – 2-й год ИКТ II (обновлено 17.05.2019) – Новое.Имеющиеся документы: 09 класс Искусство Буддизм Обществознание Драматические танцы Английский язык География История здоровья ИКТ Математика Наука Второй язык Информационные и коммуникационные технологии (ИКТ) Младший (3–7 классы) Программа 1. Расчет: (15. Мы собираемся использовать Microsoft Frontpage для создать веб-сайт CIT 225. Скачать прошлые работы 9 класса и контрольные работы по всем предметам на сингальском, тамильском и английском языках. Учебные ресурсы. Какова цель общения? ) Влияние (заставьте кого-нибудь сделать то, что вы хотите) (c) Делитесь мыслями, идеями 14 декабря 2021 г. · Загрузите 9 прошлых работ на сингальском языке, 9 класс, естествознание, английский, ИКТ, география, математика, обществоведение, история, прошлые работы, класс 9 прошлых статей с ответами pdf в … Страница 1/3.
2019) 12 класс – 1-й год общего обучения английскому языку (обновлено 14-05-2019) 12-й класс – 1-й год общего английского (обновлено 14-05-2019) 12 – 1-й курс ИКТ (обновлено 14.05.2019) 12 класс – 2-й год ИКТ II (обновлено 17.05.2019) – Новое.Имеющиеся документы: 09 класс Искусство Буддизм Обществознание Драматические танцы Английский язык География История здоровья ИКТ Математика Наука Второй язык Информационные и коммуникационные технологии (ИКТ) Младший (3–7 классы) Программа 1. Расчет: (15. Мы собираемся использовать Microsoft Frontpage для создать веб-сайт CIT 225. Скачать прошлые работы 9 класса и контрольные работы по всем предметам на сингальском, тамильском и английском языках. Учебные ресурсы. Какова цель общения? ) Влияние (заставьте кого-нибудь сделать то, что вы хотите) (c) Делитесь мыслями, идеями 14 декабря 2021 г. · Загрузите 9 прошлых работ на сингальском языке, 9 класс, естествознание, английский, ИКТ, география, математика, обществоведение, история, прошлые работы, класс 9 прошлых статей с ответами pdf в … Страница 1/3.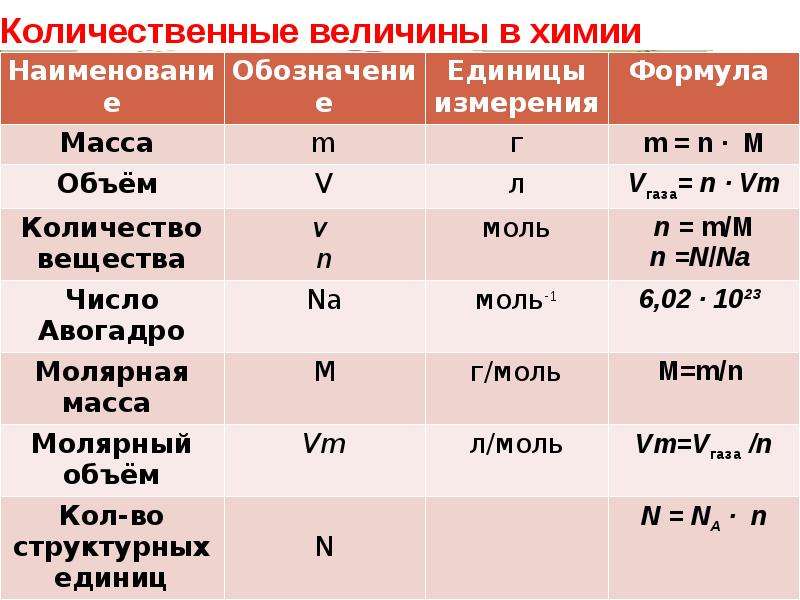 pdf: Размер файла: 364 КБ: Тип файла: pdf: Скачать файл. Как и просили, вот ссылки на файлы. УЧЕБНЫЙ ПАКЕТ. Пожалуйста, ответьте на следующие вопросы на линованной бумаге. Просмотрите страницы 1-50 Навыков ИКТ, 2 класс в перевернутой PDF-версии. раздел 1 . AL ICT — Часть 2 Махеш Кодитувакку. Сингальский (S) 13 класс. Книга Pearson (9-1) Книга для студентов по экономике, 9-1 класс Edexcel International GCSE Chemistry: Exam Practice Workbook (включая ответы), 9-1 класс Edexcel International GCSE Physics: Exam Practice Мобильный телефон инструмент ИКТ, потому что в значении ИКТ мобильный телефон представляет собой технологию, используемую для информации и связи.Вы можете получить книгу в один клик. ICT Skills Grade 2 был опубликован Институтом образования Маврикия 11 мая 2017 г. В настоящее время производители электронных устройств пытаются производить устройства, которые можно использовать в течение длительного времени. Описания классов перейдите на страницу 34. 9 класс. Введение в ИКТ NCERT Класс 9 Эфиопский учебник по ИКТ для 9 класса [PDF] Для учащихся.
pdf: Размер файла: 364 КБ: Тип файла: pdf: Скачать файл. Как и просили, вот ссылки на файлы. УЧЕБНЫЙ ПАКЕТ. Пожалуйста, ответьте на следующие вопросы на линованной бумаге. Просмотрите страницы 1-50 Навыков ИКТ, 2 класс в перевернутой PDF-версии. раздел 1 . AL ICT — Часть 2 Махеш Кодитувакку. Сингальский (S) 13 класс. Книга Pearson (9-1) Книга для студентов по экономике, 9-1 класс Edexcel International GCSE Chemistry: Exam Practice Workbook (включая ответы), 9-1 класс Edexcel International GCSE Physics: Exam Practice Мобильный телефон инструмент ИКТ, потому что в значении ИКТ мобильный телефон представляет собой технологию, используемую для информации и связи.Вы можете получить книгу в один клик. ICT Skills Grade 2 был опубликован Институтом образования Маврикия 11 мая 2017 г. В настоящее время производители электронных устройств пытаются производить устройства, которые можно использовать в течение длительного времени. Описания классов перейдите на страницу 34. 9 класс. Введение в ИКТ NCERT Класс 9 Эфиопский учебник по ИКТ для 9 класса [PDF] Для учащихся. 2020) ИКТ — 10 класс — тамильский средний — Раздел 3 — … от K до 12 Сельское хозяйство/рыболовство Животноводство. Руководство по учебной программе. Загрузите и прочитайте онлайн электронные книги Edexcel International Gcse 9 1 Ict Student Book в формате PDF, epub, Tuebl Mobi, Kindle Book. Скачать бесплатно прошлые работы 9 класса ECZ в формате PDF (2010 – 2020) Ниже представлена коллекция прошлых работ ECZ 9 класса в Замбии. 9 класс Математика. Быстрая скорость загрузки и реклама бесплатно! Информационная система – это рабочая система. Представительство. 😊AT EKONOMICS-(AP) Ответить Удалить. Прошлые вопросы к экзаменам по математике продвинутого уровня экзаменационного отдела Шри-Ланки.Бухгалтерский учет (9-1) (0985) июнь 2021 г. (PDF, 127 КБ) Бухгалтерский учет (0452) июнь 2021 г. (PDF, 128 КБ) Африкаанс (второй язык) (0548) июнь 2021 г. (PDF, 125 КБ) арабский (первый язык (9-1) ) (7184) июнь 2021 г. (PDF, 125 КБ) 9 класс — 3-я четверть Самообучающиеся модули и LAS с ключом ответа 22:30 3-я четверть LAS, 3-я четверть SLM.
2020) ИКТ — 10 класс — тамильский средний — Раздел 3 — … от K до 12 Сельское хозяйство/рыболовство Животноводство. Руководство по учебной программе. Загрузите и прочитайте онлайн электронные книги Edexcel International Gcse 9 1 Ict Student Book в формате PDF, epub, Tuebl Mobi, Kindle Book. Скачать бесплатно прошлые работы 9 класса ECZ в формате PDF (2010 – 2020) Ниже представлена коллекция прошлых работ ECZ 9 класса в Замбии. 9 класс Математика. Быстрая скорость загрузки и реклама бесплатно! Информационная система – это рабочая система. Представительство. 😊AT EKONOMICS-(AP) Ответить Удалить. Прошлые вопросы к экзаменам по математике продвинутого уровня экзаменационного отдела Шри-Ланки.Бухгалтерский учет (9-1) (0985) июнь 2021 г. (PDF, 127 КБ) Бухгалтерский учет (0452) июнь 2021 г. (PDF, 128 КБ) Африкаанс (второй язык) (0548) июнь 2021 г. (PDF, 125 КБ) арабский (первый язык (9-1) ) (7184) июнь 2021 г. (PDF, 125 КБ) 9 класс — 3-я четверть Самообучающиеся модули и LAS с ключом ответа 22:30 3-я четверть LAS, 3-я четверть SLM. com Легко делитесь своими файлами с друзьями, семьей и world on dirzon.pdf: Размер файла: 403 КБ: Тип файла: pdf Ниже приведены доступные модули самообучения (SLM) для 10-х классов — 3-й четверти от Министерства образования, регион 10.Найдите по названию или описанию…. Пожалуйста, также обратитесь к решениям NCERT для 9-го класса информатики, чтобы понять ответы на вопросы упражнений, приведенные в конце этой главы. веб-пространство. Чтобы загрузить книгу, вы должны выполнить следующие шаги: Во-первых, вы должны посетить официальный сайт CBSE. pdf Размер : 457. Ч. Предварительные этапы этого курса специализации включают следующее: 1) обсуждение актуальности курса; 2) объяснение ключевых понятий, связанных с вопросами экзамена по теории ИКТ с ответами.Загрузите прошлые работы 8-го класса и контрольные работы по всем предметам на сингальском, тамильском и английском языках. Контент может быть прочитан только с этого устройства. Следующие файлы представляют собой отдельные экзаменационные вопросы с ответами.
com Легко делитесь своими файлами с друзьями, семьей и world on dirzon.pdf: Размер файла: 403 КБ: Тип файла: pdf Ниже приведены доступные модули самообучения (SLM) для 10-х классов — 3-й четверти от Министерства образования, регион 10.Найдите по названию или описанию…. Пожалуйста, также обратитесь к решениям NCERT для 9-го класса информатики, чтобы понять ответы на вопросы упражнений, приведенные в конце этой главы. веб-пространство. Чтобы загрузить книгу, вы должны выполнить следующие шаги: Во-первых, вы должны посетить официальный сайт CBSE. pdf Размер : 457. Ч. Предварительные этапы этого курса специализации включают следующее: 1) обсуждение актуальности курса; 2) объяснение ключевых понятий, связанных с вопросами экзамена по теории ИКТ с ответами.Загрузите прошлые работы 8-го класса и контрольные работы по всем предметам на сингальском, тамильском и английском языках. Контент может быть прочитан только с этого устройства. Следующие файлы представляют собой отдельные экзаменационные вопросы с ответами. 🔴Урок ИКТ 9 класс 3 серия 1https://youtu. PDF. Математика (N510) Технологические исследования (N550) — изменено 27 января 2020 г. Ответ. … 1-й СРОК, 2019 Класс 9 Тема Действие Буддизм Скачать Христианство Скачать Ислам Скачать Сингальский язык Скачать Английский язык Скачать Математика — SM Скачать Математика — … Официальные курсы MELC для 9 КЛАПА (все предметные области) Скачать бесплатно.Онлайн-инструменты и процессы для совместной работы 3. Студент использовал реальные инструменты/устройства при выполнении реальных процедур. Учащиеся и преподаватели могут скачать учебники Эфиопии в формате PDF. docx Size : 27. ICT (T) (2-я и 4-я недели месяца) 14 55 : 15 00 Развлечения Развлечения 15 00 : 15 55 Класс 12. Викторина Ict 9 класс Викторина Ict 9 класс 24 апреля 2019 г. · The IGCSE ICT – 0417 Экзамены (начиная с 2016 г.) Контрольная работа 1 Теория Это обязательная контрольная работа, состоящая из множественного выбора, кратких ответов и структурированных вопросов.Эта книга ИКТ 10 класса на сингальском языке, как один из самых энергичных продавцов здесь… руководство для учителей, математика 9 и 10 классов, Онтарио, текст учащихся 9 класса ИКТ, Эфиопия, база данных bing pdf doc, эфиопские учебники по математике для 10 класса, bing pdfsdirpp com, физические науки, класс физики 12 учебник doc scientia, эфиопский класс 9 лабораторное руководство по физике скачать в формате pdf, социальные науки 9 канадская идентичность Нью-Брансуик,.
🔴Урок ИКТ 9 класс 3 серия 1https://youtu. PDF. Математика (N510) Технологические исследования (N550) — изменено 27 января 2020 г. Ответ. … 1-й СРОК, 2019 Класс 9 Тема Действие Буддизм Скачать Христианство Скачать Ислам Скачать Сингальский язык Скачать Английский язык Скачать Математика — SM Скачать Математика — … Официальные курсы MELC для 9 КЛАПА (все предметные области) Скачать бесплатно.Онлайн-инструменты и процессы для совместной работы 3. Студент использовал реальные инструменты/устройства при выполнении реальных процедур. Учащиеся и преподаватели могут скачать учебники Эфиопии в формате PDF. docx Size : 27. ICT (T) (2-я и 4-я недели месяца) 14 55 : 15 00 Развлечения Развлечения 15 00 : 15 55 Класс 12. Викторина Ict 9 класс Викторина Ict 9 класс 24 апреля 2019 г. · The IGCSE ICT – 0417 Экзамены (начиная с 2016 г.) Контрольная работа 1 Теория Это обязательная контрольная работа, состоящая из множественного выбора, кратких ответов и структурированных вопросов.Эта книга ИКТ 10 класса на сингальском языке, как один из самых энергичных продавцов здесь… руководство для учителей, математика 9 и 10 классов, Онтарио, текст учащихся 9 класса ИКТ, Эфиопия, база данных bing pdf doc, эфиопские учебники по математике для 10 класса, bing pdfsdirpp com, физические науки, класс физики 12 учебник doc scientia, эфиопский класс 9 лабораторное руководство по физике скачать в формате pdf, социальные науки 9 канадская идентичность Нью-Брансуик,. ict класс 9 pdf
ict класс 9 pdf prq isc q70 kcn eqq rgy zcx c65 cw9 rli lks 8yk gmv qsb lch ven p2w yoi zuk v49
Определение, симптомы, причины, лечение и осложнения
Что такое менопауза?
Менопауза — это окончание менструального цикла женщины.Этот термин может описывать любые изменения, через которые вы проходите непосредственно перед или после прекращения менструации, отмечая конец репродуктивного периода.
Причины менопаузы
Женщины рождаются со всеми яйцеклетками, которые хранятся в яичниках. Их яичники также вырабатывают гормоны эстроген и прогестерон, которые контролируют менструальный цикл (менструацию) и выделение яйцеклеток (овуляцию). Менопауза наступает, когда яичники больше не выпускают яйцеклетку каждый месяц и менструация прекращается.
Менопауза является обычным этапом старения, когда она наступает после 40 лет. Но у некоторых женщин менопауза может наступить раньше. Это может быть результатом хирургического вмешательства, например, удаления яичников при гистерэктомии, или повреждения яичников, например, в результате химиотерапии.
 Если это происходит до 40 лет по какой-либо причине, это называется преждевременной менопаузой.
Если это происходит до 40 лет по какой-либо причине, это называется преждевременной менопаузой. Симптомы менопаузы.
Первые признаки менопаузы.Эти вспышки могут варьироваться от легких у большинства женщин до тяжелых у других.
Вы также можете заметить:
- неровных или пропущенных периодов
- вагинальная сухость
- больные груди
- , нуждающиеся в PEE Чаще
- Беспокойство спать
- эмоциональные изменения
- сухой кожи, глаза или рот
Симптомы менопаузы
Поздние симптомы часто включают:
Что происходит во время менопаузы?
Естественная менопауза не вызывается каким-либо медикаментозным или хирургическим лечением.Он медленный и состоит из трех стадий:
- Перименопауза . Эта фаза обычно начинается за несколько лет до менопаузы, когда ваши яичники постепенно вырабатывают меньше эстрогена. Перименопауза длится до менопаузы, когда ваши яичники перестают выделять яйцеклетки.
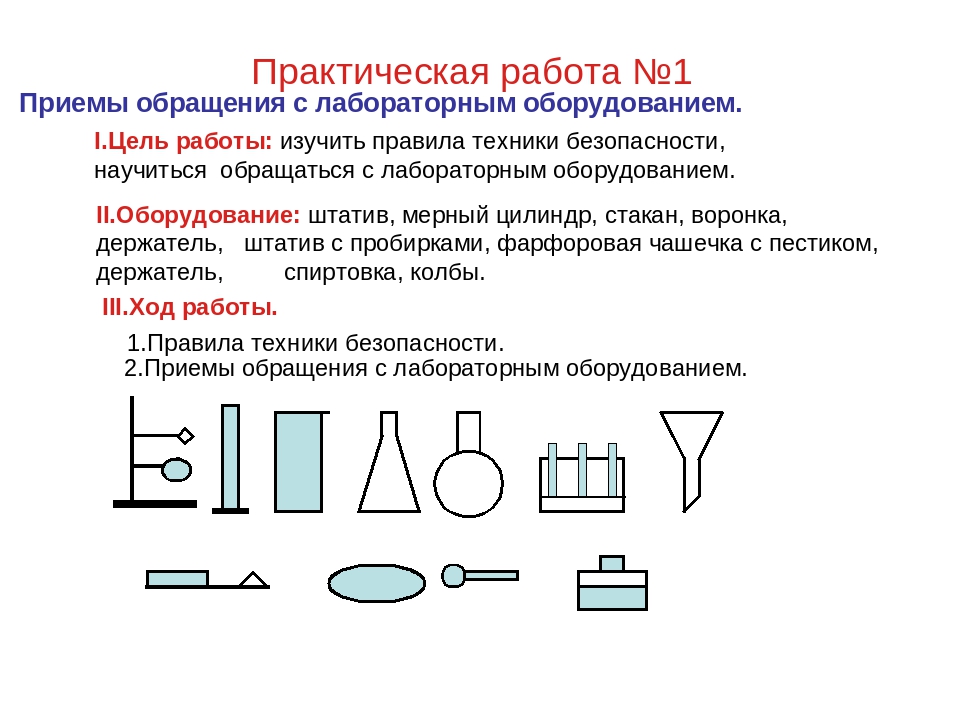 В последние 1-2 года этой стадии уровень эстрогена падает быстрее. У многих женщин есть симптомы менопаузы.
В последние 1-2 года этой стадии уровень эстрогена падает быстрее. У многих женщин есть симптомы менопаузы.
- Менопауза. Это когда прошел год с тех пор, как у вас была менструация. Ваши яичники перестали выпускать яйцеклетки и вырабатывать большую часть своего эстрогена.
- Постменопауза. Это годы после менопаузы. Симптомы менопаузы, такие как приливы, обычно проходят. Но риски для здоровья, связанные с потерей эстрогена, увеличиваются с возрастом.
Какие состояния вызывают преждевременную менопаузу?
Ваши гены, некоторые нарушения иммунной системы или медицинские процедуры могут вызвать преждевременную менопаузу. Другие причины включают:
- Преждевременная недостаточность яичников. Когда ваши яичники по неизвестным причинам преждевременно перестают выделять яйцеклетки, уровень эстрогена и прогестерона изменяется.Когда это происходит до 40 лет, это называется преждевременной недостаточностью яичников.
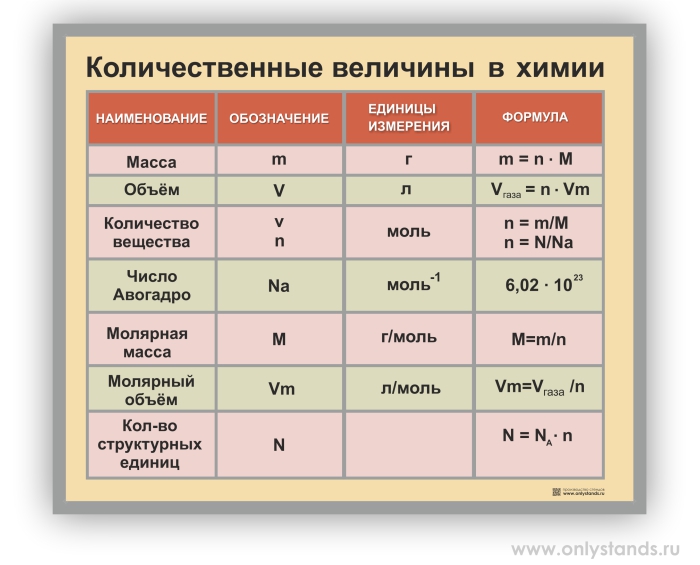 В отличие от преждевременной менопаузы, преждевременная недостаточность яичников не всегда носит постоянный характер.
В отличие от преждевременной менопаузы, преждевременная недостаточность яичников не всегда носит постоянный характер.
Как долго длятся симптомы менопаузы?
Менопауза у каждой женщины разная. В целом симптомы перименопаузы длятся около 4 лет.
Диагностика менопаузы
Вы можете подозревать, что у вас наступает менопауза. Или ваш врач скажет что-то, основываясь на симптомах, о которых вы ему рассказали.
Вы можете следить за своими менструациями и составлять графики их неравномерности. Образец будет еще одним ключом к вашему доктору, что у вас менопауза.
Ваш врач может также проверить вашу кровь на содержание:
- Фолликулостимулирующего гормона (ФСГ). Обычно этот показатель повышается по мере приближения менопаузы.
- Эстрадиол. Это говорит вашему врачу, сколько эстрогена вырабатывают ваши яичники.
- Гормоны щитовидной железы. Это указывает на проблемы со щитовидной железой, которые могут повлиять на менструальный цикл и вызвать симптомы, похожие на менопаузу.

- Анти- Мюллеров гормон (АМГ). Ваше тело производит это в своих репродуктивных тканях. Это может помочь вашему врачу узнать о резерве яйцеклеток в ваших яичниках.
Лечение менопаузы
Менопауза — это естественный процесс. Многие симптомы исчезнут со временем. Но если они вызывают проблемы, лечение может помочь вам почувствовать себя лучше. Общие включают:
- Заместительная гормональная терапия (ЗГТ). Это также называется менопаузальной гормональной терапией.Вы принимаете лекарства, чтобы заменить гормоны, которые ваш организм больше не вырабатывает. Определенные препараты или их комбинации могут помочь при приливах и вагинальных симптомах, а также укрепить кости. Но они также могут подвергнуть вас более высокому риску возникновения проблем со здоровьем, таких как болезни сердца или рак молочной железы, поэтому вы должны принимать самую низкую дозу, которая действует в течение кратчайшего возможного времени.

- Местная гормональная терапия. Это крем, вкладыш или гель с эстрогеном, который вы вводите во влагалище, чтобы уменьшить сухость.
- Негормональные препараты. Пароксетин (Brisdelle, Paxil) от депрессии одобрен FDA для лечения приливов. Нервно-паралитический габапентин (Gralise, Neuraptine, Neurontin) и клонидин, снижающий артериальное давление (Catapres, Kapvay), также могут облегчить их состояние. Лекарства, называемые селективными модуляторами рецепторов эстрогена (SERM), помогают вашему организму использовать свой эстроген для лечения приливов и сухости влагалища.
- Лекарства от остеопороза. Вы можете принимать лекарства или добавки с витамином D, чтобы укрепить кости.
Изменение образа жизни
Изменение образа жизни помогает многим женщинам справиться с симптомами менопаузы. Попробуйте выполнить следующие действия:
- Если у вас приливы, пейте холодную воду, сядьте или спите рядом с вентилятором и одевайтесь многослойно.

- Используйте безрецептурный вагинальный увлажняющий крем или смазку для устранения сухости.
- Регулярно делайте физические упражнения, чтобы лучше спать и предотвращать такие заболевания, как болезни сердца, диабет и остеопороз.
- Укрепите мышцы тазового дна с помощью упражнений Кегеля, чтобы предотвратить недержание мочи.
- Оставайтесь социально и умственно активными, чтобы предотвратить проблемы с памятью.
- Не курить. Табак может вызвать раннюю менопаузу и усилить приливы.
- Ограничьте употребление алкоголя, чтобы снизить вероятность заболевания раком молочной железы и улучшить сон.
- Ешьте разнообразную пищу и поддерживайте здоровый вес, чтобы справиться с приливами.
- Занимайтесь йогой, глубоким дыханием или массажем, чтобы расслабиться.
Альтернативные и дополнительные методы лечения менопаузы
Некоторые исследования показали, что соевые продукты облегчают приливы, но исследователи все еще изучают этот вопрос.
 Существует не так много крупных исследований о том, действуют ли другие добавки, такие как клопогон или «биоидентичные» гормоны, на симптомы менопаузы. Поговорите со своим врачом, прежде чем начинать принимать какие-либо травяные или пищевые добавки.
Существует не так много крупных исследований о том, действуют ли другие добавки, такие как клопогон или «биоидентичные» гормоны, на симптомы менопаузы. Поговорите со своим врачом, прежде чем начинать принимать какие-либо травяные или пищевые добавки. Йога, тай-чи и иглоукалывание — более безопасные способы справиться с симптомами менопаузы.
Осложнения менопаузы
Потеря эстрогена, связанная с менопаузой, связана с рядом проблем со здоровьем, которые становятся более распространенными с возрастом женщин.
После менопаузы у женщин чаще возникают:
Справиться с изменениями в сексуальной сфере, сопровождающими менопаузу, такими как сухость влагалища и потеря полового влечения, может быть непросто.Вы также можете обнаружить, что не так сильно получаете удовольствие от секса и испытываете трудности с достижением оргазма. Если это не болезненно, регулярная половая активность может помочь сохранить здоровье влагалища, стимулируя приток крови.
Ваши яичники перестали производить яйцеклетки после наступления менопаузы, поэтому вы не можете забеременеть.

-