Химия 8 класс. Все формулы и определения. Кратко, таблицы, схемы.
«Химия 8 класс. Все формулы и определения»
Ключевые слова: Химия 8 класс. Все формулы и определения, условные обозначения физических величин, единицы измерения, приставки для обозначения единиц измерения, соотношения между единицами, химические формулы, основные определения, кратко, таблицы, схемы.
1. Условные обозначения, названия и единицы измерения
некоторых физических величин, используемых в химии
| Физическая величина | Обозначение | Единица измерения |
| Время | t | с |
| Давление | p | Па, кПа |
| Количество вещества | ν | моль |
| Масса вещества | m | кг, г |
| Массовая доля | ω | Безразмерная |
| Молярная масса | М | кг/моль, г/моль |
| Молярный объем | Vn | м3/моль, л/моль |
| Объем вещества | V | м3, л |
| Объемная доля | Безразмерная | |
| Относительная атомная масса | Ar | Безразмерная |
| Относительная молекулярная масса | Mr | Безразмерная |
| Относительная плотность газа А по газу Б | DБ(А) | Безразмерная |
| Плотность вещества | р | кг/м3, г/см3, г/мл |
| Постоянная Авогадро | NA | 1/моль |
| Температура абсолютная | Т | К (Кельвин) |
| Температура по шкале Цельсия | t | °С (градус Цельсия) |
| Тепловой эффект химической реакции | Q | кДж/моль
|
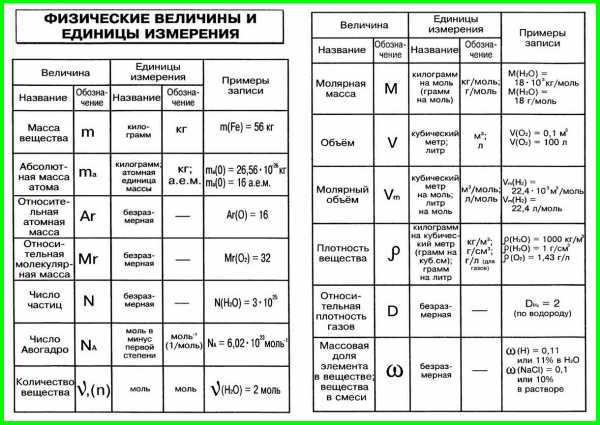
2. Соотношения между единицами физических величин

3. Химические формулы в 8 классе
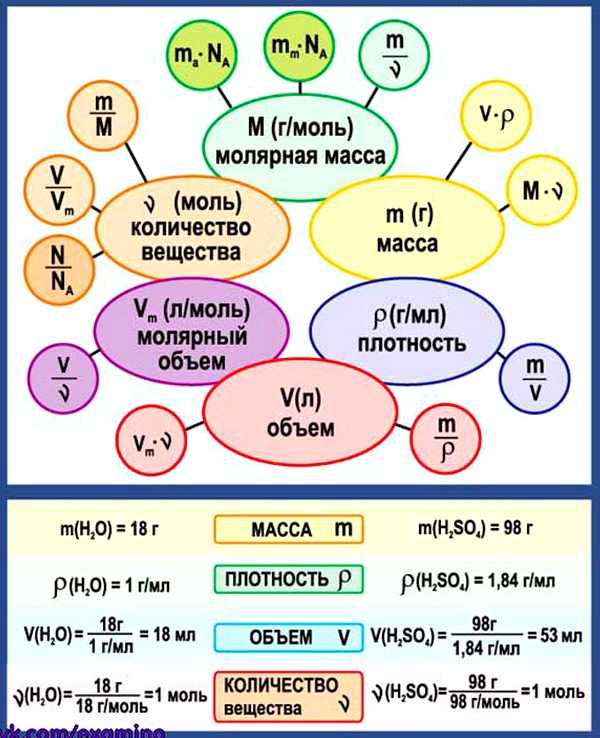
Схема. Химические формулы в 8 классе
4. Основные определения в 8 классе
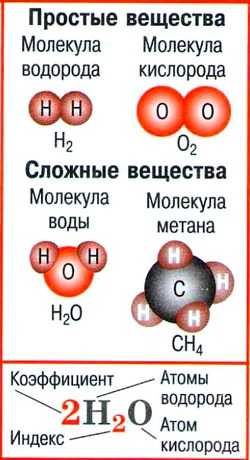
- Атом — мельчайшая химически неделимая частица вещества.
- Химический элемент — определённый вид атомов.
- Молекула — мельчайшая частица вещества, сохраняющая его состав и химические свойства и состоящая из атомов.
- Простые вещества — вещества, молекулы которых состоят из атомов одного вида.
- Сложные вещества — вещества, молекулы которых состоят из атомов разного вида.
- Качественный состав вещества показывает, из атомов каких элементов оно состоит.
- Количественный состав вещества показывает число атомов каждого элемента в его составе.
- Химическая формула — условная запись качественного и количественного состава вещества посредством химических символов и индексов.
- Атомная единица массы (а.е.м.) — единица измерения массы атома, равная массы 1/12 атома углерода 12С.
- Моль — количество вещества, в котором содержится число частиц, равное числу атомов в 0,012 кг углерода 12С.
- Постоянная Авогадро (Na = 6*1023 моль-1) — число частиц, содержащихся в одном моле.
- Молярная масса вещества (М) — масса вещества, взятого в количестве 1 моль.
- Относительная атомная масса элемента Аr — отношение массы атома данного элемента m0 к 1/12 массы атома углерода 12С.
- Относительная молекулярная масса вещества Мr — отношение массы молекулы данного вещества к 1/12 массы атома углерода 12С. Относительная молекулярная масса равна сумме относительных атомных масс химических элементов, образующих соединение, с учётом числа атомов данного элемента.
- Массовая доля химического элемента ω(Х) показывает, какая часть относительной молекулярной массы вещества X приходится на данный элемент.
АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
1. Существуют вещества с молекулярным и немолекулярным строением.
2. Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры.
3. Молекулы находятся в непрерывном движении.
4. Молекулы состоят из атомов.
6. Атомы характеризуются определённой массой и размерами.
При физических явлениях молекулы сохраняются, при химических, как правило, разрушаются. Атомы при химических явлениях перегруппировываются, образуя молекулы новых веществ.
ЗАКОН ПОСТОЯНСТВА СОСТАВА ВЕЩЕСТВА
Каждое химически чистое вещество молекулярного строения независимо от способа получения имеет постоянный качественный и количественный состав.
ВАЛЕНТНОСТЬ
Валентность — свойство атома химического элемента присоединять или замещать определённое число атомов другого элемента.

ХИМИЧЕСКАЯ РЕАКЦИЯ
Химическая реакция — явление, в результате которого из одних веществ образуются другие. Реагенты — вещества, вступающие в химическую реакцию. Продукты реакции — вещества, образующиеся в результате реакции.
Признаки химических реакций:
1. Выделение теплоты (света).
2. Изменение окраски.
3. Появление запаха.
4. Образование осадка.
5. Выделение газа.
- Химическое уравнение — запись химической реакции с помощью химических формул. Показывает, какие вещества и в каком количестве вступают в реакцию и получаются в результате реакции.
ЗАКОН СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВ
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции. В результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка.
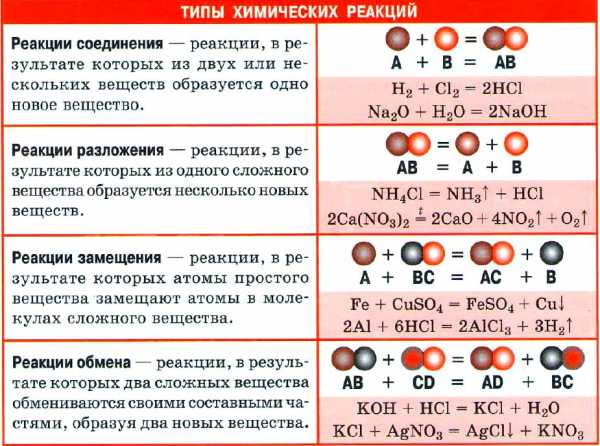
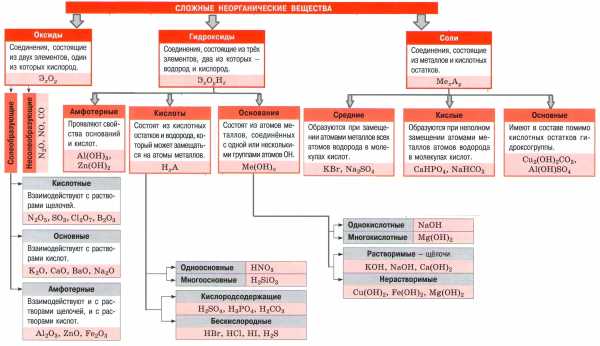
Важнейшие классы неорганических веществ
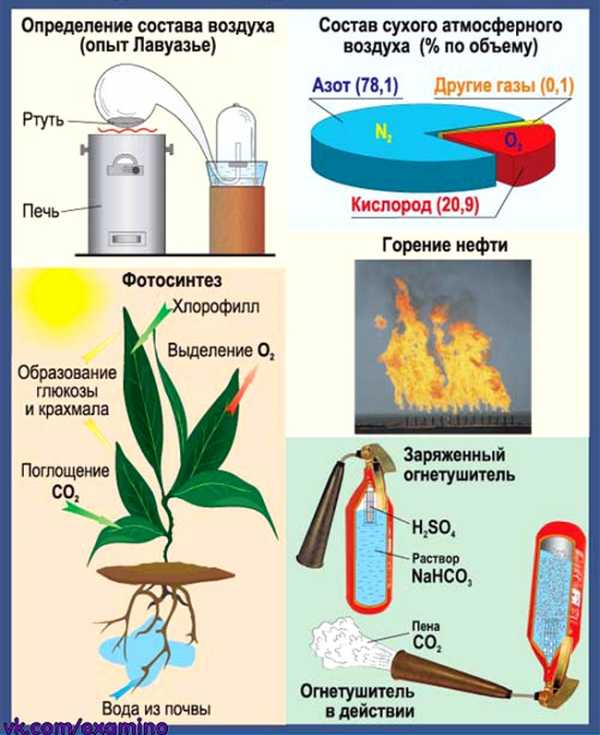
Воздух. Кислород. Горение
Конспект урока «Химия 8 класс. Все формулы и определения».
Следующая тема: «».
Химия 8 класс. Все формулы и определения
3.9 (77.9%) 105 vote[s]
uchitel.pro
ГДЗ по химии 8 класс
Изображения обложек учебников приведены на страницах данного сайта исключительно в качестве иллюстративного материала (ст. 1274 п. 1 части четвертой Гражданского кодекса Российской Федерации)
Рабочие тетради
Тесты
Решебники по химии для 8 класса
- Многие родители все чаще мучаются над вопросом – как оказать помощь своим детям с выполнением домашних заданий по таким предметам, как химия, физика, поскольку эти науки являются сложными и для многих учащихся просто неподъемными. Для решения проблем с домашними заданиями существуют ГДЗ по химии для 8 класса. Это настоящая волшебная палочка не только для учеников любых категорий, но и для родителей, которые озабочены освоением учебы своими чадами.
- Справиться с домашними задачами по химии может лишь тот ученик, кто хорошо знает специфику этого предмета и особенности решения задач в определенном классе. Поэтому помощь решебника в таких случаях – это блестящий выход для родителей. Благодаря решебнику по химии учащийся 8 класса сможет не только списать из него готовые задания (поскольку к серьезному постижению предмета это не ведет), но и разобраться в способах решения многих замысловатых задач, вспомнить материал, который изучали на уроке, и при случае обратиться к учебнику. Последовательность решений задач в решебнике расписана подробно и понятно, в них сможет разобраться даже тот, кто многое забыл из изученного материала. Поэтому устоявшееся мнение о том, что такими книжицами пользуются лишь те, кто не хочет учиться, ошибочно, к решебникам обращаются многие учащиеся, кто считает своим долгом — разобраться в изучаемом материале.
- В восьмом классе учащиеся средней школы начинают знакомство с новой дисциплиной — наукой химией. Учитывая высокое практическое, прикладное значение, которое она имеет, востребованность знаний для дальнейшего выбора профессии, важно с самого начала внимательно и вдумчиво работать с теоретическим и практическим материалом по предмету. Не всегда все складывается благополучно, многие темы достаточно сложны. В этом случае не следует сразу же записывать химию в число дисциплин, с которыми «не сложилось». Грамотные подходы и комплексы по её изучению, подбор качественной литературы и решебников к ней позволят преодолеть временные трудности и разобраться с самыми сложными вопросами.
- Но для этого надо работать с ГДЗ не время от времени, а системно. Не только для того, чтобы выполнить заданное в школе задание, но и чтобы разобрать проблему глубоко, на всех уровнях, в том числе — повышенной сложности, подготовиться и участвовать в предметных химических олимпиадах, школьных и проводимых на других площадках. Чтобы это стало реальностью, нужно:
— разработать грамотный план, программу самостоятельной работы. Сделать это можно самостоятельно или обратившись к педагогу, репетитору;
— составить график прохождения разделов и тем, решения задач, проведения практических работ;
— время от времени проводить динамику достигнутых результатов и корректировать план работы, исходя из данных такого анализа. - В число главных тем, которые изучает химия в 8 классе, включены:
— что такое химия, с помощью каких методик и технологий она изучается;
— что такое вещество, химические законы и формулы;
— атомы;
— простые вещества и соединения;
— превращения, операции с веществами, растворы;
— уравнения и реакции. - Помимо теоретического учебника по химии для 8 класса в комплект для качественного изучения дисциплины рекомендуется включить практикумы и проверочные материалы. В их числе:
— рабочая тетрадь;
— дидактические материалы;
— тетрадь для практических работ;
— сборники практических и экспериментальных задач;
— тетради для лабораторных и опытов;
— тренажеры и зачетные работы по дисциплине. - Уделив даже немного времени изучению проблем, поставленных дисциплиной, но соблюдая принцип регулярности, восьмиклассники смогут достигнуть высоких результатов в химии.
Химия 8 класс — грамотное изучение науки с азов
©
Copyright.
Все права защищены. Правообладатель SIA Ksenokss.
Адрес: 1073, Курземес проспект 106/45, Рига, Латвия.
Тел.: +371 29-851-888 E-mail: ekaterina[at]euroki.org
www.euroki.org
Химия, 8–9 класс: уроки, тесты, задания
Первоначальные химические понятия и теоретические представления
-
Предмет химии
-
Физические тела и вещества
-
Чистые вещества и смеси
-
Разделение смесей. Методы очистки веществ
-
Атомы и молекулы
-
Химические элементы. Знаки химических элементов
-
Закон постоянства состава
-
Химические формулы
-
Простые и сложные вещества
-
Валентность. Степень окисления. Составление формул по валентностям и степеням окисления
-
Физические и химические явления
-
Признаки и условия протекания химических реакций
-
Закон сохранения массы веществ
-
Уравнения химических реакций
Классы неорганических веществ
-
Классификация веществ
-
Металлы
-
Неметаллы
-
Оксиды
-
Основания
-
Кислоты
-
Амфотерные гидроксиды
-
Соли
-
Взаимосвязь между классами неорганических веществ
Периодический закон и строение атомов
-
Периодический закон
-
Периодическая система
-
Строение ядра атома
-
Строение электронной оболочки атома
-
Периодическая таблица и закономерности изменения свойств химических элементов
Строение вещества
-
Электроотрицательность химических элементов
-
Типы химической связи
-
Ионная связь
-
Ковалентная связь
-
Металлическая связь
-
Аморфные и кристаллические вещества
-
Кристаллические решётки
Окислительно-восстановительные реакции
-
Степень окисления
-
Окислители и восстановители, окисление и восстановление
Растворы
-
Состав растворов
-
Растворение. Растворимость
-
Электролиты и неэлектролиты
-
Электролитическая диссоциация кислот, оснований и солей
-
Свойства ионов
-
Среда растворов. Индикаторы
-
Реакции ионного обмена. Реакция нейтрализации
Классификация химических реакций и закономерности их протекания
-
Классификация химических реакций по числу и составу вступивших в реакцию и образовавшихся веществ
-
Классификация химических реакций по тепловому эффекту
-
Классификация химических реакций, ОВР
-
Скорость протекания химической реакции. Катализаторы
Химия неметаллов
-
Водород
-
Кислород
-
Вода
-
Галогены. Хлор и его соединения
-
Сера и её соединения
-
Азот и его соединения
-
Фосфор и его соединения
-
Углерод и его соединения
-
Кремний и его соединения
Химия металлов
-
Щелочные металлы и их соединения
-
Щелочноземельные металлы и их соединения
-
Алюминий и его соединения
-
Железо и его соединения
Органические вещества
-
Состав и строение органических веществ
-
Углеводороды. Полимеры
-
Спирты
-
Карбоновые кислоты
-
Жиры
-
Углеводы
-
Белки
Человек в мире веществ, материалов и химических реакций
-
Природные источники углеводородов
-
Химия и пища. Химия и здоровье
Методы исследования в химии
-
Методы научного познания. Химический эксперимент
-
Получение, собирание и распознавание газов
-
Обнаружение ионов
Расчётные задачи по химии
-
Физические величины
-
Относительная атомная и молекулярная массы. Вычисление относительной молекулярной массы вещества
-
Количество вещества
-
Вычисление молярной массы вещества
-
Вычисление количества вещества
-
Вычисление массовой доли элемента в химическом соединении
-
Установление простейшей формулы вещества по массовым долям элементов
-
Простейшие вычисления по уравнениям химических реакций
-
Вычисления по уравнениям реакций, если исходное вещество содержит определенную долю примесей
-
Вычисление массовой доли вещества в растворе
-
Вычисления, связанные с приготовлением растворов с заданной массовой долей растворённого вещества
-
Комбинированные задачи
Класс заполнен на 100 %
www.yaklass.ru