Химия 8 класс. Все формулы и определения. Кратко, таблицы, схемы.
«Химия 8 класс. Все формулы и определения»
Ключевые слова: Химия 8 класс. Все формулы и определения, условные обозначения физических величин, единицы измерения, приставки для обозначения единиц измерения, соотношения между единицами, химические формулы, основные определения, кратко, таблицы, схемы.
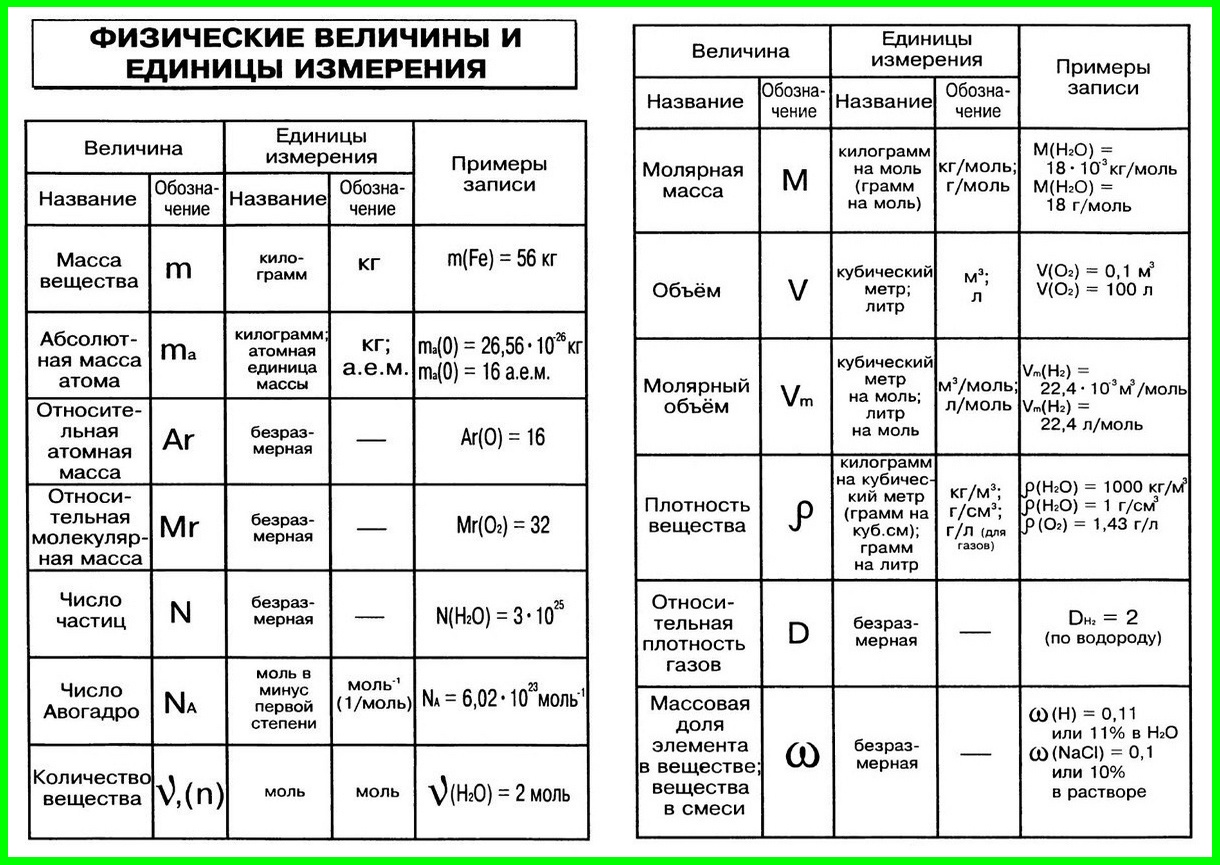
1. Условные обозначения, названия и единицы измерения
некоторых физических величин, используемых в химии
| Физическая величина | Обозначение | Единица измерения |
| Время | t | с |
| Давление | p | Па, кПа |
| Количество вещества | ν | моль |
| Масса вещества | m | кг, г |
| Массовая доля | ω | Безразмерная |
| Молярная масса | М | кг/моль, г/моль |
| Молярный объем | Vn | м3/моль, л/моль |
| Объем вещества | V | м3, л |
| Объемная доля |  |
Безразмерная |
| Относительная атомная масса | Ar | Безразмерная |
| Относительная молекулярная масса | Mr | Безразмерная |
| Относительная плотность газа А по газу Б | DБ(А) | Безразмерная |
| Плотность вещества | р | кг/м3, г/см3, г/мл |
| Постоянная Авогадро | NA | 1/моль |
| Температура абсолютная | Т | К (Кельвин) |
| Температура по шкале Цельсия | t | °С (градус Цельсия) |
| Тепловой эффект химической реакции | Q | кДж/моль
|

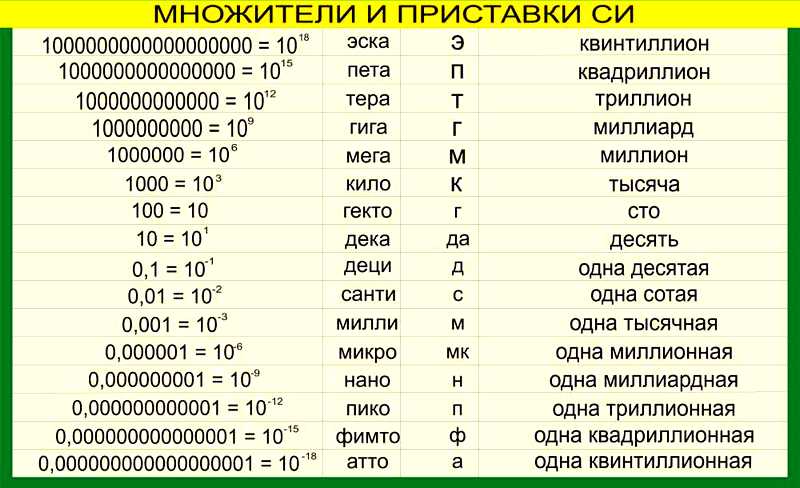
2. Соотношения между единицами физических величин


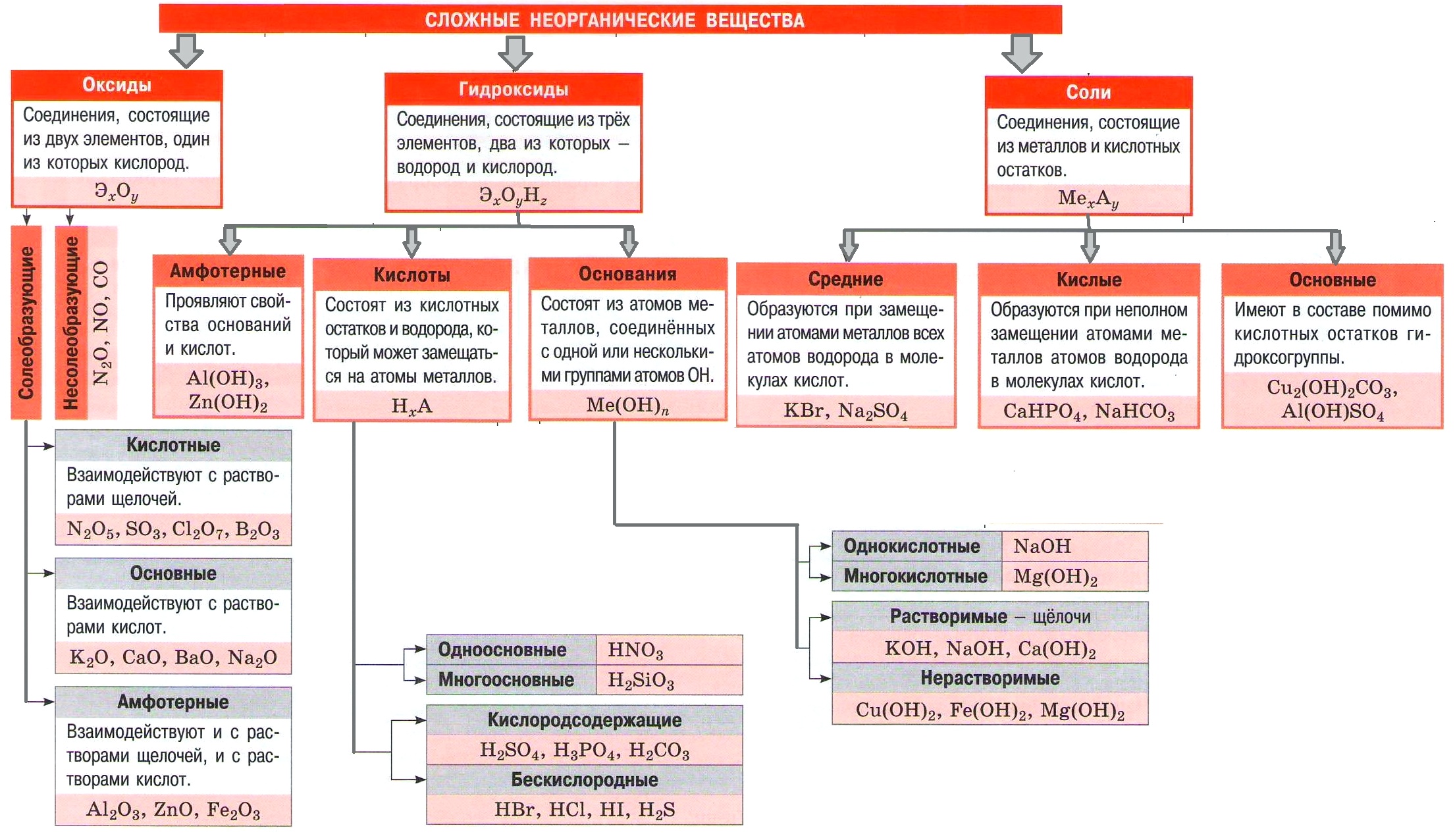
3. Химические формулы в 8 классе
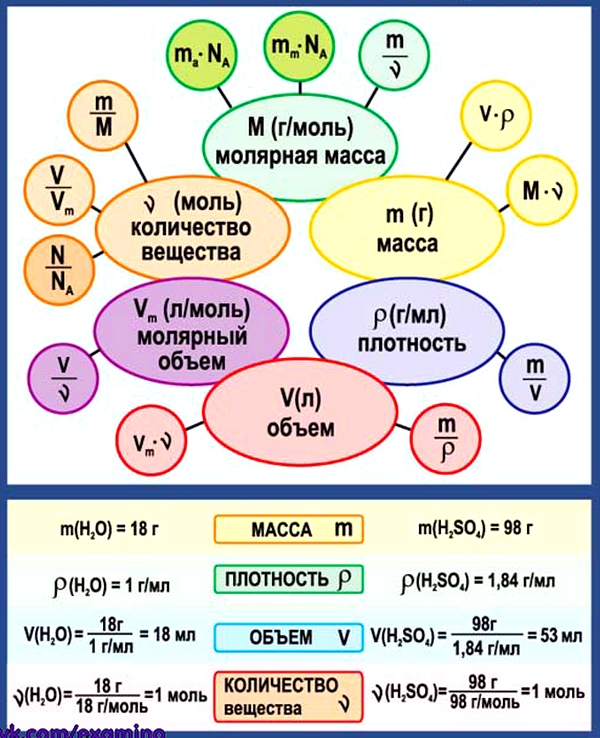
Схема. Химические формулы в 8 классе
4. Основные определения в 8 классе
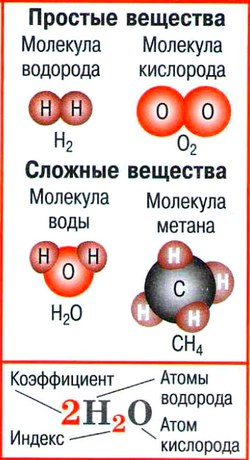
- Атом — мельчайшая химически неделимая частица вещества.
- Химический элемент — определённый вид атомов.
- Молекула — мельчайшая частица вещества, сохраняющая его состав и химические свойства и состоящая из атомов.
- Простые вещества — вещества, молекулы которых состоят из атомов одного вида.
- Сложные вещества — вещества, молекулы которых состоят из атомов разного вида.
- Качественный состав вещества показывает, из атомов каких элементов оно состоит.
- Количественный состав вещества показывает число атомов каждого элемента в его составе.
- Химическая формула — условная запись качественного и количественного состава вещества посредством химических символов и индексов.
- Атомная единица массы (а.е.м.) — единица измерения массы атома, равная массы 1/12 атома углерода 12С.
- Моль — количество вещества, в котором содержится число частиц, равное числу атомов в 0,012 кг углерода 12С.
- Постоянная Авогадро (Na = 6*1023 моль-1) — число частиц, содержащихся в одном моле.
- Молярная масса вещества (М) — масса вещества, взятого в количестве 1 моль.
- Относительная атомная масса элемента Аr — отношение массы атома данного элемента m0 к 1/12 массы атома углерода 12С.
- Относительная молекулярная масса вещества Мr — отношение массы молекулы данного вещества к 1/12 массы атома углерода 12С. Относительная молекулярная масса равна сумме относительных атомных масс химических элементов, образующих соединение, с учётом числа атомов данного элемента.
- Массовая доля химического элемента ω(Х) показывает, какая часть относительной молекулярной массы вещества X приходится на данный элемент.
АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
1. Существуют вещества с молекулярным и немолекулярным строением.
2. Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры.
3. Молекулы находятся в непрерывном движении.
4. Молекулы состоят из атомов.
6. Атомы характеризуются определённой массой и размерами.
При физических явлениях молекулы сохраняются, при химических, как правило, разрушаются. Атомы при химических явлениях перегруппировываются, образуя молекулы новых веществ.
ЗАКОН ПОСТОЯНСТВА СОСТАВА ВЕЩЕСТВА
Каждое химически чистое вещество молекулярного строения независимо от способа получения имеет постоянный качественный и количественный состав.
ВАЛЕНТНОСТЬ
Валентность — свойство атома химического элемента присоединять или замещать определённое число атомов другого элемента.

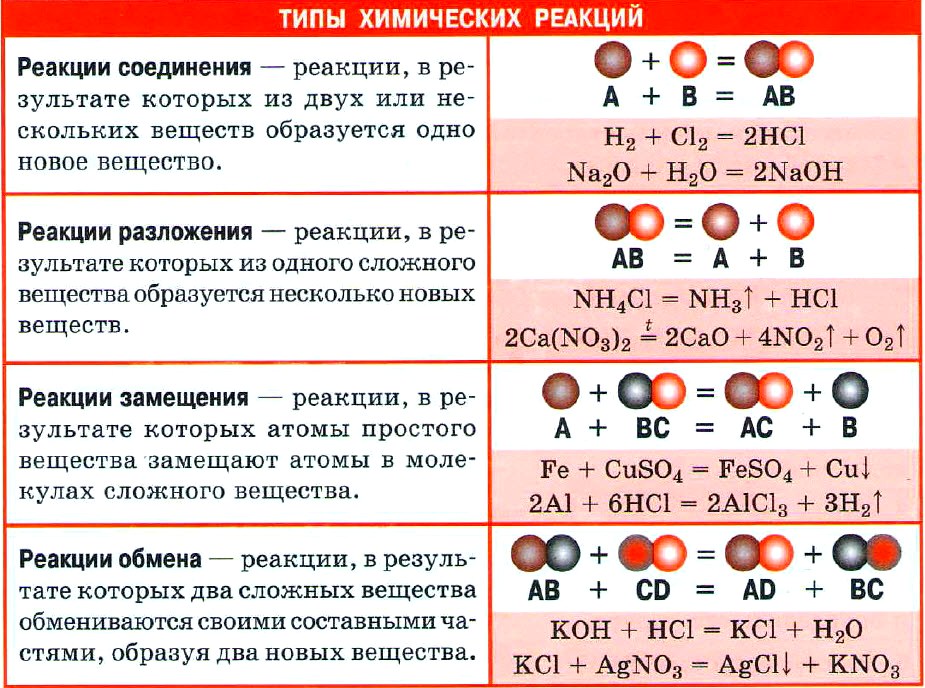
ХИМИЧЕСКАЯ РЕАКЦИЯ
Химическая реакция — явление, в результате которого из одних веществ образуются другие. Реагенты — вещества, вступающие в химическую реакцию. Продукты реакции — вещества, образующиеся в результате реакции.
Признаки химических реакций:
1. Выделение теплоты (света).
2. Изменение окраски.
3. Появление запаха.
4. Образование осадка.
5. Выделение газа.
- Химическое уравнение — запись химической реакции с помощью химических формул. Показывает, какие вещества и в каком количестве вступают в реакцию и получаются в результате реакции.
ЗАКОН СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВ
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции. В результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка.
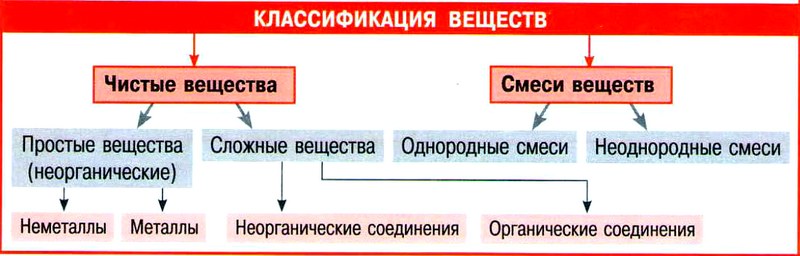
Важнейшие классы неорганических веществ
Воздух. Кислород. Горение

Конспект урока «Химия 8 класс. Все формулы и определения».
Следующая тема: «».
Для учащихся 8 класса — Сайт lysakovaen!

«Единственный путь, ведущий к знаниям, — это деятельность».
(Бернард Шоу)

Пусть зимний день с метелями
Мне навевает грусть.
Таблицу Менделеева
Я знаю наизусть!

Динамическая таблица Менделеева

Игра «Таблица Менделеева» — жми на картинку и играй!
![]()
Таблица с русскими и латинскими названиями химических элементов
ХЭ таблица.png
Portable Network Image Format
9.3 KB
![]()
Естественные семейства элементов
Зависимость свойств элементов от атомног
JPG Image
135.2 KB
![]()
Примеры составления молекулярных и структурных формул
Составление структурных формул 8 кл.gif
Graphic Interchange format
12.5 KB
![]()
Правила определения валентности
РАЗДАТОЧНЫЙ валентность 8 класс.doc
Microsoft Word Document
35.5 KB
![]()
Изменение цвета индикаторов в различных средах
Изменение окраски кислотно-основных инди
Microsoft Word Document
39.5 KB
![]()
Таблица растворимости
Таблица растворимости солей, кислот и ос
Microsoft Word Document
43.0 KB
![]()
Важнейшие классы неорганических соединений
Опорный конспект Классы неорган соед.doc
Microsoft Word Document
92.5 KB
![]()
Таблица с названиями кислот и их кислотных остатков
кислоты и остатки.doc
Microsoft Word Document
59.0 KB
![]()
Оксиды и соответствующие им гидроксиды
Раздаточный ОКСИДЫ 8 класс.doc
Microsoft Word Document
87.0 KB
![]()
Опорная схема Генетическая связь между классами неорганических соединений
Генетическая связь.jpg
JPG Image
110.5 KB
![]()
Опорная схема «Оксиды»
ОС Оксиды 8 кл.docx
Microsoft Word Document
88.0 KB
![]()
Опорная схема «Основания»
ОС Основания 8 кл.docx
Microsoft Word Document
76.5 KB
![]()
Опорная схема «Кислоты»
ОС Кислоты 8 кл.docx
Microsoft Word Document
60.1 KB
![]()
Определение степеней окисления
1.png
Portable Network Image Format
431.7 KB
![]()
Составление формул по с/о
2.png
Portable Network Image Format
383.1 KB
![]()
Опорная схема «П/гр Азота»
ОС пгр Азота.docx
Microsoft Word Document
81.8 KB
![]()
Опорная схема «Азот»
ОС Азот простое вещество.docx
Microsoft Word Document
62.9 KB
![]()
Опорная схема «Аммиак»
ОС Аммиак.docx
Microsoft Word Document
51.2 KB
![]()
ЭХ ряд активности металлов, таблица и закономерности
ПАМЯТКА ЭХ ряд Ме.doc
Microsoft Word Document
74.0 KB
![]()
ОЭО
Относительные электроотрицательности эле
Microsoft Word Document
43.5 KB
![]()
Металлы
доп мат-л по Ме.doc
Microsoft Word Document
2.0 MB
Тривиальные названия некоторых веществ

Кислоты и их кислотные остатки









![]()
Экзамен по химии за 10 класс
Экзамен ХИМИЯ за 10 класс.doc
Microsoft Word Document
58.5 KB
![]()
ВАЖНЕЙШИЕ альфа АМИНОКИСЛОТЫ.doc
Microsoft Word Document
44.0 KB
Онлайн тест для учащихся 10 и 11 класса

Интерактивный мультимедиа учебник по органической химии
![]()
Химия в таблицах и схемах 1
Хим в табл и сх1.zip
Compressed Archive in ZIP Format
1.3 MB
![]()
Химия в таблицах и схемах 2
Хим в табл и сх2.zip
Compressed Archive in ZIP Format
1.5 MB
![]()
Химия в таблицах и схемах
Хим в табл и сх1.zip
Compressed Archive in ZIP Format
1.3 MB

![]()
Краткая характеристика самостоятельных работ учащихся
Виды самостоятельных работ.docx
Microsoft Word Document
13.0 KB
![]()
Требования к оформлению реферата
Требования к оформлению реферата.doc
Microsoft Word Document
40.5 KB
![]()
Требования к оформлению презентаций
Требования к презентациям.doc
Microsoft Word Document
235.0 KB
Помогите с заполнением таблицы) Химия, 8 класс, параграф 32, 1 вопрос. Рудзитис и Фельдман
Я в столбик напишу тебе, сама в табличку впишешь
Кислотами называются сложные вещества, в состав молекул которых входят атомы водорода, способные замещаться атомами металла.
Кислоты кислородосодержащие
ΗΝO3 — кислотный остаток NO3 — валентность I
H2SO4 — кислотный остаток SO4 — валентность II
Н3РO4 — кислотный остаток РO4 — валентность III
H2SO3 — кислотный остаток SO3 — валентность II
HNO2 — кислотный остаток NO2 — валентность I
Н2СO3 — кислотный остаток СO3 — валентность II
НВO3 — кислотный остаток ВO3 — валентность I
H3AsO4 — кислотный остаток AsО4 — валентность III
Кислоты бескислородные
НСl — кислотный остаток Сl — валентность I
H2S — кислотный остаток S — валентность II
HF — кислотный остаток F — валентность I
HI — I — валентность I
НВr — кислотный остаток Вr — валентность I
НСl — кислотный остаток Сl — валентность I
HF — кислотный остаток F — валентность I
HI — кислотный остаток I — валентность I
НВг — кислотный остаток Вr — валентность I
ΗΝO3 — кислотный остаток NO3 — валентность1
HNO2 — кислотный остаток NO2 — валентность I
НВO3 — кислотный остаток ВO3 — валентность I
H2SO4 — кислотный остаток SO4 — валентность II
Кислоты двухосновные
H2SO3 — кислотный остаток SO3 — валентность II
Н2СO3 — кислотный остаток СO3 — валентность II
H2S — кислотный остаток S — валентность II
Кислоты трехосновные
Н3РO4 — кислотный остаток РO4 — валентность III
H3AsO4 — кислотный остаток AsO4 — валентность III
Химия 8 класс. Все формулы и определения. Кратко, таблицы, схемы.
«Химия 8 класс. Все формулы и определения»
Ключевые слова: Химия 8 класс. Все формулы и определения, условные обозначения физических величин, единицы измерения, приставки для обозначения единиц измерения, соотношения между единицами, химические формулы, основные определения, кратко, таблицы, схемы.
1. Условные обозначения, названия и единицы измерения
некоторых физических величин, используемых в химии
| Физическая величина | Обозначение | Единица измерения |
| Время | t | с |
| Давление | p | Па, кПа |
| Количество вещества | ν | моль |
| Масса вещества | m | кг, г |
| Массовая доля | ω | Безразмерная |
| Молярная масса | М | кг/моль, г/моль |
| Молярный объем | Vn | м3/моль, л/моль |
| Объем вещества | V | м3, л |
| Объемная доля |  |
Безразмерная |
| Относительная атомная масса | Ar | Безразмерная |
| Относительная молекулярная масса | Mr | Безразмерная |
| Относительная плотность газа А по газу Б | DБ(А) | Безразмерная |
| Плотность вещества | р | кг/м3, г/см3, г/мл |
| Постоянная Авогадро | NA | 1/моль |
| Температура абсолютная | Т | К (Кельвин) |
| Температура по шкале Цельсия | t | °С (градус Цельсия) |
| Тепловой эффект химической реакции | Q | кДж/моль
|
2. Соотношения между единицами физических величин

3. Химические формулы в 8 классе
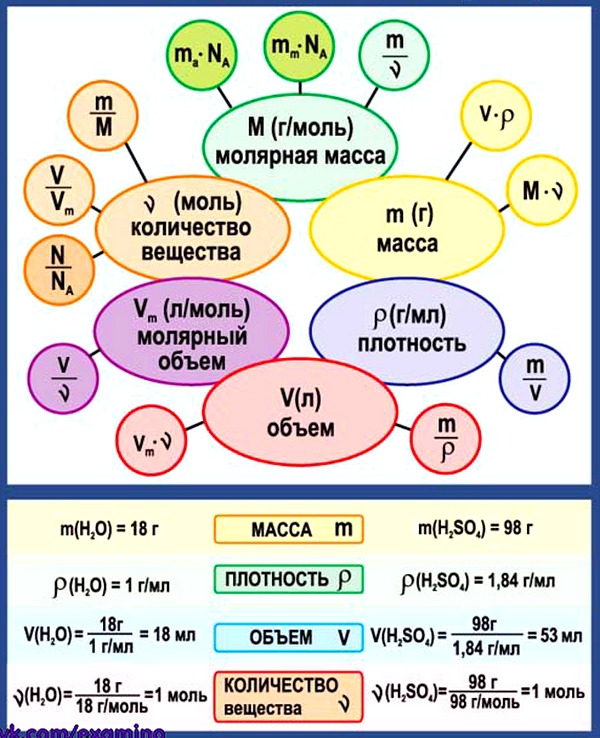
Схема. Химические формулы в 8 классе
4. Основные определения в 8 классе
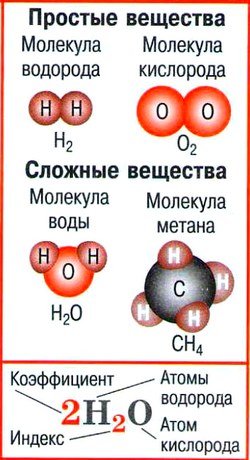
- Атом — мельчайшая химически неделимая частица вещества.
- Химический элемент — определённый вид атомов.
- Молекула — мельчайшая частица вещества, сохраняющая его состав и химические свойства и состоящая из атомов.
- Простые вещества — вещества, молекулы которых состоят из атомов одного вида.
- Сложные вещества — вещества, молекулы которых состоят из атомов разного вида.
- Качественный состав вещества показывает, из атомов каких элементов оно состоит.
- Количественный состав вещества показывает число атомов каждого элемента в его составе.
- Химическая формула — условная запись качественного и количественного состава вещества посредством химических символов и индексов.
- Атомная единица массы (а.е.м.) — единица измерения массы атома, равная массы 1/12 атома углерода 12С.
- Моль — количество вещества, в котором содержится число частиц, равное числу атомов в 0,012 кг углерода 12С.
- Постоянная Авогадро (Na = 6*1023 моль-1) — число частиц, содержащихся в одном моле.
- Молярная масса вещества (М) — масса вещества, взятого в количестве 1 моль.
- Относительная атомная масса элемента Аr — отношение массы атома данного элемента m0 к 1/12 массы атома углерода 12С.
- Относительная молекулярная масса вещества Мr — отношение массы молекулы данного вещества к 1/12 массы атома углерода 12С. Относительная молекулярная масса равна сумме относительных атомных масс химических элементов, образующих соединение, с учётом числа атомов данного элемента.
- Массовая доля химического элемента ω(Х) показывает, какая часть относительной молекулярной массы вещества X приходится на данный элемент.
АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
1. Существуют вещества с молекулярным и немолекулярным строением.
2. Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры.
3. Молекулы находятся в непрерывном движении.
4. Молекулы состоят из атомов.
6. Атомы характеризуются определённой массой и размерами.
При физических явлениях молекулы сохраняются, при химических, как правило, разрушаются. Атомы при химических явлениях перегруппировываются, образуя молекулы новых веществ.
ЗАКОН ПОСТОЯНСТВА СОСТАВА ВЕЩЕСТВА
Каждое химически чистое вещество молекулярного строения независимо от способа получения имеет постоянный качественный и количественный состав.
ВАЛЕНТНОСТЬ
Валентность — свойство атома химического элемента присоединять или замещать определённое число атомов другого элемента.

ХИМИЧЕСКАЯ РЕАКЦИЯ
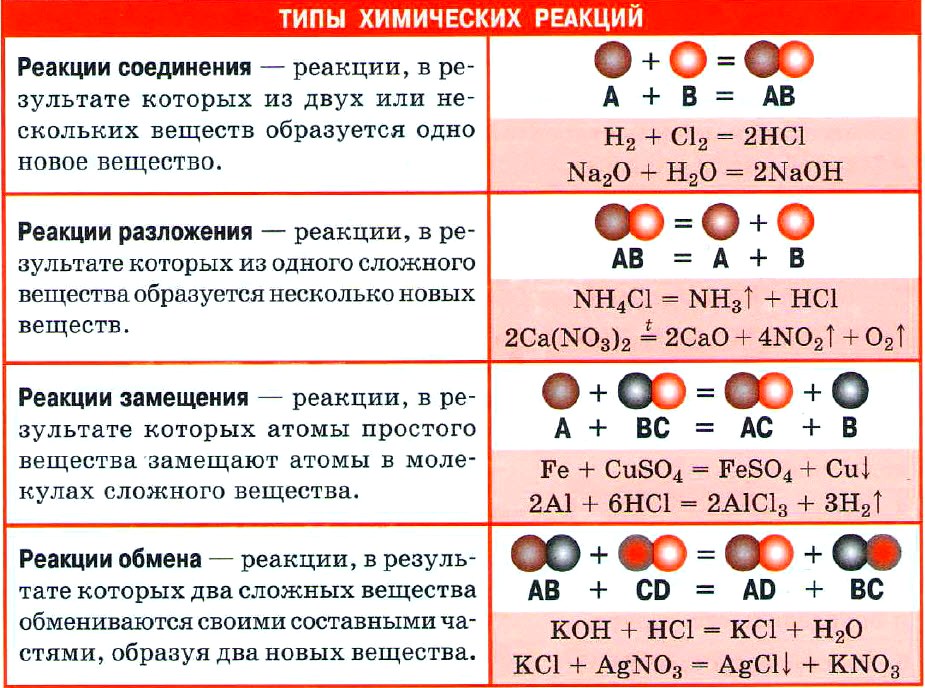
Химическая реакция — явление, в результате которого из одних веществ образуются другие. Реагенты — вещества, вступающие в химическую реакцию. Продукты реакции — вещества, образующиеся в результате реакции.
Признаки химических реакций:
1. Выделение теплоты (света).
2. Изменение окраски.
3. Появление запаха.
4. Образование осадка.
5. Выделение газа.
- Химическое уравнение — запись химической реакции с помощью химических формул. Показывает, какие вещества и в каком количестве вступают в реакцию и получаются в результате реакции.
ЗАКОН СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВ
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции. В результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка.
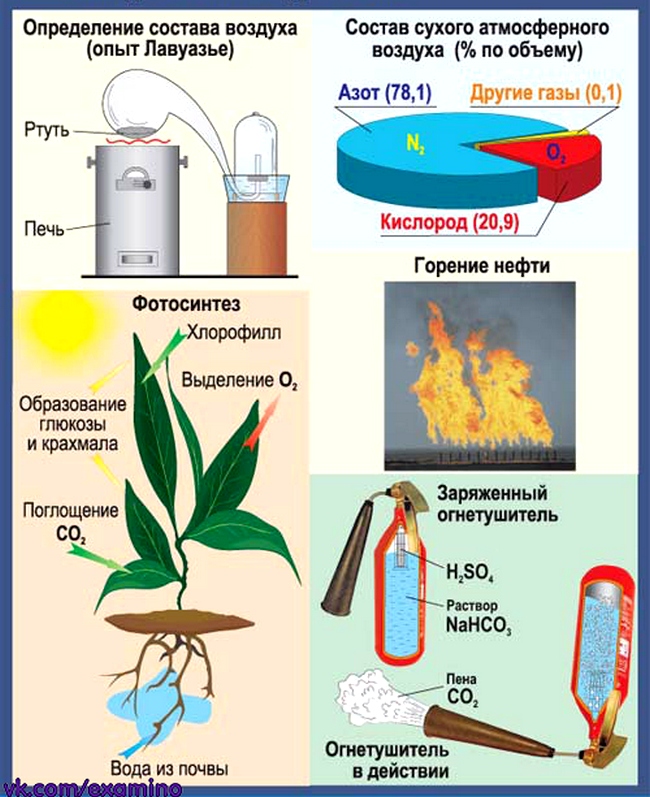
Важнейшие классы неорганических веществ
Воздух. Кислород. Горение
Конспект урока «Химия 8 класс. Все формулы и определения».
Следующая тема: «».
Химия: уроки, тесты, задания.
Первоначальные химические понятия и теоретические представления
-
Предмет химии
-
Физические тела и вещества
-
Чистые вещества и смеси
-
Разделение смесей. Методы очистки веществ
-
Атомы и молекулы
-
Химические элементы. Знаки химических элементов
-
Закон постоянства состава
-
Химические формулы
-
Простые и сложные вещества
-
Валентность. Степень окисления. Составление формул по валентностям и степеням окисления
-
Физические и химические явления
-
Признаки и условия протекания химических реакций
-
Закон сохранения массы веществ
-
Уравнения химических реакций
Классы неорганических веществ
-
Классификация веществ
-
Металлы
-
Неметаллы
-
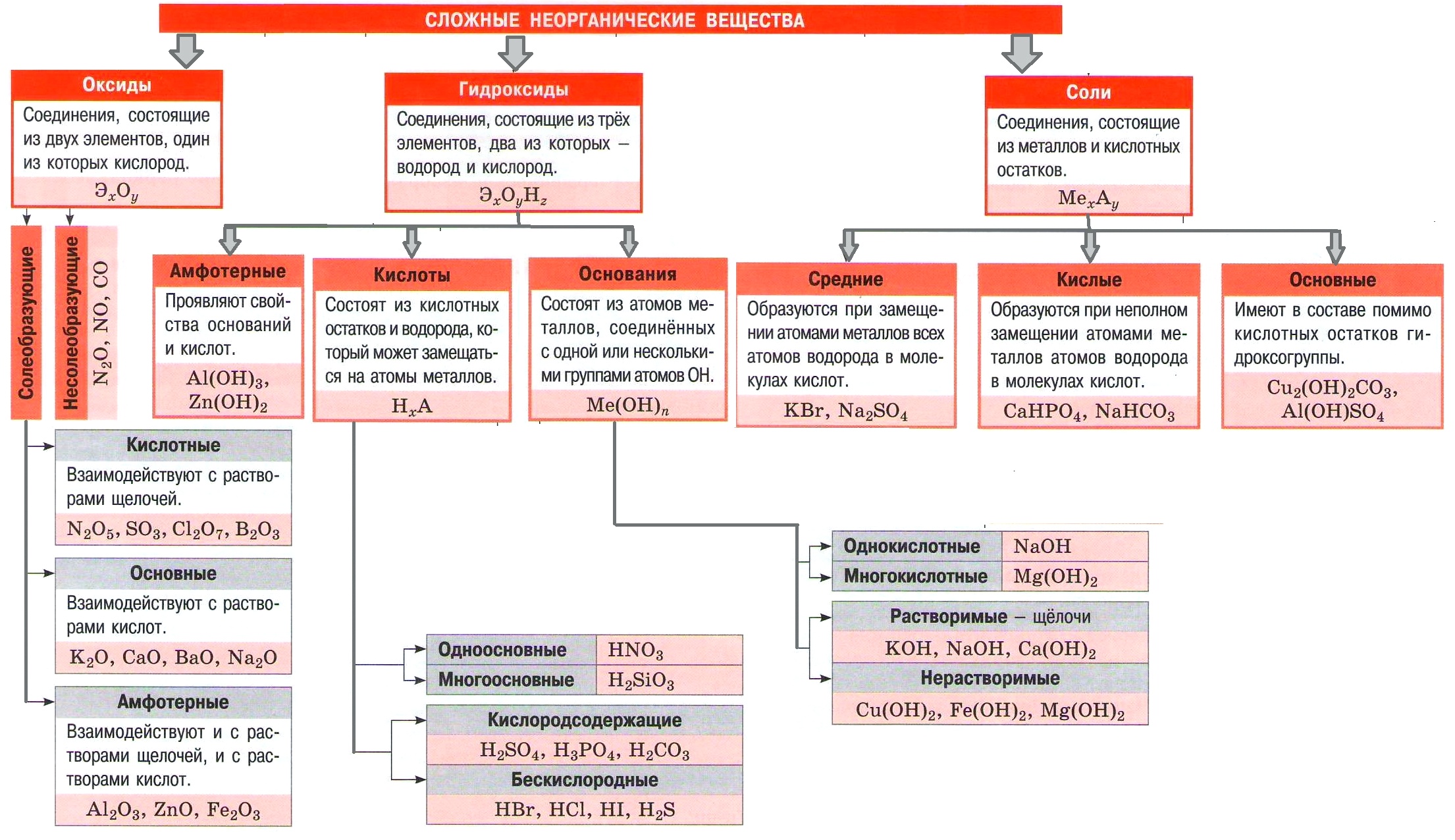
Оксиды
-
Основания
-
Кислоты
-
Амфотерные гидроксиды
-
Соли
-
Взаимосвязь между классами неорганических веществ
Периодический закон и строение атомов
-
Периодический закон
-
Периодическая система
-
Строение ядра атома
-
Строение электронной оболочки атома
-
Периодическая таблица и закономерности изменения свойств химических элементов
Строение вещества
-
Электроотрицательность химических элементов
-
Типы химической связи
-
Ионная связь
-
Ковалентная связь
-
Металлическая связь
-
Аморфные и кристаллические вещества
-
Кристаллические решётки
Окислительно-восстановительные реакции
-
Степень окисления
-
Окислители и восстановители, окисление и восстановление
Растворы
-
Состав растворов
-
Растворение. Растворимость
-
Электролиты и неэлектролиты
-
Электролитическая диссоциация кислот, оснований и солей
-
Свойства ионов
-
Среда растворов. Индикаторы
-
Реакции ионного обмена. Реакция нейтрализации
Классификация химических реакций и закономерности их протекания
-
Классификация химических реакций по числу и составу вступивших в реакцию и образовавшихся веществ
-
Классификация химических реакций по тепловому эффекту
-
Классификация химических реакций, ОВР
-
Скорость протекания химической реакции. Катализаторы
Химия неметаллов
-
Водород
-
Кислород
-
Вода
-
Галогены. Хлор и его соединения
-
Сера и её соединения
-
Азот и его соединения
-
Фосфор и его соединения
-
Углерод и его соединения
-
Кремний и его соединения
Химия металлов
-
Щелочные металлы и их соединения
-
Щелочноземельные металлы и их соединения
-
Алюминий и его соединения
-
Железо и его соединения
Органические вещества
-
Состав и строение органических веществ
-
Углеводороды. Полимеры
-
Спирты
-
Карбоновые кислоты
-
Жиры
-
Углеводы
-
Белки
Человек в мире веществ, материалов и химических реакций
-
Природные источники углеводородов
-
Химия и пища. Химия и здоровье
Методы исследования в химии
-
Методы научного познания. Химический эксперимент
-
Получение, собирание и распознавание газов
-
Обнаружение ионов
Расчётные задачи по химии
-
Физические величины
-
Относительная атомная и молекулярная массы. Вычисление относительной молекулярной массы вещества
-
Количество вещества
-
Вычисление молярной массы вещества
-
Вычисление количества вещества
-
Вычисление массовой доли элемента в химическом соединении
-
Установление простейшей формулы вещества по массовым долям элементов
-
Простейшие вычисления по уравнениям химических реакций
-
Вычисления по уравнениям реакций, если исходное вещество содержит определённую долю примесей
-
Вычисление массовой доли вещества в растворе
-
Вычисления, связанные с приготовлением растворов с заданной массовой долей растворённого вещества
-
Комбинированные задачи
Класс заполнен на 100 %
|
1. |
Радиусы атомов
|
1 |
|
2. |
Изменение свойств в группах
|
1 |
|
3. |
Самый сильный неметалл
|
1 |
|
4. |
Высшие гидроксиды
|
2 |
|
5. |
Высшие оксиды
|
2,5 |
|
6. |
Металлические свойства и радиусы атомов
|
3 |
|
7. |
Определи неметалл
|
3 |
|
8. |
Основные свойства оксидов
|
4 |
|
9. |
Реакции высших оксидов
|
4 |
Химия, 8–9 класс: уроки, тесты, задания
Первоначальные химические понятия и теоретические представления
-
Предмет химии
-
Физические тела и вещества
-
Чистые вещества и смеси
-
Разделение смесей. Методы очистки веществ
-
Атомы и молекулы
-
Химические элементы. Знаки химических элементов
-
Закон постоянства состава
-
Химические формулы
-
Простые и сложные вещества
-
Валентность. Степень окисления. Составление формул по валентностям и степеням окисления
-
Физические и химические явления
-
Признаки и условия протекания химических реакций
-
Закон сохранения массы веществ
-
Уравнения химических реакций
Классы неорганических веществ
-
Классификация веществ
-
Металлы
-
Неметаллы
-
Оксиды
-
Основания
-
Кислоты
-
Амфотерные гидроксиды
-
Соли
-
Взаимосвязь между классами неорганических веществ
Периодический закон и строение атомов
-
Периодический закон
-
Периодическая система
-
Строение ядра атома
-
Строение электронной оболочки атома
-
Периодическая таблица и закономерности изменения свойств химических элементов
Строение вещества
-
Электроотрицательность химических элементов
-
Типы химической связи
-
Ионная связь
-
Ковалентная связь
-
Металлическая связь
-
Аморфные и кристаллические вещества
-
Кристаллические решётки
Окислительно-восстановительные реакции
-
Степень окисления
-
Окислители и восстановители, окисление и восстановление
Растворы
-
Состав растворов
-
Растворение. Растворимость
-
Электролиты и неэлектролиты
-
Электролитическая диссоциация кислот, оснований и солей
-
Свойства ионов
-
Среда растворов. Индикаторы
-
Реакции ионного обмена. Реакция нейтрализации
Классификация химических реакций и закономерности их протекания
-
Классификация химических реакций по числу и составу вступивших в реакцию и образовавшихся веществ
-
Классификация химических реакций по тепловому эффекту
-
Классификация химических реакций, ОВР
-
Скорость протекания химической реакции. Катализаторы
Химия неметаллов
-
Водород
-
Кислород
-
Вода
-
Галогены. Хлор и его соединения
-
Сера и её соединения
-
Азот и его соединения
-
Фосфор и его соединения
-
Углерод и его соединения
-
Кремний и его соединения
Химия металлов
-
Щелочные металлы и их соединения
-
Щелочноземельные металлы и их соединения
-
Алюминий и его соединения
-
Железо и его соединения
Органические вещества
-
Состав и строение органических веществ
-
Углеводороды. Полимеры
-
Спирты
-
Карбоновые кислоты
-
Жиры
-
Углеводы
-
Белки
Человек в мире веществ, материалов и химических реакций
-
Природные источники углеводородов
-
Химия и пища. Химия и здоровье
Методы исследования в химии
-
Методы научного познания. Химический эксперимент
-
Получение, собирание и распознавание газов
-
Обнаружение ионов
Расчётные задачи по химии
-
Физические величины
-
Относительная атомная и молекулярная массы. Вычисление относительной молекулярной массы вещества
-
Количество вещества
-
Вычисление молярной массы вещества
-
Вычисление количества вещества
-
Вычисление массовой доли элемента в химическом соединении
-
Установление простейшей формулы вещества по массовым долям элементов
-
Простейшие вычисления по уравнениям химических реакций
-
Вычисления по уравнениям реакций, если исходное вещество содержит определённую долю примесей
-
Вычисление массовой доли вещества в растворе
-
Вычисления, связанные с приготовлением растворов с заданной массовой долей растворённого вещества
-
Комбинированные задачи
Класс заполнен на 100 %
Восьмой класс Планы уроков химии, домашние задания, викторины
Восьмой класс планы уроков химии, домашние задания, викторины
Восьмой класс Химия
-
-
Шестой класс
Седьмой класс, Восьмой класс еще 2…, седьмой класс, восьмой класс -
12,660 Просмотры
-
3
Избранные
Анализирующая точка зрения через сказки
Линдси Джозеф
Местонахождение: Остров Авторская…..
Задача: Студенты смогут:
-Описывать ключевую информацию текста с заданной точки зрения
-Обсудите разные точки зрения
-Откройте для себя важность просмотра…-
Шестой класс
Седьмой класс, Восьмой класс еще 2 …, Седьмой класс, Восьмой класс
-
Шестой класс
-
- Восьмой класс
-
1,060 Просмотры
-
1
любимец
9 22 Активность молекулярных движений
Рэйчел Риланд из Бостонской университетской чартерной школы
Местонахождение: Научный метод и характеристики живых существ
Описание: Это упражнение знакомит учащихся с идеей градиентов концентрации, с тем, как молекулы движутся, чтобы распространяться, и как молекулы движутся с высокой концентрацией…
-
-
Пятый класс
Шестой класс, Седьмой класс, Восьмой класс еще 3…, Шестой класс, Седьмой класс, Восьмой класс -
6,782 Просмотры
-
3
Избранные
Великая гонка вязкости и типы лавы
Дэвид Куявски из Bird Middle
Местонахождение: Геология
Цель: YWBAT:
1.) Определите и объясните вязкость
2.) Проверка вязкости различных жидкостей.
3.) Объясните роль содержания кремнезема и температуры в…-
Пятый класс
Шестой класс, Седьмой класс, Восьмой класс еще 3 …, Шестой класс, Седьмой класс, Восьмой класс
-
Пятый класс
-
9.28 Пассивный транспорт
Рэйчел Риланд из Бостонской университетской чартерной школы
Расположение: Ячейки
Цель: Объяснить процесс пассивного транспорта в клетках.
-
- Восьмой класс
-
2,890 Просмотры
-
1
любимец
9.27 Введение в словарь клеточного транспорта
Рэйчел Риланд из Бостонской университетской чартерной школы
Расположение: Ячейки
Цель: Определить еженедельные словарные термины. (Сотовый транспорт)
-
-
Восьмой класс
Девятый класс еще 1 …, Девятый класс -
31,957 Просмотры
-
1
любимец
Атомы и периодическая таблица
Ванесса Палмер
Местонахождение: 8-й класс физико-химического комплекса
Описание: Так же, как предыдущий блок классифицировал и характеризовал материю на макроуровне, этот блок делает то же самое для атомов и молекул.Поговорим о том, что…
-
Восьмой класс
-
Большая идея:
Нужны уроки STEM, чтобы помочь вашим ученикам изучить жару и температуру? Это тот самый.Ресурсы
(15)Размышления
(1)Избранные
(352) -
-
Восьмой класс
Девятый класс, Десятый класс еще 2…, девятый класс, десятый класс -
1,753 Просмотры
Statix 101
Кэтрин Ричард
Расположение: Static Electricity
Цель: * Понимание структуры атома и того, что называется электростатической нейтральностью / обладанием чистым положительным или отрицательным зарядом.* Понимание…
-
Восьмой класс
Девятый класс, Десятый класс еще 2 …, Девятый класс, Десятый класс
-
Восьмой класс
-
-
Пятый класс
Шестой класс, Седьмой класс, Восьмой класс еще 3 …, Шестой класс, Седьмой класс, Восьмой класс -
1,913 Просмотры
Написание выражений и уравнений для реальных сценариев, день 3
Уилл Остин из Roxbury Prep, кампус Mission Hill
Расположение: 6.Цены
Цель: Учащиеся смогут писать выражения и уравнения для реальных сценариев.
-
Пятый класс
Шестой класс, Седьмой класс, Восьмой класс еще 3 …, Шестой класс, Седьмой класс, Восьмой класс
-
Пятый класс
-
Вода в гидросфере: свойства, распределение и управление
Пьер де СенCroix from Morehead City Middle
Цель: Учащийся сможет понять круговорот воды.
Учащийся сможет понять свойства воды в отношении гидросферы. -
Фазы — движущиеся атомы
Эммануэль Баррера
Цель: SWBAT сравнить и противопоставить расположение и движение атомов в трех различных классах материи (твердое, жидкое и газообразное) в отношении температуры…
-
Дело
Ванесса Палмер
Местонахождение: 8-й класс физико-химического комплекса
Описание: Этот короткий блок задуман как мост между физическими явлениями макроуровня, которые мы изучали в первом семестре класса, и микроуровнем c…
-
- Восьмой класс
-
1,329 Просмотры
-
1
любимец
Свойства вещества
Алексис Кинг
Место проведения: 2010-2011: 8-й класс по физике и химии
Описание: Этот модуль исследует физические и химические свойства и изменения материи.
-
Химические реакции
Алексис Кинг
Место проведения: 2010-2011: 8-й класс по физике и химии
Описание: Этот модуль исследует развитие и структуру атома, организацию и применение периодической таблицы элементов, а также интерпретацию и балансирование химии…
-
Научное исследование: Измерение
Алексис Кинг
Место проведения: 2010-2011: 8-й класс по физике и химии
Описание: Этот модуль исследует основы измерения, единицы измерения и инструменты измерения.Кроме того, студенты сосредотачиваются на применении точных…
Что-то пошло не так. Смотрите подробности для получения дополнительной информации
,
Периодическая таблица элементов и химия
Chemicool
| Группа | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| Период 1 |
1 H |
2 He |
||||||||||||||||
| 2 | 3 Li |
4 Be |
5 Б |
6 К |
7 № |
8 O |
9 ф |
10 Ne |
||||||||||
| 3 | 11 Na |
12 мг |
13 Al |
14 Si |
15 п |
16 ю |
17 Класс |
18 Ар |
||||||||||
| 4 | 19 К |
20 Ca |
21 СК |
22 Ti |
23 В |
24 Кр |
25 млн |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 Как |
34 SE |
35 руб. |
36 Kr |
| 5 | 37 | 38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Пн |
43 Tc |
44 Ру |
45 Rh |
46 Pd |
47 Ag |
48 Кд |
49 В |
50 Sn |
51 Сб |
52 Te |
53 I |
54 Xe |
| 6 | 55 CS |
56 Ba |
57-71 |
72 Hf |
73 Ta |
74 Вт |
75 Re |
76 Ос |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Тл |
82 Pb |
83 Bi |
84 Po |
85 При |
86 Rn |
| 7 | 87 Fr |
88 Ra |
89-103 |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 HS |
109 тонн |
110 DS |
111 Rg |
112 Cn |
113 Nh |
114 эт |
115 Mc |
116 Ур. |
117 Ts |
118 Ог |
| 57 La |
58 CE |
59 Пр |
60 Nd |
61 пм |
62 См |
63 Eu |
64 Gd |
65 ТБ |
66 Dy |
67 Ho |
68 Er |
69 Тм |
70 Yb |
71 Лю |
||||
| 89 Ac |
90 Чт |
91 Па |
||||||||||||||||
.