План-конспект урока по физике (10 класс) по теме: Урок по физике в 10 классе Лабораторная работа Изучение изопроцессов
Учитель физики КГУ «Гимназии № 5 акимата г.Шахтинска» Антощук Л.Г.
Лабораторная работа «Изучение изотермического процесса в газе»
10 класс, физико- математический профиль.
ЦЕЛЬ: Обеспечить выполнение обучающимися экспериментальных исследований изопроцессов в газах.
ОБРАЗОВАТЕЛЬНЫЕ ЗАДАЧИ УРОКА:
1) Сделать экспериментальную проверку закона Бойля- Мариотта путем сравнения параметров газа в двух термических состояниях..
2) Продолжить формирование навыков и умений работать с графиками изопроцессов.
3) В результате обсуждения результатов работы доказать справедливость закона Бойля- Мариотта.
РАЗВИВАЮЩИЕ ЗАДАЧИ:
1) Развивать исследовательскую и творческую деятельность обучающихся, которая активизирует познавательные интересы учеников.
ВОСПИТАТЕЛЬНЫЕ ЗАДАЧИ:
1) Добиваться последовательности и аккуратности записи результатов при экспериментальных исследованиях. 2) Формирование навыков работы в команде.
Ход урока
- Огр момент. Объяснение критерий и дискриптора При подготовке к уроку учащиеся выбирают карточки по форме цвету. ( квадрат –группа теоретиков , прямоугольник- группа практиков, треугольник- группа аналитиков , круг- группа экспертов )
- Рассаживаются в зависимости от выбранной фигуры. (на столах приготовлен материал для изучения данной группы)-10 мин
- Переход учащихся в новую группу по цвету ( выполнение работы лабораторной каждый вносит свой вклад все заносят свои данные в таблицу. Теоретик объясняет теорию , практик выполнят работу, аналитик вычисляет погрешности . Эксперт готовит защиту .) ( Экспертов можно подготовить заранее )-15мин
- Физ минутка -2-3 мин
- Защита-10
- Рефлексия эксперты ставят оценку группе и каждый сам оценивает себя в группе ( итоговая оценка выводиться из трех двух эксперта и учителя)
|
Оценка эксперта |
Оценка учителя |
Средний бал |
nsportal.ru
Изучение изотермического процесса (лабораторная работа) | Физика. Закон, формула, лекция, шпаргалка, шпора, доклад, ГДЗ, решебник, конспект, кратко
Цель: проверить исследовательским путем закон Бойля-Мариотта.
Оснащение: стеклянный цилиндр с водой высотой 40—50 см; стеклянная трубка длиной 50 см, закрытая (запаянная) с одного конца; барометр; измерительная линейка с делением 1 мм; штатив.
| Рис. 1.7. Изучение изотермического процесса |
Теоретические сведения. Закон Бойля-Мариотта устанавливает соотношение между давлением и объемом данной массы газа при постоянной температуре: p1 / p2 = V2 / V1или p1V1 = p2V2.
Если в цилиндр с водой (рис. 1.7) опустить открытым концом закрытую с одного конца стеклянную трубку, то воздух в ней будет находиться под давлением:
p = (p0 + h / 13,6),
где p0 — атмосферное давление (в мм рт. ст.), h — разница уровней воды в цилиндре и в трубке (измеренная в мм).
Уровень будет изменяться в зависимости от глубины погружения трубки в воду.
Объем столбика воздуха в трубке равен V = S • l, где S — площадь поперечного сечения трубки, l — длина столбика воздуха в ней. Он также зависит от глубины погружения трубки в воду.
Выполнение работы:
1. Погрузите стеклянную трубку в воду открытым концом на максимальную глубину. Измерьте в ней длину столбика воздуха l и разницу уровней h.
2. Измерьте с помощью барометра атмосферное давление (в мм рт. ст.) и вычислите значение давления p, под которым находится воздух в трубке.
3. Данные внесите в таблицу и произведите другие необходимые расчеты.
Поскольку площадь поперечного сечения трубки S остается неизменной, объем V можно рассчитывать в условных единицах длины l.
4. Повторите опыт для другой глубины погружения трубки, внесите в таблицу и сделайте необходимые расчеты.
5. Определите абсолютную и относительную погрешности измерений. Запишите полученные результаты с учетом погрешности измерения.
6. Сравните полученные результаты и сделайте выводы.
|
№ опыта
|
p0, мм рт. ст.
|
h, мм Материал с сайта http://worldofschool.ru
|
p = (p0 + h / 13,6), мм рт. ст.
|
V(l), мм
|
pV
|
|
1.
|
|
|
|
|
|
На этой странице материал по темам:
-
Как написать вывод в лабораторной работе изучение изотермического процесса
-
Лабараторная изучение изотермического процесса
-
Решение лабораторной работы изучение изотермического процесса
-
Лабораторная работа по изучению изотермического процесса
-
Исследование изотермического процесса лабораторная работа решение
worldofschool.ru
ГДЗ №1 по физике, Физика 10 класс. Мякишев Г.Я.. Готовое домашнее задание
Наш робот распознал:
Практикум
Работа 1
Исследование зависимости между давлением, объемом и температурой газа
Мы имели уже дело с газовыми законами — в лабораторной рабо-те I проверили справедливость икот КГк.Чкхспка. Вполне может случиться, что на практикуме вас ожидает проверка закона Бой-ля-Мариотта, описывающего изотермический процесс; дело в том, что эта работа в прежние времена когда десятый класс был еще девятым была включена в число обычных лабораторны> ведено л старом учебнике; всем без исключения учш любой школьный кабинет содержит иеобхолими.: л материалы. Работа ничуть не сложнее проверки закона Гей-Люссака, тому же не требует наличия горячей воды, что упрощает ее подготовку;
е- приборы V.
Так как измерение массы мы производим дважды — до электролиза и после; в расчел же мм иоллазляем го.:ько разницу уги измерений т. если вы неплохо разобрались в ГеЙ-Люссаке, с Ьойлем-Марнотгом расправитесь без труда, тем более после объяснения этой работы учителем. Однако есть и другая возможность: школьные приборы вполне позволяю! произвести проверку справедливости уравнения состояния газа — уравнения, из которого, собственно, и вытекают газовые законы. В нашей книге мы решили рассмотреть именно эту работу; се изучение может стать хорошим подспорьем, если даже на практикуме вам встре- Бойля-Мариотта или любой другой.
Уравнение состояния идеального газа можно перепить следующим образом:
м-
Есдн К1
а будет постоянной величиной:
угие два параметра и
:е время оставалось величиной
Наша задач; ной: нужно взяч
ство газа, измерить и метра и повторить измерс!
Состояний. В состав входят лас широкие
собираем из подру
Л
расчет. Равснст-
;> :
во -г-1 и -Г докажет нам справедливость уравнения Менделеева-Клапейрона зто другое состояния.
В тиши школьных лаборант-ЕС тре чае тс я порой немудре-прибор с очаровательным ПИГС Прибор ши Газовых законов или :го прибора см. рис.
ее миллиметровыми . прибор достаточно
принципе, >го материала. Мы опишем сейчас работу, прово-прнбором.
Широкие трубки наполняются водой — холодной комнатной температуры и горячей 60-70С. Наполняют их не сверху свободное пространство. Узкую трубку опускают в горячую ноду и держат в ней 3-4 минуты.
С помощью барометра в ПИГС не 1 входит, но в работе нужен определяют давление воздуха такое же сейчас и в нашей узкой трубке, с помощью термометра температуру горячей воды, с помощью линейки — длину узкой трубки считаем, что объем V воздуха в ней численно равен длине этой трубки . Результаты измерений заносим в таблицу.
Закрыв отверстие в узкой трубке пальцем, быстро но осторожно переносим ее в холодную воду открытым концом вниз и ждем опять 3-4 минуты.
Измеряем: объем V, воздуха, численно равный Ь 11 — и. где 1и — высота столба воды, вошедшего в узкую трубку отечнтывается по миллиметровой шкале этой трубки; температуру холодной воды. Вычисляем давление Рг пну три 1 рубки как Р: Р + рви; п.-это
разность уровней волы в широкой и узкой трубках см. рис..
Вот и все. Опыты провидятся 2-3 раза, все это зано обсчитывается. Не забудьте, что I мм рт.ст. 133,3 П; ды р 1001 кг/м. Ответы на остальные вопросы, нале получить из приведенного здесь образна.
интересует конкретный объем, V.
также присутствует; глав-
опы- г; Давление Р,. На У Объем Давление 2. Па Па Р,У, Т Р>У. т.
2 3 0,6 III 179,5 185,5 0,5 0,52 0.53 106565 106467 106369 183,1 189 191.8 0,98 0.98 0.99
— 190.6-
Вычисления:
Р,-770 мм рт.ст. 133.3 Па- 102641 Па.
1 Т, — 70С, следовательно. Т, — 70 — 273 343 К; Р,У, 103641 ПаО.бм Па м
Т, 343 К 1795 К
2 Т! — 59С, следователыто, Т, 59 + 273 332 К; Р,У 102641 Па 0.6 м1 Пам
Т, 332 К 1855 К
3 Т, — 50С следовательно, Т, 50 273 323 К; Р,У, 102641ПаО.6м
Т, 323 К
Второе состояние газа: 1Т. — 18С, следовательно. Т, — 18+ 273 291 К;
Р;- 102641 Па 1000 кг/м 9,81 м/с! 0,4 м 106565 11а;
Р.У 106565 Па 0.5 м Пам
Тз — 291 К 183,1 к .
2 Т 20С, следовательно. Тт — 20 + 273 293 К;
Р,- 102641 Па+1000 кг/м-9,81 м/с;-0,39 м-106467 Па; Р.У- 106467 Па 0.52 м Нам Т. 293 К ,89 К
3Тг — 21С, следовательно. Т, — 21 — 273 — 294 К;
Р-102641 Па+1000 кг/м1-9,81 м/с30,38 м- 106369 Па; РУ. 106369 Па-0.53 м! Пам
Т2 294 К 1Л-8 К
Сравнение результатов:
т, 7 к ТЖ———ИГ
тг
При проведении внутрь в
А
/ объемы V. / Совет Что касается / 1вычным — если I
в оберегайте узкую трубку от паче вы неверно определите
ада, он должен быть для вас уже при-по1 решности измерений, при сравнении левой и гравии ч-,ч1 чг::по:1 1;рм и/ получалась бы строгая единица. Работа эта достаточно трудоемка, поэтому расчет погрешностей в
ней. к;;ь ираии.ц, : Чп: яи>..1 I и 1-Х 1реГ> 1Л01.
11 ! 1с-!0м> мри иер-тч-е у 4ьпй труокл из горячей поды холодную отверстие в ней закрывают
прошипим ,
произволение
тпК
РУ Р.У;
иным, и равенство -у — наруши
Г I I очечу у кую трубку сначала от лодную воду Нельзя ли наоборот
Нельзя. Если так сделать, объем п чиваться, и выйдет из перевернутой трубки наружу. В таких условиях
;ч>я-!, какие-ниш циклу ии; Сл.ил ш/шгиаю.
О-ба- :а гельно повторите перед зашитой построение изоифм. изобар и изохор н различных координатах потребуют. Век перемены не ви-
www.mygdz.com
Лабораторная работа Изучение изотермического процесса 10 класс
Чтобы посмотреть презентацию с картинками, оформлением и слайдами, скачайте ее файл и откройте в PowerPoint на своем компьютере.
Текстовое содержимое слайдов презентации:
ИзопроцессыУчитель физики МОУ «СОШ «22 с УИОП»Бровкина Ю.В.
Изопроцессы
Лабораторная работа.«Изучение изотермического процесса в газе и определение его характеристик»Цель: проверка закона Бойля-Мариотта, определение температуры, количества вещества, массы, плотности газа, массы молекулы, концентрации ,числа молекул, среднеквадратичной скорости , средней кинетической энергии молекулОборудование: прибор «Изотерма» из набора «Научные развлечения», микрокалькулятор, цифровая лаборатория.
Проведение эксперимента
Ход работы:1. Заполним таблицу:{E8B1032C-EA38-4F05-BA0D-38AFFFC7BED3}№ДавлениеОбъемТемпературакПа ПаМл мᵌ⁰C К12345
2. Проверим закона Бойля-Мариоттаp1V1 = p2V2 = pnVn
3. Построим изотермы
4. Вычислим характеристики газаГаз- воздух с молярной массой μ=0,029кг/мольТемпературу T = (t °C + 273,15) К.массуплотностьмассу молекулычисло молекулконцентрацию Среднеквадратичную скоростьСреднюю кинетическую энергию молекул
5. Изменение параметров{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}УвеличиваетсяУменьшаетсяНе изменяется
ПроверкаУвеличиваетсяУменьшаетсяНе изменяетсяОбъем от 36*10-6м3 до 75*10-6м3 Давление от 1,9*105Па до 0,95*105ПаТемпература 296К Плотность от2,3кг/м3 до 1,12 кг/м3Кол-во вещества 3*10-3моль Концентрация от 4,8*1027до 2,4*1027м-3Масса газа 8,4*10-5кг Масса молекулы 4*10-26кг Число молекул 1,74*1019шт Ср.кв.скорость 510м/с Ср.кин.энергия 6,1*10-21Дж
Домашнее задание:Касьянов,10, выполнение задач стр. 267 №3,4 ,Подготовить сообщения: изопроцессы вокруг меня.
Приложенные файлы
profhelp.net
Лабораторная работа Изопроцессы в газах.
Лабораторная работа № 5
Тема: Исследование изопроцессов в газах.
Цель работы: на опыте проверить изотермический, изохорический и изобарного процессов в газах.
Оборудование: пластиковый сосуд, Медицинский манометр, шприц, зажимы, тройник, трубка ПВХ, термометр, барометр, стакан.
Теория: Газовые законы.
Давление (p), объем (V) и температура (T) являются основными параметрами состояния газа. Всякое изменение состояния газа называется термодинамическим процессом. Термодинамические процессы, протекающие в газе постоянной массы при неизменном значении одного из параметров состояния газа, называются изопроцессами. Изопроцессы являются идеализированной моделью реального процесса в газе.
Изотермический процесс (T = const)
Изотермическим процессом называются изменения состояния газа, протекающие при постоянной температуре. Изотермический процесс в идеальном газе подчиняется закону Бойля-Мариотта: Для газа данной массы произведение давления газа на его объем постоянно, если температура газа не меняется.
Формулу закона можно записать иначе где — параметры газа в разные моменты времени
Изобарный процесс (p =const)
Изобарным процессом называются изменения состояния газа, протекающие при постоянном давлении. Изобарный процесс в идеальном газе подчиняется закону Гей-Люссака:
Для газа данной массы отношение объема газа к его температуре постоянно, если давление газа не меняется. Формулу закона можно записать иначе где — параметры газа в разные моменты времени.
Изохорный процесс (V = const)
Изохорным процессом называются изменения состояния газа, протекающие при постоянном объеме. Изохорный процесс в идеальном газе подчиняется закону Шарля:
Для газа данной массы отношение давления газа к его температуре постоянно, если объем газа не меняется. Формулу закона можно записать иначе где — параметры газа в разные моменты времени
Схема установки
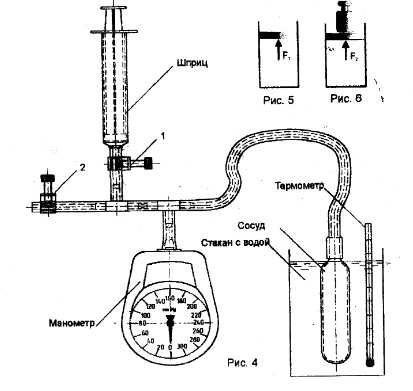
Указание к работе:
1.Изучение изотермического процесса
Открыть зажимы 1,2 и вывести поршень шприца в положение полного объема(10 мл). В этом случае воздух в сосуде сообщается с атмосферой, его температура и давление равны атмосферному.
Зафиксировать по барометру анероиду в кабинете атмосферное давление, а по показаниям термометра температуру воздуха.
Закрыть зажим 2 и, постепенно вводя поршень, зафиксировать показания приборов, занося их в таблицу
После определения объема воздуха и его давления в каждом опыте рассчитайте их произведения.
|
№ опыта |
Объем воздуха в системе, V,мл |
Давление в сосуде Р=ратм+рманом |
Произведение давления воздуха на его объем, рV |
|
1 |
50+10 |
||
|
2 |
50+7 |
||
|
3 |
50+5 |
||
|
4 |
50+3 |
Сравните результаты расчетов и сделайте вывод о выполнении закона Бойля-Мариотта
2.Изучение изобарного процесса
Открыть зажимы 1,2 установить поршень на делении 2мл, и закрыть зажим 2. Плавным перемещением поршня установить на манометре давление , например 30 мм.рт.ст.
Измерьте температуру окружающей среды и объем воздуха в замкнутой системе, заполните таблицу:
|
№опыта |
Давление Р=ратм+рманом |
Объем воздуха в системе, V,мл |
Абсолютная температура, Т |
|
1 |
|||
|
2 |
Поместите в стакан с горячей водой сосуд и термометр, снять показание термометра когда воздух в сосуде достаточно прогреется. Следить за показанием манометра, что бы показания оставались постоянными (регулируя штоком шприца).
По данным таблицы сделайте расчеты и убедитесь в справедливости закона Гей-Люссака.
3. Изучение изохорного процесса
Выжать воздух из шприца и пережать трубку зажимом 1. Убедится в нулевых показаниях монометра, пережать трубку зажимом 2.
Измерить температуру окружающей среды, а барометром атмосферное давление.
|
№опыта |
Объем, мл |
Давление |
Температура, Т |
|
1 |
|||
|
2 |
Поместить в стакан с горячей водой сосуд и термометр. Снять показания термометра и манометра после прогрева воздуха в сосуде, занести результаты в таблицу.
По данным таблицы и расчетам, проделанным по формуле, убедитесь в справедливости закона Шарля
multiurok.ru
Лабораторная работа изучение изотермического процесса
Чтобы посмотреть презентацию с картинками, оформлением и слайдами, скачайте ее файл и откройте в PowerPoint на своем компьютере.
Текстовое содержимое слайдов презентации:
ИзопроцессыУчитель физики МОУ «СОШ «22 с УИОП»Бровкина Ю.В.
Изопроцессы
Лабораторная работа.«Изучение изотермического процесса в газе и определение его характеристик»Цель: проверка закона Бойля-Мариотта, определение температуры, количества вещества, массы, плотности газа, массы молекулы, концентрации ,числа молекул, среднеквадратичной скорости , средней кинетической энергии молекулОборудование: прибор «Изотерма» из набора «Научные развлечения», микрокалькулятор, цифровая лаборатория.
Проведение эксперимента
Ход работы:1. Заполним таблицу:{E8B1032C-EA38-4F05-BA0D-38AFFFC7BED3}№ДавлениеОбъемТемпературакПа ПаМл мᵌ⁰C К12345
2. Проверим закона Бойля-Мариоттаp1V1 = p2V2 = pnVn
3. Построим изотермы
4. Вычислим характеристики газаГаз- воздух с молярной массой μ=0,029кг/мольТемпературу T = (t °C + 273,15) К.массуплотностьмассу молекулычисло молекулконцентрацию Среднеквадратичную скоростьСреднюю кинетическую энергию молекул
5. Изменение параметров{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}УвеличиваетсяУменьшаетсяНе изменяется
ПроверкаУвеличиваетсяУменьшаетсяНе изменяетсяОбъем от 36*10-6м3 до 75*10-6м3 Давление от 1,9*105Па до 0,95*105ПаТемпература 296К Плотность от2,3кг/м3 до 1,12 кг/м3Кол-во вещества 3*10-3моль Концентрация от 4,8*1027до 2,4*1027м-3Масса газа 8,4*10-5кг Масса молекулы 4*10-26кг Число молекул 1,74*1019шт Ср.кв.скорость 510м/с Ср.кин.энергия 6,1*10-21Дж
Домашнее задание:Касьянов,10, выполнение задач стр. 267 №3,4 ,Подготовить сообщения: изопроцессы вокруг меня.
Приложенные файлы
educontest.net
Лабораторная работа «Изучение изотермического процесса в газе»
План-конспект урока
Тема урока: «Изучение изотермического процесса в газе»
Учитель: Фролов Юрий Викторович
Класс: 10
Тип урока: лабораторная работа
ЦЕЛЬ: Обеспечить выполнение обучающимися экспериментальных исследований изопроцессов в газах.
ОБРАЗОВАТЕЛЬНЫЕ ЗАДАЧИ УРОКА:
1) Сделать экспериментальную проверку закона Бойля- Мариотта путем сравнения параметров газа в двух термических состояниях..
2) Продолжить формирование навыков и умений работать с графиками изопроцессов.
3) В результате обсуждения результатов работы доказать справедливость закона Бойля- Мариотта.
РАЗВИВАЮЩИЕ ЗАДАЧИ:
1) Развивать исследовательскую и творческую деятельность обучающихся, которая активизирует познавательные интересы учеников.
ВОСПИТАТЕЛЬНЫЕ ЗАДАЧИ:
1) Добиваться последовательности и аккуратности записи результатов при экспериментальных исследованиях. 2) Формирование навыков работы в команде.
Ход урока
-
Организационный момент. (2 мин.)
-
Актуализация опорных знаний (2 мин.)
-
Что такое изопроцесс и какие виды изопроцессов вы знаете?
-
Что называют изотермическим процессом?
-
Сформулируйте закон Бойля-Мариотта.
3.Инструктаж по технике безопасности. (3 мин.)
4.Выполнение работы.
Лабораторную работу обучающиеся делают в группах. При подготовке к уроку обучающиеся выбирают карточки по форме цвету ( квадрат –группа теоретиков , прямоугольник- группа практиков, треугольник- группа аналитиков , круг- группа экспертов ).
Рассаживаются в зависимости от выбранной фигуры. (на столах приготовлен материал для изучения данной группы)-10 мин
Переход обучающихся в новую группу по цвету ( выполнение работы лабораторной каждый вносит свой вклад все заносят свои данные в таблицу. Теоретик объясняет теорию , практик выполнят работу, аналитик вычисляет погрешности . Эксперт готовит защиту .) ( Экспертов можно подготовить заранее )-15мин
Защита-10 мин.
5.Рефлексия (2 мин.)
Эксперты ставят оценку группе и каждый сам оценивает себя в группе ( итоговая оценка выводиться из трех двух эксперта и учителя)
6. Домашнее задание: Повторить § 65
7. Подведение итога (1 мин.)
infourok.ru