Решение задач для подготовки к ЕГЭ по химии (11 класс)
Решение задач для подготовки к ЕГЭ по химии.
ТИП I. НЕРАСТВОРИМОСТЬ ОТДЕЛЬНЫХ КОМПОНЕНТОВ.
Задача 1. Смесь алюминия и железа обработали избытком соляной кислоты, при этом выделилось 8,96 л газа (н.у.). Это же количество смеси обработали избытком раствора гидроксида натрия, выделилось 6,72 л газа (н.у.). Найти массовую долю железа в исходной смеси.
Решение
1) Составим уравнения реакций взаимодействия металлов с
кислотой и щелочью, при этом нужно учесть, что железо не реагирует с раствором щелочи:
2Al + 6HCl = 2AlCl3+ 3h3 ↑ (1)
2моль 3моль
Fe + 2HCl = FeCl2 +h3↑ (2)
1моль 1моль
2Al + 2NaOH + 6h3O == 2Na[Al(OH)4] + 3h3↑ (3)
2моль 3моль
2) Поскольку со щелочью реагирует только алюминий, то мож-
но найти его количество вещества:
ν(Н2) = V/VM = 6,72 (л) / 22,4 (л/моль) = 0,3 моль,
следовательно, ν(Al) = 0,2 моль.
3) Поскольку для обеих реакций были взяты одинаковые количества смеси, то в реакцию с
соляной кислотой вступило такое же количество алюминия, как и в реакцию со щелочью,
– 0,2 моль.
По уравнению (1) находим:
ν(Н2) = 0,3 моль.
4) Найдем количество вещества водорода, выделившегося в результате реакции металлов с кислотой:
νобщ(Н2) = V / VМ = 8,96 (л) / 22,4 (л/моль) = 0,4 моль.
5) Найдем количество вещества водорода, выделившегося при взаимодействии железа с кислотой, и затем количество вещества железа:
ν(Н2) = νобщ(Н2) – ν(Н2) = 0,4 – 0,3 = 0,1 моль,
ν(Fe) = 0,1 моль.
6) Найдем массы Al, Fe, массу смеси и массовую долю железа в смеси:
m(Al) = 27 (г/моль) * 0,2 (моль) = 5,4 г,
m(Fe) = 56 (г/моль) * 0,1 (моль) = 5,6 г,
mсмеси(Al, Fe) = 5,4 + 5,6 = 11 г,
ω(Fe) = mв-ва / mсм = 5,6 / 11 = 0,5091 (50,91 %).
Ответ. ω(Fe) = 50,91 %.
ТИП II. ПАРАЛЛЕЛЬНЫЕ РЕАКЦИИ
Речь идет об одновременно происходящих реакциях, с реагентом (реагентами) взаимодействуют все компоненты смеси. Для определения порций отдельных компонентов придется использовать алгебраический алгоритм. Поскольку в дальнейшем предстоят расчеты по уравнениям реакций, в качестве неизвестной величины лучше всего выбрать количество вещества.
Алгоритм 1. Решение через систему уравнений с двумя неизвестными
(подходит для любой задачи такого типа)
1. Составить уравнения реакций.
2. Количества веществ (ν) в исходной смеси обозначить через х, у моль и, согласно молярным соотношениям по уравнениям реакций, выразить через х, у моль количества веществ в
образовавшейся смеси.
3. Составить математические уравнения. Для этого следует выразить массу (или объем)
веществ через х, у и молярную массу (молярный объем) по формулам:
m = ν*M; V = ν*VМ.
4. Составить систему уравнений и решить ее.
5. Далее решать согласно условиям задачи
Задача 1. Пластинку из магниево-алюминиевого сплава массой 3,9 г поместили
в раствор соляной кислоты. Пластинка растворилась, и выделилось 4,48 л газа. Найти массовые доли металлов в сплаве.
Решение
1) Запишем уравнения реакции:
Mg + 2HCl = MgCl2 +h3↑
1моль 1моль
2Al+ 6HCl = 2AlCl3 +3h3↑
2моль 3моль
2) Обозначим количества веществ:
ν(Mg) = x моль; ν(Н2) = х моль;
ν(Al) = y моль; ν(Н2) = 1,5 у моль.
3) Составим математические уравнения: найдем массы магния, алюминия и их смеси, а также ко-
личество вещества выделившегося водорода:
m(Mg) = 24x,
m(Al) = 27y,
m(смеси) = 24х + 27y;
ν(Н2) = V/VM = 4,48 (л) / 22,4 (л/моль) = 0,2 моль.
4) Составим систему уравнений и решим ее:
24x+ 27y=3,9
x + 1,5y = 0, 2 .
х = 0,2 – 1,5у,
24(0,2 – 1,5у) + 27у = 3,9,
у = 0,1;
х = 0,2 – 1,5*0,1 = 0,05.
5) Найдем массы магния и алюминия и их массовые доли в смеси:
m(Mg) = 0,05 (моль) * 24 (г /моль) = 1,2 г,
m(Al) = 0,1 (моль) * 27 (г /моль) = 2,7 г,
ω(Mg) = m(Mg) / m(см.) = 1,2 (г) / 3,9 (г) = 0,3077,
ω(Al) = m(Al) / m(см.) = 2,7 / 3,9 = 0,6923.
Ответ. ω(Mg) = 30,77 %; ω(Al) = 69,23 %.
Задача 2. К раствору, содержащему 5,48 г смеси сульфата и силиката натрия, прибавили избыток хлорида бария, в результате образовалось 9,12 г осадка. Найти массы солей в исходной смеси.
Решение
1) Составим уравнения реакций:
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl,
1моль 1моль
Na2SiO3 + BaCl2 =BaSiO3↓+ 2NaCl.
1моль 1моль
2) Обозначим количества веществ:
ν(Na2SO4) = x моль,
ν(BaSO4) = х моль;
ν(Na2SiO3) = у моль,
ν(BaSiO3) = у моль.
3) Составим формулы для массы веществ:
m(Na2SO4) = 142x,
m(BaSO4) = 233x,
m(Na2SiO3) = 122y,
m(BaSiO3) = 213y;
m(исх. см.) = m(Na2SO4) + m(Na2SiO3),
m(обр. см.) = m(BaSO4) + m(BaSiO3).
4) Составим систему уравнений и решим ее:
142x+ 122y =5,48
233x+ 213y =9,12 .
х = 0,03, y = 0,01.
m(Na2SO4) = 0,03 (моль)æ142 (г/моль) = 4,26 г,
m(Na2SiO3) = 5,48 – 4,26 = 1,22 г.
Ответ. m(Na2SO4) = 4,26 г; m(Na2SiO3) = 1,22 г.
Алгоритм 2. Решение через уравнение с одним неизвестным
(подходит только для задач, в которых можно найти общее количество продукта, образующегося во всех параллельных реакциях)
1. Составить уравнения реакций.
2. Найти количество образовавшегося вещества.
3. Обозначить количество вещества, получившегося в результате одной реакции, через
х моль, тогда количество вещества, получившегося в результате второй реакции, будет равно:
(ν – х). Выразить, согласно уравнениям реакций, количества веществ в исходной смеси.
4. Выразить массы веществ, составить и решить уравнение с одним неизвестным.
Из двух задач, решенных по алгоритму 1, этим способом можно решить только задачу 1. (в разделе
ТИП II. ПАРАЛЛЕЛЬНЫЕ РЕАКЦИИ
Решение задачи 1
1) Составим уравнения реакций:
Mg+ 2HCl = MgCl2 + h3 ↑ (1)
1моль 1моль
2Al+ 6HCl = 2AlCl3 +3h3↑ (2)
2моль 3моль
2) Найдем количество вещества образовавшегося водорода:
ν(Н2) = V / VМ = 4,48 (л) / 22,4 (л/моль) = 0,2 моль.
3) Обозначим количество вещества водорода, получившегося по реакции (2),
ν(Н2) = х моль, тогда количество вещества водорода, получившегося по реакции (1),
равно: ν(Н2) = 0,2 – х.
Согласно уравнениям реакций в исходной смеси было:
ν(Mg) = 0,2 – x; ν(Al) = 2x / 3.
4) Выразим массы:
m(Mg) = 24(0,2 – x) = 4,8 – 24x,
m(Al) = 27æ2x /3 = 18х.
Составим уравнение с одним неизвестным:
4,8 – 24х + 18х = 3,9;
х = 0,15.
ν(Mg) = 0,2 – 0,15 = 0,05 моль;
ν(Al) = 2/3 * 0,15 = 0,1 моль.
5) Найдем массы магния и алюминия и их массовые доли в смеси:
m(Mg) = 0,05 (моль) * 24 (г /моль) = 1,2 г,
m(Al) = 0,1 (моль) * 27 (г /моль) = 2,7 г,
ω(Mg) = m(Mg) / m(см.) = 1,2 (г) / 3,9 (г) = 0,3077,
ω(Al) = m(Al) / m(см.) = 2,7 / 3,9 = 0,6923.
Ответ. ω(Mg) = 30,77 %; ω(Al) = 69,23 %.
ТИП III. КОМБИНИРОВАННЫЕ ЗАДАЧИ
Задача 1. При обработке 17,4 г смеси алюминия, железа и меди избытком соляной кисло-
ты выделилось 8,96 л (н.у.) . Не растворившийся в соляной кислоте остаток растворился
в концентрированной азотной кислоте с выделением 4,48 л газа (н.у.). Определить состав
исходной смеси (в %).
Решение
1) Составим уравнения реакций:
Fe+ 2HCl = FeCl2 + h3↑
1моль 1моль
2Al+ 6HCl = 2AlCl3 +3h3↑
2моль 3моль
Cu+ 4HNO3 == Сu(NO3)2 + 2NO2↑+ 2h3O.
1моль 2моль
2) Найдем количество вещества оксида азота(IV) и количество
вещества и массу меди:
ν(NO2) = V / VМ = 4,48 л / 22,4 (л/моль) = 0,2 моль,
ν(Сu) = 0,1 моль;
m(Cu) = M * ν == 64 (г/моль) * 0,1 (моль) = 6,4 г.
3) Найдем массу смеси железа и алюминия:
m(Fe, Al) = 17,4 (г) – 6,4 (г) = 11 г.
4) Обозначим количества веществ:
ν(Fe) = x моль, ν(Н2) = х моль;
ν(Al) = y моль, ν(Н2) = 1,5 у моль.
5) Выразим массы Fe и Al через x и y; найдем количество вещества водорода:
m(Fe) = 56x; m(Al) = 27y;
ν(Н2) = V / VМ = 8,96 (л) / 22,4 (л/моль) = 0,4 моль.
6) Составим систему уравнений и решим ее:
56x + 27y = 11
X + 1,5y =0,4 .
х = 0,4 – 1,5у;
56(0,4 – 1,5у) + 27у = 11,
у = 0,2;
х = 0,4 – 1,5*0,2 = 0,1.
7) Найдем массы железа и алюминия, затем массовые доли веществ в смеси:
m(Fe) = 0,1 (моль) * 56 (г/моль) = 5,6 г,
m(Al) = 0,2 (моль) * 27 (г/моль) = 5,4 г;
ω(Cu) = m(Cu) / m(см.) = 6,4 (г) / 17,4 (г) = 0,368,
ω(Fe) = m(Fe) / m(см.) = 5,6 (г) / 17,4 (г) = 0,322,
ω(Al) = m(Al) / m(см.) = 5,4 (г) / 17,4 (г) = 0,31.
Ответ. ω(Сu) = 36,8 %; ω(Fe) = 32,2 %; ω(Al) = 31 %.
infourok.ru
| Уроки по химии 10 класс. Ютуб канал «Инфоурок» | |
|---|---|
| ТЕМА УРОКА | ССЫЛКА НА УРОК |
| Теория строения органических соединений А.М. Бутлерова. | >>>>>>>>>> |
| Современное представление о строении атома, S и P орбитали. | >>>>>>>>>> |
| Номенклатура и изомерия алканов. | >>>>>>>>>> |
| Упражнения на составление формул и названий гомологов и изомеров. | >>>>>>>>>> |
| Химические и физические свойства алканов. | >>>>>>>>>> |
| Методы получения и применения алканов. | >>>>>>>>>> |
| Решение задач на вывод формул органических соединений. | >>>>>>>>>> |
| Понятие о циклоалканах. | >>>>>>>>>> |
| Алкены. Гомологический ряд алкенов. | >>>>>>>>>> |
| Номенклатура и изомерия алкенов. | >>>>>>>>>> |
| Физические и химические свойства алкенов. | >>>>>>>>>> |
| Получение алкенов и их применение. | >>>>>>>>>> |
| Расчеты по уравнениям когда одно из веществ дано в избытке. | >>>>>>>>>> |
| Алкадиены. Типы алкадиенов. | >>>>>>>>>> |
| Алкины, гомологический ряд алкинов. | >>>>>>>>>> |
| Физические и химические свойства алкинов. | >>>>>>>>>> |
| Получение и применение алкинов. | >>>>>>>>>> |
| Бензол — представитель ароматических углеводородов. | >>>>>>>>>> |
| Гомологи бензола. | >>>>>>>>>> |
| Нефть и способы её переработки. | >>>>>>>>>> |
| Многообразие углеводородов. Взаимосвязь гомологических рядов. | >>>>>>>>>> |
| Предельные одноатомные спирты строение, номенклатура. | >>>>>>>>>> |
| Химические свойства предельных одноатомных спиртов. | >>>>>>>>>> |
| Получение и применение спиртов. Спирты и здоровье человека. | >>>>>>>>>> |
| Многоатомные спирты. | >>>>>>>>>> |
| Каменный уголь. Фенол. | >>>>>>>>>> |
| Альдегиды строение, свойства. | >>>>>>>>>> |
| Получение и применение альдегидов. | >>>>>>>>>> |
| Одноосновные карбоновые кислоты. | >>>>>>>>>> |
| Химические свойства одноосновных карбоновых кислот. | >>>>>>>>>> |
| Получение карбоновых кислот. | >>>>>>>>>> |
| Генетическая связь углеводородов, спиртов, альдегидов и карб. кислот. | >>>>>>>>>> |
| Сложные эфиры. | >>>>>>>>>> |
| Жиры. | >>>>>>>>>> |
| Углеводы. Классификация и состав углеводов. | >>>>>>>>>> |
| Глюкоза строение, свойства, применение. | >>>>>>>>>> |
| Моносахариды. | >>>>>>>>>> |
| Дисахариды. | >>>>>>>>>> |
| Полисахариды. | >>>>>>>>>> |
| Амины — органические основания. | >>>>>>>>>> |
| Анилин. Его свойства и применение. | >>>>>>>>>> |
| Аминокислоты. Названия и свойства аминокислот. | >>>>>>>>>> |
| Белки. | >>>>>>>>>> |
| Ферменты. Гормоны. | >>>>>>>>>> |
| Витамины. | >>>>>>>>>> |
| Лекарства. | >>>>>>>>>> |
| Искусственные полимеры. | >>>>>>>>>> |
| Синтетические органические соединения. | >>>>>>>>>> |
| Значение органической химии. Органическая химия среди наук о природе. | >>>>>>>>>> | Уроки химии 11 класс. Ютуб канал «Инфоурок» |
| ТЕМА УРОКА | ССЫЛКА НА УРОК |
| Атом – сложная частица. | >>>>>>>>>> |
| Периодический закон и строение атома. | >>>>>>>>>> |
| Ионная химическая связь. | >>>>>>>>>> |
| Ковалентная химическая связь. | >>>>>>>>>> |
| Металлическая химическая связь. | >>>>>>>>>> |
| Водородная химическая связь. | >>>>>>>>>> |
| Полимеры. | >>>>>>>>>> |
| Газообразные вещества. | >>>>>>>>>> |
| Жидкие вещества. | >>>>>>>>>> |
| Твердые вещества. | >>>>>>>>>> |
| Дисперсные системы. | >>>>>>>>>> |
| Состав вещества. Смеси. | >>>>>>>>>> |
| Понятие о химической реакции. | >>>>>>>>>> |
| Классификация химических реакций. | >>>>>>>>>> |
| Скорость химической реакции. | >>>>>>>>>> |
| Обратимость химических реакций. Химическое равновесие. | >>>>>>>>>> |
| Роль воды в химических реакциях. | >>>>>>>>>> |
| Гидролиз. | >>>>>>>>>> |
| Окислительно восстановительные реакции. Электролиз. | >>>>>>>>>> |
| Классификация веществ. Металлы. | >>>>>>>>>> |
| Неметаллы. | >>>>>>>>>> |
| Кислоты. | >>>>>>>>>> |
| Основания. | >>>>>>>>>> |
| Амфотерные органические и неорганические соединения. | >>>>>>>>>> |
| Соли. | >>>>>>>>>> |
| Генетическая связь между классами органических и неорганических веществ. | >>>>>>>>>> | Органическая химия 10 класс. Ютуб канал «Вурдихан Вурдиханов» |
| ТЕМА УРОКА | ССЫЛКА НА УРОК |
| Алканы. Структурные формулы, названия, гомологи, радикалы. | >>>>>>>>>> |
| Алканы. Строение, гибридизация, углы, геометрическая форма молекул. | >>>>>>>>>> |
| Пи и сигма связи, как определить? | >>>>>>>>>> |
| sp sp2 sp3 гибридизация, как определить? | >>>>>>>>>> |
| Первичный, вторичный, третичный, четвертичный атом углерода. | >>>>>>>>>> |
| Номенклатура, названия алканов. Учимся называть алканы. | >>>>>>>>>> |
| Все виды изомерии. | >>>>>>>>>> |
| Цис- Транс- Изомерия. Все виды. | >>>>>>>>>> |
| Межклассовая изомерия. Все виды. | >>>>>>>>>> |
| Алкены. Строение, гибридизация, углы, геометрическая форма молекул. | >>>>>>>>>> |
| Алкины. Строение, гибридизация, углы, геометрическая форма молекул. | >>>>>>>>>> |
| Строение атома углерода. | >>>>>>>>>> |
| Теория строения органических соединений Бутлерова. | >>>>>>>>>> |
| Предмет органической химии. Органические вещества. | >>>>>>>>>> |
| Алканы. Получение. Все реакции получения. | >>>>>>>>>> |
| Алканы. Химические свойства. Все реакции для ЕГЭ. | >>>>>>>>>> |
| Циклоалканы. Получение. | >>>>>>>>>> |
| Циклоалканы. Химические свойства. | >>>>>>>>>> |
| Галогеналканы. Получение. | >>>>>>>>>> |
| Галогеналканы. Химические свойства. | >>>>>>>>>> |
| Функциональные группы и номенклатура органических веществ. | >>>>>>>>>> |
| Общие и молекулярные формулы органических веществ. | >>>>>>>>>> |
| Алкены. Получение. Все реакции для ЕГЭ. | >>>>>>>>>> | Подготовка к олимпиаде по химии 10 — 11 класс. Ютуб канал «Онлайн-школа с 3 по 11 класс» |
| ТЕМА УРОКА | ССЫЛКА НА УРОК |
| Занятие 1 | >>>>>>>>>> |
| Занятие 2 | >>>>>>>>>> |
| Занятие 3 | >>>>>>>>>> |
| Занятие 4 | >>>>>>>>>> |
| Занятие 5 | >>>>>>>>>> |
| Занятие 6 | >>>>>>>>>> |
| Занятие 7 | >>>>>>>>>> |
| Занятие 8 | >>>>>>>>>> |
| Занятие 9 | >>>>>>>>>> |
| Занятие 10 | >>>>>>>>>> |
| Занятие 11 | >>>>>>>>>> |
| Занятие 12 | >>>>>>>>>> |
| Занятие 13 | >>>>>>>>>> |
| Занятие 14 | >>>>>>>>>> |
| Занятие 15 | >>>>>>>>>> |
| Занятие 16 | >>>>>>>>>> |
| Занятие 17 | >>>>>>>>>> |
| Занятие 18 | >>>>>>>>>> |
| Занятие 19 | >>>>>>>>>> |
| Занятие 20 | >>>>>>>>>> |
| Занятие 21 | >>>>>>>>>> |
| Занятие 22 | >>>>>>>>>> |
| Занятие 23 | >>>>>>>>>> |
| Занятие 24 | >>>>>>>>>> |
| Занятие 25 | >>>>>>>>>> |
| Занятие 26 | >>>>>>>>>> |
| Занятие 27 | >>>>>>>>>> |
| Занятие 28 | >>>>>>>>>> |
| Занятие 29 | >>>>>>>>>> |
| Занятие 30 | >>>>>>>>>> |
| Занятие 31 | >>>>>>>>>> |
| Занятие 32 | >>>>>>>>>> |
| Занятие 33 | >>>>>>>>>> |
| Задача «Относительная плотность паров» | >>>>>>>>>> |
| Задача «Ответ найдешь в самом вопросе…» | >>>>>>>>>> |
| Задача «Органическая цепочка» | >>>>>>>>>> |
| Задача «Нахождение структуры вещества» | >>>>>>>>>> |
| Задача «Душистые вещества» | >>>>>>>>>> |
| Задача «Выбор центра атаки — задача не из легких!» | >>>>>>>>>> |
| Задача «Алкины как слабые СН-кислоты» | >>>>>>>>>> |
| Задача «Закон Гесса» | >>>>>>>>>> |
| Задача «Я — циклический кетон!» | >>>>>>>>>> |
| Задача «Вицинальный дибромалкан» | >>>>>>>>>> |
| Задача «Мягкое окисление углеводородов» | >>>>>>>>>> |
| Задача «Неизвестный углеводород» | >>>>>>>>>> |
| Задача «Номенклатура органических соединений» | >>>>>>>>>> |
| Задача «Окисление неизвестного УВ» | >>>>>>>>>> |
| Задача «Смесь алканов» | >>>>>>>>>> |
| Задача «Реакции кросс-сочетания» | >>>>>>>>>> |
| Задача «Водородные соединения» | >>>>>>>>>> |
| Задача «Сравнение солей» | >>>>>>>>>> |
| Задача «Электролитическая диссоциация» | >>>>>>>>>> |
| Задача «Цепочка превращений» | >>>>>>>>>> |
| Задача «Схема превращений» | >>>>>>>>>> |
| Задача «Платиновые металлы» | >>>>>>>>>> |
| Задача «Описание опыта Д. И. Менделеевым» | >>>>>>>>>> |
| Задача «Именные реакции» | >>>>>>>>>> |
| Задача «Карбиды» | >>>>>>>>>> |
| Задача «Кинетика реакций» | >>>>>>>>>> |
| Задача «Кристаллогидраты» | >>>>>>>>>> |
| Задача «Летучие соединения» | >>>>>>>>>> |
| Задача «Диаграмма состояния серы» | >>>>>>>>>> |
| Задача «Возможно ли?» | >>>>>>>>>> |
| Сезон II | >>>>>>>>>> |
| Сезон III | 10 класс | >>>>>>>>>> |
| Сезон III | 11 класс | >>>>>>>>>> |
| Сезон IV | 10 класс | >>>>>>>>>> |
| Сезон IV | 11 класс | >>>>>>>>>> |
| Сезон V | 10 класс | >>>>>>>>>> |
| Сезон V | 11 класс | >>>>>>>>>> |
| Сезон VI | 10 класс | >>>>>>>>>> | Химия для поступающих. Ютуб канал «Дистанционные курсы для абитуриентов Химфака МГУ» |
| ТЕМА УРОКА | ССЫЛКА НА УРОК |
| Разбор задач дополнительного вступительного испытания МГУ по химии 2016 г. | >>>>>>>>>> |
| Расчет средней скорости химической реакции. Химия для поступающих. Разбор задач. | >>>>>>>>>> |
| Расчет скорости химической реакции по текущим концентрациям реагентов. Химия для поступающих. | >>>>>>>>>> |
| Использование уравнения Аррениуса для решения задач (1/2). Химия для поступающих. | >>>>>>>>>> |
| Использование уравнения Аррениуса для решения задач (2/2). Химия для поступающих. | >>>>>>>>>> |
| Использование правила Вант-Гоффа для решения задач. Химия для поступающих. | >>>>>>>>>> |
| Использование правила Вант-Гоффа для решения задач (2/2). Химия для поступающих. | >>>>>>>>>> |
| Диссоциация воды. Водородный показатель. | >>>>>>>>>> |
| Кислотно-основные равновесия в водном растворе. Гидролиз солей. | >>>>>>>>>> |
| Расчет рН растворов сильных и слабых кислот. Химия для поступающих. | >>>>>>>>>> |
| Расчет рН растворов сильных и слабых оснований. Химия для поступающих. | >>>>>>>>>> |
| Окислительно восстановительные реакции, часть 1 из 4. Определение степеней окисления. | >>>>>>>>>> |
| Окислительно восстановительные реакции, часть 2 из 4. Уравнивание ОВР методом электронного баланса. | >>>>>>>>>> |
| Уравнивание неорганических реакций (ОВР) методом электронно-ионного баланса. ОВР, часть 3 из 4. | >>>>>>>>>> |
| Уравнивание органических реакций (ОВР) методом электронно-ионного баланса. ОВР, часть 4 из 4. | >>>>>>>>>> |
zadachi-po-ximii.megapetroleum.ru
Задания по химии. 11 класс
Задача 1
На промышленном предприятии произошла утечка ацетилена. Для определения взрывоопасности получившейся ацетиленово-воздушной смеси 20 л ее пропустили через подкисленный серной кислотой раствор перманганата калия. В результате 11.3 г перманганата калия восстановилось. Опасна ли концентрация ацетилена в воздухе, если такие смеси взрываются при содержании ацетилена в интервале 2.0-81% (в объемных долях)?
Решение:
Взаимодействие кислого раствора перманганата калия с ацетиленом протекает по уравнению
2 KMnO4 + C2H2 + 3H2SO4 = 2MnSO4 + K2SO4 + 2CO2 + 4H2O
По уравнению реакции x = (11.3·22.4)/316 = 0.8 л, таким образом, объемная доля ацетилена 0.8/20 = 0.04 или 4%. Смесь взрывоопасна.
Задача 2
Сплавлением оксида железа (III) с окислительно-щелочной смесью (на основе КОН) была получена соль, содержащая 28.3 % (масс.) железа. После удаления других продуктов реакции, указанная соль была перенесена в заполненный воздухом закрытый сосуд объемом 1 л (н.у.). В сосуд также добавили воду, в количестве, необходимом для её полного гидролиза. В результате давление в сосуде увеличилось на 0.192 атм. Какая соль была подвергнута гидролизу и какое количество (г) исходного оксида железа (III) было израсходовано? (Объемом, занимаемым реагентами и водой в сосуде можно пренебречь).
Решение:
1. Определим соль железа, получаемую сплавлением оксида железа (III) с окислительно-щелочной смесью. В результате такого процесса получается феррат щелочного металла (в нашем случае калия), в котором железо находится в своей максимальной степени окисления +6. Запишем уравнение возможной реакции:
Fe2O3 + 3KNO3 + 4KOH → 2K2FeO4 + 3KNO2 + 2H2O. (1)
Массовая доля железа в феррате калия составляет 28.28 % (масс) ((56·100)/198), что хорошо согласуется с условием задачи. Итак, содержащая железо соль – феррат калия.
2. Запишем уравнение гидролиза K2FeO4:
4K2FeO4 +10Н2О → 4Fe(OH)3 + 3O2↑+ 8KOH. (2)
Из уравнения (2) видно, что в результате гидролиза K2FeO4 выделяется кислород.
Рассчитаем мольный состав воздуха объемом 1 л находящийся при нормальных условиях (Т=273 К, р=1 атм) полагая, что состав воздуха (по объемным процентам) составляет: N2 – 78%; O2 – 21% и CO2 – 1%. Принимая состояние этих газов близких к идеальному, можно рассчитать:
n(N2) = 0.78 (л)/22.4 (л/моль) = 0.0348 моль; n(О2) = 0.21 (л)/22.4 (л/моль) = 0.0094 моль; n(СО2) = 0.01 (л)/22.4 (л/моль) = 0.00045 моль.
Поскольку в воздухе содержится СО2, то он будет поглощаться продуктами гидролиза (в частности, КОН) и поэтому его необходимо исключить при определении состава конечной газовой смеси.
По уравнению состояния идеального газа определим число молей газовой смеси после проведения гидролиза K2FeO4:
n(N2 + O2) = pV/RT = (101325·(1+0.192)·10-3)/8.314·273=0.0532 моль.
Количество выделившегося в результате гидролиза K2FeO4 равно:
n(O2)гидролиз = n(N2 + O2) — n(N2)исх. — n(О2)исх. = 0.0532 — 0.0348 — 0.0094 = 0.0090 моль.
3. По уравнению реакции (2) находим количество K2FeO4, подвергнутого гидролизу:
из 4 моль K2FeO4 образуется 3 моль О2,
из x1 моль K2FeO4 образуется 0.009 моль О2,
отсюда х1 = 0.012 моль.
4. По уравнению реакции (1) находим количество Fe2O3, затраченное на получение 0.012 моль K2FeO4:
из 1 моль Fe2O3 образуется 2 моль K2FeO4,
из x2 моль Fe2O3 образуется 0.012 моль K2FeO4,
отсюда х2 = 0.006 моль, что составляет 0.96 г.
Ответ: K2FeO4; m(Fe2O3)=0.96 г.
Задача 3
Предложите схему реакций, позволяющих получить 2-хлор-4-нитробензойную кислоту из неорганических веществ.
Решение:
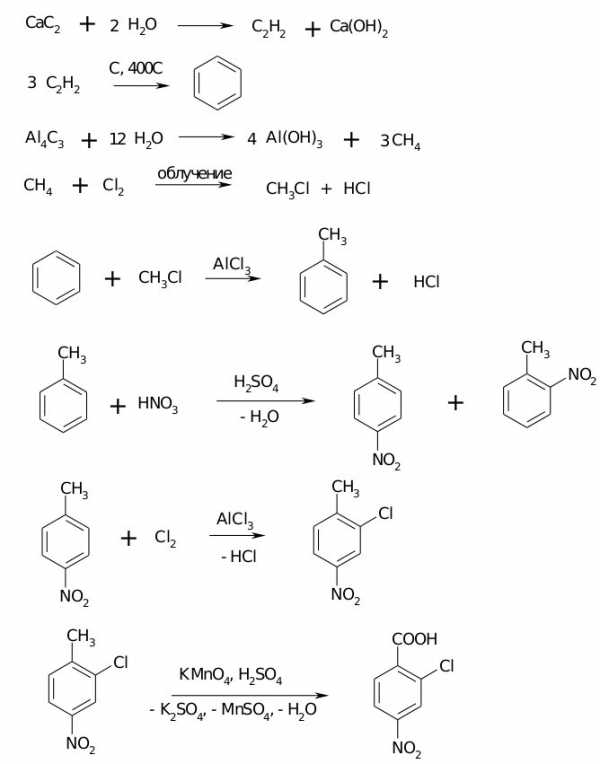
Задача 4
Соединение Х получено в результате реакции между хлоридом кобальта (II), аммиаком, хлоридом аммония и окислителем. Химический анализ вещества Х дал следующие результаты (% масс.): Со – 25.3; N – 24.0; Н – 5.14 и Cl – 45.6. Обработка 1.00 г Х раствором нитрата серебра дает 0.614 г хлорида серебра. Выведите формулу Х и назовите соединение. Докажите строение и нарисуйте структуру (или структуры) Х. Изобразите структуру соединения Y, которое получится, если вместо аммиака использовать H2NCH2CH2NH2. Назовите соединение Y. К какому классу относятся соединения Х и Y?
Решение:
-
Определим брутто-формулу вещества Х. Из условия задачи следует, что в 100 г вещества Х содержится 25.3 г Со, 24.0 г N, 5.14 г. Н и 45.6 г Сl. Отсюда можно рассчитать мольное соотношение компонентов в веществе Х:
n(Co)/n(N)/n(H)/n(Cl)=(25.3/59):(24.0/14):(5.14/1):(45.6/35.5)=0.43:1.71:5.14:1.28
или
n(Co)/n(N)/n(H)/n(Cl)=1:4:12:3.
Таким образом, простейшая формула вещества Х может быть записана как:
CoN4H12Cl3.
Вещество такого состава получается при взаимодействии CoCl2 с NH3(водн.), NH4Cl и окислителем (в качестве последнего могут выступать перекись водорода или кислород воздуха). Для химии кобальта характерно образование комплексных соединений, среди которых основную группу составляют соединения с координационным числом у кобальта равным 6. Исходя из этого можно записать реакцию получения соединения Х, имеющего состав CoN4H12Cl3:
CoCl2 + NH4Cl + 3NH3 + (0.5H2O2) → [Co(NH3)4Cl2]Cl + Н2О. (1)
Соединение [Co(NH3)4Cl2]Cl называется: хлорид тетраамминдихлорокобальта (III).
2. Доказательством строения вещества Х является реакция с AgNO3:
[Co(NH3)4Cl2]Cl + AgNO3 → [Co(NH3)4Cl2]NO3 + AgCl. (2)
Из уравнения (2) следует, что 0.614 г AgCl действительно образуется из 1 г [Co(NH3)4Cl2]Cl: 1/233.5=0.614/143.5=0.0043. Отсюда следует, что во внешней координационной сфере комплексного соединения состава CoN4H12Cl3 имеется только один атом хлора, что подтверждает наше предположение о том, что вещество Х – это хлорид тетраамминдихлорокобальта (III).
У соединения [Co(NH3)4Cl2]Cl возможно два изомера:
Хлорид цис-тетраамминдихлорокобальта (III) и хлорид транс-тетраамминдихлорокобальта (III).
3. Если вместо NH3 использовать H2NCH2CH2NH2 (1,2-диаминоэтан, этан-1,2-диамин), то получится соединение хлорид ди(этан-1,2-диамин)дихлорокобальта (III) (Y), цис— и транс-изомеры которого представлены двумя оптическими изомерами (энантиомерами):
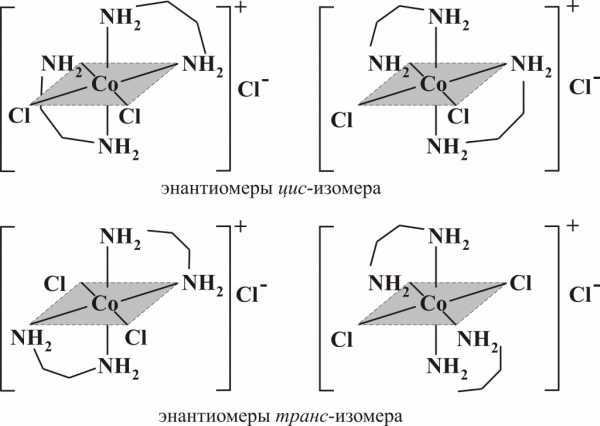
4. Рассмотренные соединения относятся к классу комплексных соединений. Соединение Y называется хелатом. Лиганд H2NCH2CH2NH2 называется хелатирующим или хелатообразующим.
Задача 5
При обработке нитрующей смесью ароматического вещества А, молекулярная формула которого C8H10, образуются преимущественно два вещества, В и В’, с молекулярной формулой C8H9O2N. При окислении вещества А подкисленным водным раствором KMnO4 образуется вещество С с молекулярной формулой С7H6O2. Окисление в тех же условиях веществ В и В’ дает изомерные вещества D и D’. Установите строение веществ А, B, B’, C, D и D’. Приведите полные уравнения реакций.
Решение:
Вещество А может иметь следующие структурные формулы:
Так как при окислении А образуется соединение с меньшим числом атомов углерода – С7Н6О2, или C6H5COOH, вещество А представляет собой этилбензол (формула I).
Описанные в условии задачи превращения можно выразить следующими схемами:
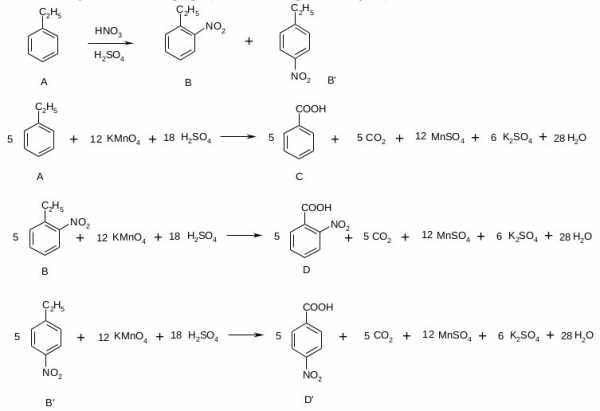
Задача 6
В объемном отношении 3:3:4 смешали 0.3 н., 0.1 М и 0.6 н. растворы ортофосфорной кислоты. Вычислить концентрацию ионов водорода в полученном растворе, принимая во внимание, что степень диссоциации кислоты по первой ступени в нем равна 20%. Чему равен рН полученного раствора? Диссоциацию кислоты по остальным ступеням можно не учитывать.
Решение:
-
Перейдем от нормальной концентрации исходных растворов к молярной. Поскольку фактор эквивалентности H3PO4 равен 1/3, имеем
СМ = СН/3.
Таким образом, в отношении 3:3:4 смешали соответственно 0.1 М, 0.1 М и 0.2 М растворы ортофосфорной кислоты
-
Допустим, что взяты 3 л 0.1 М, 3 л 0.1 М и 4 л 0.2 М растворов H3PO4. Тогда в конечном растворе (10 л) будет содержаться 1.4 моль H3PO4. В итоге получается раствор 0.14 М (СМ=n(H3PO4)/V(р-р)=1.4моль/10 л=1.4 моль/л (М)).
-
Если учитывать диссоциацию H3PO4 только по первой стадии:
H3PO4 ↔ H2PO4— + Н+,
то следует, что из каждого подвергшегося диссоциации моля H3PO4 образуется 1 моль ионов водорода. Так как степень диссоциации равна 20%, в растворе диссоциирует 0.028 моль/л H3PO4 и поэтому концентрация ионов водорода равна 0.028 моль/л.
-
По определению рН=-lg[H+]. Отсюда рН=-lg0.028=1.55
Ответ: СМ(H+)=0.028 моль/л; рН=1.55.
Задача 7
Из бензола и других необходимых реагентов получите 4-бром-3-нитробензойную кислоту (A) и 4-бром-2-нитробензойную кислоту (B). Обоснуйте выбор последовательности превращений и назовите все промежуточные продукты. Затем получите из кислот A и В сложные эфиры, используя этиловый спирт.
Решение:
Получение продукта А:
На первой стадии происходит алкилирование по Фриделю-Крафтсу, затем бромирование по Фриделю-Крафтсу. Далее окисление до бензойной кислоты и нитрование. На последней стадии происходит согласованная ориентация реакции нитрования (А). Реакция этерификации:
Получение продукта B:
На первой стадии происходит алкилирование по Фриделю-Крафтсу, затем бромирование по Фриделю-Крафтсу. Далее происходит нитрование 4-бромтолуола (несогласованная ориентация). Нитропродукт окисляется до бензойной кислоты (B). Реакция этерификации:
Вконтакте
Google+
Одноклассники
olimpotvet.ru
Решение задач по химии, 11 класс — К уроку — Химия
Решение задач. 11 класс.
Получение олеума.
О́леум
(лат. Oleum)
— раствор
серного
ангидрида
SO3
в 100%-й серной
кислоте H2SO4.
xSO3·H2O
или
H2SO4·xSO3
или
H2S2O7;
Олеум
представляет собой вязкую маслянистую
бесцветную жидкость или легкоплавкие
кристаллы, которые, однако, могут
приобретать самые различные оттенки
вследствие наличия примесей. На воздухе
«дымит», реагирует с водой с выделением
очень большого количества тепла.
Концентрация серного ангидрида может
варьировать в очень широких пределах:
от единиц до десятков процентов. Олеум
по сравнению с концентрированной серной
кислотой обладает ещё большим
водоотнимающим и окислительным действием.
Олеум содержит также пиросерные кислоты,
получающиеся по реакциям:
Физические
свойства
Температура
кипения водных растворов серной кислоты
повышается с ростом ее концентрации и
достигает максимума при содержании
98,3 % H2SO4.
Температура
кипения
олеума с увеличением содержания SO3
понижается. При увеличении концентрации
водных растворов серной кислоты общее
давление
пара над растворами понижается и при
содержании 98,3 % H2SO4
достигает минимума. С увеличением
концентрации SO3
в олеуме, общее давление пара над ним
повышается.
Пар
над водными растворами серной кислоты
состоит из смеси паров воды, H2SO4
и SO3,
при этом состав пара отличается от
состава жидкости при всех концентрациях
серной кислоты, кроме соответствующей
азеотропной
смеси.
С
повышением температуры усиливается
диссоциация:
Применение
Применяется
в промышленности при производстве
серной кислоты, капролактама
и многих других веществ. В органической
химии применяется как сульфирующий,
водоотнимающий или окисляющий реагент.
Особенности
экспериментальной работы
Олеум —
крайне едкое вещество: оставляет сильные
ожоги
на коже, быстро разъедает многие
материалы, за исключением наименее
реакционноспособных. Тем не менее,
вследствие эффекта пассивации
может храниться в стальных
ёмкостях. Олеум нельзя разбавлять водой
или выливать его в воду, из-за сильно
экзотермической
реакции. Разбавление олеума
производится прибавлением его к серной
кислоте. При приливании в воду жидкость
закипает, образуя туман из серной
кислоты.
Задача 1.
К 75 %-му раствору серной кислоты массой
288 г добавили оксид серы (VI)
массой 400 г. Вычислите массовую долю
оксида серы (VI) в
образовавшемся олеуме.
Решение:
т (Н2О)= 288 – 216 = 72 г.
Часть оксида серы (VI)
вступит в реакцию с водой. Всего оксида
серы (VI) 5 моль. На реакцию
с водой потратится 4 моль оксида серы
(VI). Останется 1 моль оксида
серы (VI).
SO3 + H2O
= H2SO4.
По уравнению химической реакции все
вещества находятся в равных количественных
соотношениях.
n (SO3)
=
n (H2O)
=72 г/18 г/моль = 4 моль.
n (SO3)
= 5 моль-4 моль = 1 моль.
m (SO3)ост.
= 80г/моль * 1 моль = 80 г.
m (H2SO4)
= 4моль*98 г/моль = 392 г.
m p-pa
= 288+400 = 688 г.
= 11,6 %. Ответ: 11,6 %.
Задача 2.
К 92 %-му раствору серной кислоты массой
562,5 г. добавили оксид серы (VI)
массой 240 г. Вычислите массовую долю
оксида серы (VI) в
образовавшемся олеуме.
Решение:
т (Н2О)= 562,5 – 517,5 = 45 г.
Часть оксида серы (VI)
вступит в реакцию с водой. Всего оксида
серы (VI) 3 моль. На реакцию
с водой потратится 2,5 моль оксида серы
(VI). Останется 0,5 моль
оксида серы (VI).
SO3 + H2O
= H2SO4.
По уравнению химической реакции все
вещества находятся в равных количественных
соотношениях.
n (SO3)
=
n (H2O)
=45 г/18 г/моль = 2,5 моль.
n (SO3)
= 3 моль-2,5 моль = 0,5 моль.
m (SO3)ост.
= 80г/моль * 0,5 моль = 40 г.
m p-pa
= 562,5+240 =802,5 г.
= 4,98 %. Ответ: 4,98 %.
Задача 3.
Вычислите массу оксида серы (VI),
который необходимо добавить к 20 %-му
раствору серной кислоты массой 200 г,
чтобы получить 10 %-ный олеум.
Решение:
т (Н2О)= 200 – 40 = 160 г.
n (H2O)
=160 г/18 г/моль = 8,89 моль.
SO3 + H2O
= H2SO4.
n (SO3)
= 8,89 моль.m (SO3)вступ.
в р-ю с Н2О= 80г/моль * 8,89 моль = 711,2
г.
Пусть масса оставшегося непрореагировавшим
оксида серы (VI) – х, тогда
Х= 20 + 71,12 + 0,1х
0,9х = 91,12
х = 101,2 г.
масса всего оксида серы (VI)
m (SO3)
= 711,2 + 101,2 = 812,4 г. Ответ:
812,4 г.
Задача 4.
Вычислите массу оксида серы (VI),
который необходимо добавить к 90 %-му
раствору серной кислоты массой 250 г,
чтобы получить 20 %-ный олеум.
Решение:
т (Н2О)= 250 – 225 = 25 г.
n (H2O)
=25 г/18 г/моль = 1,39моль.
SO3 + H2O
= H2SO4.
n (SO3)
= 1,39 моль.m (SO3)вступ.
в р-ю с Н2О= 80г/моль * 1,39 моль = 111,1
г.
Пусть масса оставшегося непрореагировавшим
оксида серы (VI) – х, тогда
Х= 50 + 22,22 + 0,2х
0,8 х = 72,22
х = 90,3 г.
масса всего оксида серы (VI)
m (SO3)
= 90,3 + 111,1 = 201,3 г. Ответ:
201,3 г.
Задача 5.
Вычислите массу 50 %-ной серной кислоты
и массу оксида серы (VI),
которые необходимо взять, чтобы получить
200 г 20 %-ого олеума.
Решение:
Можно определить сколько осталось
оксида серы (VI) в олеуме.
,
m (SO3)
= 40 г.
Пусть масса вступившего в реакцию с
водой оксида серы (VI) –
х, тогда всего m (SO3)
= х + 40
По уравнению:
SO3 +
H2O =
H2SO4
n (SO3)
=
= 0,225 х ;
Пусть m p.в.
Н2S O4
– y, тогда:
Масса олеума 200 г, тогда:
200 = х + 40 + y + 0.225 x
; 160 = 1.225 x + y
;
160 = 1.225 x + 0.225 x
160 = 1.45 x ; x
= 110.3 ; y = 24.8
т (Н2О)= 24.8
г.
m (SO3)
= 110,3 + 40 = 150,3 г.
m p-pa
H2SO4
= 24,8 + 24,8 = 49,6 г. Ответ: 49,6 г и
150,3 г.
Задача 6.
Вычислите массу оксида серы (VI)
и массу 25 %-ого раствора серной кислоты,
необходимых для приготовления 20 % -ого
олеума массой 400 г.
Решение:
Можно определить сколько осталось
оксида серы (VI) в олеуме.
,
m (SO3)
= 80 г.
Пусть масса вступившего в реакцию с
водой оксида серы (VI) –
х, тогда всего m (SO3)
= х + 80
По уравнению: SO3 +
H2O =
H2SO4
n (SO3)
=
= 0,225 х ;
Пусть m p.в.
Н2S O4
– y, тогда:
Масса олеума 400 г, тогда:
400 = х + 80 + y + 0,225 x
; 320 = 1,225 x + y
;
320 = 1,225 x + 0,075 x
320 = 1,3 x ; x
= 246,2 ; y = 18,5
т (Н2О)= 55.4 г.
m (SO3)
= 80 + 246,2 = 326,2 г.
m p-pa H2SO4
= 18,5 + 55,4 = 73,9 г.
Ответ: 326,2 г.
и 73,9 г.
Задача 7.
Вычислите массу серного ангидрида и
массу 40 %-ого раствора серной кислоты,
необходимых для приготовления 200 г 16
%-ого олеума.
Можно определить сколько осталось
оксида серы (VI) в олеуме.
,
m (SO3)
= 32 г.
Пусть m p.в.
Н2S O4
– х, тогда: m p-pa
H2SO4
= 100х/40 = 2,5 х
200 = 2,5 х + 32 + m (SO3)прор.
т (Н2О) в р-ре H2SO4
=2,5 х – х = 1,5 х
n (H2O)
=
n (SO3)
=
m (SO3)прор.
= 80г/моль *
= г.
200 = 2,5 х + 32 +
; 27,5 х = 504 ; х = 18,3
Следовательно: m
p-pa H2SO4
= 45,8 г.
m (SO3)прор.
= 122,2г. m (SO3)ост.
= 32 г. m (SO3)
= 154,2 г.
Ответ: 154,2 г. и 45,8 г.
Использованы для статьи:
Материал из Википедии — свободной
энциклопедии. Олеум.
Задачник по химии: 11 класс. А.Н. Левкин,
Н.Е.Кузнецова.- М., Вентана-Граф, 2009.
Автор статьи «Решение задач»: учитель
химии высшей категории МКОУ СОШ №1 г.
Усть-Катава
Щурихина Фларида Фасхетдиновна.
pedsovet.su
Решение задач по химии 11 класса
ЗАДАНИЯ ШКОЛЬНОГО ЭТАПА ВСЕРОССИЙСКОЙ ОЛИМПИАДЫ ШКОЛЬНИКОВ ПО ХИМИИ
2014/15 УЧЕБНОГО ГОДА
Г. НЯГАНЬ ХМАО-ЮГРА ТЮМЕНСКАЯ ОБЛАСТЬ
11 класс
Часть 1.
При выполнении заданий этой части из предложенных вариантов ответов выберите один
-
Ядро атома железа содержит:
а) 26 протонов и 30 нейтронов; б) 26 протонов и 26 электронов;
в) 30 нейтронов и 26 электронов; г) 26 протонов и 26 электронов.
2. Корпускулярно-волновым дуализмом обладают:
а) протоны; б) нейтроны; в) электроны; г) все ответы верны.
3. Орбиталь какого типа имеется на любом энергетическом уровне:
а) s; б) p; в) d; г) f.
4. Иону Ca2+ соответствует электронная формула: а) 1s22s22p63s23p6 ;
б) 1s22s22p63s23p64s2; в) 1s22s22p6; г) нет верного ответа.
5. Ионный характер связи наиболее выражен в соединении:
а) CCl4; б) SiO2; в) CaBr2; г) NH3.
6. Путем соединения атомов одного и того же химического элемента образуется связь:
а) ионная; б) ковалентная полярная; в) ковалентная неполярная; г) водородная.
7. В какой молекуле степень окисления элемента равна нулю, а валентность равна единице?
а) O2; б) СaC2; в) Сl2; г) СO.
8. Вещества, обладающие твердостью, тугоплавкостью, хорошей растворимостью в воде, как правило, имеют кристаллическую решетку:
а) молекулярную; б) атомную; в) ионную; г) металлическую.
9. Какой из элементов может образовывать кислотный оксид?
а) стронций; б) марганец; в) кальций; г) магний.
10. Число веществ, которым соответствуют названия: муравьиный альдегид, формальдегид, метаналь, этаналь, уксусный альдегид, ацетальдегид, — равно:
а) 6; б) 4; в) 2; г)1.
11. Высший оксид химического элемента с порядковым номером 25 относится к оксидам:
а) основным; б) кислотным; в) амфотерным; г) несолеобразующим.
12. Для производства елочных украшений в промышленности используется химическая реакция:
а) реакция Зинина; б) реакция Кучерова; в) реакция «серебряного зеркала»; г) реакция нитрования;
За каждый правильно выбранный ответ участник получает 1 балл.
Часть 2.
Решите задачи, приведите полные развернутые решения.
Задача 1.
При взаимодействии с водой 27,4 г двухвалентного металла выделяется 4, 48 л (н.у.) газа. К полученному раствору, масса которого равна 800 г, добавили 200 г 10%-ного раствора сульфата натрия, при этом образовался осадок. О каком металле идет речь? Какова масса полученного осадка? Чему равны массовые доли веществ в полученном растворе?
Задача 2.
Соль состоит из 26,53% калия, 35,37% хрома, 38,1% кислорода. Определите формулу соли и рассчитайте ее массу, израсходованную на взаимодействие с избытком соляной кислоты, если при этом образовался хлорид хрома (lll) и выделилось 13,4 л хлора (н.у.).
Задача 3.
Для обезвоживания этанола использовали карбид кальция. Определите массу карбида кальция, который необходимо добавить к спирту объемом 150 мл с плотностью 0,8 г/мл, содержащего 96% этанола для получения безводного спирта?
Задача 4.
Допишите уравнение, уравняйте методом электронного баланса, определите окислитель и восстановитель:
KNO2 + KMnO4 + H2SO4 → KNO3 + ….
Задача 5.
На схеме приведены превращения Х.
Х + О2→
X + Br2 →
X + KOH →
X + FeCl3 →
X + SO2 → S + H2O
Предложите Х и запишите уравнения осуществленных превращений.
Ответы к заданиям. 11 класс.
Ответы части 1.
Всего: 12 баллов.
Ответы части 2.
Задача 1.
Условию задачи соответствуют уравнения реакций:
Me + 2H2O = Me(OH)2 + H2↑, — 0,5 балла
Me(OH)2 + Na2SO4 = MeSO4↓ + 2NaOH — 0,5 балла
Вычислим количество газа (Н2) : 4.48/22,4 = 0,2 (моль) — 0,5 балла
N(Me) = n(H2) = 0,2 моль; отсюда атомная масса металла равна : m(Me)/n(Me)=27,4/0,2=137 г/моль. Искомым металлом является барий. – 1 балл
Вычислим количество вещества Ba(OH)2 ; n(Ba(OH)2)=n(H2) =0,2 моль. – 0,5 балла
Вычислим m(Na2SO4) = w(Na2SO4)*m(раствора)/100; m(Na2SO4)=10*200/100=20г,- 0,5б
вычислим n(Na2SO4)= m(Na2SO4)/М(Na2SO4)=20/142=0,14(моль). 0,5 балла
Отсюда: n(Ba(OH)2)=n(Na2SO4)=0,14моль, т.е. сульфат натрия полностью реагирует в реакции. – 1 балл
Вычисляем количество вещества осадка: n(BaSO4) = 0,14моль.
В растворе содержится NaOH: nNaoH = 2*0, 14= 0,28 моль; количество оставшегося Ba(OH)2 = 0,2-0,14=0,06 (моль). – 1балл
Масса осадка: m(BaSO4)=n(BaSO4)*M(BaSO4)=0,14*233=32,62(г).
Массовая доля NaOH в растворе: m(NaOH)*100/800= 0,28*40*100/800=1,4% -0,5 балла
W(Ba(OH)2)=0,06*171*100/800=1,3% —0,5 балла.
Всего: 6 баллов
Задача 2 Определим атомное отношение элементов в соли KxCryOz:
x:у:z =26,53/39 : 35,37/52 : 38,1/16 = 0,68:0,68:2,38 = 1:1:3,5 = 2:2:7 —0,5 баллов
искомая соль – дихромат калия – K2Cr2O7. – 0,5 баллов
Соль реагирует с соляной кислотой по уравнению:
K2Cr2O7 + 14 HCl = 2KCl + 2CrCl3 + 3Cl2↑ + 7H2O — 1 балл
Вычислим количество вещества хлора: n(Cl2) = V/Vm = 13,4/22,4=0,6 (моль) — 0,5
баллов
Вычислим количество вещества дихромата калия: n(K2Cr2O7)=1/3 n(Cl2) = 0,6:3=0,2(моль). Отсюда, m(K2Cr2O7) = n(K2Cr2O7)*M(K2Cr2O7) =0,2 * 294= 58,8 (г). —0,5баллов
Таким образом, масса израсходованной соли равна 58,8 граммов.
Всего: 3 балла
Задача 3.
Вычислим массу спирта m=V*плотность; m(C2H5OH) =150*0,8= 120(г). – 0,5 баллов
Вычислим массу воды в спирте: m(H2O) = w(H2O)*m(раствора)/ 100=4*120/100=4,8(г). – 0,5 баллов
Вычислим количество вещества воды: n(H2O)=m(H2O):M(H2O)= 4,8:18=0,27 (моль). – 0,5 баллов
По условию задачи вода реагирует с карбидом кальция:
CaC2 +2 H2O = Ca(OH)2↓ + C2H2↑ — 0,5 баллов
n(CaC2) =1/2 n(H2O) = 0, 27/2 моль=0,135 моль – 0,5 баллов
вычислим массу карбида кальция : m(CaC2) = n(CaC2) * M(CaC2) = 0,27*64=17,28 (г) – 0,5 баллов.
следовательно, потребуется 17,28 граммов карбида кальция.
Всего: 3 балла
Задача 4.
5K+1N+3O2-2 +2K+1Mn+7O4-2 +3 H+12S+6O4-2 = 5K+1N+5O3-2 + K2S+6O4-2 + 2Mn+2S+6O4-2 + 3H+12O-2
N+3 – 2e— = N+5 5 восстановитель, окисление
Mn+7 + 5e— = Mn+2 2 окислитель, восстановление
Всего: 3 балла
Задача 5.
Х – H2S
2H2S + 3O2 = 2H2O + 2SO2
H2S + Br2 = 2HBr + S↓
H2S + 2KOH = K2S + 2H2O ( H2S + KOH = KHS + H2O)
H2S + 2FeCl3 = 2FeCl2 + 2HCl + S↓
2H2S + SO2 = 3S↓ + 2H2O
За каждое правильно написанное уравнение – 2 балла.
Всего: 10 баллов.
ИТОГО: за правильное выполнение всей работы – 37 баллов
Задания подготовила: Якунина Л.Б., МБОУ «СОШ №2»
infourok.ru
Урок химии в 11 классе «Решение комбинированных задач».
Урок химии в 11 классе в контексте подготовки к ЕГЭ
«Решение комбинированных задач».
Цель урока: отработать навыки решения основных типов задач, показать пути решения комбинированных задач как разновидности задания контрольно-измерительных материалов ЕГЭ.
Задачи урока:
1. Образовательная:
-
приобрести навык решения подобных заданий
-
акцентировать внимание на правильном оформлении результатов работы
2. Развивающая:
-
развитие логического, абстрактного мышления
-
развитие навыков быстрого счета
-
развитие способности концентрироваться при выполнении ответственного задания
3. Воспитательная:
Дидактический материал: распечатанный раздаточный материал с заданиями.
Мотивационная модель. Учащиеся решают задачи.
Уровень подготовленности учащихся выясняется в процессе решения.
Этапы урока:
-
Организационный момент.
-
Вводное слово учителя.
-
Алгоритм решения задач.
-
Подробный разбор задачи.
-
Отработка навыка решения подобных задач.
-
Самостоятельная работа.
-
Домашнее задание.
Пояснение к уроку. Длительность урока 45 минут. На всех этапах урока учитель контролирует выполнение задач. Во время урока приобретаются навыки решения задач определенного типа. Используется соревновательный элемент: кто решит задачу быстрее отвечающего у доски.
Ход урока.
-
Организационный момент.
2. Разминка (Повторение и обобщение пройденного).
Учитель. Сегодня на уроке мы продолжим решать расчетные задачи. На прошлом уроке мы вспомнили основные типы расчетных задач. Поэтому, я не буду долго останавливаться на них и в качестве разминки я предлагаю вашему вниманию следующие задачи.
(Задачи написаны на доске ).
Вас же попрошу предложить логическую схему решение данных задач. И определить к какому типу они относятся.
Задача 1. Какой объем газа (н. у.) получается при разложение 8г оксида меди(2).
2CuO=2Cu + O2.
Ответ уч-ся: m(Cu)→ n(Cu)→ n(O2)→V(O2)
Тип: нахождения объёма (массы и кол-ва вещества ) одного вещества по известной массе, объёму или количеству вещества другого вещества.
3. Решение комбинированных задач из части В.
Учитель. А теперь я предлагаю перейти к решению более сложных, так называемых комбинированных задач. Тексты задач находятся у вас на столах.
Задача 2. (на листочках уч-ся). Масса метилового эфира масляной кислоты, полученного при взаимодействии 48г метилового спирта и 100г 44%раствора масляной кислоты, равна___г.
Учитель: А кто помнит, запах чего имеет данный эфир и где используется?
Учащиеся: Запах яблок, используется как ароматизатор в пищевой и парфюмерной промышленности.
Учитель. Хорошо. А знаете ли вы, что первыми стали получать и использовать душистые вещества арабы, а в Европе греки и римляне ещё в античные времена.После античных времён духи снова появились только в эпоху возрождения.При дворе французского короля дамы в изобилии расходовали благовония, чтобы заглушить неприятный запах, исходящий от тела. В те времена не принято было мыться: считалось, что частые омовения тела вредны для здоровья. Известно, что король Франции Людовик 04 за 78 лет жизни мылся всего … четыре раза.
А теперь продолжим решения задач и попытаемся решить ещё более сложную задачу. 4. Решение комбинированной задачи.
Задача 3 . Рассчитайте массовую долю серной кислоты в растворе, полученном при пропускании 2,24л (н. у.).сероводорода через 250г 10% раствора сульфата меди
Учащийся у доски записывает условие задачи и приступает к решению.
V(h3S)=2,24л СuSO4+h3S = CuS↓+h3SO4
mр-ра(СuSO4)=250г 1моль 1моль 1моль
ω%(СuSO4)=10% V(H2S)→n(H2S)
n(H2SO4)→m(H2SO4)→ω%(H2SO4)
mр-ра(CuSO4)→m(CuSO4)→n (CuSO4)
ω%(H2SO4)-?
n(H2S)=2,24/22,4=0,1моль
m(CuSO4)=250•10/100=25г
n (CuSO4)=m/M=25/160=0,156моль-избыток
M(CuSO4)=160г/моль
n (H2SO4)=n(h3S)=0,1моль
m (H2SO4)=n•M = 0,1•98=9,8г
M(H2SO4)=98г/моль
ω% (H2SO4)=m(H2SO4)/mр-ра•100%
mр-ра2=mр-ра(H2SO4)+m(H2S)-m(CuS)
n(CuS)=n(H2S)=0,1моль
m(СuS)=0,1•96=9,6г
M(CuS)=96г/моль
m(H2S)=n•M=0.1•34=3,4г
mр-ра2=250+3,4-9,6=243,8г
ω% (H2SO4)=9,8/243,8=4%
Ответ: ω% (H2SO4)= 4%
5. Решение задач с использованием алгебраических уравнений.
Речь идет об одновременно происходящих реакциях, с реагентом (реагентами) взаимодействуют все компоненты смеси. Для определения порций отдельных компонентов придется использовать алгебраический алгоритм. Поскольку в дальнейшем предстоят расчеты по уравнениям реакций, в качестве неизвестной величины лучше всего выбрать количество вещества.
Алгоритм 1. Решение через систему уравнений с двумя неизвестными
(подходит для любой задачи такого типа)
1. Составить уравнения реакций.
2. Количества веществ (ν) в исходной смеси обозначить через х, у моль и, согласно молярным соотношениям по уравнениям реакций, выразить через х, у моль количества веществ в
образовавшейся смеси.
3. Составить математические уравнения. Для этого следует выразить массу (или объем)
веществ через х, у и молярную массу (молярный объем) по формулам:
m = ν*M; V = ν*VМ.
4. Составить систему уравнений и решить ее.
5. Далее решать согласно условиям задачи
Задача 4. Пластинку из магниево-алюминиевого сплава массой 3,9 г поместили
в раствор соляной кислоты. Пластинка растворилась, и выделилось 4,48 л газа. Найти массовые доли металлов в сплаве.
Решение
1) Запишем уравнения реакции:
Mg + 2HCl = MgCl2 +H2↑
1моль 1моль
2Al+ 6HCl = 2AlCl3 +3H2↑
2моль 3моль
2) Обозначим количества веществ:
ν(Mg) = x моль; ν(Н2) = х моль;
ν(Al) = y моль; ν(Н2) = 1,5 у моль.
3) Составим математические уравнения: найдем массы магния, алюминия и их смеси, а также ко-
личество вещества выделившегося водорода:
m(Mg) = 24x,
m(Al) = 27y,
m(смеси) = 24х + 27y;
ν(Н2) = V/VM = 4,48 (л) / 22,4 (л/моль) = 0,2 моль.
4) Составим систему уравнений и решим ее:
24x+ 27y=3,9
x + 1,5y = 0, 2 .
х = 0,2 — 1,5у,
24(0,2 — 1,5у) + 27у = 3,9,
у = 0,1;
х = 0,2 — 1,5*0,1 = 0,05.
5) Найдем массы магния и алюминия и их массовые доли в смеси:
m(Mg) = 0,05 (моль) * 24 (г /моль) = 1,2 г,
m(Al) = 0,1 (моль) * 27 (г /моль) = 2,7 г,
ω(Mg) = m(Mg) / m(см.) = 1,2 (г) / 3,9 (г) = 0,3077,
ω(Al) = m(Al) / m(см.) = 2,7 / 3,9 = 0,6923.
Ответ. ω(Mg) = 30,77 %; ω(Al) = 69,23 %.
Задача 5. К раствору, содержащему 5,48 г смеси сульфата и силиката натрия, прибавили избыток хлорида бария, в результате образовалось 9,12 г осадка. Найти массы солей в исходной смеси.
5.Подведение итогов урока, проверка решения задач по карточкам, выставление оценок.
Домашнее задание: составить обратную задачу к одной из предложенных и решить её.
infourok.ru
Факультативный курс по химии 11 класс «Решение химических задач»
Муниципальное бюджетное общеобразовательное учреждение
СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА №1 г. Поронайска
Рассмотрена на
МО
Протокол №_____
от «___»_____2016г.
Согласована
Протокол №_____от «___»_____2016г.
«Утверждаю»
Директор школы
Ч.С. Ким ______
Приказ № от
«____»______2016г.
Рабочая программа
факультативного курса по химии
«Решение химических задач»
для учащихся 11- х классов
срок реализации — 1 год, 34 часа
Разработчик:
учитель химии
Поронайск 2016 г
Пояснительная записка
Данная программа факультативного курса предназначена для учащихся 11 классов рассчитана на 34 часов, продолжительность курса — 1 год. Содержание программы составлено на основе УМК по химии Рудзитиса Г. Е. и Фельдмана Ф. Г.
Решение задач занимает в химическом образовании важное место, так как это один из приемов обучения, посредством которого обеспечивается более глубокое и полное усвоение учебного материала по химии. Чтобы научиться химии, изучение теоретического материала должно сочетаться с систематическим использованием решения различных задач. Умение решать задачи развивается в процессе обучения, и развивать это умение можно только одним путем — постоянно, систематически решать задачи.
Факультативный курс развивает у учащихся умения решать расчетные и экспериментальные задачи, развивает общие интеллектуальные умения, а именно, логического мышления, умений анализировать, конкретизировать, обобщать, применять приемы сравнения, развитие творческого мышления. При решении задач осуществляется осознание учащимися своей собственной деятельности, обеспечение самостоятельности и активности учащихся, достижение прочности знаний и умений применять полученные знания в нестандартных, творческих заданиях. Также у детей воспитывается трудолюбие, целеустремленность, развивается чувство ответственности, упорство и настойчивость в достижении поставленной цели. В процессе решения задач реализуются межпредметные связи, показывающие единство природы, что позволяет развивать мировоззрение учащихся. Выполнение задач расширяет кругозор учащихся, позволяет устанавливать связи между явлениями, между причиной и следствием, развивает умение мыслить логически, воспитывает волю к преодолению трудностей. Умение решать задачи, является одним из показателей уровня развития химического мышления учащихся, глубины усвоения ими учебного материала.
Актуальность данного курса заключается в том, что для базисных планов по химии общеобразовательных школ характерно эпизодическое включение расчетных задач, что ведет к поверхностным представлениям учащихся о химизме процессов в природе, технике. Сознательное изучение основ химии немыслимо без понимания количественной стороны химических процессов. Так как на решение задач отведено очень мало времени, то данный курс позволит устранить эти пробелы. Он окажет помощь учащимся, выбирающим химию в старших классах для сдачи экзамена, а также участникам олимпиад разного уровня. Особенностью данного элективного курса является то, что за небольшой период времени учащиеся знакомятся с различными способами решения задач, развивают навыки решения основных типов задач курса химии.
Цель курса:
Задачи курса:
-
Показать учащимся разные способы решения задач;
-
научить выбирать наиболее рациональный способ расчета;
-
Научить составлять авторские задачи;
-
способствовать формированию умений применять теоретические знания на практике;
-
развивать целеустремленность, трудолюбие, упорство и настойчивость, комплекс умственных действий;
-
Научить решать задачи повышенной сложности;
-
Формировать навыки исследовательской деятельности.
-
Способствовать профессиональному самоопределению в сфере химии.
Формы проведения занятий:
Главным назначением данного курса является:
-
совершенствование подготовки учащихся с повышенным уровнем мотивации к изучению химии;
-
— сознательное усвоение теоретического материала по химии, умение использовать при решении задач совокупность приобретенных теоретических знаний, развитие логического мышления, приобретение необходимых навыков работы с литературой.
Формы подведения итогов реализации образовательной программы:
-
Вводная диагностика
-
Диагностика знаний учащихся по темам;
-
Решение экзаменационных задач с последующей коррекцией.
Учебно-тематический план.
п/п
Наименование разделов и тем
Количество часов (всего)
Из них(количество часов)
Контрольные работы
Лабораторные и практические работы
Проектные, тестовые, творческие
1
Тема 1. Введение. Основные типы задач школьного курса. Алгоритм решения химических задач
1
1
2
Тема 2. Основные законы химии.
5
3
Тема 3. Расчеты по химическим уравнениям.
4
4
Т е м а 4. Растворы. Смеси.
6
5
Тема 5: Окислительно-восстановительные реакции.
8
6
Тема 6 Задачи по физической химии.
6
7
Тема 7. Решение экспериментальных задач
4
1
4
В нижней части таблицы часы суммируются
Итого:
34
2
4
Содержание тем учебного курса
Тема 1. Введение. Вводная диагностика. Выяснение уровня учащихся в области решения задач по химии.Основные типы задач школьного курса. Алгоритм решения химических задач. Расчеты по химическим формулам. Расчеты по уравнениям реакций. Базовая задача. Задачи по неорганической и органической химии.
Тема 2. Основные законы химии. Расчеты по химической формуле. Массовые доли элементов. Нахождение массы элементов и веществ. Нахождение химической формулы. Задачи на число Авогадро и на закон Авогадро. Относительные плотности газов. «Ненормальные условия». Уравнение Менделеева-Клайперона.
Тема 3. Расчеты по химическим уравнениям. Элементарные схемы решения простейших задач. Теория и реальность. Практический выход продукта. Реакции, в которых один из реагентов взят в избытке. Реакции, протекающие в газовой фазе.
Тема 4. Растворы. Смеси. Массовая доля вещества в растворе. Примеси. Смеси. Действия над растворами. Разбавление и концентрирование. Молярная и нормальная концентрация. Растворимость. Кристаллогидраты.
Тема 5. Окислительно-восстановительные реакции. Окислители и восстановители. Вычисление степеней окисления. Электронный баланс. Метод полуреакций. Особые случаи. Электролиз. Электролиз расплавов и растворов. Составление уравнений на электролиз.
Тема 6. Задачи по физической химии. Термохимия. Закон Гесса. Химическая кинетика. Закон Вант-Гоффа. Химическое равновесие. Принцип Ле-Шателье.
Тема 7. Решение экспериментальных задач. Генетическая связь неорганических веществ. Распознавание неорганических веществ и их состава на основе качественных реакций. Генетическая связь органических веществ. Распознавание органических веществ и их состава на основе качественных реакций. Итоговая контрольная работа. Подведение итогов курса.
Схема календарно-тематического планирования факультативного курса на учебный год
Тема занятия
Кол-во часов
Тема 1. Вводная диагностика. Как решать задачи по химии 1 ч
Тема 2. Основные законы химии. 5 ч
2, 3
Расчеты по химической формуле
2
4, 5
Составление формул веществ по известной массовой доле элемента.
2
6
Задачи на число Авогадро и на закон Авогадро
1
Тема 3. Расчеты по химическим уравнениям. 4 ч
7
Вычисление массы веществ по химическим уравнениям
Вычисление объема газов, если известна масса веществ или количество вещества
1
8
Расчеты по химическим уравнениям, если
одно из веществ дано в избытке
1
9, 10
Определение массовой или объемной доли
выхода продукта от теоретически возможного
2
Т е м а 4. Растворы. Смеси. 6 ч
11
Массовая доля вещества в растворе
1
12
Действия над растворами: разбавление, концентрирование и смешивание растворов
1
13
Молярная концентрация. Нормальная концентрация
1
14
Гидролиз солей
1
15
Растворимость
1
16
Вычисление массы компонентов в смеси
1
Тема 5: Окислительно-восстановительные реакции. 8 ч
17
Вычисление степеней окисления.
1
18
Окислительно-восстановительные реакции . Электронный баланс
1
19-22
Окислительно-восстановительные реакции.
Метод полуреакций
4
23, 24
Электролиз веществ
2
Тема 6. Задачи по физической химии. 6 ч
25
Расчеты по термохимическим уравнениям
1
26
Решение задач по термохимии
1
27
Химическая кинетика
1
28
Решение задач по химической кинетике
1
29
Химическое равновесие
1
30
Решение задач на химическое равновесие
1
Тема 7. Решение экспериментальных задач 5 ч
31
Генетическая связь неорганических веществ
1
32
Распознавание неорганических веществ и их состава на основе качественных реакций
1
33
Генетическая связь органических веществ
1
34
Репетиция экзамена. Итоговая контрольная работа.
1
Требования к уровню подготовки учеников
Учащиеся должны знать:
-
Основные типы задач;
-
Основные способы решения задач;
-
Химические свойства веществ основных классов;
-
Формулы, используемые при решении задач;
-
признаки, условия и сущность химических реакций;
-
химическую номенклатуру.
Учащиеся должны уметь:
-
Определять тип задачи;
-
Выбирать наиболее рациональный способ решения задач по химии;
-
Решать задачи разными способами;
-
производить расчеты:
-
по формулам и уравнениям реакций;
-
определения компонентов смеси;
-
определение формул соединений;
-
растворимости веществ;
-
вычисление объема газообразных веществ при н.у. и условиях, отличающихся от нормальных;
-
энтальпии веществ;
-
переход от одного способа выражения концентрации к другому.
Методические рекомендации
Отличительная особенность построения курса состоит в том, что он предназначен для учащихся 11 класса. К этому времени пройдена программа общей и неорганической химии, учащиеся в основном курсе уже ознакомлены с типами расчетных задач и их решением. Это дает возможность на занятиях факультативного курса обратить внимание на наиболее сложные и мало встречающиеся в основной программе направления решения задач. Уровень химической грамотности учащихся должен лежать в основе оценки их знаний.
При реализации программы данного курса рекомендуем обратить внимание на типологию расчетных задач, использовать дифференцированный подход.
Очень важно, чтобы учащиеся научились не только решать задачи по образцу, но и самостоятельно работать над текстом задачи, критически анализировать условия и возможные пути решения.
Несомненно, представленный факультативный курс можно расценивать как динамичный «тренинг», но для повышения мотивации учащихся, интенсификации учебной деятельности следует обращаться к современным образовательным технологиям (технология решения изобретательских задач, технология развития критического мышления).
Необходимо акцентировать внимание на том, чтобы ребята могли научиться не только великолепно решать задачи разных типов, но и самостоятельно составлять собственные задачи (на примере краеведческого материала, информации экологической направленности, практических жизненных ситуаций).
Литература
1. Гудкова А.С., Ефремова К.М., Магдесиева Н.Н., Мельчакова Н.В. 500 задач по химии: Пособие для учащихся. – 2-е изд. – М.: Просвещение, 1981.
2. Кузьменко Н.Е., Еремин В.В. 2000 задач и упражнений по химии. Для школьников и абитуриентов. – М.: 1 Федеративная Книготорговая Компания, 1998.
3. Пузаков С.А., Попков В.А. Пособие по химии для поступающих в вузы. Программы. Вопросы, упражнения, задачи. Образцы экзаменационных билетов: Учебное пособие. – 2-е изд., перераб. и доп. – М.: Высш. шк., 1999.
4. Хомченко Г.П., Хомченко И.Г. Сборник задач по химии для поступающих в вузы. – М.: Новая волна, 1996.
5. Цитович И.К., Протасов П.Н. Методика решения расчетных задач
по химии: Кн. для учителя. – 4-е изд., перераб – М.: Просвещение, 1983.
Основные понятия курса.
Базовая задача, усложненная задача, комбинированная задача, избыток и недостаток, выход продукта, примеси, растворы, растворимость, массовая доля растворенного вещества, массовая доля элемента, молярная концентрация, нормальная концентрация, кристаллогидраты, параллельные реакции, последовательные реакции, химическое равновесие, сдвиг химического равновесия, нормальные условия, газовые законы, закон постоянства состава, закон Вант-Гоффа, основной закон кинетики, закон Фарадея, правило Бертолле, правило Ле-Шателье.
Примерный перечень рефератов, творческих работ.
-
Гидраты и кристаллогидраты.
-
Жизнь и деятельность ученого…
-
Основные окислители и восстановители.
-
Окислительно-восстановительные реакции в органической химии.
-
Расстановка коэффициентов методом электронного баланса в случае дробных степеней окисления.
-
Способ полуреакций.
-
Составление задач с межпредметным содержанием.
-
Составление усложненных задач.
-
Химические ребусы, шарады, кроссворды.
Материалы для контроля.
1. В состав углеводорода входит 92,3% углерода. Плотность вещества при н.у. равна 1,17 г/л. Установите молекулярную формулу углеводорода.
2. Какой оксид наиболее богат железом: оксид железа(II), оксид железа(III), оксид железа(II,III)?
3. Образец вещества массой 6,6 г содержит 9,03•1022 молекул. Определите молекулярную массу этого вещества.
4. Определите массу образца оксида серы(IV), который содержит столько же молекул, сколько атомов содержится в кусочке железа массой 1,4 г.
5. Масса 0,327 л газа при 13 оС и давлении 1,040 •105 Па равна 0,828 г. Вычислите молярную массу газа.
6. К 120 г 20%-го раствора нитрата цинка добавили 5 г этой же соли и 15 г воды. Определите массовую долю растворенного вещества в образовавшемся растворе.
7. Определите массу воды и медного купороса CuSO4•5H2O, необходимого для приготовления 800 г 5%-го раствора сульфата меди(II). Какова молярная концентрация сульфата меди(II) в этом растворе, если его плотность равна1,051 г/мл?
8. 250 г мела, содержащего 20% примесей, реагирует с азотной кислотой. Найдите объем выделившегося газа, если выход продукта составляет 95% от теоретически возможного.
9. 40 л метана горит в 40л кислорода. Какой газ и в каком объеме выделится в реакции?
10. 16,6 г. Смеси этилового и пропилового спиртов обработали избытком натрия, при этом выделилось 3,36 л водорода (н.у.). определите массовые доли спиртов в смеси.
11. Газ, полученный гидролизом 6,4 г карбида кальция, подвергли гидратации в кислой среде в присутствии катализатора. Найдите массу альдегида, выделившегося в этой реакции.
12. После проведения электролиза водного раствора гидроксида калия током 20А в течение 67 ч было получено 200 г 10%-го раствора. Найдите массы образовавшихся продуктов и массовую долю исходного раствора.
13. При сгорании 3,52 г органического вещества образовалось 1,792 л углекислого газа и 1,44 мл воды. Плотность паров этого вещества по воздуху равна 1,517. Найдите молекулярную формулу вещества, приведите структурные формулы и названия веществ.
14. При сгорании магния массой 6,08 г в кислороде выделилось 150,5 кДж теплоты. Определите тепловой эффект образования оксида магния.
15. Реакция идет по уравнению
2NO + O2 = 2NO2
Начальные концентрации реагирующих веществ были: [NO] = 98 моль/л и [О2 ] = 0,6 моль/л. Как изменится начальная скорость реакции, если концентрацию кислорода увеличить до 0,9 моль/л, а концентрацию оксида азота – до 1,2 моль/л?
infourok.ru