§4. Практическая работа 1. Изучение влияния условий проведения химической реакции на ее скорость. (стр. 16-17). Задание №1
§39. Характеристика металлов. (стр. 138-141):
Лабораторный опыт:
39-pod;
Подумай, ответь, выполни:
1;
2;
3;
4;
5;
6;
Тестовые задания:
1;
2;
3;
§40. Нахождение металлов в природе и общие способы их получения. (стр. 142-143):
Подумай, ответь, выполни:
1;
2;
3;
§41. Химические свойства металлов. Электрохимический ряд напряжения металлов. (стр. 144-148):
Лабораторный опыт:
1;
Подумай, ответь, выполни:
1;
2;
3;
§42. Сплавы. (стр. 149-150):
Подумай, ответь, выполни:
1;
2;
3;
§43. Щелочные металлы. (стр. 151-155):
Подумай, ответь, выполни:
1;
2;
3;
4;
5;
6;
Тестовые задания:
1;
2;
3;
§44. Магний. Щелочноземельные металлы. (стр. 156-158):
Подумай, ответь, выполни:
1;
2;
3;
4;
5;
Тестовые задания:
1;
2;
3;
§45. Важнейшие соединения кальция. Жесткость воды. (стр. 159-163):
Лабораторный опыт:
1;
Подумай, ответь, выполни:
1;
2;
3;
4;
5;
Тестовые задания:
1;
2;
3;
Интернет задание:
1;
§46. Алюминий. (стр. 164-167):
Тестовые задания:
1;
2;
3;
4;
§47. Важнейшие соединения алюминия. (стр. 168-170):
Лабораторный опыт:
1;
Подумай, ответь, выполни:
1;
2;
3;
4;
5;
§48. Железо. (стр. 171-173):
Подумай, ответь, выполни:
1;
2;
3;
4;
Тестовые задания:
1;
2;
3;
§49. Соединения железа. (стр. 174-176):
Лабораторный опыт:
1;
Подумай, ответь, выполни:
1;
2;
3;
4;
Тестовые задания:
1;
2;
3;
§50. Практическая работа 7. Решение экспериментальных задач по теме ,,Металлы”. (стр. 177):
gdzplus.me
Практические работы по химии 9 класс
Просмотр содержимого документа
«Практическая работа №5 -9 кл»
Практическая работа №5.
Получение оксида углерода (IV) и изучение его свойств.
Цель работы:_________________________________________________________________
__________________________________________________________________________________________________________________________________________________________
Оборудование:________________________________________________________________
_____________________________________________________________________________
Реактивы:
|
Название |
Химическая формула |
|
Мрамор |
|
|
Соляная кислота |
|
|
Известковая вода |
|
|
Карбонат натрия |
Меры предосторожности:_____________________________________________________________
_____________________________________________________________________________________
Ход работы: Оформите результаты работы в виде таблицы
|
Название опыта |
Что делали? |
Что наблюдали? |
Уравнение химической реакции (в молекулярном, полном, сокращённом ионном виде) |
|
Опыт №1. Получение углекислого газа и изучение его свойств |
CaCO3 + HCl = H2O + CO2 ↔ Н2CO3 + Ca(OH)2 = |
||
|
Опыт №2. Взаимопревращение карбонатов и гидрокарбонатов |
CO2 + Ca(OH)2 = CaCO3 + CO2 + H2O ↔ Ca(HCO3)2 t˚C→ |
||
|
Опыт №3. Распознавание карбонатов |
Na2CO3 + HCl = |
Вывод (заполните пропуски):
Оксид углерода (IV) в лаборатории можно получить________________________________________
_____________________________________________________________________________________
Обнаружены следующие свойства CO2:
Физические__________________________________________________________________________Химические__________________________________________________________________________
_____________________________________________________________________________________
При пропускании углекислого газа через известковую воду сначала образуется _____________ карбонат кальция, который ________________ в избытке углекислого газа.
Гидрокарбонат кальция термически ____________________, при нагревании _______________ с образованием ______________________.
Все карбонаты могут вступать в реакцию с ________________ кислотами с образованием _________________, эта реакция является __________________________________________________________________________________.
Просмотр содержимого документа
«Практическая работа №4 -9 кл»
Практическая работа № 4.(9 класс)
Тема: «Получение аммиака и изучение его свойств»
Цель: Получить аммиак и ознакомиться со свойствами водного раствора аммиака.
Оборудование и реактивы: спиртовка, металлический штатив, пробка с газоотводной трубкой, лопаточка, фарфоровая чашечка, стеклянная палочка, 5 пробирок, ватный тампон, кристаллизатор, наполненный наполовину водой, фенолфталеиновая бумажка; хлорид аммония, гидроксид кальция, раствор аммиака (1%), раствор серной кислоты (1:5), раствор соляной кислоты (1:3).
Инструкция к выполнению практической работы.
Повторите по учебнику вопросы: получение и свойства аммиака, аммиачной воды и солей аммония. После этого приступайте к работе.
Опыт №1. Получение аммиака.
Соберите прибор для получения аммиака.
В фарфоровую чашечку насыпьте четыре лопаточки хлорида аммония и две лопаточки гидроксида кальция. Смесь перемешайте лопаточкой и насыпьте в сухую пробирку. Закройте её пробкой с газоотводной трубкой и укрепите в лапке штатива (обратите внимание на наклон пробирки со смесью). На газоотводную трубку наденьте сухую пробирку для собирания аммиака и отверстие её закройте ватным тампоном.
Пробирку со смесью хлорида аммония и гидроксида кальция слегка прогрейте (2-3 движениями пламени), а затем нагревайте в том месте, где находится смесь. Для обнаружения аммиака поднесите к отверстию перевёрнутой вверх дном пробирки влажную фенолфталеиновую бумажку. Обнаружив аммиак, поднесите к отверстию пробирки стеклянную палочку, смоченную раствором соляной кислоты. Что наблюдаете? Каков химический состав образующихся твёрдых частиц (дыма)? Напишите уравнение реакции.
Прекратите нагревание смеси. Пробирку, в которой собран аммиак, осторожно снимите с газоотводной трубки, держа её вверх дном (конец газоотводной трубки сразу же после снятия с неё пробирки с аммиаком закройте кусочком мокрой ваты).
Немедленно закройте отверстие снятой пробирки большим пальцем и опустите в сосуд с водой. Палец отнимите только под водой. Что наблюдаете? Почему вода поднялась в пробирке? Снова закройте пальцем отверстие пробирки под водой и выньте её из сосуда.
Ответьте на вопросы
1. Почему пробирку со смесью веществ для получения аммиака нужно укреплять в лапке штатива наклонно с приподнятым дном?
2. Почему аммиак собирают в перевёрнутую вверх дном пробирку? Какие ещё газы можно собирать таким способом?
3. Как доказать, что в водном растворе аммиака содержатся гидроксид-ионы?
С полученным водным раствором аммиака проделайте следующие опыты.
Изучение свойств водного раствора аммиака
Опыт № 1. В пробирку налейте 2-3мл водного раствора аммиака и добавьте 2-3 капли фенолфталеина. Каков цвет раствора? Нагрейте этот раствор до кипения. Как изменится окраска раствора? Чем вызвано это изменение?
Опыт № 2. Налейте в пробирку 2-3мл водного раствора аммиака. Добавьте 2-3 капли фенолфталеина и приливайте по каплям раствор серной кислоты до исчезновения малиновой окраски. Почему исчезла окраска? Напишите ионные уравнения реакции.
Составьте отчёт о работе. Сделайте вывод.
|
Название опыта. |
Наблюдения. Рисунки. |
Уравнения реакций |
Выводы |
Все видеоопыты по данной работе можно посмотреть на сайте Цифровые образовательные ресурсы.
Просмотр содержимого документа
«Практические работы 9 класс оборудование и реактивы»
multiurok.ru
Практическая работа №3. Экспериментальные задачи по распознаванию и получению соединений металлов
§18. Неметаллы: атомы и простые вещества. Кислороду озон, воздух. (стр. 129-135)
§19. Водород. (стр. 136-142)
Вопросы к параграфу:
1;
2;
3;
4;
5;
Лабораторный опыт:
№19;
§20. Вода. (стр. 143-152)
§21. Вода в жизни человека. (стр. 152-159)
§22. Галогены. (стр. 159-167)
§23. Соединения галогенов. (стр. 167-173)
Вопросы к параграфу:
1;
2;
3;
4;
Лабораторный опыт:
№26;
§24. Получение галогенов. Биологическое значение и применение галогенов и их соединений. (стр. 173-180)
§25. Кислород. (стр. 180-188)
Лабораторный опыт:
№27;
§26. Сера. (стр. 188-195)
Вопросы к параграфу:
1;
2;
3;
4;
5;
Лабораторный опыт:
№28;
§27. Соединения серы. (стр. 195-204)
Лабораторный опыт:
№29;
§28. Азот. (стр. 204-209)
Вопросы к параграфу:
1;
2;
3;
4;
5;
§29. Аммиак. (стр. 210-216)
Лабораторный опыт:
№30;
§30. Соли аммония. (стр. 216-219)
Вопросы к параграфу:
1;
2;
3;
4;
5;
Лабораторный опыт:
№31;
§31. Кислородные соединения азота. (стр. 220-225)
§32. Фосфор и его соединения. (стр. 225-232)
§33. Углерод. (стр. 232-241)
Лабораторный опыт:
№36;
§34. Кислородные соединения углерода. (стр. 242-249)
§35. Кремний и его соединения. (стр. 249-265)
Вопросы к параграфу:
1;
2;
3;
4;
Лабораторный опыт:
№40;
Темы для дискуссии::
1;
2;
3;
gdzplus.me
Опыты и эксперименты по химии (9 класс) на тему: Инструктивные карты для практических работ по химии 9 класс
Практическая работа № _2__
Тема: «Окислители, восстановители»
Цель: изучить изменение окраски перманганата калия(KMnO4) и йода (I2) в растворах восстановителей, а йодида калия (KI) – в растворах окислителей.
Оборудование:
Реактивы:
Ход работы:
Опыт 1. Вещества – тесты на восстановители.
А) В 3 пробирки налейте по 0,5 мл перманганата калия. В 1 пробирку прилейте 1 мл серной кислоты, во 2 – воды, в 3 – гидроксида калия (NaОН). Затем в каждую по 1 мл сульфита натрия (Na2SO3).
В 2 пробирку прикапайте фенолфталеин для обнаружения КОН.
Зарисуйте ваши действия:
Отметьте наблюдения в таблицу:
|
Наблюдения в пробирке |
||
|
№ 1 |
№ 2 |
№ 3 |
|
Уравнения |
||
|
KMnO4+К2SO3+h3SO4 = = MnSO4 + K2SO4+ h3O |
KMnO4+К2SO3+ h3O = = MnO2..+ К2SO4 + KOH |
KMnO4+К2SO3+КОН = = К2MnO4 + К2SO4 + h3O |
|
Вывод |
||
|
+7 +6 КMnO4 в кислой среде (Н+) Mn+2 |
+7 +6 КMnO4 в нейтральной среде (Н2О) MnО2↓ |
+7 +6 КMnO4 в щелочной среде (ОН-) (MnО4)2↓ |
Расставить коэффициенты методом электронного баланса.
Б) Помимо перманганата калия, в качестве теста на окислители используют раствор йода, который при восстановлении обесцвечивается, образуя I йодид – ион (в виде соли или кислоты HI).
I2 +2ē → I
Однако, если KMnO4 окисляет даже слабые восстановители, то I2 окисляет только сильные восстановитель.
Наберите 0,5 мл раствора I2, прилейте немного воды до 1 мл и добавьте 1 мл K2SO3.
- Зарисуйте ваши действия;
- Допишите уравнение реакции и расставьте в нем коэффициенты методом электронного баланса:
K2SO3 +I2 +h3O = K2SO4 + …
- Отметьте наблюдения под уравнением;
- Сделайте вывод: можно ли считать K2SO3 сильным восстановителем?
Вывод по йоду:
I2 + сильный восстановитель 2I–
коричнев. р-р бесцвет. р-р
Опыт 2. Вещества – тесты на окислители.
В пробирку налить 1 мл раствора KI и добавить FeCl3.
- Зарисуйте ваши действия;
- Допишите уравнения реакции, расставьте коэффициенты методом электронного баланса:
FeCl3 + KI = FeCl2 + …↓ + KCl
- Отметьте наблюдения под уравнением;
- Сделайте вывод: какой атом выступает в роли окислителя, а какой в роли восстановителя?
- Составьте схему перехода восстановителя. (см. в опыте 1 А,В)
Домашний эксперимент по ОВР
Тема: «Взаимодействие перманганата калия или йодной настойки с натуральными соками и с искусственными прохладительными напитками»
Если в домашней аптечке есть перманганат калия (марганцовка) и/ или йодная настойка, вы можете «поискать» восстановители вокруг. Приготовьте из них растворы.
Проверьте наличие восстановителей в соках, прохладительных напитках, бульонах, моющих средствах и т.д. Сравните по данному признаку натуральные соки и прохладительные напитки.
Приготовьте фото-, видеоотчет или письменное объяснение наблюдений.
План:
- Тема
- Цель
- Реактивы:
- Оборудование
- Ход работы:
- Что делали:
- Рисунок или фото
- Наблюдения
- Вывод: Есть восстановитель или нет в исследуемом растворе
nsportal.ru
Практическая работа по химии (9класс)
9 класс Тема №2 «Практикум №1. Свойства металлов и их соединений».
Практическая работа №2 «Получение и свойства соединений металлов 1-3 групп»
ЦЕЛЬ РАБОТЫ: Изучить свойства металлов1-3 групп и их соединений.
Ход выполнения работы.
Опыт 1: Вытеснение металлов из растворов солей другими металлами.
http://files.school-collection.edu.ru/dlrstore/071e7152-156c-edf1-3fe1-f52d09f94462/index.htm
Оборудование
Реактивы
Правила по ТБ
Инструкция по выполнению
Задание
Пробирки,
штатив для пробирок.
пинцет,
воронка
1)Раствор сульфата меди
и железный гвоздик
( стружка)
2)Раствор нитрата серебра и медная проволока
3)раствор нитрата свинца и гранулы цинка
Соли свинца и соли серебра — ядовиты, остерегаться попадания на кожу и на слизистые оболочки.
Раствор нитрата серебра оставляет черные пятна на одежде и на коже.
В пробирку налить :
1)2 – 3 мл. раствора сернокислой меди и опустить гвоздь (Fe).
2)2-3мл нитрата серебра и опустить медную проволоку
3) 2-3мл раствора нитрата свинца и опустить с помощью пинцета гранулы цинка
Наблюдать что происходит.
Написать уравнения реакции в молекулярном виде.
Объяснить наблюдаемое с помощью Электрохимического ряда напряжений металлов, рассмотрев нахождение в них :
Cu/ Fe,
Ag/ Cu
Pb/ Zn
Электрохимический ряд напряжений металлов
Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au
Предполагаемый ответ:
На железном гвозде появился розовый налет металлической меди:
CuSO4 + Fe = FeSO4 + Cu
Медь покрылась белыми кристаллами серебра:
2AgNO3 + Cu = Cu(NO3)2 + 2 Ag
Цинк покрылся рыхлым слоем металлического свинца:
Pb(NO3)2 + Zn = Pb + Zn (NO3)2
Активные металлы вытесняют менее активные из растворов их солей. В первой пробирке – медь (Cu) и раствор соли менее активного металла – серебра (AgNO3). Вторая пара – железо (Fe) и раствор соли меди (CuSO4). Железо активнее меди. В третьей пробирке – цинк (Zn) и раствор соли менее активного свинца Pb(NO3)2.
Вывод: в ходе химического эксперимента мы убедились в том, что активные металлы вытесняют менее активные из растворов их солей.
Опыт 2: Взаимодействие металлов с водой.
(Виртуально : Взаимодействие алюминия с водой: http://files.school-collection.edu.ru/dlrstore/bcdf78d2-10a1-a609-e295-1c79473e6eb0/index.htm)
Оборудование
Реактивы
Правила по ТБ
Инструкция по выполнению
Задание
Фарфоровая чашка (или кристаллизатор)
Нож, пинцет.
Металлический натрий,
кальций
Следует соблюдать правила работы с горючими газами (Натрий активен и «прыгает» по воде с выделением газа и теплоты),
Не использовать большое количество металла .
Не брать металл руками во избежание ожога.
Налить воды в фарфоровую чашку (или кристаллизатор) и опустить с помощью пинцета кусочек
металлического натрия, затем повторить с кальцием.
Наблюдать что происходит.
Проверить
раствор индикатором – фенолфталеином.
Записать уравнение реакции.
Сделать вывод об активности щелочных и щелочно-земельных металлов.
Предполагаемый ответ:
Щелочные металлы более активны и реагируют с водой моментально с выделением водорода . Активность щелочно-земельных металлов ниже.
2 Na + 2H2О =2 NaОН+ H2
Сa + 2H2О = Сa(ОН) 2+ H2
Вывод : Щелочные металлы более активно реагируют с водой.
Опыт3.Взаимодействие кислот с металлами.
http://files.school-collection.edu.ru/dlrstore/432f464f-1f22-5224-e016-91243ab1f09c/index.htm,
Оборудование
Реактивы
Правила по ТБ
Инструкция по выполнению
Задание
Пробирки, держатель для пробирок
Соляная кислота,
цинк,
медь
Следует соблюдать правила работы с горючими газами и правила работы с кислотами.
В две пробирки поместить цинк и медь.
Добавить соляную кислоту ( осторожно!)
Наблюдать что происходит.
Написать уравнения реакции в молекулярном виде.
Объяснить наблюдаемое с помощью Электрохимического ряда напряжений металлов.
Предполагаемый ответ:
Активные металлы вытесняют водород из кислот.
В пробирке с цинком начинается реакция с выделением водорода.
Zn + 2HCl = ZnCl2 + H2 ↑.
Цинк восстанавливает водород из кислот, в ряду напряжений он расположен левее водорода.
Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au
Медь не реагирует с кислотой: в ряду напряжений медь — правее водорода.
Вывод: Активный цинк реагирует с кислотой, неактивная медь – не реагирует с соляной кислотой.
Опыт4.Получение йодида алюминия
Виртуально : http://files.school-collection.edu.ru/dlrstore/bf44b9fa-6fc0-d64d-c5f0-39781d96d5d1/index.htm
Оборудование
Реактивы
Правила по ТБ
Инструкция по выполнению
Задание
Фарфоровые чашка и ступка, стальная пластинка, шпатель, пипетка.
Порошок алюминия,
порошок иода,
вода.
Опыт необходимо проводить под тягой. (Образуются фиолетовые пары йода.)
Порошок алюминия смешать с порошком йода. и добавить катализатор — капельку воды — начинается бурная реакция.
Наблюдать что происходит.
Написать уравнение реакции в молекулярном виде
Предполагаемый ответ:
Галогены и металлы активно взаимодействуют.
2Al + 3I2 = 2AlI3
При смешивании порошка алюминия с порошком йода реакция не идет. Плотная окисная пленка на алюминии тормозит процесс. Добавим катализатор — капельку воды — начинается бурная реакция. Вода взаимодействует с йодом, образовавшиеся йодсодержащие кислоты растворяют защитную окисную пленку алюминия – металл начинает бурно реагировать с йодом. Реакция проходит с выделением теплоты, поэтому непрореагировавший йод нагревается и возгоняется образуются фиолетовые пары йода
Вывод: Металлы активно реагируют с неметаллами с образованием солей.
Общий вывод: В ходе работы я опытным путем изучил(а) свойства металлов и их соединений, убедился(лась) в их зависимости от природы и активности металла ( его положения в электрохимическом ряду напряжения металлов).
infourok.ru
Практические работы по химии 8-9 классы
Практическая работа №1
Лабораторное оборудование и приемы работы с ним.
Цель: познакомиться с основным лабораторным оборудованием, его назначением и приемам обращения с ними.
С техникой безопасности знаком (а) ___________________________
1 часть
-
Знакомство со штативом.
По учебнику ознакомьтесь с устройством и назначением штатива. Внимательно посмотрите, как пользуется штативом учитель, демонстрируя его вам. Соберите штатив. Сделайте в тетради рисунок штатива, подписав его основные части: стержень, подставка, зажим, кольцо.
-
Знакомство со спиртовкой.
Рассмотрите нагревательный прибор, которым вы будете пользоваться при выполнении химических опытов. Прочитайте правила работы со спиртовкой по учебнику. Зарисуйте устройство спиртовки, подпишите её части.
-
Перечертите кроссворд в тетрадь. Впишите в него названия химического оборудования и посуды. Ключевое слово – название химического элемента
|
4 |
||||||
|
|
||||||
|
|
5 |
|||||
|
2 |
3 |
|
|
|||
|
1 |
|
|
|
|
||
|
|
|
|
|
|
||
|
|
|
|
|
|||
|
|
|
|
|
|||
|
|
|
|
||||
|
|
|
|||||
|
|
|
|||||
1. 
2.
3.
4.
5
Тест на знание правил техники безопасности
-
Вещество на вкус
А) можно пробовать
Б) нельзя пробовать
В) надо спросить у учителя
-
Знакомясь с запахом вещества надо
А) поднести пробирку к носу
Б) направить воздух рукой от пробирки к носу.
В) нет верного ответа
3. Число склянок, которое можно одновременно открыть при проведении опыта
А) 1 Б) 2 В) много Г) нет верного ответа
4. Спиртовка имеет следующие части:
А) резервуар
Б) фитиль
В) подставка
Г) колпачок
5. Выберите правильные суждения
А) спиртовку можно зажигать от другой спиртовки
Б) нельзя дуть на спиртовку
В) тушить пламя спиртовки можно колпачком
Г) пробирку с веществом сразу греют в нужном месте.
Д) при нагревании отверстие пробирки должно быть направлено в сторону от себя и соседей.
-
Стеклянную пробирку
А) можно класть на стол
Б) ставят только в штатив
В) можно класть на стол
Г) ставят только в штатив.
Бланк ответа
|
№ вопроса |
1 |
2 |
3 |
4 |
5 |
6 |
|
Буква ответа |
||||||
|
А |
||||||
|
Б |
||||||
|
В |
||||||
|
Г |
||||||
|
Д |
Практическая работа №2
Исследование физических и химических свойств веществ.
Цель: изучить физические и химические свойства предложенных веществ, используя различные методы.
С техникой безопасности знаком (а) ___________________________
Для выполнения работы используйте табличные данные
1 часть
-
Рассмотрите выданные вам образцы различных веществ. Исследуйте растворимость твердых веществ. Найдите в справочной таблице данные о плотности, температуре кипения, плавления. Результаты проведенного исследования внесите в таблицу.
|
Название вещества |
Агрегатное состояние |
цвет |
запах |
растворимость |
плотность |
Температура кипения и плавления |
|
железо |
||||||
|
сахар |
||||||
|
масло подсолнечное |
-
Исследуйте химические свойства цинка:
— взаимодействие с водой
— взаимодействие с соляной кислотой HCl
— взаимодействие с хлоридом меди CuCl2
Результаты проведенного исследования внесите в таблицу:
|
свойство |
наблюдения |
Вывод о протекании реакции |
Уравнения реакций |
Вывод: С помощью, каких методов вы изучали вещества во время практической работы?
Тест по правилам техники безопасности
-
Как определить газ по запаху?
А) наклониться над сосудом и вдохнуть
Б) направить пары газа к себе и сделать осторожный вдох
В) не знаю
Г) нет верного ответа
-
Растворы из склянки необходимо наливать так, чтобы:
А) при наклоне этикетка оказалась сверху, в ладони
Б) этикетка находится снизу
В) не имеет значения, как взять склянку для реактивов
Г) нет верного ответа
-
При разливе жидкости на столе необходимо:
А) сообщить учителю или лаборанту
Б) самостоятельно убрать разлитое вещество
В) сделать вид, что ничего не случилось.
Г) нет верного ответа
-
Почему нельзя собирать на рабочем месте много реактивов?
А) можно перепутать реактивы
Б) создается беспорядок
В) можно запачкать лабораторную тетрадь
Г) все выше перечисленное
-
Почему нельзя пробирку с раствором нагревать в одном месте:
А) долго не закипит
Б) может произойти выброс жидкости и как следствие ожог руки
В) плохо нагревается
Г) не знаю
Бланк ответа
|
№ вопроса |
1 |
2 |
3 |
4 |
5 |
|
Буква ответа |
|||||
|
А |
|||||
|
Б |
|||||
|
В |
|||||
|
Г |
Справочная таблица
|
Физические свойства некоторых веществ |
|||||
|
Вещество |
Температура плавления, ° С |
Температура кипения, ° С |
Удельная теплоемкость, кДж/кг с |
Удельная теплота плавления, Дж/кг |
Плотность, г/см3 |
|
Алюминий |
650 |
2450 |
920 |
397 |
2,7 |
|
Бронза |
1100 |
2590 |
380 |
210 |
7,8 |
|
Вода |
0 |
100 |
4200 |
330 |
1 |
|
Вольфрам |
3380 |
|
150 |
192 |
19,3 |
|
Железо |
1539 |
3200 |
7,9 |
||
|
Золото |
1063 |
2700 |
130 |
65,7 |
19,3 |
|
Иридий |
2450 |
|
|
117 |
22,4 |
|
Кремний |
1420 |
|
|
164 |
|
|
Латунь |
500 |
2590 |
380 |
210 |
8,5 |
|
Медь |
1083 |
2590 |
380 |
210 |
8,93 |
|
Никель |
1453 |
2800 |
500 |
303 |
8,9 |
|
Олово |
231,9 |
2430 |
250 |
60 |
|
|
Платина |
1772 |
3800 |
128 |
111 |
21,4 |
|
Поваренная соль |
800,8° С |
1465° |
2,165 |
||
|
Сахар |
185 |
1,6 |
|||
|
Свинец |
327,4 |
1750 |
250 |
25 |
11,3 |
|
Серебро |
961 |
|
250 |
104,5 |
10,5 |
|
Сталь |
1539 |
2735 |
460 |
270 |
7,8 |
|
Титан |
1668 |
3227 |
523 |
|
4,5 |
|
Углерод |
3650 |
4350 |
840 |
|
2,3 |
|
Цинк |
419.5 |
906 |
7.1 |
||
|
Чугун |
1250 |
2735 |
460 |
270 |
7,2 |
Практическая работа №3
«Очистка поваренной соли»
Цель: познакомится со способами разделения смесей, освоить простейшие способы очистки веществ: фильтрование и выпаривание; продолжить формировать умение работать по инструкции и оформлять отчет о химическом эксперименте.
С техникой безопасности знаком (а) ___________________________
1 часть
-
Получите загрязненную соль. Поместите её в стакан и растворите в 20 мл воды (при растворении перемешивайте стеклянной палочкой).
-
Разделите получившуюся смесь фильтрованием:
А) приготовьте бумажный фильтр, вложите его в воронку и смочите водой, используя стеклянную палочку
Б) проведите фильтрование. Помните, что жидкости надо наливать столько в воронку, чтобы она не доходила до краев 0,5 см, иначе смесь может протекать между фильтром и стенками воронки, не очищаясь от примесей
В) отфильтрованный раствор сохраните.
-
Проведите выпаривание:
А) полученный фильтрат вылейте в фарфоровую чашечку
Б) нагрейте чашку в пламени спиртовки, после появления кристаллов соли в чашке, нагревание прекратите
-
Сравните полученную соль с выданной в начале работы
-
Оформите отчет о работе
|
Что делали |
Что наблюдали |
Объяснения и выводы |
|
1. Растворение соли |
При добавлении воды соль…, а песок … |
Одни вещества в воде …, а другие нет. Песок оседает на дно, так как … |
|
2. Приготовление фильтра |
||
|
3. Фильтрование (рисунок) |
На стенках фильтра остается …, а в колбу отфильтровывается … |
Происходит разделение …, так как они отличаются… |
|
4. Выпаривание (рисунок) |
При нагревании в фарфоровой чашке раствора соли вода …, а соль … |
Произошло разделение …, так как у них разные |
Вывод:
2 часть
Тест по правилам техники безопасности
-
Как положено вести себя в школьной химической лаборатории?
А) можно перекусить
Б) можно смешивать реактивы, не пользуясь инструкцией
В) можно бегать и шуметь
Г) следует соблюдать на рабочем месте чистоту и порядок
-
Чего нельзя делать при работе со спиртовкой?
А) тушить огонь колпачком
Б) зажигать спичками
В) заполнять этиловым спиртом
Г) зажигать от другой спиртовки
-
Фарфоровую чашечку нагревают в пламени спиртовки, держа:
А) руками
Б) держателем
В) щипцами
Г) нет верного ответа
-
Полученную очищенную соль:
А) можно попробовать на вкус
Б) нельзя пробовать на вкус
В) нет верного ответа
-
Что нужно делать, если разлил раствор вещества:
А) сообщить учителю или лаборанту
Б) самостоятельно убрать разлитое вещество
В) сделать вид, что ничего не случилось.
Г) нет верного ответа
Бланк ответа
|
№ вопроса |
1 |
2 |
3 |
4 |
5 |
|
Буква ответа |
|||||
|
А |
|||||
|
Б |
|||||
|
В |
|||||
|
Г |
Практическая работа №4
«Приготовление раствора с указанной массовой долей вещества»
Цель:
1) научиться приготавливать растворы с указанной массовой долей () растворенного вещества;
2) продолжить формировать умение пользоваться химической посудой, весами.
С техникой безопасности знаком (а) ___________________________
1 часть
Задача. Для подкормки комнатных растений применяют раствор сульфата калия с массовой долей 2 %. Приготовьте 75 г такого раствора.
1 часть
-
Рассчитайте массы соли и воды, необходимые для приготовления раствора.
-
Приготовьте раствор.
-
Составьте отчет о последовательности ваших действий при приготовлении раствора, проиллюстрируйте их рисунками.
-
Запишите вывод.
2 часть
Тест по правилам техники безопасности
-
Твердые вещества берут:
А) рукой
Б) ложечкой
В) как придется
Г) не знаю
-
Какую посуду надо использовать при работе?
А) чистую
Б) грязную
В) с трещинами
Г) какая есть, ту и использовать
-
Когда можно приступать к работе в лаборатории?
А) когда хочешь
Б) с разрешения учителя
В) когда будешь готов
Г) нет верного ответа
-
Объем воды измеряют:
А) на весах
Б) в мерном цилиндре
В) в мерном стакане
Г) нет верного ответа
-
Полученный раствор необходимо:
А) отдать учителю
Б) вылить в канализацию
В) поставить на соседний стол
Г) нет верного ответа
Бланк ответа
|
№ вопроса |
1 |
2 |
3 |
4 |
5 |
|
Буква ответа |
|||||
|
А |
|||||
|
Б |
|||||
|
В |
|||||
|
Г |
Практическая работа №5
«Получение кислорода»
Цель: 1) познакомиться со способом получения кислорода в лаборатории и его химическим свойством — поддерживать горение;
2) научиться собирать газ в сосуд вытеснением воздуха;
3) совершенствовать умение работать с простейшими приборами.
С техникой безопасности знаком (а)________________________________
1 часть
-
В основание пробирки, в которой находится перманганат калия поместить комочек ваты и закрыть пробирку газоотводной трубкой.
-
Закрепить пробирку держателем. Опустить конец газоотводной трубки в пустую пробирку.
-
Нагреть пробирку с перманганатом калия, соблюдая правила нагревания.
-
Соберите кислород в пробирку способом вытеснения воздуха. Проверьте его наличие с помощью тлеющей лучинки. Прекратите нагревание.
-
Оформите отчет о работе: а) зарисуйте прибор для сбора кислорода, сделайте соответствующие подписи; б) заполните таблицу, дописав предложения и закончив уравнения реакций.
|
Что делали |
Что наблюдали |
Объяснения и выводы |
|
1. сборка прибора для получения кислорода |
Рисунок |
Кислород в лаборатории можно получить разложением кислородосодержащих веществ, например: … KMnO4 K2MnO4 + … + … |
|
2. Нагревание пробирки с перманганатом калия и собирание кислорода методом вытеснения воздуха |
В пробирке происходит… |
Пробирку для сбора кислорода следует держать … дном, потому что… |
|
3. Доказательство наличия кислорода в пробирке с помощью тлеющей лучинки |
Тлеющая лучинка… |
Кислород поддерживает … С + О2 = |
Вывод:
2 часть
Подумайте и ответьте:
-
Кислород в лаборатории получают при нагревании перманганата калия. Полученный газ можно собрать путем вытеснения воздуха, используя прибор;
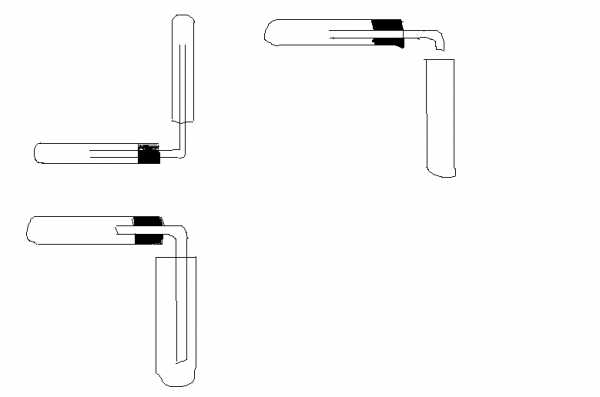
-
Какую посуду надо использовать при работе?
А) чистую
Б) грязную
В) с трещинами
Г) какая есть, ту и использовать
-
Пробирку нагревают
А) в верхней части пламени
Б) в нижней части пламени
В) не имеет значения
Г) нет верного ответа
-
Спиртовку тушат
А) задувая огонь
Б) колпачком
В) руками
Г) нет верного ответа
-
Почему нельзя пользоваться грязной посудой?
А) неприятно брать в руки
Б) можно получить неточный результат
В) нет верного ответа
Бланк ответа
|
№ вопроса |
1 |
2 |
3 |
4 |
5 |
|
Буква ответа |
|||||
|
А |
|||||
|
Б |
|||||
|
В |
|||||
|
Г |
Практическая работа №6
«Химические свойства кислот и оснований»
Цель: практически изучить свойства кислот и оснований, продемонстрировать умения фиксировать результаты наблюдений, делать выводы.
С техникой безопасности знаком (а)_____________________
1 часть
Последовательно выполните перечисленные ниже задания и оформите отчет о проведенном химическом эксперименте в виде предложенной таблицы.
-
Взаимодействие кислоты с металлом.
В пробирку налить 1 мл соляной (хлороводородной кислоты) и добавить гранулу цинка
-
Изменение окраски индикатора.
В пробирку налить 0,5 мл соляной кислоты, добавить индикатор метилоранжевый
-
Взаимодействие кислоты с основанием.
В пробирку из предыдущего опыта добавить гидроксид натрия до видимых признаков реакции
-
Взаимодействие растворимого основания с солью.
В пробирку налить 1 мл гидроксида натрия и добавить несколько капель хлорида железа (III)
-
Взаимодействие кислоты с основанием
К веществу, полученному в предыдущем опыте добавить соляную кислоту до видимых признаков.
|
Название опыта |
наблюдения |
Уравнение реакции |
Признак реакции (выпадение осадка, выделение газа, изменение окраски) |
|
Взаимодействие кислоты с металлом |
HCl + Zn = |
||
|
— |
||
|
Взаимодействие кислоты с основанием |
HCl + NaOH = |
||
|
Взаимодействие растворимого основания с солью |
NaOH + FeCl3 = |
||
|
Fe(OH)3 + HCl |
Вывод: какие свойства веществ изучили, какие признаки реакции наблюдали
2 часть
Тест по правилам техники безопасности
-
Если налил в пробирку избыток растворов реактивов надо:
А) слить обратно
Б) слить в канализацию
В) поставить в известность учителя или лаборанта
Г) нет верного ответа
-
Твердые вещества
А) берут руками
Б) берут шпателем
В) берут ложечкой
Г) берут всем выше перечисленным
-
При попадании на кожу раствора кислоты надо:
А) смыть холодной водой
Б) смыть холодной водой, обработать 2 % раствором соды
В) обработать 2 % раствором уксусной кислоты
Г) нет верного ответа
-
Кислоту разбавляют:
А) наливая воду в кислоту
Б) наливая кислоту в воду
В) порядок смешивания не имеет значения
Г) не знаю
-
Признак реакции:
А) изменение объема жидкости
Б) выпадение осадка
В) изменение формы вещества
Г) нет верного ответа
-
Нагревая пробирку её необходимо держать так, чтобы отверстие было направлено
А) вверх
Б) в сторону от себя
В) вниз
Г) в сторону от себя и от соседей
Бланк ответа
|
№ вопроса |
1 |
2 |
3 |
4 |
5 |
6 |
|
Буква ответа |
||||||
|
А |
||||||
|
Б |
||||||
|
В |
||||||
|
Г |
Практическая работа №7
«Решение экспериментальных задач по теме «Основные классы неорганических соединений»
Цель: повторить свойства оксидов, кислот, оснований и солей и применить эти знания при экспериментальном решении задач; научиться распознавать вещества, помещенные в склянках без этикеток.
С техникой безопасности знаком (а) _________________
1 часть
-
В двух склянках без этикеток находятся растворы: в одной – соляная кислота, во второй – гидроксид натрия. Как опытным путем доказать, в какой склянке находится каждое из веществ?
-
Химическим способом отмойте пробирку, загрязненную на практическом занятии гидроксидом железа (III)
-
Докажите, что выданное вещество – серная кислота.
-
Из имеющихся на столе реактивов получите несколькими способами сульфат меди (II)
(решите несколько задач по указанию учителя)
Результаты эксперимента оформите в произвольной форме, отметьте наблюдения, запишите уравнения реакций.
2 часть
Тест по правилам техники безопасности
-
Пробирка для опыта должна быть чистой так как:
А) это эстетично
Б) наличие грязи может сказаться на проведении эксперимента
В) цвет осадка может измениться
Г) не имеет значения
-
Почему избыток вещества (реактива) нельзя сливать (ссыпать) обратно в склянку?
-
Почему избыток вещества (реактива) нельзя сливать (ссыпать) обратно в склянку?
А) можно перепутать вещества
Б) загрязнить вещество
В) запачкать руки
Г) трудно открыть пробки
-
Проводить опыты, не предусмотренные инструкцией:
А) не разрешается
Б) можно с согласия учителя
В) можно, если знаешь, что получится
Г) нет верного ответа
-
При попадании на кожу раствора щелочи необходимо:
А) смыть холодной водой
Б) обработать 2 % раствором соды
В) обработать 2 % раствором уксусной кислоты
Г) нет верного ответа
-
Как оформляются результаты практической работы:
А) на отдельном листочке
Б) в тетради для практических работ
В) в рабочей тетради
Г) нет верного ответа
-
Пробирку в пробиркодержателе закрепляют
А) на середине пробирки
Б) у отверстия пробирки
В) в нижней части пробирки
Г) не имеет значения
Бланк ответа
|
№ вопроса |
1 |
2 |
3 |
4 |
5 |
6 |
|
Буква ответа |
||||||
|
А |
||||||
|
Б |
||||||
|
В |
||||||
|
Г |
Практическая работа №8
«Получение водорода»
Цель: научиться собирать газ с относительной плотностью меньше плотности воздуха; убедиться опытным путем, что водород является восстановителем
С техникой безопасности знаком (а) _________________
1 часть
-
В пробирку с газоотводной трубкой опустите 2-3 гранулы цинка и налейте соляной кислоты (чтобы кислота покрывала цинк)
-
Соберите водород методом вытеснения воздуха.
-
Проверка водорода на чистоту. Для опыта используем водород, собранный вытеснением воздуха. Поднесите её к пламени спиртовки. Если раздавшийся звук напоминает сухой треск, то значит водород чистый. А если звук резкий, «тявкающий», то водород смешан с воздухом.
-
В сухую пробирку поместите 0,5 см3 оксида меди (II). Пропустите водород через нагретый оксид меди (II).
Оформите отчет о работе в виде таблицы. Сделайте рисунки с обозначениями к ним. Запишите наблюдения. Составьте уравнения реакций. Сделайте выводы о свойствах водорода.
Вывод к практической работе.
2 часть
Тест по правилам техники безопасности
-
Перед поджиганием водорода его надо проверить
А) на наличие примесей
Б) на чистоту
В) на наличие водяных паров
Г) нет верного ответа
-
Водород можно собрать, используя следующий прибор:
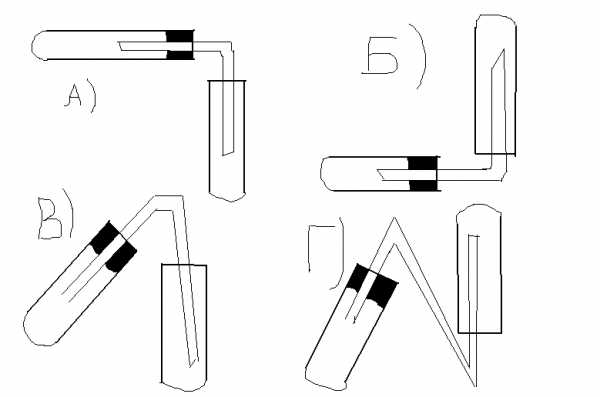
-
С целью предотвращения возможного взрыва при демонстрации горения водорода его поджигают:
А) лучинкой
Б) спиртовкой
В) газовой горелкой
Г) пламенем горящего водорода
-
При попадании на кожу раствора кислоты надо:
А) смыть холодной водой
Б) обработать 2 % раствором соды
В) обработать 2 % раствором уксусной кислоты
Г) нет верного ответа
-
Приготовленный к работе прибор:
А) можно использовать по назначению
Б) надо продемонстрировать учащимся
В) необходимо показать учителю или лаборанту
Г) нет верного ответа
Бланк ответа
|
№ вопроса |
1 |
2 |
3 |
4 |
5 |
|
Буква ответа |
|||||
|
А |
|||||
|
Б |
|||||
|
В |
|||||
|
Г |
kopilkaurokov.ru
Инструкции к проведению практических работ по химии в 9 классе по УМК О.С.Габриеляна
Практическая работа №3
Решение экспериментальных задач на распознавание и получение веществ
Инструктаж по технике безопасности.
Цель работы: научиться опытным путем определять и получать вещества.
Оборудование: штатив с пробирками.
Реактивы: NaOH, K2CO3, BaCl2, индикаторная бумага, H2SO4, алюминиевая пудра.
Вариант №1
Ход работы
Задача1. Определить в какой пробирке находится каждое из веществ: NaOH, K2CO3, BaCl2.
1. Приливаем в каждую пробирку Н2О.
Наблюдаем:…
Вывод: в пробирке № … находится ……..
2.Определим индикаторной бумагой пробирку в которой находится щелочь:
Пробирка №1- цвет: …
№2- цвет: …
№3- цвет: …
Вывод: в пробирке № … находится щелочь.
3.Приливаем в пр № … H2SO4
(Наблюдение, уравнения реакций, выводы.).
Вывод: в пробирке № … находится……..
Задача2. Получить NaAlO2 из Al.
1.Добавим в пробирку с алюминиевой пудрой избыток щелочи:
(Наблюдение, уравнения реакций, выводы.)
Результаты оформить в виде таблицы:
|
Что делаю? |
Что наблюдаю? |
Уравнения реакции или выводы |
Практическая работа №3
Решение экспериментальных задач на распознавание и получение веществ
Инструктаж по технике безопасности.
Цель работы: научиться опытным путем определять и получать вещества.
Оборудование: штатив с пробирками.
Реактивы: Na2SO4, CaCO3, KCl, BaCl2, HCl, железные опилки.
Вариант №2
Ход работы
Задача1. Определить в какой пробирке находится каждое из веществ: Na2SO4, CaCO3, KCl .
1. Приливаем в каждую пробирку Н2О.
Наблюдаем растворение веществ:…
Вывод: в пробирке № … находится ……..
2.Добавим в пробирку HCl :
(Наблюдение, уравнения реакций.)
Вывод: в пробирке № … находится ……..
3.Приливаем в пр № … BaCl2
(Наблюдение, уравнения реакций, выводы.)
Вывод: в пробирке № … находится ……..
Задача2. Получить FeCl2 из Fe.
Добавим в пробирку с железными опилками HCl:
(Наблюдение, уравнения реакций, выводы.)
Результаты оформить в виде таблицы:
|
Что делаю? |
Что наблюдаю? |
Уравнения реакции или выводы |
kopilkaurokov.ru