|
1. |
Распознавание оснований
|
1 |
|
2. |
Распознавание щелочей
|
1 |
|
3. 
|
Составление названий оснований
|
2 |
|
4. |
Химические свойства оснований в реакциях нейтрализации
|
3 |
|
5. 
|
Химические свойства оснований в реакциях с солями
|
3 |
|
6. |
Составление уравнений химических реакций нейтрализации
|
3 |
|
7. 
|
Составление химических реакций оснований с солями
|
3 |
|
8. |
Способы получения оснований
|
1 |
|
9. 
|
Химические свойства оснований
|
1 |
|
10. |
Способы получения оснований
|
3 |
Общая характеристика оснований — урок.
 Химия, 8–9 класс.
Химия, 8–9 класс.
В \(1754\) году французский химик Г. Руэль (\(1703\)–\(1770\)) ввёл термин «основание», подразумевая, что к соединениям данного класса относится любое вещество, которое способно взаимодействовать с кислотами, образуя соли.
Гийом Франсуа Руэль
\(1703\)–\(1770\)
Позже значение этого термина неоднократно уточнялось. Одно из определений, которым пользуются в настоящее время, звучит так:
Основаниями называют сложные вещества, в состав которых входят металлические химические элементы, соединённые с одной или несколькими гидроксогруппами (группами атомов \(-OH\)).
Исходя из этого, общую химическую формулу оснований можно изобразить следующим образом:
M(OH)n,
где \(M\) — знак металлического химического элемента,
а \(n\) — индекс, численно совпадающий с валентностью металла.
Основания относятся к электролитам, то есть к веществам, растворы и расплавы которых проводят электрический ток.
С точки зрения теории электролитической диссоциации, основания — электролиты, которые, диссоциируя, из отрицательно заряженных ионов образуют только гидроксид-ионы.
Номенклатура оснований
Название основания состоит из слова «гидроксид» и названия металлического химического элемента в родительном падеже. Если металлический элемент имеет переменную валентность, то последняя указывается римскими цифрами в скобках без пробела сразу же после названия металла.
Пример:
NaOH — гидроксид натрия,
Fe(OH)2 — гидроксид железа(\(II\)),
Fe(OH)3 — гидроксид железа(\(III\)).
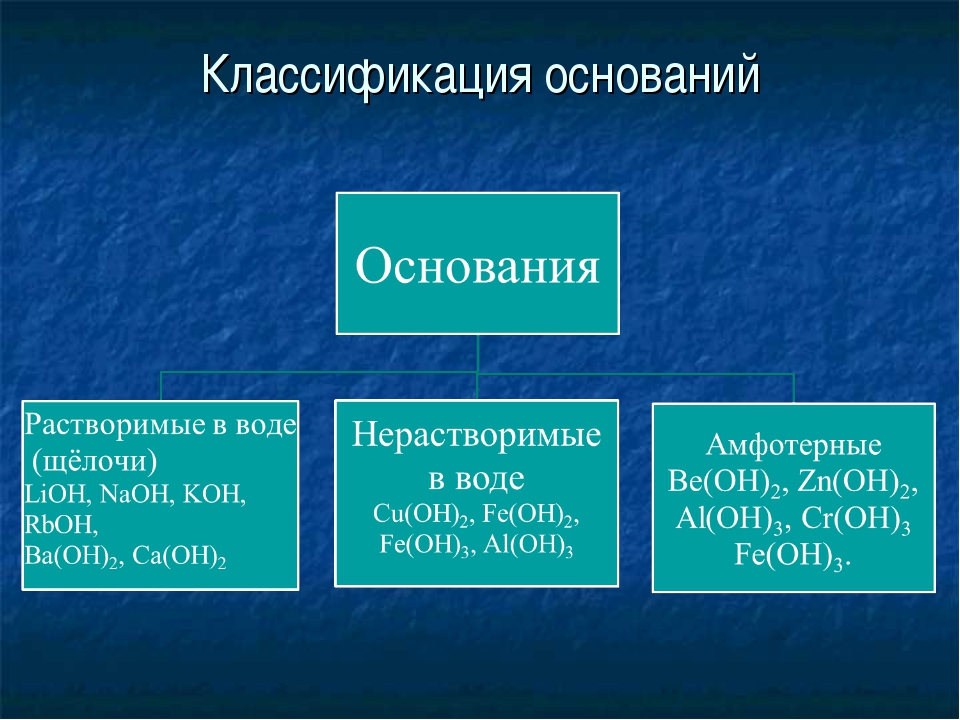
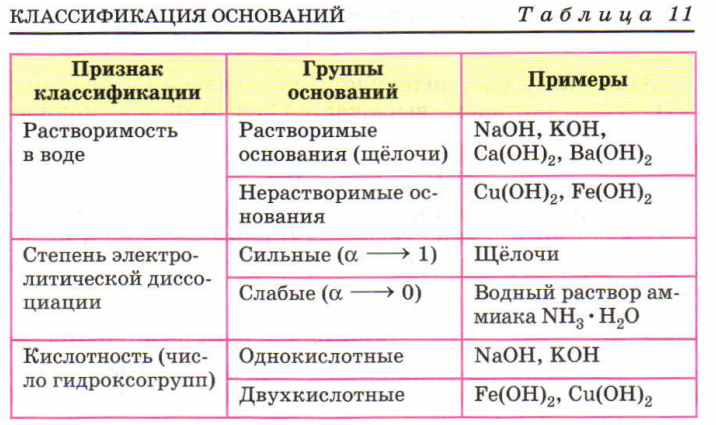
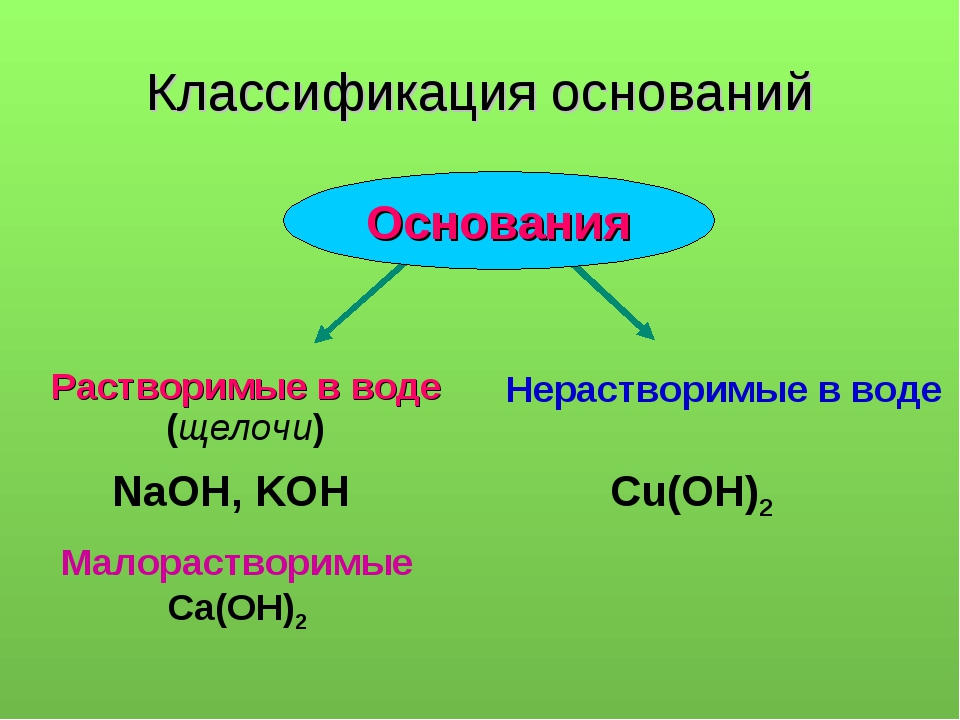
Классификация оснований
Растворимые в воде основания называют щелочами.
По их способности растворяться в воде основания делят на растворимые и практически нерастворимые.
|
Примеры: NaOH — гидроксид натрия, KOH — гидроксид калия, Ca(OH)2 — гидроксид кальция. |
Примеры: Cu(OH)2 — гидроксид меди(\(II\)), Fe(OH)2 — гидроксид железа(\(II\)), Fe(OH)3 — гидроксид железа(\(III\)). |
Источники:
https://upload.wikimedia.org/wikipedia/commons/d/d5/Guillaume-Fran%C3%A7ois_Rouelle.jpg
Химические свойства оснований — урок. Химия, 8–9 класс.
Химические свойства гидроксида металла во многом зависят от того, к какой группе он принадлежит — к щелочам или к нерастворимым основаниям.
Общие химические свойства щелочей
1. Кристаллы щелочей при растворении в воде полностью диссоциируют, то есть распадаются на положительно заряженные ионы металла и отрицательно заряженные гидроксид-ионы.
A) Например, при диссоциации гидроксида натрия образуются положительно заряженные ионы натрия и отрицательно заряженные гидроксид-ионы:
NaOH→Na++OH−.
Б) Процесс диссоциации гидроксида кальция отображается следующим уравнением:
Ca(OH)2→Ca2++2OH−.
2. Растворы щелочей изменяют окраску индикаторов.
Фактически с индикатором взаимодействуют гидроксид-ионы, содержащиеся в растворе любой щёлочи. При этом протекает химическая реакция с образованием нового продукта, признаком протекания которой является изменение окраски вещества.
При этом протекает химическая реакция с образованием нового продукта, признаком протекания которой является изменение окраски вещества.
Изменение окраски индикаторов в растворах щелочей
|
Индикатор |
Изменение окраски индикатора |
| Лакмус |
Фиолетовый лакмус становится синим |
| Фенолфталеин |
Беcцветный фенолфталеин становится малиновым |
|
Универсальный индикатор |
Универсальный индикатор становится синим |
Видеофрагмент:
|
Действие щелочей на индикаторы |
3. Щёлочи взаимодействуют с кислотами, образуя соль и воду.
Реакция нейтрализации — частный случай реакции обмена: при взаимодействии щелочи и кислоты образуются соль и вода.
А) Например, при взаимодействии гидроксида натрия с соляной кислотой образуются хлорид натрия и вода: NaOH+HCl→NaCl+h3O.
Видеофрагмент:
|
Взаимодействие гидроксида натрия с соляной кислотой |
Б) Если нейтрализовать гидроксид кальция азотной кислотой, образуются нитрат кальция и вода:
Ca(OH)2+2HNO3→Ca(NO3)2+2h3O.
4. Щёлочи взаимодействуют с кислотными оксидами, образуя соль и воду.
А) Например, при взаимодействии гидроксида кальция с оксидом углерода(\(IV\)) т. е. углекислым газом, образуются карбонат кальция и вода:
Ca(OH)2+CO2→CaCO3↓+h3O.
Обрати внимание!
При помощи этой химической реакции можно доказать присутствие оксида углерода(\(IV\)): при пропускании углекислого газа через известковую воду (насыщенный раствор гидроксида кальция) раствор мутнеет, поскольку выпадает осадок белого цвета — образуется нерастворимый карбонат кальция.
Б) При взаимодействии гидроксида натрия с оксидом фосфора(\(V\)) образуются фосфат натрия и вода:
6NaOH+P2O5→2Na3PO4+3h3O.
5. Щёлочи могут взаимодействовать с растворимыми в воде солями.
Обрати внимание!
Реакция обмена между основанием и солью возможна в том случае, если оба исходных вещества растворимы, а в результате образуется хотя бы одно нерастворимое вещество (выпадает осадок).
А) Например, при взаимодействии гидроксида натрия с сульфатом меди(\(II\)) образуются сульфат натрия и гидроксид меди(\(II\)):
2NaOH+CuSO4→Na2SO4+Cu(OH)2↓.
Б) При взаимодействии гидроксида кальция с карбонатом натрия образуются карбонат кальция и гидроксид натрия:
Ca(OH)2+Na2CO3→CaCO3↓+2NaOH.
6. Малорастворимые щёлочи при нагревании разлагаются на оксид металла и воду.
Например, если нагреть гидроксид кальция, образуются оксид кальция и водяной пар:
Ca(OH)2⟶t°CaO+h3O↑.
Общие химические свойства нерастворимых оснований
1. Нерастворимые основания взаимодействуют с кислотами, образуя соль и воду.
А) Например, при взаимодействии гидроксида меди(\(II\)) с серной кислотой образуются сульфат меди(\(II\)) и вода:
Cu(OH)2+h3SO4→CuSO4+2h3O.
Б) При взаимодействии гидроксида железа(\(III\)) с соляной (хлороводородной) кислотой образуются хлорид железа(\(III\)) и вода:
Fe(OH)3+3HCl→FeCl3+3h3O.
Видеофрагмент:
|
Взаимодействие гидроксида железа(\(III\)) с соляной кислотой |
2. Некоторые нерастворимые основания могут взаимодействовать с некоторыми кислотными оксидами, образуя соль и воду.
Например, при взаимодействии гидроксида меди(\(II\)) с оксидом серы(\(VI\)) образуются сульфат меди(\(II\)) и вода:
Cu(OH)2+SO3⟶t°CuSO4+h3O.
3. Нерастворимые основания при нагревании разлагаются на оксид металла и воду.
А) Например, при нагревании гидроксида меди(\(II\)) образуются оксид меди(\(II\)) и вода:
Cu(OH)2⟶t°CuO+h3O.
Видеофрагмент:
|
Разложение гидроксида меди(\(II\)) |
Б) Гидроксид железа(\(III\)) при нагревании разлагается на оксид железа(\(III\)) и воду:
2Fe(OH)3⟶t°Fe2O3+3h3O.
Физические свойства оснований — урок. Химия, 8–9 класс.
При обычных условиях основания (гидроксиды металлов) являются твёрдыми кристаллическими веществами. Они нелетучи и не имеют запаха.
Растворимость оснований в воде
По растворимости в воде эти соединения делят на две группы: щёлочи и практически нерастворимые основания. В свою очередь щёлочи делят на хорошо растворимые в воде и малорастворимые основания.
В свою очередь щёлочи делят на хорошо растворимые в воде и малорастворимые основания.
Общеустановленных чётких границ между хорошо-, малорастворимыми и практически нерастворимыми в воде веществами не существует, поэтому справочные данные, взятые из разных источников, могут несколько отличаться друг от друга. Приведём сведения о растворимости щелочей, которых мы будем придерживаться.
Классификация щелочей по их растворимости в воде:
|
LiOH — гидроксид лития, NaOH — гидроксид натрия, KOH — гидроксид калия, RbOH — гидроксид рубидия, CsOH — гидроксид цезия, FrOH — гидроксид франция, Ba(OH)2 — гидроксид бария, Ra(OH)2 — гидроксид радия. |
Ca(OH)2 — гидроксид кальция, Sr(OH)2 — гидроксид стронция.
|
Обрати внимание!
Почти все остальные основания (гидроксиды металлов) являются практически нерастворимыми.
Окраска оснований
Большинство оснований — вещества белого цвета. Но существуют гидроксиды металлов, которые имеют отличающуюся окраску.
|
Цвет основания |
Примеры |
|
Белый
|
LiOH — гидроксид лития, Mg(OH)2 — гидроксид магния, Ca(OH)2 — гидроксид кальция |
| Жёлтый | CuOH — гидроксид меди(\(I\)) |
|
Светло-розовый (при соприкосновении с кислородом воздуха окраска становится коричневой) |
Mn(OH)2 — гидроксид марганца(\(II\)) |
| Красно-коричневый | Fe(OH)3 — гидроксид железа(\(III\)) |
|
Белый с зеленоватым оттенком (при соприкосновении с кислородом воздуха окраска становится темнее) |
Fe(OH)2 — гидроксид железа(\(II\)) |
| Светло-зелёный | Ni(OH)2 — гидроксид никеля(\(II\)) |
| Синий | Cu(OH)2 — гидроксид меди(\(II\)) |
Физические свойства оснований — урок.
 Химия, 8–9 класс.
Химия, 8–9 класс.
При обычных условиях основания (гидроксиды металлов) являются твёрдыми кристаллическими веществами. Они нелетучи и не имеют запаха.
Растворимость оснований в воде
По растворимости в воде эти соединения делят на две группы: щёлочи и практически нерастворимые основания. В свою очередь щёлочи делят на хорошо растворимые в воде и малорастворимые основания.
Общеустановленных чётких границ между хорошо-, малорастворимыми и практически нерастворимыми в воде веществами не существует, поэтому справочные данные, взятые из разных источников, могут несколько отличаться друг от друга. Приведём сведения о растворимости щелочей, которых мы будем придерживаться.
Классификация щелочей по их растворимости в воде:
|
LiOH — гидроксид лития, NaOH — гидроксид натрия, KOH — гидроксид калия, RbOH — гидроксид рубидия, CsOH — гидроксид цезия, FrOH — гидроксид франция, Ba(OH)2 — гидроксид бария, Ra(OH)2 — гидроксид радия. |
Ca(OH)2 — гидроксид кальция, Sr(OH)2 — гидроксид стронция.
|
Обрати внимание!
Почти все остальные основания (гидроксиды металлов) являются практически нерастворимыми.
Окраска оснований
Большинство оснований — вещества белого цвета. Но существуют гидроксиды металлов, которые имеют отличающуюся окраску.
|
Цвет основания |
Примеры |
|
Белый
|
LiOH — гидроксид лития, Mg(OH)2 — гидроксид магния, Ca(OH)2 — гидроксид кальция |
| Жёлтый | CuOH — гидроксид меди(\(I\)) |
|
Светло-розовый (при соприкосновении с кислородом воздуха окраска становится коричневой) |
Mn(OH)2 — гидроксид марганца(\(II\)) |
| Красно-коричневый | Fe(OH)3 — гидроксид железа(\(III\)) |
|
Белый с зеленоватым оттенком (при соприкосновении с кислородом воздуха окраска становится темнее) |
Fe(OH)2 — гидроксид железа(\(II\)) |
| Светло-зелёный | Ni(OH)2 — гидроксид никеля(\(II\)) |
| Синий | Cu(OH)2 — гидроксид меди(\(II\)) |
Химические свойства оснований — урок.
 Химия, 8–9 класс.
Химия, 8–9 класс.
Химические свойства гидроксида металла во многом зависят от того, к какой группе он принадлежит — к щелочам или к нерастворимым основаниям.
Общие химические свойства щелочей
1. Кристаллы щелочей при растворении в воде полностью диссоциируют, то есть распадаются на положительно заряженные ионы металла и отрицательно заряженные гидроксид-ионы.
A) Например, при диссоциации гидроксида натрия образуются положительно заряженные ионы натрия и отрицательно заряженные гидроксид-ионы:
NaOH→Na++OH−.
Б) Процесс диссоциации гидроксида кальция отображается следующим уравнением:
Ca(OH)2→Ca2++2OH−.
2. Растворы щелочей изменяют окраску индикаторов.
Фактически с индикатором взаимодействуют гидроксид-ионы, содержащиеся в растворе любой щёлочи. При этом протекает химическая реакция с образованием нового продукта, признаком протекания которой является изменение окраски вещества.
Изменение окраски индикаторов в растворах щелочей
|
Индикатор |
Изменение окраски индикатора |
| Лакмус |
Фиолетовый лакмус становится синим |
| Фенолфталеин |
Беcцветный фенолфталеин становится малиновым |
|
Универсальный индикатор |
Универсальный индикатор становится синим |
Видеофрагмент:
|
Действие щелочей на индикаторы |
3. Щёлочи взаимодействуют с кислотами, образуя соль и воду.
Реакция нейтрализации — частный случай реакции обмена: при взаимодействии щелочи и кислоты образуются соль и вода.
А) Например, при взаимодействии гидроксида натрия с соляной кислотой образуются хлорид натрия и вода: NaOH+HCl→NaCl+h3O.
Видеофрагмент:
|
Взаимодействие гидроксида натрия с соляной кислотой |
Б) Если нейтрализовать гидроксид кальция азотной кислотой, образуются нитрат кальция и вода:
Ca(OH)2+2HNO3→Ca(NO3)2+2h3O.
4. Щёлочи взаимодействуют с кислотными оксидами, образуя соль и воду.
А) Например, при взаимодействии гидроксида кальция с оксидом углерода(\(IV\)) т. е. углекислым газом, образуются карбонат кальция и вода:
Ca(OH)2+CO2→CaCO3↓+h3O.
Обрати внимание!
При помощи этой химической реакции можно доказать присутствие оксида углерода(\(IV\)): при пропускании углекислого газа через известковую воду (насыщенный раствор гидроксида кальция) раствор мутнеет, поскольку выпадает осадок белого цвета — образуется нерастворимый карбонат кальция.
Б) При взаимодействии гидроксида натрия с оксидом фосфора(\(V\)) образуются фосфат натрия и вода:
6NaOH+P2O5→2Na3PO4+3h3O.
5. Щёлочи могут взаимодействовать с растворимыми в воде солями.
Обрати внимание!
Реакция обмена между основанием и солью возможна в том случае, если оба исходных вещества растворимы, а в результате образуется хотя бы одно нерастворимое вещество (выпадает осадок).
А) Например, при взаимодействии гидроксида натрия с сульфатом меди(\(II\)) образуются сульфат натрия и гидроксид меди(\(II\)):
2NaOH+CuSO4→Na2SO4+Cu(OH)2↓.
Б) При взаимодействии гидроксида кальция с карбонатом натрия образуются карбонат кальция и гидроксид натрия:
Ca(OH)2+Na2CO3→CaCO3↓+2NaOH.
6. Малорастворимые щёлочи при нагревании разлагаются на оксид металла и воду.
Например, если нагреть гидроксид кальция, образуются оксид кальция и водяной пар:
Ca(OH)2⟶t°CaO+h3O↑.
Общие химические свойства нерастворимых оснований
1. Нерастворимые основания взаимодействуют с кислотами, образуя соль и воду.
А) Например, при взаимодействии гидроксида меди(\(II\)) с серной кислотой образуются сульфат меди(\(II\)) и вода:
Cu(OH)2+h3SO4→CuSO4+2h3O.
Б) При взаимодействии гидроксида железа(\(III\)) с соляной (хлороводородной) кислотой образуются хлорид железа(\(III\)) и вода:
Fe(OH)3+3HCl→FeCl3+3h3O.
Видеофрагмент:
|
Взаимодействие гидроксида железа(\(III\)) с соляной кислотой |
2. Некоторые нерастворимые основания могут взаимодействовать с некоторыми кислотными оксидами, образуя соль и воду.
Например, при взаимодействии гидроксида меди(\(II\)) с оксидом серы(\(VI\)) образуются сульфат меди(\(II\)) и вода:
Cu(OH)2+SO3⟶t°CuSO4+h3O.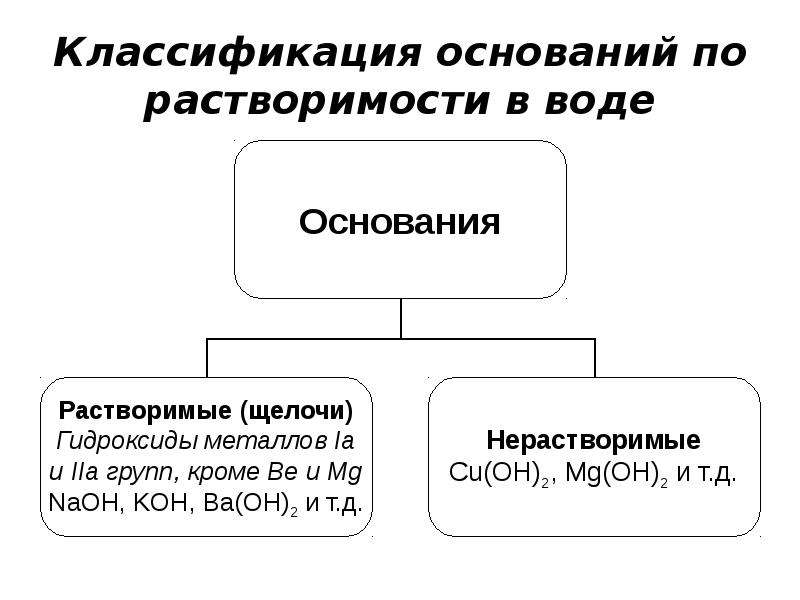
3. Нерастворимые основания при нагревании разлагаются на оксид металла и воду.
А) Например, при нагревании гидроксида меди(\(II\)) образуются оксид меди(\(II\)) и вода:
Cu(OH)2⟶t°CuO+h3O.
Видеофрагмент:
|
Разложение гидроксида меди(\(II\)) |
Б) Гидроксид железа(\(III\)) при нагревании разлагается на оксид железа(\(III\)) и воду:
2Fe(OH)3⟶t°Fe2O3+3h3O.
Общая характеристика оснований — урок. Химия, 8–9 класс.
В \(1754\) году французский химик Г. Руэль (\(1703\)–\(1770\)) ввёл термин «основание», подразумевая, что к соединениям данного класса относится любое вещество, которое способно взаимодействовать с кислотами, образуя соли.
Гийом Франсуа Руэль
\(1703\)–\(1770\)
Позже значение этого термина неоднократно уточнялось. Одно из определений, которым пользуются в настоящее время, звучит так:
Одно из определений, которым пользуются в настоящее время, звучит так:
Основаниями называют сложные вещества, в состав которых входят металлические химические элементы, соединённые с одной или несколькими гидроксогруппами (группами атомов \(-OH\)).
Исходя из этого, общую химическую формулу оснований можно изобразить следующим образом:
M(OH)n,
где \(M\) — знак металлического химического элемента,
а \(n\) — индекс, численно совпадающий с валентностью металла.
Основания относятся к электролитам, то есть к веществам, растворы и расплавы которых проводят электрический ток.
С точки зрения теории электролитической диссоциации, основания — электролиты, которые, диссоциируя, из отрицательно заряженных ионов образуют только гидроксид-ионы.
Номенклатура оснований
Название основания состоит из слова «гидроксид» и названия металлического химического элемента в родительном падеже. Если металлический элемент имеет переменную валентность, то последняя указывается римскими цифрами в скобках без пробела сразу же после названия металла.
Пример:
NaOH — гидроксид натрия,
Fe(OH)2 — гидроксид железа(\(II\)),
Fe(OH)3 — гидроксид железа(\(III\)).
Классификация оснований
Растворимые в воде основания называют щелочами.
По их способности растворяться в воде основания делят на растворимые и практически нерастворимые.
|
Примеры: NaOH — гидроксид натрия, KOH — гидроксид калия, Ca(OH)2 — гидроксид кальция. |
Примеры: Cu(OH)2 — гидроксид меди(\(II\)), Fe(OH)2 — гидроксид железа(\(II\)), Fe(OH)3 — гидроксид железа(\(III\)). |
Источники:
https://upload.wikimedia.org/wikipedia/commons/d/d5/Guillaume-Fran%C3%A7ois_Rouelle.jpg
открытых учебников | Сиявула
Математика
Наука
-
- Читать онлайн
-
Учебники
-
Английский
-
класс 7А
-
Марка 7Б
-
Класс 7 (вместе A и B)
-
-
Африкаанс
-
Граад 7А
-
Граад 7Б
-
Граад 7 (A en B saam)
-
-
-
Пособия для учителя
-
- Читать онлайн
-
Учебники
-
Английский
-
класс 8А
-
Марка 8Б
-
Оценка 8 (вместе A и B)
-
-
Африкаанс
-
Граад 8А
-
Граад 8Б
-
Граад 8 (A en B saam)
-
-
-
Пособия для учителя
-
- Читать онлайн
-
Учебники
-
Английский
-
Марка 9А
-
Марка 9Б
-
Оценка 9 (комбинированные A и B)
-
-
Африкаанс
-
Граад 9А
-
Граад 9Б
-
Graad 9 (A en B saam)
-
-
-
Пособия для учителя
-
- Читать онлайн
-
Учебники
-
Английский
-
класс 4А
-
класс 4Б
-
Класс 4 (вместе A и B)
-
-
Африкаанс
-
Граад 4А
-
Граад 4Б
-
Graad 4 (A en B saam)
-
-
-
Пособия для учителя
-
- Читать онлайн
-
Учебники
-
Английский
-
Марка 5А
-
Марка 5Б
-
Оценка 5 (комбинированные A и B)
-
-
Африкаанс
-
Граад 5А
-
Граад 5Б
-
Граад 5 (A en B saam)
-
-
-
Пособия для учителя
-
- Читать онлайн
-
Учебники
-
Английский
-
класс 6А
-
Марка 6Б
-
Класс 6 (вместе A и B)
-
-
Африкаанс
-
Граад 6А
-
Граад 6Б
-
Граад 6 (A en B saam)
-
-
-
Пособия для учителя
Наша книга лицензионная
Эти книги не просто бесплатные, они также имеют открытую лицензию! Один и тот же контент, но разные версии (брендированные или нет) имеют разные лицензии, как объяснено:
CC-BY-ND (фирменные версии)
Вам разрешается и поощряется свободное копирование этих версий. Вы можете копировать, распечатывать и распространять их столько раз, сколько захотите. Вы можете загрузить их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете каким-либо образом адаптировать или изменять эти версии учебников, их содержание или обложки, поскольку они содержат соответствующие бренды Siyavula, логотипы спонсоров и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Вы можете копировать, распечатывать и распространять их столько раз, сколько захотите. Вы можете загрузить их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете каким-либо образом адаптировать или изменять эти версии учебников, их содержание или обложки, поскольку они содержат соответствующие бренды Siyavula, логотипы спонсоров и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Узнайте больше о спонсорстве и партнерстве с другими организациями, которые сделали возможным выпуск каждого из открытых учебников.
CC-BY (версии без марочного знака)
Эти небрендовые версии одного и того же контента доступны для вас, чтобы вы могли делиться ими, адаптировать, трансформировать, изменять или дополнять их любым способом, с единственным требованием — указать Сиявула надлежащим образом.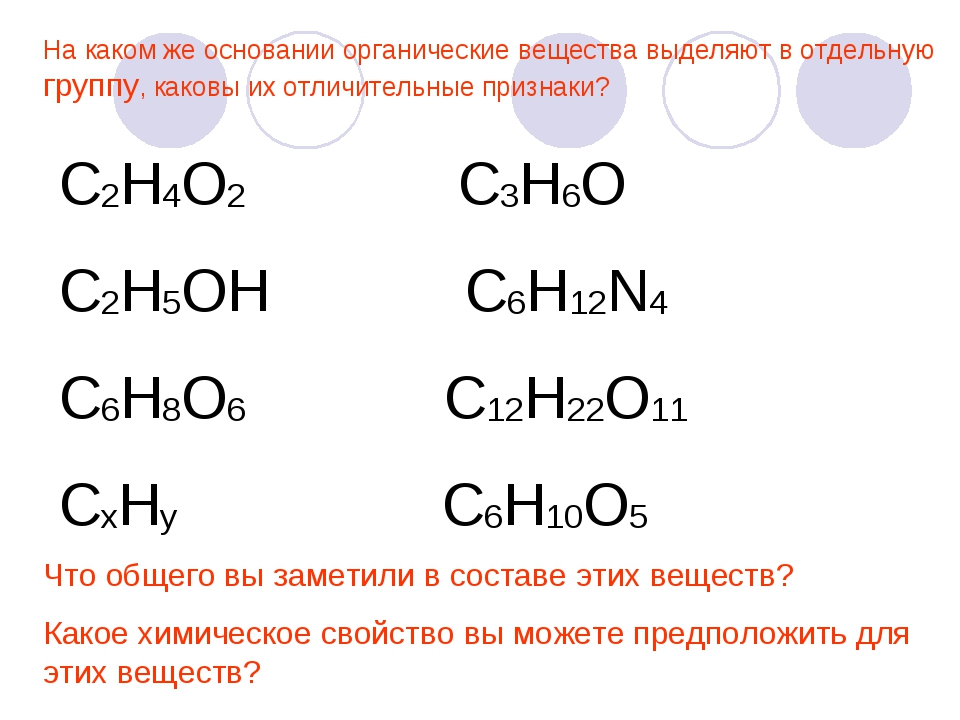 Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
Разница между кислотой и основанием
Что такое кислота?
Согласно Аррениусу, вещество можно назвать кислотным, если оно ионизируется или распадается в водном растворе с образованием ионов водорода (ионов Н+). Этот тип классификации кислот может работать для водных растворов.Ограничение этого типа классификации заключается в том, что когда и кислоты, и основания реагируют друг с другом, они нейтрализуются, поскольку ионы водорода и ионы гидроксида реагируют с образованием воды.
H+ (водн.) + OH- (водн.) H₂O (л)
Согласно теории Бренстеда, вещество считается кислотным, если оно отдает протон (донор ионов водорода). Бренстед не пошел против теории Аррениуса, он лишь дополнил ее. Соединение, которое отдает ионы H+, называется кислотой Бренстеда-Лоури, включая типичные кислоты, амины и спирт.Это определение кислоты по Бренстеду-Лоури является лучшим определением, которое может дать кислота.
Согласно теории Льюиса, вещество считается кислотным, если оно принимает электроны от другого вещества, участвующего в реакции. Внешняя оболочка кислот завершается после принятия электронных пар в их валентную оболочку. Не происходит изменения степени окисления реакции, включая кислоты.
Кислоты обладают следующими свойствами:
-
Кислоты проводят электричество (т.е. они являются электролитами)
-
Они превращают лакмус из синего в красный
-
Большинство кислот являются твердыми
-
Имеет кислый вкус алюминия или железа.
-
Кислоты имеют низкое значение pH, то есть ниже 7.
-
Соли и вода образуются при взаимодействии кислоты с основанием или щелочью.
-
Большинство кислот являются твердыми веществами.
-
Некоторые кислоты можно назвать коррозионными по своей природе.
-
Слабые и более летучие кислоты замещаются сильными и менее летучими кислотами из их солей.
Типы кислот следующие:
Сильные кислоты полностью диссоциируют ионы в воде, в то время как слабые кислоты частично диссоциируют ионы в воде. Кислоты делятся на 2 типа в зависимости от диссоциации ионов в воде, то есть сильные кислоты и слабые кислоты, как указано ниже: —
1.Сильные кислоты — сильная кислота полностью диссоциирует ионы в воде. Существует всего 6 сильных кислот:
2. Слабые кислоты. Слабые кислоты частично диссоциируют ионы в воде. Остальные кислоты, за исключением этих 6 кислот, являются слабыми кислотами. Водород и галоген объединяются в реакции с образованием слабой кислоты, а именно плавиковой кислоты, в то время как соляная кислота является очень сильной и чрезвычайно мощной, а также коррозионной по своей природе, но заявлена как слабая кислота.
Водород и галоген объединяются в реакции с образованием слабой кислоты, а именно плавиковой кислоты, в то время как соляная кислота является очень сильной и чрезвычайно мощной, а также коррозионной по своей природе, но заявлена как слабая кислота.
Что такое база?
Основание представляет собой химическое вещество, которое отдает электроны, принимает протоны или высвобождает ионы гидроксида (ОН-) в водных растворах.Существуют определенные характеристики, отображаемые базой, которые можно использовать для их идентификации. Вы можете идентифицировать основание с помощью этих данных способов, как будто они скользкие на ощупь (например, мыло), горькие на вкус, реагируют с кислотой с образованием соли и катализируют определенные реакции. Он включает основание Аррениуса, основание Бренстеда-Лоури и основание Льюиса как типы оснований. Есть несколько примеров оснований, таких как гидроксиды щелочных металлов, гидроксиды щелочноземельных металлов и мыло.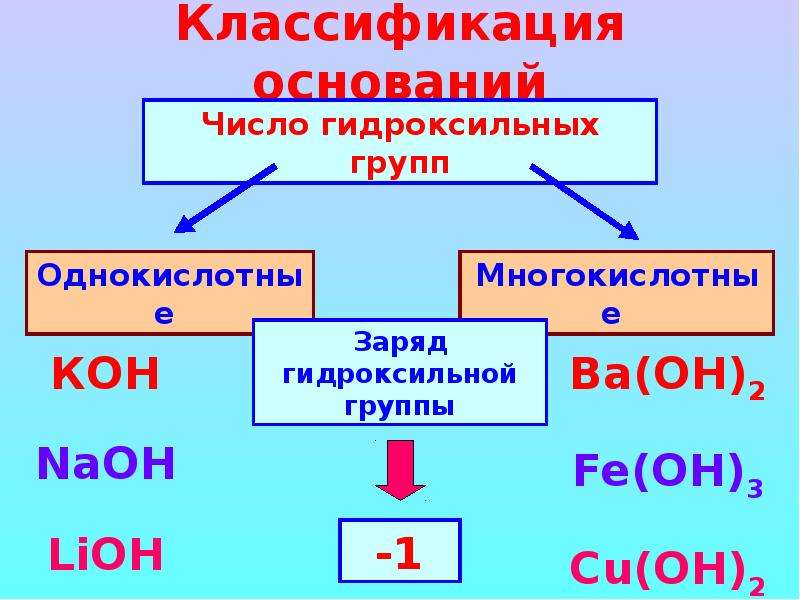
Свойства основания могут быть перечислены следующим образом:
-
Раствор основания имеет баланс pH более 7.
-
Основы имеют горьковатый привкус, поэтому никогда не пробуйте их на вкус.
-
Когда водный раствор основания или раствор расплавленного основания диссоциирует на ионы, они проводят электричество.
-
Сильное основание энергично реагирует с кислотами и органическими веществами, поскольку эти основания являются едкими.
-
Основания правильно реагируют с индикаторами pH. Он окрашивает лакмусовую бумагу в синий цвет, метиловый оранжевый — в желтый, а фенолфталеин — в розовый, тогда как бромтимоловый синий остается синим в присутствии основания.
Типы оснований
-
Сильное основание – оно полностью диссоциирует на свои ионы в воде или в соединении, которое может удалить протон (H+) из слабой кислоты.
 Примерами сильного основания являются гидроксид натрия (NaOH) и гидроксид калия (KOH).
Примерами сильного основания являются гидроксид натрия (NaOH) и гидроксид калия (KOH). -
Слабое основание — эти основания полностью диссоциируют в воде. Водный раствор является одним из примеров, включающих основание и сопряженную с ним кислоту.
-
Нейтральное основание – это основание, которое образует связь с нейтральной кислотой.
-
Супероснование – Этот тип основания образован щелочным металлом с его сопряженной кислотой и даже лучше по сравнению с сильным основанием. Одним из примеров суперосновы является гидрид натрия (NaH).
-
Твердое основание – Может использоваться в анионообменных смолах или для реакций с газообразными кислотами. Он активен в твердой форме. Диоксид кремния (SiO₂) и NaOH на оксиде алюминия являются примерами твердой основы.
Различия между кислотой и основанием
|
|
Кислота |
База |
||
|
1Определение по Аррениусу |
Кислота – это вид химического соединения, которое при растворении в воде дает раствор с большей активностью ионов Н+, чем в очищенной воде. |
Основание представляет собой водное вещество, которое отдает электроны, принимает протоны или выделяет ионы гидроксида (ОН-). |
||
|
2. Bronstead Lowry Определение |
Кислота является донором протонов. |
В то время как основание является акцептором протона. |
||
|
3.Примеры |
Уксусная кислота (CH3COOH) и серная кислота являются двумя примерами кислоты. |
Гидроксид натрия (NaOH) и аммиак являются двумя примерами оснований. |
||
|
4. Значение pH |
Значение pH кислоты меньше 7,0. |
С другой стороны, значение pH основания выше 7,0. |
||
|
5. Фенолфталеин |
Кислота остается бесцветной при растворении. |
Основания окрашивают раствор в розовый цвет при растворении. |
||
|
6. Химическая формула |
Кислота начинается с химической формулы H, например, HCL (соляная кислота), но есть исключение CH₂COOH. |
В то же время основание имеет на конце химическую формулу ОН. Например, NaOH (гидроксид натрия). |
||
|
7. Лакмусовая бумага |
Кислота превращает синюю лакмусовую бумагу в красную. |
База превращает красную лакмусовую бумажку в синюю. |
||
|
8. Прочность |
Кислотность в основном зависит от концентрации ионов гидроксония. |
Аналогично происходит в базе. |
||
|
9. Характеристики |
Кислота может находиться в твердом, жидком или газообразном состоянии в зависимости от температуры. |
Основания имеют горький вкус, немного скользкий и твердый вид, за исключением аммиака, который присутствует в газообразном состоянии |
||
|
10. |
Когда кислоты растворяются в воде, выделяются ионы водорода (H+). |
Основание высвобождает ионы гидроксида (OH-) при растворении в воде. |
||
|
11. Примеры |
Примеры кислот — уксусная кислота, серная кислота и др. |
Примеры баз представляют собой гидроксид натрия, аммиак и т. Д. |
кислоты, основания и шкала рН
Кислотный или основной?
Что такое кислота или основание?
Является ли жидкость кислотой или основанием, зависит от ионов водорода (обозначается химическим символом H + ).В воде (H 2 O) небольшое количество молекул диссоциирует (расщепляется). Некоторые молекулы воды теряют водород и превращаются в ионы гидроксида (ОН — ). «Потерянные» ионы водорода соединяются с молекулами воды, образуя ионы гидроксония (H 3 O + ). Для простоты ионы гидроксония обозначаются как ионы водорода H + . В чистой воде содержится равное количество ионов водорода и гидроксид-ионов. Раствор не является ни кислотным, ни щелочным.
Некоторые молекулы воды теряют водород и превращаются в ионы гидроксида (ОН — ). «Потерянные» ионы водорода соединяются с молекулами воды, образуя ионы гидроксония (H 3 O + ). Для простоты ионы гидроксония обозначаются как ионы водорода H + . В чистой воде содержится равное количество ионов водорода и гидроксид-ионов. Раствор не является ни кислотным, ни щелочным.
Кислота — это вещество, отдающее ионы водорода.Из-за этого при растворении кислоты в воде баланс между ионами водорода и гидроксид-ионами смещается. Теперь в растворе больше ионов водорода, чем ионов гидроксида. Такой раствор кислый.
Основание — это вещество, которое принимает ионы водорода. При растворении основания в воде баланс между ионами водорода и гидроксид-ионами смещается в противоположную сторону. Поскольку основание «впитывает» ионы водорода, в результате получается раствор с большим количеством ионов гидроксида, чем ионов водорода. Такой раствор является щелочным.
Такой раствор является щелочным.
Что такое рН?
Кислотность и щелочность измеряются по логарифмической шкале, которая называется pH . Вот почему: в сильнокислом растворе может быть в сто миллионов миллионов или в сто триллионов (100 000 000 000 000) раз больше ионов водорода, чем в сильно щелочном растворе! Обратной стороной, конечно же, является то, что сильно щелочной раствор может содержать в 100 000 000 000 000 раз больше гидроксид-ионов, чем сильнокислый раствор. Более того, концентрации ионов водорода и гидроксид-ионов в повседневных растворах могут варьироваться во всем этом диапазоне.
Чтобы легче справляться с этими большими числами, ученые используют логарифмическую шкалу , шкалу рН. Каждая единица изменения шкалы pH соответствует десятикратному изменению концентрации ионов водорода. Теоретически шкала pH является открытой, но большинство значений pH находятся в диапазоне от 0 до 14. Гораздо проще использовать логарифмическую шкалу вместо того, чтобы постоянно записывать все эти нули! Кстати, обратите внимание, что сто миллионов миллионов — это единица с четырнадцатью нулями после нее? Это не совпадения, это логарифмы!
Чтобы быть более точным, pH представляет собой отрицательный логарифм концентрации ионов водорода:
pH = -log [H + ]
Квадратные скобки вокруг H + автоматически означают для химика «концентрация». Это уравнение означает именно то, о чем мы говорили ранее: при изменении рН на 1 единицу концентрация ионов водорода изменяется в десять раз. Чистая вода имеет нейтральный рН 7. Значения рН ниже 7 являются кислыми, а значения рН выше 7 являются щелочными (основными). В таблице 1 приведены примеры веществ с различными значениями pH (Decelles, 2002; Environment Canada, 2002; EPA, дата неизвестна).
Это уравнение означает именно то, о чем мы говорили ранее: при изменении рН на 1 единицу концентрация ионов водорода изменяется в десять раз. Чистая вода имеет нейтральный рН 7. Значения рН ниже 7 являются кислыми, а значения рН выше 7 являются щелочными (основными). В таблице 1 приведены примеры веществ с различными значениями pH (Decelles, 2002; Environment Canada, 2002; EPA, дата неизвестна).
Общие примеры кислот и оснований
Измерение pH
Как вы измеряете pH?
pH жидкости или раствора часто является важной частью научной информации.Измерение pH может быть выполнено просто и быстро с использованием индикаторной бумаги pH , индикаторной палочки pH или pH-метра . Бумага для тестирования pH и индикаторные палочки представляют собой кусочки бумаги или более жесткие палочки, содержащие индикаторов pH (химические вещества, которые меняют цвет в зависимости от того, насколько кислым или щелочным является раствор). Для измерения рН в жидкость погружают кусочек индикаторной бумаги или индикаторную палочку. Затем цвет смоченной бумаги/палочки сопоставляется с цветовым кодом, который поставляется с контейнером с индикаторной бумагой или индикаторными палочками.Каждый цвет на клавише соответствует своему уровню pH. Пример использованной палочки-индикатора pH и соответствующей цветовой маркировки показан ниже на рисунке 1. pH-метры — это электронные устройства, используемые для измерения pH. Они состоят из зонда, погруженного в раствор, и цифрового считывающего устройства. pH-метры даже более точны, чем pH-метры или индикаторные палочки. В приведенной ниже Таблице 2 обсуждается, какие типы устройств для измерения pH лучше всего подходят для различных научных проектов, а также предлагается быстрая ссылка для приобретения различных индикаторных полосок и индикаторной бумаги для измерения pH.
Для измерения рН в жидкость погружают кусочек индикаторной бумаги или индикаторную палочку. Затем цвет смоченной бумаги/палочки сопоставляется с цветовым кодом, который поставляется с контейнером с индикаторной бумагой или индикаторными палочками.Каждый цвет на клавише соответствует своему уровню pH. Пример использованной палочки-индикатора pH и соответствующей цветовой маркировки показан ниже на рисунке 1. pH-метры — это электронные устройства, используемые для измерения pH. Они состоят из зонда, погруженного в раствор, и цифрового считывающего устройства. pH-метры даже более точны, чем pH-метры или индикаторные палочки. В приведенной ниже Таблице 2 обсуждается, какие типы устройств для измерения pH лучше всего подходят для различных научных проектов, а также предлагается быстрая ссылка для приобретения различных индикаторных полосок и индикаторной бумаги для измерения pH.
Для получения точных показаний pH всегда помните:
- Подождите минуту или две после добавления в раствор кислоты или основания.
 Это позволит завершить реакцию (отдаваемые ионы [кислота] или принимаемые [основание]) до того, как вы измерите.
Это позволит завершить реакцию (отдаваемые ионы [кислота] или принимаемые [основание]) до того, как вы измерите. - Хорошо взболтайте или перемешайте раствор перед измерением. Это поможет обеспечить однородность раствора.
При использовании индикаторной бумаги/индикаторных стержней рН необходимо также:
- Используйте только бумагу/палочки, которые не были предварительно смочены.
- Подождите, пока цвет перестанет меняться (максимум 1–2 минуты), прежде чем сопоставлять бумагу/карандаш с цветовым ключом. Не ждите более 5 минут после стабилизации цвета, иначе он может начать тускнеть, что повлияет на точность показаний.
При использовании pH-метра необходимо также:
- Внимательно прочтите руководство к рН-метру перед его использованием.
- Промывайте датчик рН-метра дистиллированной водой перед каждым измерением.
- Используйте растворы с известными значениями pH, см. Таблицу 2, чтобы обеспечить точную калибровку pH-метра.

- Перед снятием показаний убедитесь, что датчик рН-метра полностью погружен в раствор.
Библиография
Библиография
Для получения дополнительной информации о кислотах, основаниях и шкале рН попробуйте этот справочник:
Ознакомьтесь с нашими научными видеороликами
Научные друзья: запуск спорового мешка пилоболуса
Действия при штормовом нагоне — защита домов от волн
Научные и технологические решения для класса 9 Science Chapter 5
Страница № 73:
Вопрос 1:
Определите лишнее и обоснуйте.
(a) Хлориды, нитраты, гидриды, аммоний
(b) Хлористый водород, гидроксид натрия, оксид кальция, аммиак
(c) Уксусная кислота, угольная кислота, соляная кислота, азотная кислота
(d) Хлорид аммония, хлорид натрия, нитрат калия, сульфат натрия
(e) Нитрат натрия, карбонат натрия, сульфат натрия, хлорид натрия
(f) Оксид кальция, оксид магния, оксид цинка, оксид натрия.
(г) Медный купорос кристаллический, соль поваренная кристаллическая, железный купорос кристаллический, натрия карбонат кристаллический.
(з) Хлорид натрия, гидроксид калия, уксусная кислота, ацетат натрия.
Ответ:
АНС
А. 4 4 0 + 6 +
Nitroate = No 3 —
гидрид = H — Хлорид = CL —
аммоний нечетной, потому что аммоний катион и отдых — это анионы .
b. Хлористый водород является нечетным, потому что хлористый водород является кислотой, а остальные являются щелочными.
C.Каксусная кислота = CH 3 COOH углекислота = H 2 CO 2 CO 3 соляная кислота = HCl
азотная кислота = — HLO 3
HCl является единственным диатомическим хетро-ядерным соединением и оставшимся являются полиатомными соединениями.
d. Хлорид аммония нечетный, потому что это кислая соль, а все остальные соли являются нейтральными.
e. Карбонат натрия является нечетным, поскольку растворы нитрата натрия, сульфата натрия и хлорида натрия нейтральны.А вот раствор карбоната натрия BASIC .
f. Оксид кальция = CaO
Оксид магния = MgO
Оксид цинка = ZnO
оксид натрия = Na 2 O
ZnO является нечетным, поскольку он амфотерен по своей природе, а другие ионы являются основными по своей природе
900 странно, потому что при нагревании цвет соединения не меняется. Но в остальных соединениях есть изменение цвета.
Но в остальных соединениях есть изменение цвета.
час. Гидроксид калия странный, потому что в реакции, когда хлорид натрия реагирует с уксусной кислотой, образуется ацетат натрия.В приведенной ниже реакции гидроксид калия не участвует.
NaCl +Ch4COOH→Ch4COONa +HCl
Страница № 73:
Вопрос 2:
Запишите изменения, которые будут видны в каждом экземпляре, и объясните их причину.
(a) 50 мл воды добавляют к 50 мл раствора медного купороса.
(b) Две капли индикатора фенфталеина были добавлены к 10 мл раствора гидроксида натрия.
(c) К 10 мл разбавленной азотной кислоты добавляли две или три медные опилки и перемешивали.
(d) Лакмусовую бумажку опустили в 2 мл разбавленной HCl. Затем к нему добавляли 2 мл концентрированного NaOH и перемешивали.
(e) Оксид магния добавляли к разбавленной HCl, а оксид магния добавляли к разбавленному NaOH.
(f) Оксид цинка добавляли к разбавленной HCl, а оксид цинка добавляли к разбавленному NaOH.
(g) К известняку добавляли разбавленную HCl.
(з) Кусочки медного купороса нагревали в пробирке.При охлаждении к нему добавляли воду.
(i) Разбавленную H 2 SO 4 помещали в электролитическую ячейку и пропускали через нее электрический ток.
Ответ:
и
а. При добавлении 50 мл воды к 50 мл раствора сульфата меди происходит обратимая реакция и цвет меняется с бледно-голубого на белый, а затем снова на синий при повторном добавлении воды.
CuSO4 +h3O ↔ CuSO4,5h3O ( СИНИЙ ВИТРИОЛ).
б. Фенолфталеин — индикатор, используемый для определения количества основания. При добавлении 2 капель индикатора фенолфталеина к 10 мл раствора едкого натра раствор окрашивается в розовый цвет, так как кислая часть фенофталеина реагирует с основанием, образуя натриевую соль фенолфталеина розового цвета.
Например: При кислотно-щелочном титровании фенолфталеин используется для определения конечной точки основания.
в. Медь является нереакционноспособным металлом и в нормальных условиях не реагирует с разбавленными кислотами.
На самом деле имеют место два уравнения реакции меди с азотной кислотой. Это зависит от того, концентрирована азотная кислота или нет. Если он концентрированный, то соотношение меди и азотной кислоты составляет 1:4. Если он разбавлен, то соотношение составляет 3:8.
Cu + 4HNO3 (разб.) → Cu(NO3)2 + 2NO2 + 2h3O 3Cu + 8HNO3 (конц.) → 3Cu(NO3)2 + 2NO + 4h3O
Концентрированная азотная кислота действует как сильный окислитель, поэтому имеет смысл образование более высокой степени окисления оксида азота (IV).
д. При погружении лакмусовой бумаги в 2 мл разбавленного раствора HCl синяя лакмусовая бумага окрашивается в красный цвет, а на красную лакмусовая бумага не действует. Опять же, если ту же лакмусовую бумажку опустить в 2 мл концентрированного раствора NaOH, то красная лакмусовая бумажка окрасится в синюю, но на синюю лакмусовую бумагу не повлияет. Это связано с соответствующими свойствами синей и красной лакмусовой бумажки с кислотой. и база.
Это связано с соответствующими свойствами синей и красной лакмусовой бумажки с кислотой. и база.
эл. Оксид магния является основанием. когда основание реагирует с кислотой, оно образует соль и воду.Эта реакция известна как реакция нейтрализации.
MgO(т) + 2HCl(ж) = MgCl2 (водн.) + h3O(ж)
MgO не реагирует с NaOH. Поскольку NaOH является основанием, а основания реагируют только с оксидами неметаллов с образованием соли и воды, потому что оксиды неметаллов считаются кислыми по своей природе, поэтому имеет место реакция нейтрализации. Но MgO — это оксид металла, поэтому реакция невозможна.
ф. Оксид цинка добавляют к разбавленной HCl, затем происходит реакция нейтрализации с образованием соли и воды.
Реакция выглядит следующим образом:
ZnO(водн.)+2HCl(водн.)→ZnCl2(водн.)+h3O(л)
Оксид цинка реагирует с гидроксидом натрия с образованием цинката натрия и воды. Эта реакция протекает при температуре 500-600°С. Это экзотермическая реакция.
ZnO + 2NaOH→Na2ZnO2 + h3O
г. Известняк – это карбонат кальция. При добавлении известняка к 10%-му раствору разбавленной HCl происходит бурное вскипание CO 2 за счет реакции кислоты с карбонатом металлов.
2HCl + CaCO3 → CaCl2 + CO2 +h30
ч. При нагревании кусочков медного купороса в пробирке происходит разрушение кристаллической структуры медного купороса с образованием бесцветного порошка и выделением воды. Эта вода называется кристаллизационной. при добавлении воды в ту же пробирку белый порошок снова приобретал синий цвет. Это связано с обратимой реакцией из безводной соли в водную и наоборот.
CUSO4.5h3O↔CUSO4 +5h3O
я.При электролизе разбавленного раствора серной кислоты газы образуются как на аноде, так и на катоде.
т
Газ, образующийся на катоде , горит с хлопком, когда образец поджигается зажженной лучинкой. Это показывает, что газ водород .
Газ, образующийся на аноде , повторно зажигает светящуюся лучину, погруженную в образец газа. Это показывает, что газ кислород .
Это показывает, что газ кислород .
Газы образуются, когда ионы движутся к электродам.
На катоде:
На аноде:
Страница № 73:
Вопрос 3:
Классифицируйте следующие оксиды по трем типам и назовите типы.
CaO, MgO, CO 2 , SO 3 , Na 2 O, ZnO, Al 2 O 3 , Fe 2 3 O
Ответ:
Оксиды бывают трех типов:
1) Кислотные оксиды: CO 2 (двуокись углерода), SO 3 (триоксид серы)
2) Основные оксиды: CaO (оксид кальция), MgO (оксид магния), Na 2 O (оксид натрия)
3) Амфотерные оксиды: ZnO (оксид цинка), Al 2 O 3 (оксид алюминия), Fe 2 O 3 (оксид железа)
Страница № 73:
Вопрос 4:
Объясните, нарисовав рисунок электронной конфигурации.
а. Образование хлорида натрия из натрия и хлора.
б. Образование хлорида магния из магния и хлора.
Ответ:
а. Атомный номер атома натрия (Na) равен 11.
Электронная конфигурация:
Na = 2, 8, 1
Таким образом, он содержит 1 валентный электрон. Чтобы достичь ближайшей конфигурации благородного газа, он теряет один электрон, образуя ион натрия.
Na + = 2,8
Атомный номер атома хлора (Cl) равен 17.
Электронная конфигурация:
Cl = 2, 8, 7
Таким образом, он содержит 7 валентных электронов. Чтобы достичь ближайшей конфигурации благородного газа, он получает один электрон, образуя ион хлорида.
Cl — = 2,8
Ионная связь образуется между ионом натрия и ионом хлора за счет полного переноса электрона от натрия к хлору.
б. Атомный номер атома магния (12) равен 12.
Электронная конфигурация:
Mg = 2, 8, 2
Таким образом, он содержит 2 валентных электрона. Чтобы достичь ближайшей конфигурации благородного газа, он теряет два электрона, образуя ион магния.
Чтобы достичь ближайшей конфигурации благородного газа, он теряет два электрона, образуя ион магния.
Mg 2+ = 2,8
Атомный номер атома хлора (Cl) равен 17.
Электронная конфигурация:
Cl = 2, 8, 7
Таким образом, он содержит 7 валентных электронов. Чтобы достичь ближайшей конфигурации благородного газа, он получает один электрон, образуя ион хлорида.
Cl — = 2,8
Ионная связь образуется между ионом магния и двумя ионами хлорида путем полного переноса одного электрона на каждый ион хлора.
Страница № 74:
Вопрос 5:
Покажите диссоциацию следующих соединений при растворении в воде с помощью химического уравнения и напишите, мала или велика доля диссоциации.
Соляная кислота, хлорид натрия, гидроксид калия, аммиак, уксусная кислота, хлорид магния, сульфат меди
Ответ:
а.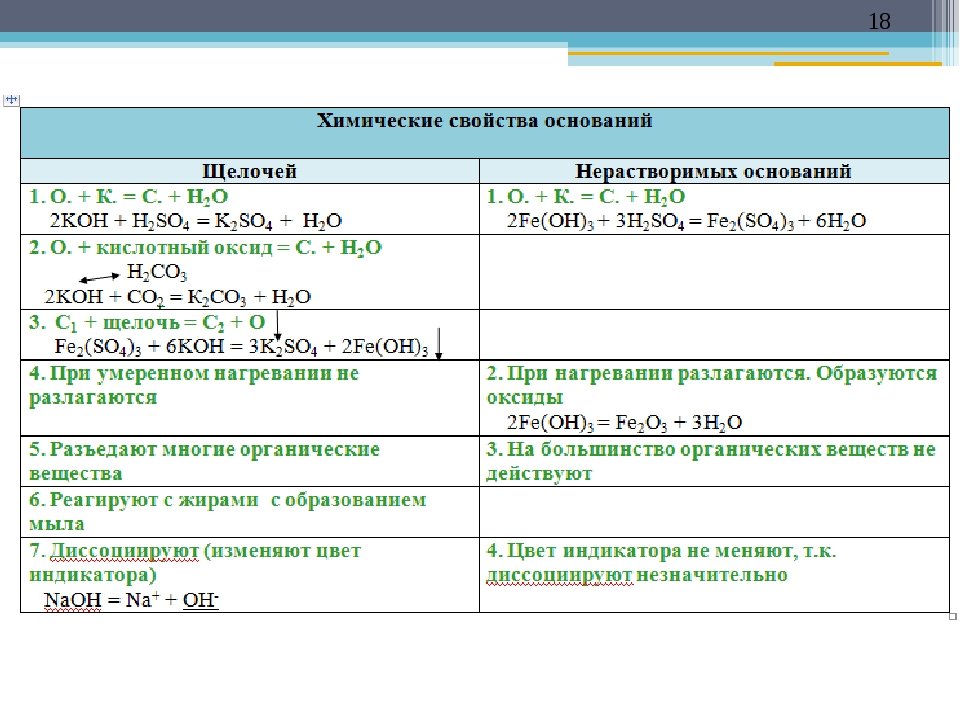 HCl(водн.) + h3O(л)→h4O + (водн.)+Cl — (водн.)
HCl(водн.) + h3O(л)→h4O + (водн.)+Cl — (водн.)
Объяснение:
Соляная кислота (HCl) является сильной кислотой, поэтому HCl полностью ионизируется в водном растворе. Другими словами, каждая молекула соляной кислоты, добавленная к воде, отдает свой протон H + молекуле воды с образованием катиона гидроксония, и образуются H 3 O + и ионы хлорида Cl — .
б. Реакция:
NaCl(s) + H 2 O(водн.) -> Na + (водный) + Cl — (водный) + H 2 O(ж)
Объяснение:
Когда натрий хлорид реагирует с водой: Na + часть NaCl притягивается к кислородной стороне молекулы воды, а часть Cl — притягивается к водородной стороне молекулы воды.
Это приводит к тому, что хлорид натрия (соль) расщепляется в воде, а NaCl полностью ионизируется на ионы Na + и Cl — .
c)KOH(s) + H 2 O(l)<--> K + (водн. ) + OH — (водн.) + H 2 O(l)
) + OH — (водн.) + H 2 O(l)
Объяснение:
КОН является основанием, поэтому при смешивании его с водой получается основной раствор, находящийся в равновесии. КОН просто растворяется в воде.
d)NH 3 (основание) + H 2 O(кислота)<--> NH 4 + (сопряженная кислота) + OH — (сопряженная основа)
Объяснение:
при растворении аммиака в воде.В водном растворе аммиак действует как основание, приобретая ионы водорода из H 2 O с образованием катиона аммония и ионов гидроксида.
e)CH 3 COOH(l) + H 2 O(l) -> CH 3 COO — + H 3 O +
Пояснение:
Когда
, из-за разности электроотрицательностей кислорода и водорода в ОН-группе уксусной кислоты и имеет место дипольное взаимодействие с молекулой воды. Следовательно, уксусная кислота ионизируется в ацетат-ион, а ион H + соединяется с водой с образованием иона гидроксония. —
—
f)MgCl 2 (т) + H 2 O(ж) -> Mg 2+ (водный) + Cl — (водный) + H 2 O(ж)
Объяснение:
При добавлении воды Mg 2+ часть MgCl 2 притягивается к кислородной стороне молекулы воды, тогда как Cl- сторона притягивается к водородной стороне молекулы воды. Это приводит к тому, что хлорид магния (соль) расщепляется в воде, и MgCl 2 полностью ионизируется на ионы Mg 2+ и Cl — .
g)CuSO 4 (т) + H 2 O (ж) —> Cu +2 (водн.) + SO 4 -2 (водн.) + H 2 O(л)
Объяснение:
когда соединение растворяется в воде, оно диссоциирует с образованием ионов. Реакция между безводным сульфатом меди (II) (белым) и водой становится синей в присутствии воды.
Страница № 74:
Вопрос 6:
Запишите концентрацию каждого из следующих растворов в г/л и моль/л.
а. 7,3 г HCl в 100 мл раствора
б. 2 г NaOH в 50 мл раствора
в. 3 г CH 3 COOH в 100 мл раствора
д. 4,9 г H 2 SO 4 в 200 мл раствора
Ответ:
a) 7,3 г HCl в 100 мл раствор:
Концентрация HCl в G L-1 = Масса раствора в Gramvolume HCl в литр
= 7.3 × 1000100=73 г л -1
В граммах на литр:
7,3 г HCl в 100 мл имеет концентрацию = 73 г л -1
Молекулярная масса HCl5 = 1+3 36.59
MOLARITY = масса раствора в мольюволю HCl в L
= 7,3 × 100036,5 × 100 = 2 MOL L -1
с точки зрения молей на литр:
7,3 г HCl в 100 мл Имеет концентрацию = 2 MOL L
0 -1
B) 2G NaOH в 50 мл раствор
Концентрация NaOH в G L-1 = Масса NaOH в Gvolume NaOH в L
= 2 × 100050 = 40 г L -1
В пересчете на грамм на литр:
2 г NaOH в 50 мл имеет концентрацию = 40 г. = Масса растворенного вещества в моляхОбъем NaOH в л
= Масса растворенного вещества в моляхОбъем NaOH в л
=2 × 100040 ×50=1 моль л -1
В молях на литр:
2 г NaOH в 50 мл имеет концентрацию = 1 моль л -1
c)3 г CH 3 6 COOH в 50 мл раствор
концентрация CH4COOH в G L-1 = масса ofch4cooh в Gvolume из CH4COOH в L
= 3 × 1000100 = 30 г L -1
с точки зрения грамма на литр:
3 г CH 3 COOH в 100 мл имеет концентрацию = 30 г L -1
Молекулярная масса CH 3 COOH = 2 × 12 + 2 × 16 + 4 × 1 = 60 906 Масса растворенного вещества в моляхОбъем раствора в л
=3 × 100060 ×100=0.5 моль л -1
В молях на литр:
3 г CH 3 COOH в 100 мл имеет концентрацию = 0,5 моль л -1
d) Таким образом, 4 в 200 мл раствор
концентрация H3SO4 в G L-1 = масса H3SO4 в Gvolume H3SO4 в L
= 4,9 × 1000200 = 24,5 г L -1
в терминах грамма на литр :
4. 9 г H 2 SO 4 в 200 мл имеет концентрацию = 24,5 г L -1
9 г H 2 SO 4 в 200 мл имеет концентрацию = 24,5 г L -1
Молекулярная масса H 2 SO 4 = 2 = 60
1
МОЛОДА = Масса раствора в мольюволю раствора в L
= 4,9 × 100098 × 200 = 1 моль L -1
в терминах моль на литр:
4,9 г H 2 SO 4 в 200 мл имеет концентрацию = 1 моль л -1
Страница № 74:
Вопрос 7:
Получите образец дождевой воды.Добавьте к нему несколько капель универсального индикатора. Измерьте его рН. Опишите природу пробы дождевой воды и объясните ее влияние на живой мир.
Ответ:
Ответ 7. Это вопрос, основанный на деятельности, в котором вы должны собрать дождевую воду из разных мест и сравнить полученные результаты на основе следующих параметров:
а) рН воды
б) Действие воды на синюю лакмусовую бумажку
в) Действие воды на красную лакмусовую бумажку
г) Влияние индикатора типа фенолфталеина и метилового оранжевого
Вывод:
Если мы возьмем пробы дождевой воды из разных мест, то увидим следующие результаты:
- pH воды находится в пределах 1-6
- Синяя лакмусовая бумажка становится красной
- Не изменяет цвет красной лакмусовой бумажки
- Отсутствие изменения цвета дождевой воды при добавлении фенолфталеина
- дождевая вода окрашивается в красный цвет при добавлении метилового оранжевого
Приведенные выше наблюдения показывают, что дождевая вода имеет кислую природу.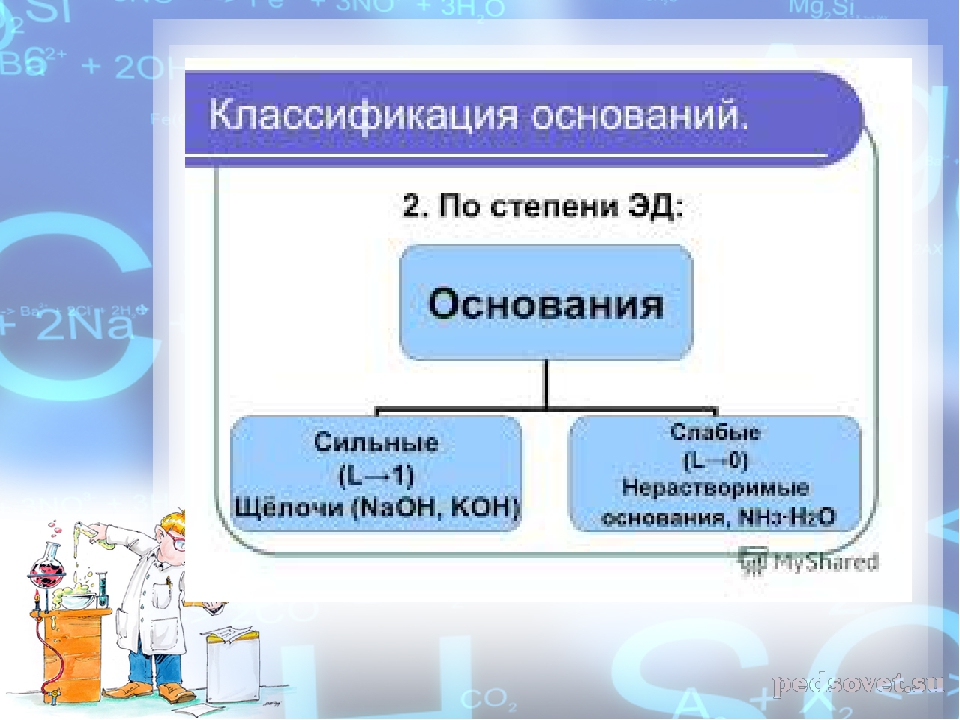 Для большей уверенности мы можем сравнить синюю лакмусовую бумажку, смоченную в разных образцах дождевой воды, со шкалой рН.
Для большей уверенности мы можем сравнить синюю лакмусовую бумажку, смоченную в разных образцах дождевой воды, со шкалой рН.
Если дождевая вода кислая, то ее рН должен быть в пределах 0-6.
Сила кислоты зависит от ее значения pH, т.е. чем ниже значение pH, тем выше сила кислоты и наоборот.
Страница № 74:
Вопрос 8:
Ответьте на следующие вопросы.
а.Классифицируйте кислоты по их щелочности и приведите по одному примеру каждого типа.
б. Что понимается под нейтрализацией? Приведите два примера из повседневной жизни реакции нейтрализации.
в. Объясните, что понимается под электролизом воды. Напишите электродные реакции и объясните их.
Ответ:
Ответ 8.
а. Количество ионизируемых ионов водорода (Н+), присутствующих в одной молекуле кислоты, называется ее основностью .
Например:
HCl ———> H + + Cl —
Основность HCl равна 1.
H 2 SO 4 > 2H + + SO 4 2-
Основность H 2 SO 4 равна 2. 2. Двухосновные кислоты
3. Трехосновные кислоты
1. Одноосновные кислоты:
Кислоты, которые при ионизации образуют один ион гидроксония при реакции с водой.
Кислоты, которые при ионизации образуют один ион водорода.
Например: HCl, HNO 3 и т. д.
2. Двухосновные кислоты:
Кислоты, которые при ионизации образуют два иона гидроксония при реакции с водой
Кислоты, которые при ионизации образуют два иона водорода
Например: H 2 SO 4, H 2 CO 3 и т. д.
3. Трехосновные кислоты:
Кислоты, которые при ионизации образуют три гидроксония. , которые при ионизации образуют три иона водорода
, которые при ионизации образуют три иона водорода
Например: H 3 PO 4 , H 3 PO 3 и т. д.
б. Реакция нейтрализации:
Реакция нейтрализации – это реакция, в которой кислота и основание реагируют с образованием воды и соли. Он включает комбинацию ионов H + и ионов OH — для образования воды.
Нейтрализация сильной кислоты и сильного основания имеет рН, равный 7.
Нейтрализация сильной кислоты и слабого основания будет иметь рН менее 7.
Нейтрализация сильного основания нейтрализует слабую кислоту больше чем 7.
Когда раствор нейтрализуют, это означает, что соли образуются из равных по весу кислоты и основания.
Реакция нейтрализации имеет применение в повседневной жизни:
1) Самозащита животных и растений с помощью химического оружия:
Пчелиные укусы кислые в природе, домашнее средство от укуса пчелы пищевая сода или бикарбонат натрия, который является основным веществом.
Укусы осы слабощелочные, домашним средством от этого будет уксус, он же уксусная кислота.
Эти простые методы лечения облегчают эти болезненные укусы с помощью процесса, называемого нейтрализацией.
2)pH в нашей пищеварительной системе:
Повышенную кислотность желудка из-за употребления слишком большого количества острой пищи можно уменьшить, приняв антацид. Антацид является щелочным / основным по своей природе и помогает нейтрализовать кислотность желудка, или вы можете принять гидроксид магния (молоко магнезии) и гидрокарбонат натрия (пищевая сода).
3) Изменение рН как причина кариеса:
Когда мы едим пищу, содержащую сахар, бактерии, присутствующие во рту, расщепляют сахар с образованием кислот (таких как молочная кислота).Таким образом, после пищеварения во рту образуется кислота. Это приведет к возникновению кариеса. Лучший способ предотвратить кариес – чистить полость рта после еды зубной пастой, которая по своей природе является основной. Это приведет к нейтрализации кислоты основанием.
4) рН почвы и рост растений:
Большинство растений лучше всего растут, когда рН почвы близок к 7, что соответствует нейтральному уровню. Если почва слишком кислая или слишком щелочная (щелочная), растения плохо растут.
Кислая почва нейтрализуется путем обработки такими материалами, как негашеная известь (оксид кальция), гашеная известь (гидроксид кальция) или мел (карбонат кальция).
Если почва слишком щелочная, то щелочность можно уменьшить, добавив разлагающееся органическое вещество (навоз или композит), которое содержит кислые вещества.
в. Электролиз воды :
Электролиз воды – это разложение на кислород и газообразный водород под действием электрического тока, проходящего через воду.
Следующее уравнение представляет собой электролиз воды :h3O(l)
В чистой воде на отрицательно заряженном катоде происходит реакция восстановления, при этом электроны (e − ) с катода отдаются катионам водорода с образованием газообразного водорода.
- Восстановление на катоде: 2 H + + 2e − → H 2
На положительно заряженном аноде происходит реакция окисления с образованием газообразного кислорода путем передачи электронов аноду:
- Окисление на аноде: 2 H 2 O → O 2 ( г ) + 4 H + ( водный раствор ) + 4e −
Те же полуреакции можно уравновесить основанием, как указано ниже. Чтобы добавить полуреакции, они должны быть уравновешены кислотой или основанием.
| Катод (восстановление): | 2 H 2 O( l ) + 2e − | → | H 2 ( г ) + 2 OH − ( водный раствор ) |
| Анод (окисление): | 4 ОН — ( водный ) | → | O 2 ( г ) + 2 H 2 O( l ) + 4 e − |
Объединение любой пары полуреакций приводит к одинаковому общему разложению воды на кислород и водород:
- Общая реакция: 2 H 2 O( l ) → 2 H 2 ( г ) + O 2 ( г )
Таким образом, количество произведенных молекул водорода в два раза превышает количество молекул кислорода.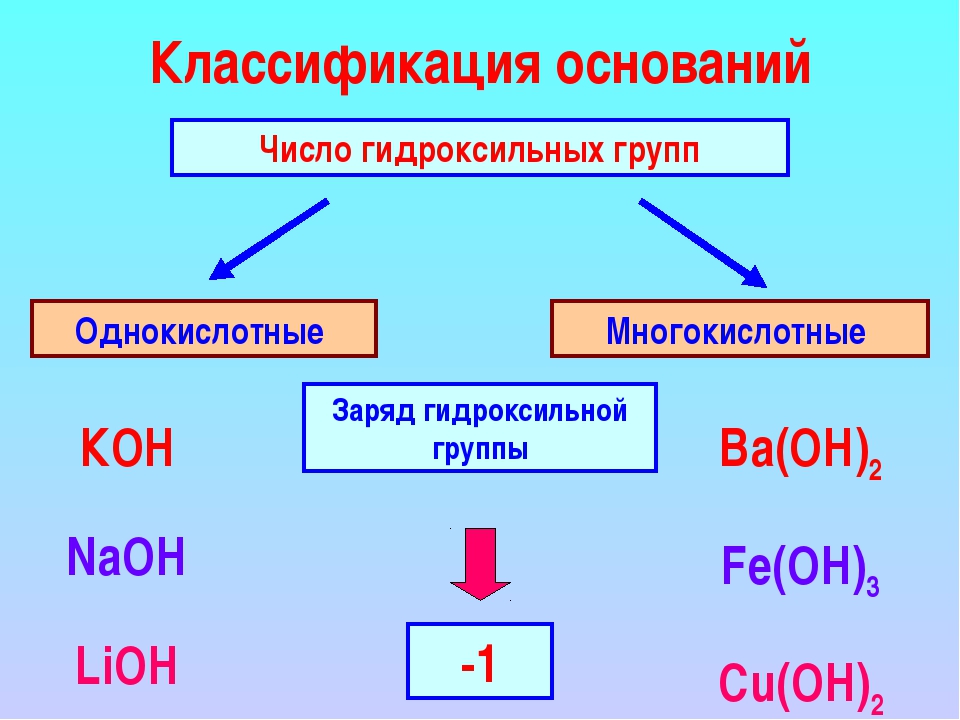 Таким образом, произведенный газообразный водород имеет вдвое больший объем, чем произведенный газообразный кислород. Количество электронов, проталкиваемых через воду, в два раза превышает количество генерируемых молекул водорода и в четыре раза превышает количество генерируемых молекул кислорода.
Таким образом, произведенный газообразный водород имеет вдвое больший объем, чем произведенный газообразный кислород. Количество электронов, проталкиваемых через воду, в два раза превышает количество генерируемых молекул водорода и в четыре раза превышает количество генерируемых молекул кислорода.
2h3O(ж)⟶2h3(г)+O2(г)
Страница № 74:
Вопрос 9:
Обоснуйте следующее.
а. Ионы гидроксония всегда находятся в форме H 3 O +
б. Пахта портится, если хранится в медной или латунной посуде.
Ответ:
а) Когда кислоты растворяются в воде. Ион H + из кислоты всегда идет к ближайшей молекуле воды, образуя ион гидроксония.
HCl(водн.)+H 2 O(водн. )→h4O + (водн.)+Cl-(водн.)
)→h4O + (водн.)+Cl-(водн.)
Например: Когда соляная кислота (HCl) является сильной кислотой.При растворении в воде HCl полностью ионизируется в водном растворе. Соляная кислота отдает свой протон H + молекуле воды с образованием катиона гидроксония H 3 O + и хлорид-анионов Cl —.
b) Пахта портится, если хранится в медной или латунной емкости, потому что пахта на самом деле является молочной кислотой. Молочная кислота вступает в реакцию с материалом контейнера и образует ядовитый комплекс. На самом деле это реакция между кислотой и металлом.Эта реакция называется электрохимической реакцией.
Страница № 74:
Вопрос 10:
Напишите химические уравнения для следующих действий.
(a) Раствор NaOH добавляли к раствору HCl.
(b) Цинковая пыль была добавлена к разбавленному H 2 SO 4 .
(c) К оксиду кальция добавили разбавленную азотную кислоту.
(e) Газообразный диоксид углерода пропускали через раствор КОН.
(f) Разбавленную HCl вылили на пищевую соду.
Ответ:
а. HCl(ж) + NaOH(ж) → NaCl(т) + h3O(ж) + Энергия b. Zn(s)+ h3SO4(l)→ ZnSO4(s) +h3 (g)c. CaO(тв) + 2HNO3(ж)→ Ca(NO3)2(т)+ h3O(ж) d. KOH(ж) + CO2(г)→ KHCO3 э. NaHCO3(т)+ 2HCl(л)→ NaCl(т) + h3O(л)+ CO2
Страница № 74:
Вопрос 11:
Укажите различия.
а. Кислоты и основания
б. Катион и анион
в. Отрицательный электрод и положительный электрод.
Страница № 74:
Вопрос 12:
Классифицируйте водные растворы следующих веществ в зависимости от их рН на три группы: 7, более 7, менее 7.
Поваренная соль, ацетат натрия, соляная кислота, диоксид углерода, бромид калия, гидроксид кальция, хлорид аммония, уксус , карбонат натрия, аммиак, диоксид серы.
Ответ:
Ответ7.
| ВЕЩЕСТВА | Значение pH |
| Раствор поваренной соли | равно 7 |
| Раствор ацетата натрия | больше 7 |
| Раствор соляной кислоты | меньше 7 |
| Раствор двуокиси углерода | меньше 7 |
| Раствор калия бромида | равно 7 |
| Раствор гидроксида кальция | больше 7 |
| Раствор хлорида аммония | меньше 7 |
| Раствор уксуса | меньше 7 |
| Раствор карбоната натрия | больше 7 |
| Раствор аммиака | больше 7 |
| Раствор диоксида серы | меньше 7 |
Посмотреть решения NCERT для всех глав класса 9
Какое определение основания в химии
Какое определение основания в химии?
Основания
Основания – это вещества, которые являются мыльными на ощупь и горькими на вкус.
Вещества, содержащие основание, называются основными веществами. Гидроксид натрия (NaOH) и гидроксид кальция [Ca(OH) 2 ] являются примерами оснований, используемых в лаборатории. Кукурузный крахмал, свежий яичный белок и т. д. являются другими примерами оснований. Основы
могут иметь сильный раздражающий запах, и их следует использовать с осторожностью, так как они могут повредить кожу и глаза.
Некоторые основания
Основание представляет собой вещество, обычно оксид или гидроксид металла, которое может реагировать с кислотой с образованием соли и воды.
Например, оксид натрия (Na 2 O), оксид кальция (CaO), оксид меди (CuO), оксиды железа (FeO, Fe 2 O 3 и т. д.), гидроксид натрия (NaOH) и гидроксид кальция (Ca(OH) 2 — все основания.
Некоторые вещества также называются основаниями, хотя они не подпадают под приведенное выше определение. Например, аммиак (NH 3 ). Он образует соль с кислотой без воды. Таким образом, его не следует рассматривать как основание. Но гидроксид аммония (NH 4 OH), водный раствор NH 3 , является основанием, поскольку он реагирует с кислотой с образованием соли и воды
Таким образом, его не следует рассматривать как основание. Но гидроксид аммония (NH 4 OH), водный раствор NH 3 , является основанием, поскольку он реагирует с кислотой с образованием соли и воды
.
NH 4 OH + HCl → NH 4 Cl + H 2 O
Щелочи :
Основания, растворимые в воде, называются щелочами.Например, гидроксид натрия, гидроксид калия, гидроксид кальция растворимы в воде. Следовательно, они щелочи. Но такие основания, как гидроксид меди (Cu(OH) 2 , гидроксид железа (Fe(OH) 3 ), гидроксид алюминия (Al(OH) 3 ), не растворяются в воде. Следовательно, они не являются щелочами.
, следовательно, все щелочи являются основаниями, но все основания не щелочны. Некоторые базы перечислены здесь в таблице.
|
Оксиды |
Нерастворимые гидроксиды | |
|
Монооксид натрия (Na 2 O) |
Гидроксид натрия (NaOH) |
Гидроксид железа (Fe(OH) 3 ). |
|
оксид кальция (CaO) 7 4 гидроксид калия (KOH) |
||
| CUPRIC OXIDE (CUO)
ZNO |
Известковая вода,
Люди также спрашивают
Забавные эксперименты, которые можно попробовать дома
Эксперименты с кислотами и основаниями могут стать основой для увлекательных проектов по химии!
Кислые растворы имеют более высокую концентрацию ионов водорода (H+).
Это атомы водорода, которые потеряли электрон и теперь имеют только протон, что придает им положительный электрический заряд.
Основные растворы, напротив, содержат ионы гидроксида (OH-). Один из самых простых способов показать, как кислоты и основания реагируют друг с другом (и продемонстрировать их различные свойства), — это приготовить вулкан из уксуса и пищевой соды.
Для другого реакционного эксперимента поместите таблетку Alka-Seltzer на дно канистры из прозрачной пластиковой пленки (такой, в которой крышка входит внутрь, а не закрывается снаружи).
Наполните канистру теплой водой, затем быстро закройте крышку и наблюдайте за кислотно-щелочной реакцией!
Шкала рН используется для измерения кислотности или щелочности раствора. Кислоты имеют рН ниже 7; основания имеют рН выше.
Нейтральные растворы (например, дистиллированная вода) со сбалансированным количеством ионов H+ и OH- имеют pH 7. Выполните следующие проекты, чтобы изучить охлаждающие эффекты pH.
Лакмус – это природный кислотно-щелочной индикатор, извлекаемый из лишайника.Если у вас есть красная и синяя лакмусовая бумажка, вы можете проверить разные растворы на кислотность или щелочность.
Синяя лакмусовая бумажка становится красной, когда раствор кислый; красная лакмусовая бумажка синеет в щелочных растворах.
Попробуйте протестировать средство для мытья окон, средство для чистки унитаза, апельсиновый и яблочный сок — налейте немного каждого в отдельные пробирки, маленькие стаканы или баночки.
С помощью лакмусовой бумажки определите, какие вещества являются кислотами, а какие основаниями. Вот уровни pH некоторых других веществ, которые вы можете проверить:
- Лимонный сок (2)
- Уксус (3)
- Молоко (6)
- Яичный белок (8)
- Пищевая сода (9)
- Аммиак (10)
.4; даже небольшие колебания могут серьезно повлиять на наш организм.
Вы также можете сделать свой собственный индикатор pH — используйте блендер, чтобы смешать одну часть нарезанной краснокочанной капусты с двумя частями кипящей воды и использовать сок для тестирования различных растворов.
Кислоты окрашивают пигменты индикатора в красноватый цвет; основы сделают пигменты голубоватыми или желто-зелеными.
Таинственный кувшин
Сделайте обычную воду ярко-розовой, а затем снова прозрачной! Это отличный «волшебный трюк», чтобы произвести впечатление на ваших друзей — просто будьте осторожны, чтобы никто не принял его за фруктовый пунш и напитки!
>> Посмотрите видео нашего проекта, чтобы увидеть этот трюк в действии!
Что вам нужно:
Что вы делаете:
1.В первый стакан положите чуть меньше 1/8 чайной ложки карбоната натрия, во второй положите 6 капель раствора фенолфталеина, а в третий положите три полных капельницы уксуса.
2. Добавьте несколько капель воды в первый стакан и перемешайте, чтобы растворить карбонат натрия.
3. Наполните все стаканы водой из кувшина, затем вылейте все обратно в кувшин, кроме стакана с уксусом.
4. Наполните оставшиеся четыре стакана – вода станет красной!
5.Теперь вылейте все пять стаканов обратно в кувшин. Наполните стаканы в последний раз — жидкость снова станет бесцветной!
Что произошло:
Фенолфталеин является индикатором pH, но он меняет цвет только в ответ на щелочи. Когда вы наливали четыре стакана обратно в кувшин, фенолфталеин вступал в реакцию с карбонатом натрия, основанием, и раствор превращался в ярко-розовый «прохладитель». Чтобы превратить его обратно в «воду», все, что вам нужно было сделать, это добавить кислый уксус, который снова сделал фенолфталеин бесцветным.
Чтобы превратить его обратно в «воду», все, что вам нужно было сделать, это добавить кислый уксус, который снова сделал фенолфталеин бесцветным.
| Рекомендуемый набор Набор «Химические фокусы» С помощью этого крутого набора для экспериментов вы сможете создавать растворы, меняющие цвет, и даже мгновенно превращать воду в твердое вещество! 12 химических трюков в этом наборе удивят ваших друзей, а также научат вас науке о рН, кислотах и основаниях, плотности, хроматографии и полимерах. Этот набор включает в себя высококачественное химическое оборудование, такое как стеклянные стаканы и градуированный цилиндр, а также три химиката для изготовления двух видов невидимых чернил, окрашивания обычной воды в ярко-красный цвет, создания разноцветной радуги в пробирке и многого другого. |
Радужная реакционная трубка
Удивите своих друзей, смешав два раствора, чтобы получить радугу!
Наблюдайте, как фиолетовый опускается на дно, а красный всплывает наверх, и они смешиваются друг с другом, образуя все промежуточные цвета.
Что вам нужно:
Что вы делаете:
1. Нанесите 15 капель универсального индикатора в мерный цилиндр и добавьте фильтрованную воду до отметки 10 мл. Раствор должен быть желто-зеленого цвета.
2. Добавьте 3 капли уксуса в раствор в мерном цилиндре, и он должен стать красным.
3. В химический стакан насыпьте две мерные ложки карбоната натрия и добавьте примерно 30 мл воды. Смешайте вместе палочкой для перемешивания, пока карбонат натрия не растворится. Решение должно быть ясным.
4. Чтобы начать реакцию, наполните одну пипетку раствором карбоната натрия. Быстро выдавливайте пипетку в градуированный цилиндр, а не по каплям. Прозрачный раствор должен мгновенно стать темно-фиолетовым и медленно опускаться на дно, образуя радугу.
5. Дайте содержимому цилиндра отстояться, пока не увидите каждый цвет от голубовато-фиолетового до красного. Чтобы радуга исчезла, налейте ее в пустой стакан, и она должна стать желтой или желтовато-зеленой.
Что произошло:
Универсальный индикатор меняет цвет, чтобы показать уровень pH вещества. В этом случае при смешивании кислого раствора (уксуса) с щелочным (карбонатом натрия) индикатор давал красочный спектр — от темно-синего до красного.Интересно, что если бы вы складывали решения в обратном порядке, вы бы не увидели радугу. Чтобы получить эффект радуги, работает еще один научный принцип — плотность . Приготовленный вами раствор карбоната натрия более плотный, чем раствор индикатора, поэтому он опускается на дно. Когда раствор карбоната натрия опускается на дно, некоторые его молекулы смешиваются с молекулами уксуса, образуя новый раствор, который проявляется в виде цвета на шкале рН.
Если не перевернуть градуированный цилиндр вверх дном, радуга продержится несколько дней.Со временем цвета будут смешиваться вместе в процессе диффузии. Молекулы каждого раствора будут смешиваться по всему градуированному цилиндру, а не оставаться сконцентрированными вверху или внизу. После того, как вы смешаете растворы кислоты и основания, раствор станет нейтральным по pH и будет выглядеть желтым или слегка зеленым.
После того, как вы смешаете растворы кислоты и основания, раствор станет нейтральным по pH и будет выглядеть желтым или слегка зеленым.
Чтобы сделать радужную трубку другого типа, попробуйте сделать эту радужную колонку плотности из всех бытовых материалов.
Больше проектов по химии pH:
Вычисление pH и pOH — Химия для старших классов
Если вы считаете, что контент, доступный с помощью Веб-сайта (как это определено в наших Условиях обслуживания), нарушает одно
или более ваших авторских прав, пожалуйста, сообщите нам, предоставив письменное уведомление («Уведомление о нарушении»), содержащее
в
информацию, описанную ниже, назначенному агенту, указанному ниже.Если университетские наставники примут меры в ответ на
ан
Уведомление о нарушении, он предпримет добросовестную попытку связаться со стороной, предоставившей такой контент
средства самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Ваше Уведомление о нарушении может быть направлено стороне, предоставившей контент, или третьим лицам, таким как
в виде
ChillingEffects.org.
Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатов), если вы существенно
искажать информацию о том, что продукт или деятельность нарушают ваши авторские права.Таким образом, если вы не уверены, что содержимое находится
на Веб-сайте или на который ссылается Веб-сайт, нарушает ваши авторские права, вам следует сначала обратиться к адвокату.
Чтобы подать уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись владельца авторских прав или лица, уполномоченного действовать от его имени;
Идентификация авторских прав, которые, как утверждается, были нарушены;
Описание характера и точного местонахождения контента, который, как вы утверждаете, нарушает ваши авторские права, в \
достаточно подробно, чтобы преподаватели университета могли найти и точно идентифицировать этот контент; например, мы требуем
а
ссылку на конкретный вопрос (а не только название вопроса), который содержит содержание и описание
к какой конкретной части вопроса — изображению, ссылке, тексту и т. д. — относится ваша жалоба;
д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; и
Заявление от вас: (а) что вы добросовестно полагаете, что использование контента, который, как вы утверждаете, нарушает
ваши авторские права не разрешены законом или владельцем авторских прав или его агентом; б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство вы
либо владельцем авторских прав, либо лицом, уполномоченным действовать от их имени.
Отправьте жалобу нашему назначенному агенту по адресу:
Чарльз Кон
Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
Сент-Луис, Миссури 63105
Или заполните форму ниже:
.




 Диссоциация
Диссоциация 