Урок 25. классификация химических элементов.понятие о группах сходных элементов.периодический закон и периодическая таблица д. и. менделеева — Химия — 8 класс
Классификация химических элементов. Понятие о группах сходных элементов. Периодический закон и периодическая таблица Д. И. Менделеева
Для ориентировки в мире окружающих нас веществ необходима их классификация. Попытки ее создать предпринимались с давних пор. Металлы уже с давних времён выделяли в отдельную группу. Михаил Васильевич Ломоносов говорил про металлы так: «Металлы – суть светлые тела, которые ковать можно». В этих словах заключено общее свойство металлов – ковкость. Если посмотреть на внешний вид металла, то мы заметим ещё одно сходство – все металлы обладают металлическим блеском. И ещё все металлы хорошо проводят тепло и электрический ток. Существуют физические свойства – общие для всех металлов, которые позволили их объединить под этим названием. А у неметаллов общих физических свойств нет.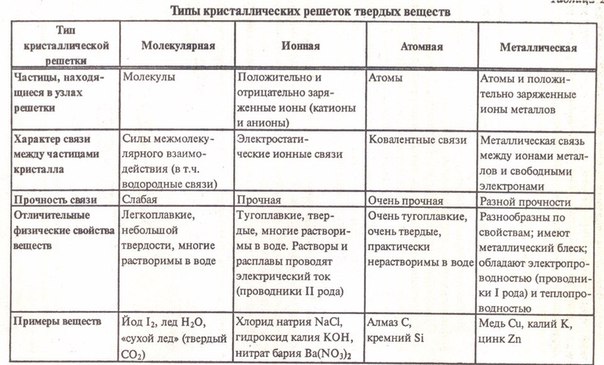 Общим в простых веществах-неметаллах является только то, что для них не характерны свойства металлов. На металлы и неметаллы стали разделять и химические элементы. Такая классификация была слишком условной, учёные не оставляли попыток боле точно классифицировать химические элементы.
Общим в простых веществах-неметаллах является только то, что для них не характерны свойства металлов. На металлы и неметаллы стали разделять и химические элементы. Такая классификация была слишком условной, учёные не оставляли попыток боле точно классифицировать химические элементы.
Дёберейнер Иоганн Вольфганг выявил сходство между химическими элементами, так называемое «Правило Триад»: элементы в триадах образуют сходные по составу со-единения и обладают сходными свойствами (например, общей формулой оксидов)
Li Na K;
Ca Sr Ba;
P As Sb;
S Se Te;
Cl Br I
В дальнейшем число элементов в триадах увеличилось до 4–5. Такие группы полу-чили своё название – естественные семейства химических элементов. К началу 60-х годов XIX века практически все известные химические элементы были объединены в естественные семейства.
Были предприняты и другие попытки создать единую систему химических элемен-тов. Александр Эмиль Бегье де Шанкуртуа Расположил химические элементы по спирали, пытаясь связать свойства с их атомной массой, Джон Александер Ньюлендс расположил элементы в таблицу по возрастанию их атомных масс и сформулировал закон Октав, Лотар-Юлиус Мейер рассмотрел общую систему химических элементов, расположив их по возрастанию атомных масс.
Все предложенные системы имели слишком много исключений из правил, в отли-чие от системы, созданной Дмитрием Ивановичем Менделеевым.
В основу системы были положены следующие подходы:
— расположение химических элементов в порядке возрастания их атомных масс;
учёт валентности и свойств образуемых ими соединений.
В таблице Менделеева были предусмотрены пробелы для ещё неоткрытых химиче-ских элементов. Открытие предсказанных химических элементов только подтвердило теорию Дмитрия Ивановича. С течением времени были изменены атомные массы некото-рых элементов, изменён порядок расположения элементов по сравнению с принципом возрастания атомной массы.
1869 год считается годом открытия периодического закона: «Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов».
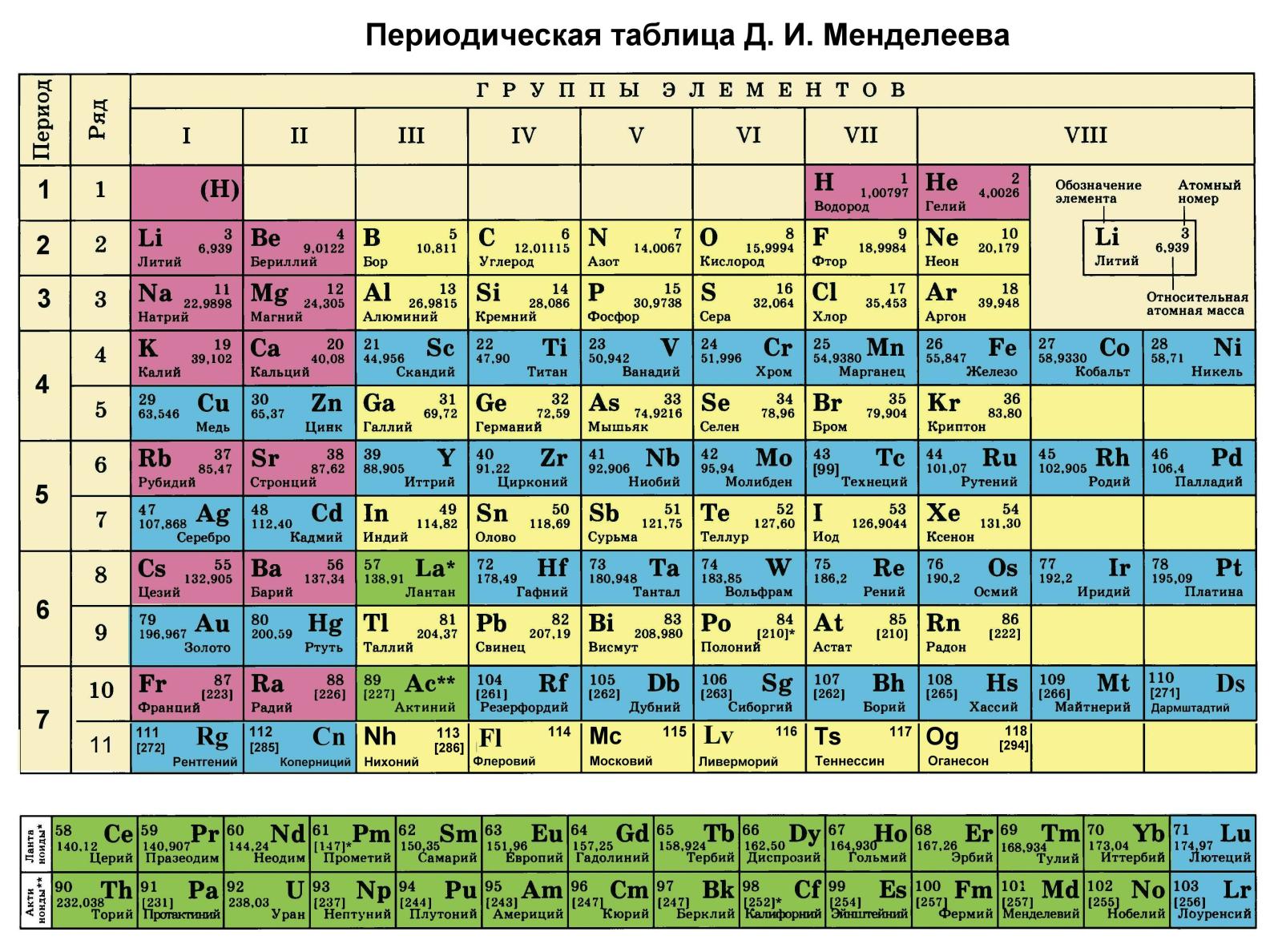
Периодическую систему химических элементов можно представить в виде перио-дической таблицы. Каждый элемент занимает определённое место (клетку) и имеет свой порядковый (атомный) номер. Расположив химические элементы по возрастанию их атомных масс, Менделеев разделил эту последовательность на ряды (периоды), которые начинались щелочным металлом, а заканчивались инертным газом.
Расположив химические элементы по возрастанию их атомных масс, Менделеев разделил эту последовательность на ряды (периоды), которые начинались щелочным металлом, а заканчивались инертным газом.
Например, элементы третьего периода – 11Na 12Mg 13Al 14N 15P 16S 17Cl
В периодах постепенно увеличивается высшая валентность химических элементов, свойства металлов сменяются неметаллическими свойствами.
Вертикальные ряды химических элементов тоже получили своё название – группы.
Малые периоды состоят только из элементов главных подгрупп, символы химических элементов побочных подгрупп находятся сбоку от символов главных. Элементы одной подгруппы обладают сходными свойствами:
1. Одинаковое значение высшей валентности
2. Одинаковые общие формулы высших оксидов, летучих водородных соеди-нений, гидроксидов.
3. Сходство в свойствах простых веществ и соединениях химических элемен-тов.
Атомы химических элементов. 8 класс
Тип урока: урок обобщения (урок-путешествие).
Цели урока:
- Образовательные: Повторить, обобщить и систематизировать знания по теме: «Атомы химических элементов»
- Развивающие: Развивать умения сравнивать, анализировать, применять полученные знания на практике, делать выводы, развивать логическое мышление
- Воспитательные: Совершенствовать умения самостоятельной работы и работы в группе, формировать естественно-научное мировоззрение; информационную культуру.
Задачи: Организация частично – поисковой деятельности. Работа в группах, индивидуальная работа. Проведение самостоятельной работы по вариантам. Рефлексия.
Использованные источники:
- учебник для общеобразовательных учреждений «Химия 8 класс» О. С. Габриелян , М.: Дрофа, 2010.
- «Химия 8 класс» контрольные и проверочные работы к учебнику О. С. Габриеляна, М.: Дрофа, 2007.
- Рабочая тетрадь «Химия 8 класс» к учебнику О.
 С. Габриеляна, Дрофа 2010.
С. Габриеляна, Дрофа 2010.
Оборудование: периодическая таблица химических элементов Д.И.Менделеева; индивидуальные карточки – заготовки; компьютер; интерактивная доска.
Ход урока
Вводная часть
Учитель: Добрый день, ребята. Сегодня у нас урок обобщения и систематизации знаний по теме: «Атомы химических элементов».
Но это не обычный урок, а урок-путешествие. Чтобы оно было увлекательным и запоминающимся необходимо подумать, что мы хотим получить от него. Какие цели мы будем преследовать? (уч-ся пытаются назвать цели, учитель их корректирует)
Итак, мы отправляемся в увлекательное путешествие по стране АТОМЫ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ. Жители этой страны очень разнообразны, порой противоречивы, но все они чтут законы и обычаи своей страны и бережно хранят в памяти имя своего создателя. Прежде чем отправиться в путь, давайте проверим, а готовы ли мы с вами соблюдать обычаи и законы этой страны? Я буду задавать вопросы, а вы отвечать на них:
– Что такое атом?
– Из чего атом состоит?
– Назовите физический смысл порядкового номера элемента
– Охарактеризуйте массовое число атома
– Назовите типы химических связей
– Что такое валентность?
Я думаю, что разрешение на въезд в страну мы получили. А теперь давайте выполним задание
А теперь давайте выполним задание
Задание №1: угадайте химический элемент.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Задание №2: (работа в парах)
Карточка № 1 (синего цвета)
Определите, какие величины, характеризующие строение атома и положение химического элемента в таблице периодической системы, численно равны между собой. Буквы, соответствующие правильным ответам, образуют название химического элемента, обнаруженного в 1868 году астрономами Ж. Жансеном и Н. Локьером в солнечном спектре. Каждый участник команды выполняет одно задание и карточку передает другому ученику. (Этот элемент – гелий).
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Задание №3: Заполните таблицу по вариантам
Карточка № 2 ( желтого цвета)
Вариант 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Вариант 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Взаимопроверка.
Учитель: Ребята, посмотрите! Пришла телеграмма: «Дорогие путешественники!!! Просим Вас оказать содействие в поисках потерявшихся жителей нашего государства. С уважением, Правитель страны “Атомы химических элементов”».
Давайте поможем найти заблудившихся жителей? Что нам необходимо сделать? (Разбиться на группы.)
Задание №4: (работа в группах)
Определите виды химической связи в веществах и обведите в таблице соответствующие цифры. Порядковому номеру какого элемента равна сумма этих цифр?
(Карточка № 3 красного цвета)
1 группа
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(Предполагаемый ответ: 14Si)
2 группа
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(Предполагаемый ответ: 13Al)
3 группа
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(Предполагаемый ответ: 12Mg)
4 группа
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(Предполагаемый ответ: 11Na)
Один обучающийся из каждой группы выходит к доске, находит на столе учителя карточку с изображением своего элемента и крепит магнитом к доске.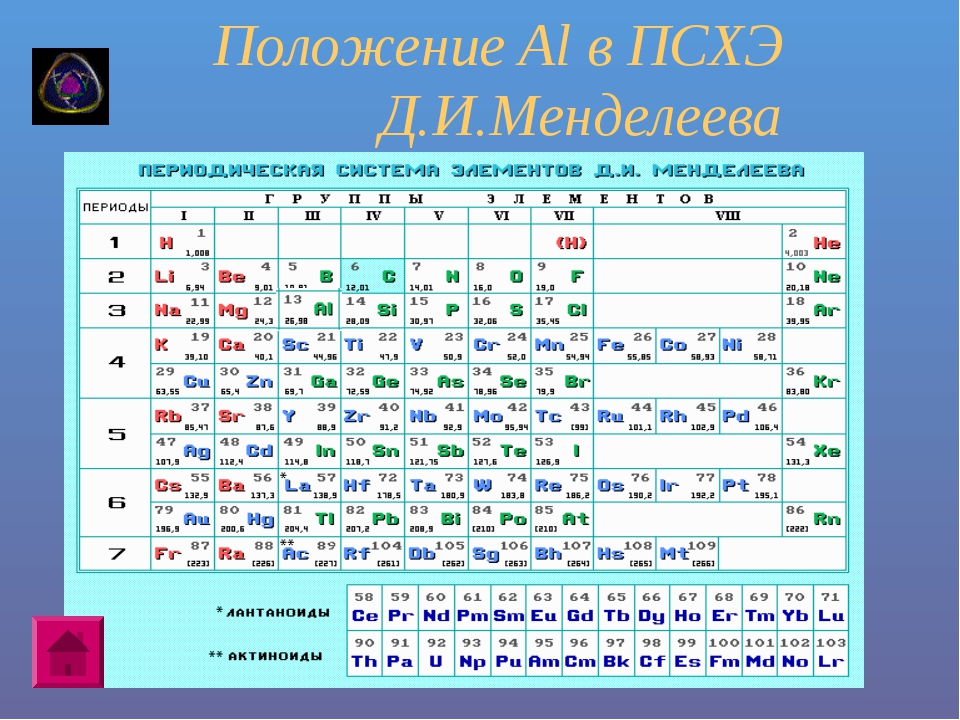
Последний обучающийся получает дополнительное задание: расположить полученные элементы в порядке увеличения металлических свойств
(Si‹ Al ‹ Mg ‹Na)
Физкультминутка
Учитель: Ребята, предлагаю сделать привал, вы очень долго шли, устали. Давайте отдохнем!
А дальше мы идти не можем, речка с подводными камнями. Чтобы нам ее пересечь необходимо очень быстро решить задание 4 на стр. 80 учебника.
Какая команда справится быстрее?
Молодцы!!! Но посмотрите, совсем стемнело. Не видно куда идти, очень похоже на какой-то лабиринт. Давайте его пройдем (карточка № 4 зеленого цвета) .
Задание №5: Мини-лабиринт (карточка № 4)
Найдите выход из химического лабиринта. Начните прохождение с верхней левой клетки. Если суждение, вписанное в эту клетку, правильно, то продолжайте путь по стрелке с обозначением “Да”. Если данное суждение ошибочно, то вам следует продолжить путь по стрелке с обозначением “Нет”. Если Вы потеряли путь, то начните его сначала.
Если суждение, вписанное в эту клетку, правильно, то продолжайте путь по стрелке с обозначением “Да”. Если данное суждение ошибочно, то вам следует продолжить путь по стрелке с обозначением “Нет”. Если Вы потеряли путь, то начните его сначала.
Лабиринт
Путь укажите карандашом на вспомогательной карте-схеме.
Тестовое задание (по вариантам)
Вариант 1
1. Атом какого химического элемента имеет электронную конфигурацию 1s22s22p63s23p1
А) Al
Б) В
В) Mg
Г) Si
2. Число протонов в атоме серы равно
А) 39
Б) 20
В) 16
Г) 4
3. Какой химический элемент имеет наиболее выраженные металлические свойства
А) Na
Б) Li
В) K
Г) Mg
4. Ковалентный полярный тип связи в соединении
Ковалентный полярный тип связи в соединении
А) О2
Б) КВr
В) HCl
Г) Al
5. Валентность кислорода в соединениях чаще всего равна
А) 1
Б) 2
В) 3
Г) 4
Вариант 2
1. Атом какого химического элемента имеет электронную конфигурацию 1s22s22p63s23p3
А) B
Б) Al
В) Na
Г) P
2. Число протонов в атоме хлора равно
А) 17
Б) 23
В) 14
Г) 6
3. Какой химический элемент имеет наименее выраженные металлические свойства
А) Al
Б) Na
В) Ca
Г) Si
4. Ионный тип связи в соединении
Ионный тип связи в соединении
А) H2
Б) H2O
В) NaCl
Г) Mg
5. Валентность водорода в соединениях чаще всего равна
А) 1
Б) 2
В) 3
Г) 4
Заключительный этап. (Рефлексия)
Учитель: Наше путешествие подходит к концу, давайте вспомним весь путь, который мы прошли. Что мы сегодня делали?
И в заключение мы проведем с вами предметную рефлексию, чтобы быть уверенным, что вы легко справитесь с заданиями на контрольной работе.
Для этого составим синквейн по сегодняшней теме: «Атомы химических элементов».
Учитель напоминает, что слово синквейн происходит от французского “пять”. Это нерифмованное стихотворение из пяти строк, которые строятся по правилам. Правила составления синквейна:
- Первая строка — тема синквейна, заключает в себе одно слово (обычно существительное или местоимение), которое обозначает объект или предмет, о котором пойдет речь.

- Вторая строка — два слова (чаще всего прилагательные или причастия), они дают описание признаков и свойств выбранного в синквейне предмета или объекта.
- Третья строка — образована тремя глаголами или деепричастиями, описывающими характерные действия объекта.
- Четвертая строка — фраза из четырёх слов, выражающая личное отношение автора синквейна к описываемому предмету или объекту.
- Пятая строка — одно слово-резюме, характеризующее суть предмета или объекта.
Задание №6: Составить синквейн на тему «атом».
Предполагаемый ответ:
- атом
- положительный, отрицательный
- состоит, окружает, образует
- наименьшая часть химического элемента
- неделимый
Домашнее задание. Повторить §§ 7–13.
8 класс — первый год обучения
УРОКИ
Урок №1. Предмет химии. Химия как часть естествознания. Вещества и их свойства
Химия как часть естествознания. Вещества и их свойства
Урок №2. Методы познания в химии
Урок №3. Практическая работа №1.Правила техники безопасности при работе в химическом кабинете. Ознакомление с лабораторным оборудованием
Урок №4. Чистые вещества и смеси. Способы разделения смесей
Урок №5. Практическая работа №2. Очистка загрязнённой поваренной соли
Урок №6. Физические и химические
явления. Химические реакции
Урок №7. Атомы и молекулы. Ионы
Урок №8. Вещества молекулярного и
немолекулярного строения. Кристаллические решетки
Урок№9. Простые и сложные вещества.
Химический элемент. Металлы и неметаллы
Урок№10. Язык химии. Знаки
химических элементов. Относительная атомная масса
Урок №11. Закон постоянства состава
веществ
Урок №12. Химические формулы.
Относительная молекулярная масса. Качественный и количественный состав вещества
Урок №13. Массовая доля химического
элемента в соединении
Урок №14-15. Валентность химических
Валентность химических
элементов. Определение валентности элементов по формулам бинарных соединений.
Составление химических формул бинарных соединений по валентности
Урок №16. Атомно-молекулярное
учение
Урок№17-18. Закон сохранения массы
веществ. Химические уравнения
Урок№19. Типы химических реакций
Урок №20. Повторение и обобщение по
теме «Первоначальные химические понятия»
Урок №21. Контрольная работа №1 по
теме: «Первоначальные химические понятия»
Урок №22. Кислород, его общая
характеристика и нахождение в природе. Получение кислорода и его физические
свойства
Урок №23. Химические свойства
кислорода. Оксиды. Применение. Круговорот кислорода в природе
Урок №24. Практическая работа №3.
Получение и свойства кислорода
Урок №25. Озон. Аллотропия
кислорода
Урок №26. Воздух и его состав. Защита атмосферного воздуха от загрязнения
Урок №27. Водород, его общая
характеристика и нахождение в природе. Получение водорода и его физические
свойства. Меры безопасности при работе с водородом
Меры безопасности при работе с водородом
Урок №28. Химические свойства
водорода. Применение
Урок №29. Практическая работа
№4. «Получение водорода и исследование
его свойств»
Урок №30. Вода. Методы определения
состава воды — анализ и синтез. Вода в природе и способы её очистки. Аэрация
воды
Урок №31. Физические и химические
свойства воды. Применение воды
Урок №32. Вода — растворитель.
Растворы. Насыщенные и ненасыщенные растворы. Растворимость веществ в воде
Урок №33-34. Массовая доля
растворенного вещества
Урок №35. Практическая работа №5.
Приготовление растворов солей с определенной массовой долей растворенного
вещества
Урок №36. Повторение и обобщение по
темам «Кислород», «Водород», «Вода. Растворы»
Урок №37. Контрольная работа №2 по
темам «Кислород», «Водород», «Вода. Растворы»
Урок №38. Моль — единица количества
вещества. Молярная масса
Урок №39. Вычисления по химическим
уравнениям
Урок №40. Закон Авогадро. Молярный
Молярный
объем газов
Урок №41. Относительная плотность
газов
Урок №42. Объемные отношения газов
при химических реакциях
Урок №43. Оксиды: классификация,
номенклатура, свойства, получение, применение
Урок №44. Гидроксиды. Основания:
классификация, номенклатура, получение
Урок №45. Химические свойства оснований. Реакция нейтрализации. Окраска индикаторов в щелочной и нейтральной средах. Применение оснований
Урок №46. Амфотерные оксиды и гидроксиды
Урок №47. Кислоты. Состав.
Классификация. Номенклатура. Получение кислот
Урок №48. Химические свойства
кислот
Урок №49. Соли. Классификация.
Номенклатура. Способы получения солей
Урок №50. Свойства солей
Урок №51. Генетическая связь между
основными классами неорганических соединений
Урок №52. Практическая работа №6. Решение
экспериментальных задач по теме «Основные классы неорганических соединений»
Урок №53-54. Повторение и обобщениепо теме «Важнейшие классы неорганических соединений»
Урок №55.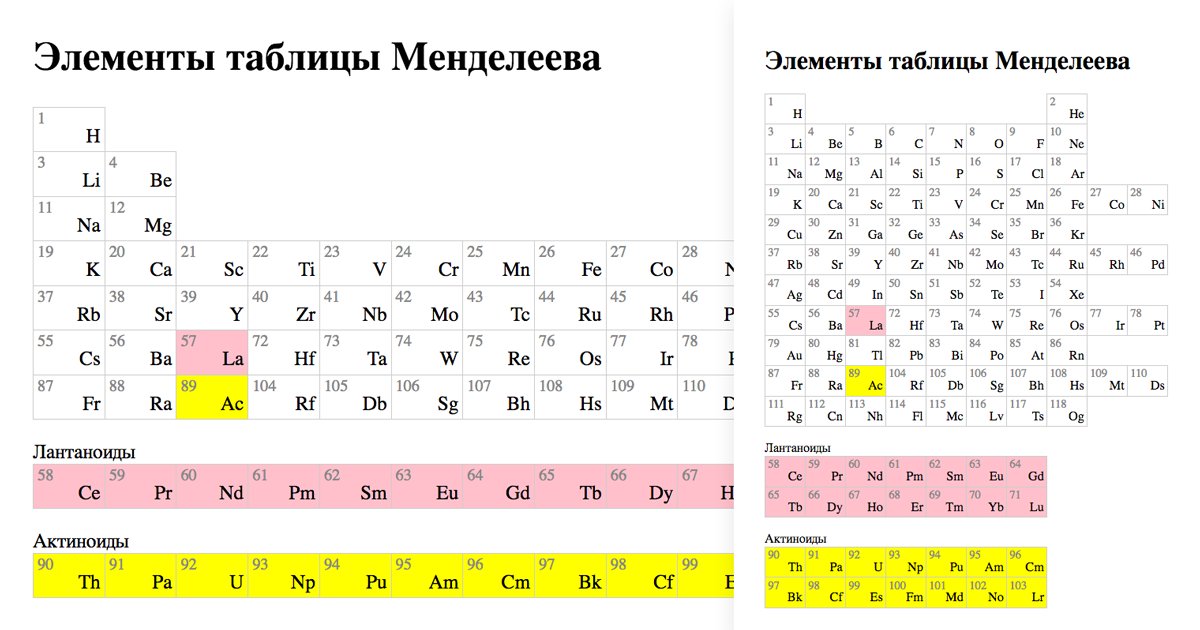 Контрольная работа №3 по
Контрольная работа №3 по
теме: «Основные классы неорганических соединений»
Урок №56. Классификация химических
элементов. Понятие о группах сходных элементов
Урок №57. Периодический закон Д. И.
Менделеева
Урок №58. Периодическая таблица
химических элементов (короткая форма): А- и Б-группы, периоды
Урок №59. Строение атома. Состав
атомных ядер. Изотопы. Химический элемент — вид атома с одинаковым зарядом
ядра
Урок №60. Расположение электронов
по энергетическим уровням. Современная формулировка периодического закона
Урок №61. Значение периодического
закона. Научные достижения Д. И. Менделеева
Урок №62. Повторение и обобщение по
теме: Периодический закон и периодическая система химических элементов Д. И.
Менделеева. Строение атома
Урок №63. Электроотрицательность
химических элементов
Урок №64. Ковалентная связь.
Полярная и неполярная ковалентные связи
Урок №65. Ионная связь
Урок №66. Валентность и степень
окисления. Правила определения степеней окисления элементов
Правила определения степеней окисления элементов
Урок №67-68. Окислительно-восстановительные
реакции
Урок №69. Повторение и обобщение по
теме: «Строение веществ. Химическая связь»
Урок №70. Контрольная работа №4 по
темам: «Периодический закон и периодическая система химических элементов Д. И.
Менделеева. Строение атома. Строение веществ. Химическая связь»
Апрельская образовательная программа по химии: О программе
Положение об апрельской химической образовательной программе Образовательного центра «Сириус»
1. Общие положения
Настоящее Положение определяет порядок организации и проведения апрельской химической образовательной программы Образовательного центра «Сириус» (далее – образовательная программа), ее методическое и финансовое обеспечение.
1.1. Образовательная программа по химии проводится в Образовательном центре «Сириус» (Образовательный Фонд «Талант и Успех») с 1 по 24 апреля 2019 года.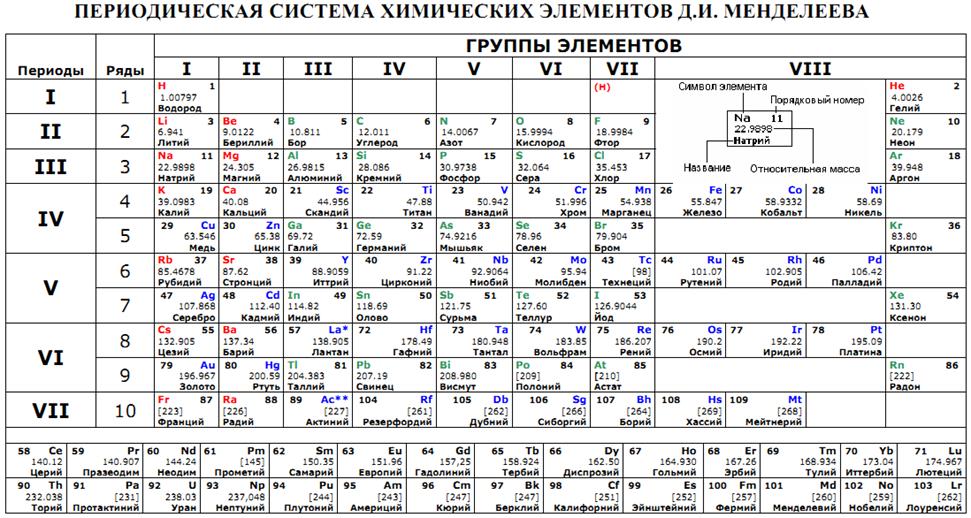
1.2. Количество участников образовательной программы: не более 150 школьников 8-10 классов, успешно прошедших конкурсный отбор, из них: 8 класс – до 25 человек, 9 класс – до 75 человек, 10 класс – до 50 человек.
Принять участие в образовательной программе могут только зарегистрировавшиеся школьники.
1.3. К участию в образовательной программе допускаются школьники, являющиеся гражданами Российской Федерации.
1.4. Персональный состав участников образовательной программы утверждается Экспертным советом Образовательного Фонда «Талант и успех» (далее – Фонд) по направлению «Наука».
1.5. Научно-методическое и кадровое сопровождение образовательной программы осуществляют Химический факультет МГУ имени М.В. Ломоносова, Центр Педагогического мастерства г. Москвы.
1.6. В связи с целостностью и содержательной логикой образовательной программы, интенсивным режимом занятий и объемом академической нагрузки, рассчитанной на весь период пребывания обучающихся в Образовательном центре «Сириус», не допускается участие школьников в отдельных мероприятиях или части образовательной программы: исключены заезды и выезды школьников вне сроков, установленных Экспертным советом Фонда по направлению «Наука».
1.7. В случае нарушений правил пребывания в Образовательном центре «Сириус» или требований настоящего Положения решением Координационного совета участник образовательной программы может быть отчислен с образовательной программы.
1.8. В течение учебного года (с июля по июнь следующего календарного года) допускается участие школьников не более, чем в двух образовательных программах по направлению «Наука» (по любым профилям, включая проектные образовательные программы), не идущих подряд.
2. Цели и задачи образовательной программы
2.1. Цели проведения образовательной программы: подготовка к участию в олимпиадах по химии высшего уровня, развитие способностей учащихся и расширение кругозора путем интенсивных занятий по углубленной программе у ведущих педагогов России, развитие проектного мышления и умения работать в коллективе в процессе выполнения практико-ориентированных задач.
2.2. Задачи образовательной программы:
• углубление знаний участников образовательной программы в области химии и материаловедения;
• развитие умений, навыков и отработка приемов решения олимпиадных задач;
• развитие умений и навыков экспериментальной работы с веществами и материалами;
• развитие умений ставить перед собой задачи и самостоятельно их решать;
• формирование межпредметных связей путем решения практико-ориентированных задач;
• популяризация химии и смежных областей знания.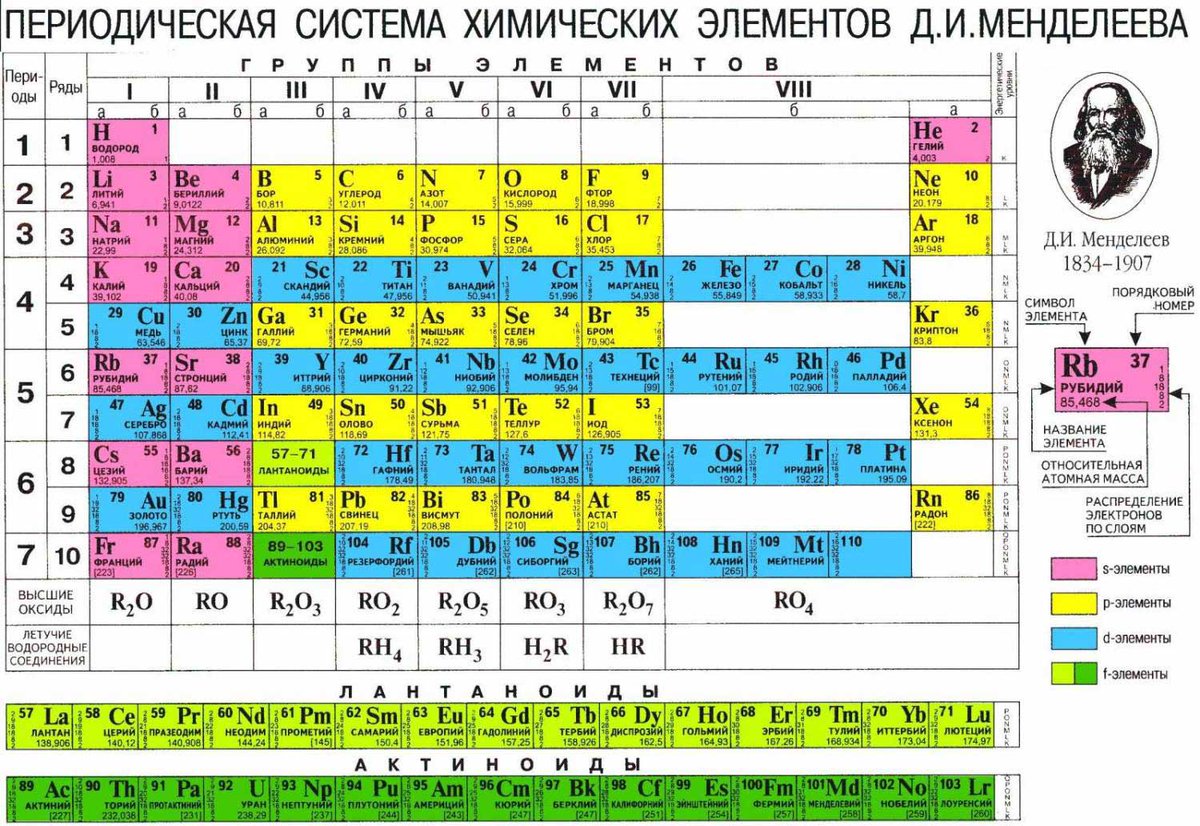
3. Порядок отбора участников образовательной программы
3.1. Отбор участников образовательной программы осуществляется Координационным советом, формируемым Руководителем Образовательного Фонда «Талант и успех», на основании требований, изложенных в настоящем Положении, а также Порядку отбора школьников на профильные образовательные программы Фонда по направлению «Наука».
3.2. Для участия в образовательной программе приглашаются учащиеся образовательных организаций всех регионов РФ, показавшие высокие результаты на химических олимпиадах в 2017-2018 и 2018-2019 учебных годах.
3.3. Для участия в отборе на образовательную программу необходимо пройти регистрацию на сайте Образовательного центра «Сириус». Регистрация будет доступна до 22 февраля 2019 года.
3.4. На образовательную программу приглашаются учащиеся 8-9-10 классов в соответствии с рейтингом, составленным на основании оценки академических достижений школьников.
3.5. При отборе на образовательную программу будут оцениваться следующие академические достижения школьников:
- Победитель регионального этапа Всероссийской олимпиады школьников по химии 2018-2019 учебного года – 10 баллов.
- Призер регионального этапа Всероссийской олимпиады школьников по химии 2018-2019 учебного года – 7 баллов.
- Участник регионального этапа Всероссийской олимпиады школьников по химии 2018-2019 учебного года (только для 8 класса) – 5 баллов.
- Победитель олимпиад по химии 1-го уровня за 2017-2018 учебный год – 5 баллов.
- Призер олимпиад по химии 1-го уровня за 2017-2018 учебный год – 3 балла.
- Победитель олимпиад по химии 2—3-го уровней за 2017-2018 учебный год – 2 балла.
- Призер олимпиад по химии 2—3-го уровней за 2017-2018 учебный год – 1 балл.
3. 6. К участию в конкурсном отборе также приглашаются школьники 8 класса – победители и призеры муниципального этапа Всероссийской олимпиады школьников по химии 2018-2019 учебного года.
6. К участию в конкурсном отборе также приглашаются школьники 8 класса – победители и призеры муниципального этапа Всероссийской олимпиады школьников по химии 2018-2019 учебного года.
Учащиеся 8 класса, участвующие в конкурсном отборе, дополнительно должны предоставить мотивационное письмо, с указанием трех наивысших, по мнению школьника, академических достижений по химии и смежным дисциплинам.
Мотивационные письма необходимо загрузить в графу «Иные достижения».
За оценку мотивационного письма может быть дополнительно начислено от 0 до 3 баллов.
3.7. По итогам оценки академических достижений кандидатов формируется рейтинговый список кандидатов на участие в образовательной программе, который упорядочивается по убыванию суммы баллов, набранных школьниками (отдельно по 8-му, 9-му и 10-му классу).
3.8. При формировании рейтинга суммируются наивысшее достижение школьника за участие во Всероссийской олимпиаде школьников 2018-2019 учебного года и наивысшее достижение школьника за участие в олимпиадах по химии 1-2-3-го уровня 2017-2018 учебного года.
В случае равенства баллов в рейтинговом списке у двух и более школьников приоритет в приглашении на программу имеют школьники, показавшие лучший результат на региональном этапе Всероссийской олимпиады школьников по химии 2018-2019 учебного года
3.9. От одного региона в образовательной программе могут принять участие не более 20% школьников по каждому классу, то есть, за 8 класс – до 5 человек, за 9 класс – до 15 человек, за 10 класс – до 10 человек.
3.10. Участники заключительного этапа Всероссийской олимпиады школьников по химии 2018-2019 учебного года не могут принять участие в апрельской образовательной программе по химии. При этом они могут принять участие в августовской образовательной программе по химии Образовательного центра «Сириус».
3.11. Учащиеся, отказавшиеся от участия в образовательной программе, могут быть заменены на следующих за ними по рейтингу школьников. Решение о замене участников принимается Координационным советом программы.
3. 12. Список участников Образовательной программы будет опубликован на сайте Образовательного центра «Сириус» не позднее 26 февраля 2019 года.
12. Список участников Образовательной программы будет опубликован на сайте Образовательного центра «Сириус» не позднее 26 февраля 2019 года.
4. Аннотация образовательной программы
Программа включает в себя теоретические (лекции, семинары) и практические занятия в лабораториях по неорганической, аналитической и органической химии, лекции и семинары ведущих преподавателей. Также предусмотрены спортивные и культурно-досуговые мероприятия, экскурсии по Олимпийскому парку, в Красную Поляну. Помимо этого, в вечернее время школьникам предоставляется возможность посещать образовательные лекции, расширяющие их кругозор.
5. Финансирование образовательной программы
Оплата проезда, пребывания и питания школьников – участников образовательной программы осуществляется за счет средств Образовательного Фонда «Талант и успех».
App Store: Химия
Решайте химические уравнения, Таблица Менделеева 2021, Таблица Растворимости и другие — и всё в одном приложении! Незаменимый помощник по химии! Химия — это просто!
Приложение находит Химические Реакции и химические уравнения с одним и несколькими неизвестными. У вас всегда будет под рукой Таблица Менделеева и Таблица Растворимости. И даже калькулятор молярных масс!
У вас всегда будет под рукой Таблица Менделеева и Таблица Растворимости. И даже калькулятор молярных масс!
Добавляйте виджеты с химическими элементами на рабочий стол – запоминайте полезную информацию подсознательно.
Находит уравнения химических реакций, даже если неизвестна правая или левая часть, поможет с органической и неорганической химией. Вам будут отображен список найденных реакций в обычном и ионном виде и нарисованы формулы органической химии.
Удобная интерактивная Таблица Менделеева с поиском и информацией о всех химических элементах доступной оффлайн. Нажмите на химический элемент в таблице, чтобы посмотреть справочную информацию.
Запоминайте химические элементы подсознательно с использованием виджетов для рабочего стола. Разместите один или несколько виджетов и время от времени смотрите информацию о химических элементах: порядковый номер и расположение в Таблице Менделеева, фотографии химических веществ, даты открытия элементов.
Калькулятор молярных масс. Введите правильно химическое соединение и калькулятор покажет молярные массы и процентные содержания элементов в заданном химическом веществе.
Введите правильно химическое соединение и калькулятор покажет молярные массы и процентные содержания элементов в заданном химическом веществе.
Таблица растворимости будет всегда под рукой, и вы сможете понять какая реакция идет, а какая нет. Теперь не придется открывать учебник, чтобы узнать нужную информацию.
Самый лучший решатель химических уравнений для iPhone и iPad.
* Таблица Менделеева
* Таблица растворимости
* Поиск химических реакций
* Оффлайн доступ к информации о химических элементах
* Калькулятор молярных масс химических веществ
* Ряд электроотрицательности элементов
* Молекулярные массы органических веществ
* Электрохимический ряд активности металлов
* Ряд активности кислот
* Названия кислот и кислотных остатков
* Виджеты для легкого изучения Химии
И все эти таблицы и калькуляторы в бесплатном приложении Химия.
Подробнее про условия использовани приложения можно прочитать по следующим ссылкам:
Terms of Use: http://getchemistry. io/terms-and-conditions/ios/
io/terms-and-conditions/ios/
Privacy policy: http://getchemistry.io/privacy-policy/ios/
история открытия, интересные факты и байки – Москва 24, 24.10.2012
Фото: ИТАР-ТАСС
Открытие таблицы периодических химических элементов стало одной из важных вех в истории развития химии как науки. Первооткрывателем таблицы стал российский ученый Дмитрий Менделеев. Неординарный ученый с широчайшим научным кругозором сумел объединить все представления о природе химических элементов в единую стройную концепцию.
Об истории открытия таблицы периодических элементов, интересных фактах, связанных с открытием новых элементов, и народных байках, которые окружали Менделеева и созданную им таблицу химических элементов, М24.RU расскажет в этой статье.
История открытия таблицы
К середине XIX века было открыто 63 химических элемента, и ученые всего мира не раз предпринимали попытки объединить все существовавшие элементы в единую концепцию. Элементы предлагали разместить в порядке возрастания атомной массы и разбить на группы по сходству химических свойств.
В 1863 году свою теорию предложил химик и музыкант Джон Александр Ньюленд, который предложил схему размещения химических элементов, схожую с той, что открыл Менделеев, но работа ученого не была принята всерьез научным сообществом из-за того, что автор увлекся поисками гармонии и связью музыки с химией.
В 1869 году Менделеев опубликовал свою схему периодической таблицы в журнале Русского химического общества и разослал извещение об открытии ведущим ученым мира. В дальнейшем химик не раз дорабатывал и улучшал схему, пока она не приобрела привычный вид.
Суть открытия Менделеева в том, что с ростом атомной массы химические свойства элементов меняются не монотонно, а периодически. После определенного количества разных по свойствам элементов, свойства начинают повторяться. Так, калий похож на натрий, фтор — на хлор, а золото схоже с серебром и медью.
В 1871 году Менделеев окончательно объединил идеи в периодический закон. Ученые предсказал открытие нескольких новых химических элементов и описал их химические свойства. В дальнейшем расчеты химика полностью подтвердились — галлий, скандий и германий полностью соответствовали тем свойствам, которые им приписал Менделеев.
В дальнейшем расчеты химика полностью подтвердились — галлий, скандий и германий полностью соответствовали тем свойствам, которые им приписал Менделеев.
Байки о Менделееве
Гравюра, на которой изображен Менделеев. Фото: ИТАР-ТАСС
Об известном ученом и его открытиях ходило немало баек. Люди в то время слабо представляли себе химию и считали, что занятия химией — это что-то вроде поедания супа из младенцев и воровства в промышленных масштабах. Поэтому деятельность Менделеева быстро обросла массой слухов и легенд.
Одна из легенд гласит, что Менделеев открыл таблицу химических элементов во сне. Случай не единственный, точно также говорил о своем открытии Август Кекуле, которому приснилась формула бензольного кольца. Однако Менделеев только смеялся над критиками. «Я над ней, может быть, двадцать лет думал, а вы говорите: сидел и вдруг … готово!», — как-то сказал ученый о своем открытии.
Другая байка приписывает Менделееву открытие водки. В 1865 году великий ученый защитил диссертацию на тему «Рассуждение о соединении спирта с водою», и это сразу дало повод для новой легенды. Современники химика посмеивались, мол ученый «неплохо творит под действием спирта, соединенного с водой», а следующие поколения уже называли Менделеева первооткрывателем водки.
Современники химика посмеивались, мол ученый «неплохо творит под действием спирта, соединенного с водой», а следующие поколения уже называли Менделеева первооткрывателем водки.
Посмеивались и над образом жизни ученого, а особенно над тем, что Менделеев оборудовал свою лабораторию в дупле огромного дуба.
Также современники подтрунивали над страстью Менделеева к чемоданам. Ученый в пору своего невольного бездействия в Симферополе вынужден был коротать время за плетением чемоданов. В дальнейшем он самостоятельно мастерил для нужд лаборатории картонные контейнеры. Несмотря на явно «любительский» характер этого увлечения, Менделеева часто называли «чемоданных дел мастером».
Открытие радия
Одна из наиболее трагичных и в то же время известных страниц в истории химии и появления новых элементов в таблице Менделеева связана с открытием радия. Новый химический элемент был открыт супругами Марией и Пьером Кюри, которые обнаружили, что отходы, остающиеся после выделения урана из урановой руды, более радиоактивны, чем чистый уран.
Поскольку о том, что такое радиоактивность, тогда еще никто не знал, то новому элементу молва быстро приписала целебные свойства и способность излечивать чуть ли не от всех известных науке болезней. Радий включили в состав пищевых продуктов, зубной пасты, кремов для лица. Богачи носили часы, циферблат которых был окрашен краской, содержащей радий. Радиоактивный элемент рекомендовали как средство для улучшения потенции и снятия стресса.
Подобное «производство» продолжалось целых двадцать лет — до 30-х годов двадцатого века, когда ученые открыли истинные свойства радиоактивности и выяснили насколько губительно влияние радиации на человеческий организм.
Мария Кюри умерла в 1934 году от лучевой болезни, вызванной долговременным воздействием радия на организм.
Небулий и короний
Фото: ИТАР-ТАСС
Таблица Менделеева не только упорядочила химические элементы в единую стройную систему, но и позволила предсказать многие открытия новых элементов. В то же время некоторые химические «элементы» были признаны несуществующими на основании того, что они не укладывались в концепцию периодического закона. Наиболее известна история с «открытием» новых элементов небулия и корония.
Наиболее известна история с «открытием» новых элементов небулия и корония.
При исследовании солнечной атмосферы астрономы обнаружили спектральные линии, которые им не удалось отождествить ни с одним из известных на земле химических элементов. Ученые предположили, что эти линии принадлежат новому элементу, который получил название короний (потому что линии были обнаружены при исследовании «короны» Солнца — внешнего слоя атмосферы звезды).
Спустя несколько лет астрономы сделали еще одно открытие, изучая спектры газовых туманностей. Обнаруженные линии, которые снова не удалось отождествить ни с чем земным, приписали другому химическому элементу — небулию.
Открытия подверглись критике, поскольку в периодической таблице Менделеева уже не оставалось места для элементов, обладающих свойствами небулия и корония. После проверки обнаружилось, что небулий является обычным земным кислородом, а короний — сильно ионизированное железо.
Отметим, что сегодня в московском Центральном доме ученых РАН торжественно присвоят имена двум химическим элементам, открытым учеными из подмосковной Дубны.
Материал создан на основе информации из открытых источников. Подготовил Василий Макагонов @vmakagonov
Урок химии в 8 классе «Классификация и свойства кислот»
________________________________НАЧАЛО ФОРМЫ___________________________
ПЛАН-КОНСПЕКТ УРОКА
__________________________________________
(Тема урока)
|
1. |
ФИО (полностью) |
Бурякова Елена Викторовна |
|
2. |
Место работы |
МБОУ Кагальницкая СОШ №1 |
|
3. |
Должность |
учитель |
|
4. |
Предмет |
химия |
|
5. |
Класс |
8 |
|
6. |
Тема и номер урока в теме |
Тема5. «Растворение. Растворы. Свойства растворов электролитов. Урок №7 «Классификация и свойства кислот». |
|
7. |
Базовый учебник |
Химия 8. О.С. Габриелян |
8. Цель урока: Сформировать представление о кислотах как классе электролитов, рассмотреть их классификацию и общие свойства кислот в свете ионных представлений.
9. Задачи:
— обучающие: совершенствовать знания учащихся о составе, физических свойствах кислот, изучить химические свойства кислот.
-развивающие: развивать мышление учащихся, умения анализировать, сравнивать, обобщать, выделять существенные признаки и свойства объектов, классифицировать факты, делать выводы, продолжить развитие умений объяснять смысл изученных понятий, применять эти понятия, устанавливать причинно-следственные связи, объяснять результаты эксперимента.
-воспитательные: формировать у учащихся умения участвовать в обсуждении, отстаивать свою точку зрения, уважая точку зрения других людей; способствовать формированию научного мировоззрения через установление причинно-следственных связей, продолжить формирование таких качеств личности, как ответственное отношение к порученному делу, умение объективно оценивать результаты своего труда.
10. Тип урока урок-исследование
11. Формы работы учащихся знакомство с содержанием модулей, ответы на вопросы, выполнение заданий, выполнения лабораторных работ, составление схем и кластера, работа с тренажёром. Схема взаимодействия: учитель – компьютер – проектор – экран – ученики.
12. Необходимое техническое оборудование мультимедийное оборудование, реактивы (пробирки, медные и цинковые опилки, оксид меди, соляная кислота, гидроксид натрия, карбонат натрия, индикаторы, нумерованные пробирки с растворами.
13. Структура и ход урока
Таблица 1.
СТРУКТУРА И ХОД УРОКА
|
№ |
Этап урока |
Название используемых ЭОР (с указанием порядкового номера из Таблицы 2) |
Деятельность учителя (с указанием действий с ЭОР, например, демонстрация) |
Деятельность ученика П – познавательная деятельность; К – коммуникативная деятельность; Р – регулятивная деятельность |
Время (в мин. |
|
1 |
2 |
3 |
5 |
6 |
7 |
|
1 |
Организационный |
Проверка готовности к уроку |
Подготовка к уроку |
1мин |
|
|
2 |
Стадия вызова |
Модуль 1(И-типа) |
Фронтальный опрос. Путём выбора активных зон ознакомит учащихся с видами классификации кислот по летучести, стабильности, основности, по степени электролитической диссоциации. Ставит цель, организует беседу, комментирует ответы учащихся, корректирует их, просит выдвинуть предположение о теме предстоящего урока. |
Ученики должны просмотреть и прослушать материал представленный в интерактивных схемах. И начать составлять в тетради кластер «Портрет кислоты». П. Воспринимают информацию. Отвечают на вопросы. Формулируют тему урока. К. Взаимодействуют с учителем во время опроса, осуществляемого во фронтальном режиме. Р. Контролируют правильность ответов обучающихся. |
3 мин |
|
3 |
Стадия осмысления |
Модуль 2(П-тип) |
Анализирует выполнение учащимися задания, корректирует, оценивает их деятельность. |
Ученику предлагается изучить классификацию кислот путем переноса формулы кислоты в ячейки с соответствующими характеристиками. П. Обучающиеся, выходя к доске заполняют пустые клетки соответствующими характеристиками. К. Озвучивают сделанный выбор, приводя аргументы. |
3 мин |
|
4 |
Изучение нового материала |
Модуль 3,4,5 (И-тип) |
Демонстрирует видеофрагмент. Формулирует задание. Задаёт проблемный вопрос. |
Ученики должны просмотреть и прослушать материал. Выполняют исследование по инструктивной карточке. Записывают свои наблюдения. Отвечают на вопросы. |
10 мин |
|
5 |
Выполнение лабораторной работы. |
Модуль 6 (П-тип) |
Анализирует выполнение учащимися задания, корректирует, оценивает их деятельность. Инструктирует учащихся, выполняющих опыты на местах. |
Обучающие выходят к доске и проводят реакции, используя модуль 6. На местах учащиеся также проводят эти же реакции, записывают уравнения и выводы в тетради. После проведения опытов обсуждают полученные результаты. |
10 мин |
|
6 |
Закрепление изученного материала. |
Модуль 7(И-тип) |
Учитель демонстрирует интерактивную схему «Химические свойства кислот» |
Учащиеся комментируют эту схему и записывают её в тетрадь. |
5 мин |
|
7 |
Выполнение учащимися контрольного задания (продуктивного уровня) |
Модуль 8( К-тип) |
Побуждает к высказыванию своего мнения. Отмечает степень вовлеченности обучающихся в работу на уроке. Организует проверку выполнения задания, взаимопроверку. Анализируют ответы учащихся, оценивает их деятельность |
П. Знакомятся с содержанием ЭУМ. Выполняют задание, отвечая на вопросы. К. Участвуют в обсуждении содержания модуля. Учатся анализировать предложенный материал и формулировать собственное мнение. Р. Контролируют правильность и полноту ответов. По мере необходимости дополняют ответы. |
10 мин |
|
8 |
Домашнее задание |
Модуль 9 (П-тип) |
Формулирует задание, комментируя его по необходимости. |
Воспринимают информацию, фиксируют задание. |
3 мин |
Приложение к плану-конспекту урока
__________________________________________
(Тема урока)
Таблица 2.
ПЕРЕЧЕНЬ ИСПОЛЬЗУЕМЫХ НА ДАННОМ УРОКЕ ЭОР
|
№ |
Название ресурса |
Тип, вид ресурса |
Форма предъявления информации (иллюстрация, презентация, видеофрагменты, тест, модель и т.д.) |
|
1 |
http://fcior.edu.ru/card/9472/sostav-i-klassifikaciya-kislot.html |
Тип: И |
Модуль состоит из одного кадра, на котором представлена интерактивная схема, представляющая классификацию кислот. В том числе, ученику предлагается путём выбора активных зон ознакомиться с видами классификации кислот по летучести, стабильности, основности, по степени электролитической диссоциации. |
|
2 |
http://fcior.edu.ru/card/9265/trenazher-klassifikaciya-kislot.html |
Тип: П |
Модуль содержит формулы кислот и таблицу с некоторыми их характеристиками. Ученику предлагается изучить классификацию кислот путем переноса формулы кислоты в ячейки с соответствующими характеристиками. |
|
3 |
Действие кислот на индикаторы http://www.school-collection.edu.ru). |
Тип:И |
Видеофрагмнет |
|
4 |
Взаимодействие кислот с металлами http://www. |
Тип:И |
Видеофрагмент |
|
5 |
Взаимодействие кислот с солями http://www.school-collection.edu.ru). |
Тип: И |
Видеофрагмент |
|
6 |
Лабораторная работа “Типичные свойства кислот” http://fcior.edu.ru/card/14696/laboratornaya-rabota-tipichnye-svoystva-kislot.html |
Тип: П |
Модуль включает необходимые модели оборудования и веществ, для проведения реакций характерных для кислот, инструкцию, указывающую порядок действий. |
|
7 |
http://fcior.edu.ru/card/9001/himicheskie-svoystva-kislot.html |
Тип: И |
Состоит из одного кадра, на котором представлена интерактивная схема, содержащая видеофрагменты, уравнения реакций. В том числе, ученику предлагается, с помощью интерактивной схемы ознакомиться с химическими свойствами кислот путём выбора активных зон в интерактивной схеме. |
|
8 |
http://fcior. |
Тип: К |
Модуль включает 10 тестовых вопросов. В том числе ученик должен соотнести основность предлагаемых кислот с их химическими формулами, а так же распределить кислоты по силе переносом формул в соответствующие зоны. |
|
9 |
http://fcior.edu.ru/card/7944/trenazher-himicheskie-svoystva-kislot.html |
Тип: П |
Модуль состоит из таблицы с формулами и названиями кислот и поля ввода. Ученику предлагается дописать уравнения реакций взаимодействия разбавленных растворов кислот с металлами и расставить коэффициенты путем ввода с клавиатуры необходимых формул и коэффициентов. |
________________________________КОНЕЦ ФОРМЫ___________________________
Основы таблицы Менделеева: 8-й класс Science-Brogden
Приборная панель
8-я наука
Основы периодической таблицы
Перейти к содержанию
Приборная панель
-
Авторизоваться
-
Овал-95
Приборная панель
-
значок-календарь
Календарь
-
значок входящей почты
Входящие
-
История
-
Помощь
Закрывать
-
Мой Dashboard
- 8-е отделение науки
- Страниц
- Периодическая таблица Основы
- Главная
- Модули
- Задания
- Страницы
- Файлы
- Программа
- Тесты
- Сотрудничество
- Google Диск
открытых учебников | Сиявула
Математика
Наука
-
- Читать онлайн
-
Учебники
-
Английский
-
Класс 7A
-
Марка 7Б
-
Оценка 7 (вместе A и B)
-
-
Африкаанс
-
Граад 7А
-
Граад 7Б
-
Граад 7 (A en B saam)
-
-
-
Пособия для учителя
-
- Читать онлайн
-
Учебники
-
Английский
-
класс 8A
-
класс 8Б
-
Оценка 8 (вместе A и B)
-
-
Африкаанс
-
Граад 8А
-
Граад 8Б
-
Граад 8 (A en B saam)
-
-
-
Пособия для учителя
-
- Читать онлайн
-
Учебники
-
Английский
-
Марка 9А
-
Марка 9Б
-
9 класс (A и B вместе)
-
-
Африкаанс
-
Граад 9А
-
Граад 9Б
-
Граад 9 (A en B saam)
-
-
-
Пособия для учителя
-
- Читать онлайн
-
Учебники
-
Английский
-
Класс 4A
-
Класс 4Б
-
Класс 4 (вместе A и B)
-
-
Африкаанс
-
Граад 4А
-
Граад 4Б
-
Граад 4 (A en B saam)
-
-
-
Пособия для учителя
-
- Читать онлайн
-
Учебники
-
Английский
-
Марка 5А
-
Марка 5Б
-
Оценка 5 (вместе A и B)
-
-
Африкаанс
-
Граад 5А
-
Граад 5Б
-
Граад 5 (A en B saam)
-
-
-
Пособия для учителя
-
- Читать онлайн
-
Учебники
-
Английский
-
Класс 6A
-
класс 6Б
-
6 класс (A и B вместе)
-
-
Африкаанс
-
Граад 6А
-
Граад 6Б
-
Граад 6 (A en B saam)
-
-
-
Пособия для учителя
Наша книга лицензионная
Эти книги не просто бесплатные, они также имеют открытую лицензию! Один и тот же контент, но разные версии (брендированные или нет) имеют разные лицензии, как объяснено:
CC-BY-ND (фирменные версии)
Вам разрешается и поощряется свободное копирование этих версий. Вы можете делать ксерокопии, распечатывать и распространять их сколько угодно раз. Вы можете скачать их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете адаптировать или изменять эти версии учебников, их содержание или обложки каким-либо образом, поскольку они содержат соответствующие бренды Siyavula, спонсорские логотипы и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Вы можете делать ксерокопии, распечатывать и распространять их сколько угодно раз. Вы можете скачать их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете адаптировать или изменять эти версии учебников, их содержание или обложки каким-либо образом, поскольку они содержат соответствующие бренды Siyavula, спонсорские логотипы и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Узнайте больше о спонсорстве и партнерстве с другими, которые сделали возможным выпуск каждого из открытых учебников.
CC-BY (версии без марочного обозначения)
Эти небрендированные версии одного и того же контента доступны для вас, чтобы вы могли делиться ими, адаптировать, трансформировать, модифицировать или дополнять их любым способом, с единственным требованием — дать соответствующую оценку Siyavula. Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
планов уроков | Химия средней школы
Используйте наши удаленные уроки, заполненные видео экспериментов, анимацией и вопросами, чтобы создать виртуальные уроки, которые студенты могут проводить дома! Посмотреть задания →
Стандарты NGSS и CCELA
Сортировать по ГОСТ
Найдите уроки, которые соответствуют вашим государственным стандартам.
Студенты знакомятся с идеей, что материя состоит из атомов и молекул, которые притягиваются друг к другу и находятся в постоянном движении. Учащиеся исследуют притяжение и движение атомов и молекул, экспериментируя и наблюдая за нагреванием и охлаждением твердого тела, жидкости и газа.
- Молекулы вещества
- Движущиеся молекулы
- Взлеты и падения термометров
- Движущиеся молекулы в твердом теле
- Воздух, это действительно так
Студенты помогают разрабатывать эксперименты, чтобы проверить, влияет ли температура воды на скорость испарения и влияет ли температура водяного пара на скорость конденсации.Студенты также более подробно рассматривают молекулу воды, чтобы объяснить изменения состояния воды.
- Тепло, температура и проводимость
- Изменение состояния — испарение
- Изменение состояния — конденсация
- Изменение состояния — остановка
- Изменение состояния — плавление
Учащиеся экспериментируют с объектами, имеющими одинаковый объем, но разную массу, и другими объектами, которые имеют одинаковую массу, но разный объем, чтобы развить смысл плотности.Студенты также экспериментируют с плотностью в контексте погружения и плавания и смотрят на вещества на молекулярном уровне, чтобы понять, почему одно вещество более или менее плотно, чем другое.
- Что такое плотность?
- Определение объема — метод вытеснения воды
- Плотность воды
- Плотность — погружение и всплытие твердых тел
- Плотность — слив и поплавок для жидкостей
- Температура и плотность
Учащиеся более глубоко изучают структуру атома и играют в игру, чтобы лучше понять взаимосвязь между протонами, нейтронами, электронами и уровнями энергии в атомах и их положением в периодической таблице.Студенты также изучат ковалентные и ионные связи.
- Протоны, нейтроны и электроны
- Периодическая таблица
- Периодическая таблица и модели уровней энергии
- Уровни энергии, электроны и ковалентные связи
- Уровни энергии, электроны и ионные связи
- Представляют связь с точечными диаграммами Льюиса
Студенты исследуют полярность молекулы воды и разрабатывают тесты для сравнения воды с менее полярными жидкостями по скорости испарения, поверхностному натяжению и способности растворять определенные вещества.Студенты также обнаруживают, что растворение применимо к твердым телам, жидкостям и газам.
- Вода — полярная молекула
- Поверхностное натяжение
- Почему вода растворяет соль?
- Почему вода растворяет сахар?
- Использование растворения для идентификации неизвестного
- Влияет ли температура на растворение?
- Могут ли жидкости растворяться в воде?
- Могут ли газы растворяться в воде?
- Изменения температуры при растворении
Студенты изучают концепцию, согласно которой химические реакции включают разрыв связей между атомами в реагентах, а также перегруппировку и повторное связывание этих атомов с образованием продуктов.Учащиеся исследуют реакции, которые вызывают образование газа, образование осадка и изменение цвета. Студенты также изучают эндотермические и экзотермические реакции и занимаются инженерными работами по разработке устройства с использованием экзотермической реакции.
- Что такое химическая реакция?
- Контроль количества продуктов в химической реакции
- Образует осадок
- Температура и скорость химической реакции
- Катализатор и скорость реакции
- Использование химического изменения для идентификации неизвестного
- Изменения энергии в химических реакциях
- pH и изменение цвета
- Нейтрализующие кислоты и основания
- Двуокись углерода может сделать раствор кислым
Уроки на основе проекта
- Химические реакции и инженерное проектирование
- Природные ресурсы и синтетические материалы
| Физические науки | |
|---|---|
| Академические стандарты штата Индиана 2016 | Мероприятия, лабораторные работы или моделирование |
| 8.PS.1 Создание моделей для представления расположения и зарядов субатомных частиц в атоме (протонов, нейтронов и электронов). Поймите значение того, что 118 известных в настоящее время химических элементов объединяются, чтобы сформировать всю материю во Вселенной. | Руководство по ядерной настенной диаграмме |
| 8.PS.2 Проиллюстрируйте схемами (рисунками), как атомы расположены в простых молекулах. Различайте атомы, элементы, молекулы и соединения. | Постройте молекулу PhET |
| 8.PS.3 Используйте основную информацию, предоставленную для элемента (атомная масса, атомный номер, символ и название), чтобы определить его место в Периодической таблице. Используйте эту информацию, чтобы найти количество протонов, нейтронов и электронов в атоме. | Атом PBS |
| 8.PS.4 Определите организационные модели (радиус, атомный номер, атомная масса, свойства и радиоактивность) в Периодической таблице. | Происхождение и анатомия периодической таблицы |
| 8.PS.5 Изучить свойство плотности и предоставить доказательства того, что такие свойства, как плотность, не меняются для чистого вещества. | Масса и объем |
| 8.PS.6 Сравните и сопоставьте физическое изменение с химическим изменением. Проанализируйте свойства веществ до и после взаимодействия веществ, чтобы определить, произошла ли химическая реакция. | Химические и физические изменения |
| 8.PS.7 Химические уравнения баланса, чтобы показать, как общее количество атомов каждого элемента не изменяется в химических реакциях, и в результате масса всегда сохраняется в замкнутой системе.(Закон сохранения массы) | Реагенты, продукты и остатки PhET |
| Наука о Земле и космосе | |
| Академические стандарты штата Индиана 2016 | Мероприятия, лабораторные работы и моделирование |
| 8.ESS.1 Исследование глобальной температуры за последнее столетие. Сравните и сопоставьте данные относительно теории изменения климата. | |
| 8.ESS.2 Создайте диаграмму или проведите моделирование, чтобы описать, как вода циркулирует в земной коре, атмосфере и океанах. Объясните, как круговорот воды управляется энергией солнца и силой тяжести. | |
| 8.ESS.3 Изучить, как потребление человеком ограниченных природных ресурсов (например, угля, нефти, природного газа и чистой воды) и деятельность человека повлияли на окружающую среду (т.е. световое и шумовое загрязнение). | Гигиена окружающей среды Национальная медицинская библиотека |
| Науки о жизни | |
| Академические стандарты штата Индиана 2016 | Мероприятия, лабораторные работы или моделирование |
| 8.LS.1 Сравните и сопоставьте передачу генетической информации при половом и бесполом размножении. Исследуйте организмы, которые подвергаются этим двум типам воспроизводства. | Репродукция |
| 8.LS.2 Продемонстрируйте, как генетическая информация передается от родителей к потомству через хромосомы в процессе мейоза. Объяснять, как живые существа растут и развиваются. | Живые клетки мейоза |
| 8.LS.3 Создайте и проанализируйте квадраты Пеннета, чтобы вычислить вероятность передачи определенных черт от родителей к потомству с использованием различных моделей наследования. | |
| 8.LS.4 Различать и приводить примеры приобретенных и генетически наследуемых признаков. | |
| 8.LS.5 Объясните, как факторы, влияющие на естественный отбор (конкуренция, генетические вариации, изменения окружающей среды и перепроизводство), увеличивают или уменьшают способность вида к выживанию и воспроизводству. | Естественный отбор |
| 8.LS.6 Создайте модели, чтобы показать, как структуры хроматина, хромосом, хроматид, генов, аллелей и молекул дезоксирибонуклеиновой кислоты (ДНК) связаны и отличаются друг от друга. | ДНК, гены, хромосомы |
| 8.LS.7 Распознавание организмов классифицируется по таксономическим уровням в соответствии с общими характеристиками. Объясните, как научное название организма соотносится с этими общими характеристиками. | Биологический уголок |
| 8.LS.8 Исследуйте и прогнозируйте эволюционные отношения между видами, глядя на анатомические различия между современными организмами и ископаемыми организмами. | |
| 8.LS.9 Изучите черты особей внутри вида, которые могут дать им преимущество или недостаток для выживания и воспроизводства в стабильной или изменяющейся среде. | Научный канал |
| 8.LS.10 Собирать и синтезировать информацию о том, как люди изменяют организмы генетически с помощью различных методов. | |
| 8.LS.11 Изучите, как вирусы и бактерии влияют на человеческий организм. | Что вас действительно беспокоит? Атака гриппа! Вирус вторгается в ваше тело |
| Инженерное дело | |
| Академические стандарты штата Индиана 2016 | Мероприятия, лабораторные работы или моделирование |
| 6-8.E.1. Определите критерии и ограничения проекта, чтобы гарантировать успешное решение, принимая во внимание соответствующие научные принципы и потенциальные воздействия на людей и окружающую среду, которые могут ограничить возможные решения. | Обучение и инженерия |
| 6-8.E.2 Оцените конкурирующие проектные решения, используя систематический процесс, чтобы определить, насколько хорошо они соответствуют критериям и ограничениям проблемы. | Цикл инженерного проектирования |
| 6-8.E.3 Анализируйте данные исследований, чтобы определить сходства и различия между несколькими проектными решениями, чтобы определить лучшие характеристики каждого из них, которые можно объединить в новое решение, чтобы лучше соответствовать критериям успеха. | НАСА Давайте спроектируем |
| 6-8.E.4 Разработайте прототип для создания данных для повторных исследований и измените предлагаемый объект, инструмент или процесс таким образом, чтобы можно было достичь оптимального дизайна. | Design Squad PBS |
Научные стандарты учебных ресурсов
Ваш браузер не поддерживает джаваскрипт! Этот сайт использует JavaScript, но полностью работает без него.Стандарты обучения (SOL) и тестирования
Новости и объявления
Научно-учебные планы (SIP)
Учебные планы по науке загружаются ежедневно в #GoOpenVA, и к ним можно легко получить доступ через группу Science VDOE. Найдите планы уроков для каждого уровня обучения и дисциплины, которые были созданы для вовлечения учащихся в формирование концептуального понимания естественных наук с использованием Научных стандартов обучения 2018 г.
Новости науки
Заинтересованы в получении обновлений от научно-учебной группы VDOE? Пожалуйста, зарегистрируйтесь, чтобы участвовать в этих двухнедельных обновлениях.
Отложены сроки обучения по научным стандартам 2018 г. (Записка суперинтенданта 131-20-Это документ Word. (Word))
Признавая, что 2020-2021 учебный год поставит новые задачи для школьных подразделений и Департамента образования Вирджинии (VDOE) в ответ на пандемию COVID-19, VDOE откладывает сроки внедрения научных стандартов обучения на 2018 год на один год, как описано ниже.
2020-2021 учебный год — переход между научными стандартами обучения
2010 г. и научными стандартами обучения 2018 г.
- Школьные подразделения включают новые стандарты в письменные учебные программы местных учебных заведений для включения в преподаваемые учебные программы в течение 2021-2022 учебного года.
2021-2022 учебный год — год пешеходного перехода
- 2010 Научные стандарты обучения и 2018 Научные стандарты обучения включены в письменные и преподаваемые учебные программы.
- Весной 2022 г. Стандарты обучения оценивают научные стандарты обучения 2010 г. и включают элементы полевых тестов, измеряющие научные стандарты обучения 2018 г. .
2022-2023 учебный год — год полного внедрения
- Письменные и преподаваемые учебные программы отражают научные стандарты обучения 2018 г.
- Весна 2023 г.Стандарты обучения оцениваются по научным стандартам обучения 2018 г.
Школьные подразделения должны продолжить свою работу до:
- пересмотреть и привести учебные программы в соответствие с пересмотренными стандартами;
- проанализировать текущие справочные материалы и сопоставить их с пересмотренными стандартами;
- при необходимости разрабатывать новые материалы; и
- обеспечивает повышение квалификации учителей.
Учебник, утвержденный VDOE Science
17 сентября 2020 года Банк Англии штата Вирджиния утвердил предлагаемый список учебников по естественным наукам в поддержку инструкций по научным стандартам обучения 2018 года.Все книги прислал
издатели прошли два разных уровня рецензирования, чтобы убедиться, что они точно отражают содержание, изложенное в научных стандартах обучения 2018 г., и чтобы книги отражали
богатое разнообразие студентов и сообществ Вирджинии.
Научные стандарты обучения 2018 года отражают интеграцию научных и инженерных практик для поддержки концептуального понимания научных тем.Инструкция этих
Стандарты призваны позволить учащимся увидеть себя способными к науке, участвуя в практических занятиях и экспериментах, которые соответствуют ожиданиям, изложенным в Основах учебной программы по естествознанию на 2018 год. Список учебников по естествознанию можно найти на сайте Science Textbook Review.
Содержание страницы
Научные стандарты обучения — приняты в 2018 г.
Научные стандарты обучения — приняты в 2010 г.
«Стандарты обучения» и «Структура учебной программы» включают в себя научные дисциплины, которые учителя в Вирджинии будут преподавать, а студенты — изучать.
Реализация и сроки
- Меморандум суперинтенданта № 031-10 — Начиная с 2012-2013 гг., Тесты на соответствие стандартам обучения (SOL) будут оценивать полное выполнение программы Science SOL 2010 года. В рамках подготовки к внедрению новых оценок, измеряющих SOL 2010, были разработаны новые планы научных испытаний.
- Записка суперинтенданта № 258-11 — Внедрение научных стандартов оценки успеваемости 2010 г.
- Записка суперинтенданта № 213-12 — Новые научные тесты на основе научных стандартов обучения 2010 г.
Ресурсы для инструкций
Руководство по научному содержанию
Руководящие принципы по содержанию находятся в процессе разработки для всех курсов «Биология II» и «Науки о Земле II».Целью руководящих принципов по содержанию является информирование инструкций и обеспечение равноправного охвата содержания во всем Содружестве. Это руководящие принципы, и подразделения могут адаптировать их для удовлетворения потребностей учащихся в своих школах. В настоящее время доступны руководства для областей, указанных ниже, и они будут добавляться по мере разработки рекомендаций, прошедших экспертную оценку. Отправляйте отзывы об этих рекомендациях по адресу [email protected].
Ресурсы для оценки
- Практические задания SOL в TestNav 8 — Приведите примеры нового содержания и повышенной строгости 2010 Science SOL
- Выпущенные тесты SOL и наборы элементов — тесты и наборы элементов, отражающие содержание и навыки, включенные в тесты SOL в Вирджинии.
- Тестовые манипуляторы
Студентам разрешается использовать Периодическую таблицу элементов на тесте EOC по химии. Эти тестовые манипуляторы включены в ваши защищенные посылки для тестирования бумаги / карандаша. Для онлайн-тестирования на панели инструментов TestNav ™ доступны следующие манипуляторы. Обязательно обратитесь к руководствам по бумаге / карандашу и / или руководствам по онлайн-тестированию для получения дополнительной информации о тестовых манипуляторах. - Альтернативы диссекции животных, Руководство BOE (PDF) — Совет по образованию устанавливает правила, которые должны быть реализованы местными школьными подразделениями в отношении альтернативных методов диссекции.
- Моделирование вскрытия через Интернет
- Рассечение лягушки
- Вскрытие плода свиньи
- Моделирование вскрытия через Интернет
Предыдущая версия SOL
Наука SOL: 2003
Наука SOL: 1995
Начало страницы
Chem4Kids.com: Элементы и периодическая таблица
Теперь мы подошли к сути и сути того, как работает Вселенная. Вы знаете, что у обычного атома есть несколько протонов и нейтронов в ядре и несколько электронов, перемещающихся по орбиталям. Когда эти части начинают объединяться в определенные числа, вы можете строить атомы с узнаваемыми чертами. Если у вас есть восемь протонов, нейтронов и электронов, у вас будет атом кислорода (O). Если у вас есть семь протонов, нейтронов и электронов, у вас будет атом азота (N).Атомы каждого элемента уникальны, хотя все они состоят из одинаковых субатомных частей.
Помните, что «атом» — это общий термин. Все состоит из атомов. Термин «элемент» используется для описания атомов с определенными характеристиками. Известно почти 120 элементов. Например, вы состоите из миллиардов миллиардов атомов, но вы, вероятно, не найдете в своем теле более 40 элементов (типов атомов). Химики выяснили, что более 95% вашего тела состоит из водорода (H), углерода (C), азота, кислорода, фосфора (P) и кальция (Ca).
Насколько нам известно, существует ограниченное количество основных элементов. К настоящему моменту мы обнаружили или создали около 120. Ученые только что подтвердили создание элемента 117 в 2014 году. Хотя есть еще элементы, которые предстоит открыть, основные элементы остаются прежними. Атомы железа (Fe), обнаруженные на Земле, идентичны атомам железа, обнаруженным на метеоритах. Атомы железа в красной почве Марса тоже такие же.
С помощью инструментов, которые вы изучаете здесь, вы можете исследовать и понимать Вселенную.Вы никогда не перестанете открывать новые реакции и соединения, но элементы останутся прежними.
С момента запуска сайта нас спрашивают: «Зачем начинать с 18?» Правила для первых восемнадцати элементов очень просты:
(1) Электроны хорошо вписываются в три орбитали. Помните, что орбитали — это места, где вы обычно найдете электроны, когда они вращаются вокруг ядра.
(2) Эти восемнадцать элементов составляют большую часть материи Вселенной.
(3) Намного легче запомнить факты о 18 элементах, чем о более чем 100 элементах.
По мере того, как мы проходим мимо первых восемнадцати элементов, вы можете начать узнавать о переходных элементах в четвертом периоде (строка) периодической таблицы. Электронные конфигурации переходных металлов немного отличаются от первых восемнадцати. Убедитесь, что вы понимаете основы электронных орбиталей, прежде чем переходить к этой строке.
В космосе обнаружены молекулы в форме футбольного мяча (видео НАСА)
19 TAC Глава 112, подраздел B
19 TAC Глава 112, подраздел B
Глава 112.Техас: основные знания и навыки для науки,
Подраздел B. Средняя школа
Законодательные органы: положения данного подраздела
B выдан в соответствии с Кодексом об образовании Техаса, 7.102 (c) (4) и 28.002, если не указано иное.
принято к сведению.
112,17. Внедрение основных знаний Техаса
и навыки для естественных наук, средняя школа, принято в 2017 г.
Положения
§§112.18-112.20 настоящего подраздела реализуются школьными округами.
начиная с 2018-2019 учебного года.
Источник: Положения настоящего §112.17 приняты в качестве
действует с 4 августа 2009 г., 34 TexReg 5063; с поправками, вступающими в силу 24 августа,
2010 г., 35 TexReg 7230; с изменениями, вступающими в силу 27 августа 2018 г., 42 TexReg 5052.
112,18. Естественные науки, 6 класс, принято в 2017 г.
(а) Введение.
(1) Естественные науки 6 класса имеют междисциплинарный характер;
однако большая часть содержания сосредоточена на физических науках. Национальные стандарты
по естественным наукам организованы в виде многоуровневых блоков, таких как 5-8 классы, а не
индивидуальные уровни обучения.Чтобы соответствовать формату уровня обучения, используемому в
Техас, различные национальные стандарты относятся к 6, 7 и 8 классам.
Повторяющиеся темы широко используются в науках, математике и технологиях. Эти
идеи выходят за рамки дисциплинарных границ и включают в себя изменение и постоянство,
паттерны, циклы, системы, модели и масштаб.
Пряди для 6-го класса включают следующее.
(A) Научные исследования и рассуждения.
(i) Развивать глубокие познания в науке и естественных
мира, студенты должны познакомиться с различными способами научного
запрос, правила доказательства, способы формулирования вопросов, способы предложения
объяснения и различные способы, которыми ученые изучают мир природы и
предлагать объяснения, основанные на доказательствах, полученных в результате их работы.
(ii) Научные исследования проводятся для различных
причины. Все исследования требуют исследовательского вопроса, внимательных наблюдений,
сбор данных и анализ данных для выявления закономерностей, которые будут
объясните результаты. Описательные исследования используются для изучения новых
такие явления, как обследование организмов или измерение абиотических
компоненты в данной среде обитания. Описательная статистика включает частоту, диапазон,
среднее, медиана и мода.Гипотеза не требуется в описательной
изучение. С другой стороны, когда условия можно контролировать, чтобы
сосредоточиться на одной переменной, экспериментальный план исследования используется для определения
причинно-следственная связь. Студенты должны пройти оба типа исследований и
понимать, что разные вопросы научных исследований требуют разных
исследовательские проекты.
(iii) Научные исследования используются для изучения
Натуральный мир.Студенты должны понимать, что некоторые типы вопросов могут
получить ответы на вопросы исследований, а также построенных методов, моделей и выводов.
результаты этих исследований меняются по мере появления новых наблюдений. Модели
объекты и события являются инструментами для понимания мира природы и могут показать
как работают системы. Модели имеют ограничения и основаны на новых открытиях.
постоянно модифицируется, чтобы более точно отражать мир природы.
(B) Материя и энергия.
(i) Вещество может быть классифицировано как элементы, соединения или
смеси. Учащиеся уже имели опыт работы со смесями в 5 классе, поэтому
В 6 классе основное внимание уделяется развитию понимания элементов и соединений.
Важно, чтобы учащиеся узнали различия между элементами и
соединения, основанные на наблюдениях, описании физических свойств и
химические реакции. Элементы представлены химическими символами, а
соединения представлены химическими формулами.Последующие классы узнают
о различиях на молекулярном и атомном уровне.
(ii) Элементы классифицируются как металлы, неметаллы и
металлоиды в зависимости от их физических свойств. Элементы делятся на
три группы в Периодической таблице. Каждое различное вещество обычно имеет
разная плотность, поэтому плотность может использоваться в качестве идентифицирующего свойства.
Следовательно, расчет плотности помогает классифицировать вещества.
(iii) Энергетические ресурсы доступны на возобновляемых или
невозобновляемая основа.Понимание происхождения и использования этих ресурсов
позволяет принимать обоснованные решения. Студенты должны учитывать этические / социальные
проблемы, связанные с природными энергетическими ресурсами Земли, глядя на
преимущества и недостатки их длительного использования.
(C) Сила, движение и энергия. Энергия возникает в двух
типы, потенциальные и кинетические, и могут принимать несколько форм. Тепловая энергия может быть
переносится за счет теплопроводности, конвекции или излучения. Его также можно изменить
из одной формы в другую.Студенты исследуют взаимосвязь между
сила и движение с использованием различных средств, включая вычисления и
измерения.
(D) Земля и космос. В центре внимания этой пряди
знакомство с земными процессами. Студенты должны развить понимание Земли
как часть нашей солнечной системы. Темы включают организацию нашего солнечного
система, роль гравитации и освоение космоса.
(E) Организмы и окружающая среда. Студенты получат
понимание самых широких таксономических классификаций организмов и того, как
характеристики определяют их классификацию.Другие важные темы
развитые в этой цепи, включают взаимозависимость между организмами и
их среды и уровни организации в экосистеме.
(2) Наука, как определено Национальной академией
Наука — это «использование доказательств для построения проверяемых объяснений и
предсказания природных явлений, а также знания, полученные благодаря
этот процесс ». Это огромное количество изменяющихся и возрастающих знаний
описывается физическими, математическими и концептуальными моделями.Студенты должны
знайте, что некоторые вопросы выходят за рамки науки, потому что они касаются
с явлениями, которые не поддаются научной проверке.
(3) Научные гипотезы предварительные и проверяемые.
утверждения, которые должны поддерживаться или не поддерживаться
данные наблюдений. Гипотезы устойчивой объяснительной силы, которые были
Проверенные в самых разных условиях становятся теориями. Научные теории
основаны на природных и физических явлениях и могут быть проверены
несколько независимых исследователей.Студенты должны знать, что научные
теории, в отличие от гипотез, хорошо обоснованы и очень надежны, но они
могут по-прежнему изменяться по мере развития новой информации и технологий.
Студенты должны уметь различать научные решения
методы и этические / социальные решения, предполагающие применение научных
Информация.
(4) Заявления, содержащие слово «включая»
справочный контент, который необходимо освоить, а те, которые содержат фразу
«такие как» предназначены в качестве возможных иллюстративных примеров.
(b) Знания и навыки.
(1) Научные исследования и рассуждения. Студент,
не менее 40% учебного времени проводит лабораторные и полевые исследования
соблюдение процедур безопасности, экологически приемлемых и этических
практики. Ожидается:
(A) продемонстрировать безопасные методы работы в лаборатории и
полевые исследования, как указано в стандартах безопасности, утвержденных Техасским агентством по образованию;
и
(B) практиковать надлежащее использование и сохранение
ресурсы, включая утилизацию, повторное использование или переработку материалов.
(2) Научные исследования и рассуждения. Студент
использует научные методы при лабораторных и полевых исследованиях. В
ожидается:
(A) спланировать и реализовать сравнительный и описательный
расследования, делая наблюдения, задавая четко определенные вопросы и используя
соответствующее оборудование и технологии;
(B) разработать и провести экспериментальные исследования
делать наблюдения, задавать четко определенные вопросы, формулировать проверяемые
гипотезы и использование соответствующего оборудования и технологий;
(C) собирать и записывать данные с помощью Международного
Система единиц (СИ) и качественные средства, такие как маркированные чертежи, письменность,
и графические органайзеры;
(D) построить таблицы и графики, используя повторные испытания
и средства для организации данных и выявления закономерностей; и
(E) анализировать данные для формулирования разумных объяснений,
сообщать достоверные выводы, подкрепленные данными, и прогнозировать тенденции.
(3) Научные исследования и рассуждения. Студент
использует критическое мышление, научные рассуждения и решение проблем, чтобы
информированные решения и знает вклад соответствующих ученых. В
ожидается:
(A) анализировать, оценивать и критиковать научные
объяснения с использованием эмпирических данных, логических рассуждений и экспериментальных
и тестирование с наблюдением, чтобы стимулировать критическое мышление учащегося;
(B) использовать модели для представления аспектов естественного
мир, такой как модель слоев Земли;
(C) идентифицируют преимущества и ограничения моделей, таких
как размер, масштаб, свойства и материалы; и
(D) относятся к влиянию исследований на научную мысль.
и общество, включая историю науки и вклад ученых
что касается содержания.
(4) Научные исследования и рассуждения. Студент
знает, как использовать различные инструменты и оборудование для обеспечения безопасности для проведения научных исследований
расследование. Ожидается:
(A) используйте соответствующие инструменты, в том числе
журналы / записные книжки, мензурки, чашки Петри, измерительные стержни, градуированные цилиндры,
плиты, пробирки, весы, микроскопы, термометры, калькуляторы,
компьютеры, таймеры и другое необходимое оборудование для сбора, записи,
и анализировать информацию; и
(B) использовать средства профилактической безопасности, в том числе:
защитные очки, фартуки и перчатки, защищающие от брызг химикатов, и будьте готовы к чрезвычайным ситуациям.
защитное снаряжение, в том числе средство для мытья глаз / лица, противопожарное одеяло и огонь
огнетушитель.
(5) Материя и энергия. Студент знает различия
между элементами и соединениями. Ожидается:
(A) знать, что элемент — это чистое вещество
представлен химическим символом и что соединение является чистым веществом
представлен химической формулой;
(B) признают, что ограниченное число из многих известных
элементы составляют большую часть твердой Земли, живого вещества, океанов,
и атмосфера; и
(C) определить образование нового вещества с помощью
свидетельство возможного химического изменения, такого как производство газа, изменение
по температуре, образованию осадка или изменению цвета.
(6) Материя и энергия. Студент знает, что материя
физические свойства, которые можно использовать для классификации. Студент
ожидается:
(A) сравнить металлы, неметаллы и металлоиды, используя
физические свойства, такие как блеск, проводимость или пластичность;
(B) вычислить плотность для идентификации неизвестного вещества;
и
(C) испытание физических свойств минералов, в том числе
твердость, цвет, блеск и штрих.
(7) Материя и энергия. Студент знает, что некоторые из земных
энергоресурсы доступны почти на постоянной основе, в то время как другие могут быть
возобновляется в течение относительно короткого периода времени. Некоторые энергоресурсы, когда-то
истощены, практически невозобновляемы. Студент ожидается
исследуйте и обсудите преимущества и недостатки
использования угля, нефти, природного газа, атомной энергии, биомассы, ветра, гидроэнергии,
геотермальные и солнечные ресурсы.
(8) Сила, движение и энергия. Студент знает силу и
движение связаны с потенциальной и кинетической энергией. Ожидается:
(A) сравнить и сопоставить потенциальную и кинетическую энергию;
(B) идентифицировать и описывать изменения положения,
направление и скорость объекта под действием неуравновешенных сил;
(C) вычислить среднюю скорость, используя измерения расстояния и времени;
(D) измеряет и отображает изменения в движении; и
(E) изучить, как наклонные плоскости могут использоваться для
изменить количество силы для перемещения объекта.
(9) Сила, движение и энергия. Студент знает, что
Закон сохранения энергии гласит, что энергия не может быть ни создана, ни
уничтожен, он просто меняет форму. Ожидается:
(A) исследует методы передачи тепловой энергии,
включая проводимость, конвекцию и излучение;
(B) проверить с помощью исследований, что тепловая энергия
движется по предсказуемой схеме от более теплого к более холодному, пока все вещества
достичь такой же температуры, как тает кубик льда; и
(C) демонстрируют преобразования энергии, такие как энергия
в фонарике батарея переходит с химической энергии на электрическую, чтобы
Световая энергия.
(10) Земля и космос. Студент понимает
структура Земли, цикл горных пород и тектоника плит. Студент
ожидается:
(A) построить модель, чтобы проиллюстрировать композиционные и
механические слои Земли, включая внутреннее ядро, внешнее ядро, мантию,
кора, астеносфера и литосфера;
(B) классифицирует породы как метаморфические, магматические или
осадочные по процессам их образования;
(C) идентифицируют основные тектонические плиты, включая
Евразийский, африканский, индо-австралийский, тихоокеанский, североамериканский и южный
Американец; и
(D) описывает, как тектоника плит вызывает основные
геологические события, такие как образование бассейнов океана, землетрясения, вулканические
извержения и горообразование.
(11) Земля и космос. Студент понимает
организация нашей солнечной системы и отношения между различными телами
которые составляют его. Ожидается:
(A) описывают физические свойства, расположение и
движения Солнца, планет, лун, метеоров, астероидов и комет;
(B) поймите, что гравитация — это сила, которая управляет
движение нашей солнечной системы; и
(C) описать историю и будущее космоса
геологоразведочные работы, включая типы оборудования и транспорта, необходимые для
космическое путешествие.
(12) Организмы и окружающая среда. Студент знает все
организмы подразделяются на области и царства. Организмы в этих
таксономические группы имеют схожие характеристики, которые позволяют им взаимодействовать с
живые и неживые части их экосистемы. Ожидается:
(A) понимает, что все организмы состоят из одного
или более ячеек;
(B) признают, что наличие ядра является ключевым
фактор, используемый для определения того, является ли клетка прокариотической или эукариотической;
(C) признают, что самый широкий таксономический
классификация живых организмов делится на признанные в настоящее время
домены;
(D) определяет основные характеристики организмов,
включая прокариотические или эукариотические, одноклеточные или многоклеточные, автотрофные
или гетеротрофные, и способ воспроизводства, которые дополнительно классифицируют их в
признанные в настоящее время королевства;
(E) описывает биотические и абиотические части экосистемы
в каких организмах взаимодействуют; и
(F) диаграмма уровней организации внутри
экосистема, включая организм, популяцию, сообщество и экосистему.
Источник: Положения настоящего §112.18 приняты в качестве
действует с 4 августа 2009 г., 34 TexReg 5063; с поправками, вступающими в силу 27 августа,
2018, 42 TexReg 5052.
112,19. Естественные науки, 7 класс, принято в 2017 г.
(а) Введение.
(1) Естественные науки 7 класса имеют междисциплинарный характер;
тем не менее, большая часть контента сосредоточена на организмах и окружающей среде.
Национальные стандарты в науке организованы в виде многоуровневых блоков, таких как
5-8 классы, а не отдельные классы.Чтобы следить за оценкой
формат уровней, используемый в Техасе, различные национальные стандарты можно найти среди
6, 7 и 8 классы. Повторяющиеся темы широко распространены в науках, математике,
и технологии. Эти идеи выходят за рамки дисциплинарных ограничений и включают:
изменение и постоянство, закономерности, циклы, системы, модели и масштаб.
Пряди для класса 7 включают следующее.
(A) Научное исследование и рассуждения.
(i) Развивать глубокие познания в науке и естественных
мира, студенты должны познакомиться с различными способами научного
запрос, правила доказательства, способы формулирования вопросов, способы предложения
объяснения и различные способы, которыми ученые изучают мир природы и
предлагать объяснения, основанные на доказательствах, полученных в результате их работы.
(ii) Научные исследования проводятся для различных
причины. Все исследования требуют исследовательского вопроса, внимательных наблюдений,
сбор данных и анализ данных для выявления закономерностей, которые будут
объясните результаты. Описательные исследования используются для изучения новых
такие явления, как обследование организмов или измерение абиотических
компоненты в данной среде обитания. Описательная статистика включает частоту, диапазон,
среднее, медиана и мода.Гипотеза не требуется в описательной
изучение. С другой стороны, когда условия можно контролировать, чтобы
сосредоточиться на одной переменной, экспериментальный план исследования используется для определения
причинно-следственная связь. Студенты должны пройти оба типа исследований и
понимать, что разные вопросы научных исследований требуют разных
исследовательские проекты.
(iii) Научные исследования используются для изучения
Натуральный мир.Студенты должны понимать, что некоторые типы вопросов могут
получить ответы на вопросы исследований, а также построенных методов, моделей и выводов.
результаты этих исследований меняются по мере появления новых наблюдений. Модели
объекты и события являются инструментами для понимания мира природы и могут показать
как работают системы. Модели имеют ограничения и основаны на новых открытиях.
постоянно модифицируется, чтобы более точно отражать мир природы.
(B) Материя и энергия.Материя и энергия сохраняются
во всех живых системах. Лучистая энергия Солнца движет большую часть потока
энергии во всех живых системах за счет процесса фотосинтеза в
организмы, описанные как продуценты. Таким образом, большинство потребителей зависят от производителей.
удовлетворить их потребности в энергии. Последующие классы узнают о
различия на молекулярном и атомном уровне.
(C) Сила, движение и энергия. Сила, движение и
энергия наблюдается в живых системах и окружающей среде по-разному.Взаимодействие между мышечной и скелетной системами позволяет организму применять
силы и трансформируют энергию как внутренне, так и внешне. Сила и движение
может также описать направление и рост проростков, тургорное давление и
геотропизм. Катастрофические явления погодных систем, такие как ураганы, наводнения,
и торнадо могут формировать и реструктурировать окружающую среду за счет силы и
движение очевидно в них. Выветривание, эрозия и осаждение происходят в
окружающей среде из-за сил тяжести, ветра, льда и воды.
(D) Земля и космос. Земные и космические явления могут быть
наблюдается в различных условиях. Как природные явления, так и деятельность человека могут
воздействие на земные системы. Есть характеристики Земли и отношения к
объекты в нашей солнечной системе, которые позволяют жизни существовать.
(E) Организмы и окружающая среда.
(i) Учащиеся поймут взаимосвязь между живыми
организмы и их среда. Разные среды поддерживают разные
живые организмы, адаптированные к этому региону Земли.Организмы живые
системы, которые поддерживают устойчивое состояние с этой средой и баланс которых
может нарушаться внутренними и внешними раздражителями. К внешним раздражителям относятся:
деятельность человека или окружающая среда. Успешные организмы могут восстановить
балансировать с помощью различных процессов, таких как механизм обратной связи. Экологический
преемственность можно увидеть в широком или малом масштабе.
(ii) Студенты узнают, что все организмы получают энергию, избавляются от нее.
отходов, расти и воспроизводиться.Как при половом, так и при бесполом размножении,
черты характера передаются следующему поколению. Эти черты содержатся в
генетический материал, который находится в генах в хромосоме от родителя.
Изменения в чертах иногда происходят в популяции на протяжении многих поколений. Один из
изменения могут происходить в процессе естественного отбора.
Студенты расширяют свое понимание структур живых систем с
предыдущий акцент на внешних структурах для понимания внутренних
структуры и функции в живых существах.
(iii) Все живые организмы состоят из более мелких единиц
называется ячейками. Все клетки используют энергию, избавляются от отходов и содержат генетические
материал. Студенты сравнят клетки растений и животных и поймут
внутренние структуры внутри них, которые позволяют им получать энергию, избавляться от отходов,
растут и размножаются по-разному. Клетки могут организовываться в ткани, ткани
в органы и органы в системы органов. Студенты изучат основные
функции систем человеческого тела, такие как способность покровной системы
для защиты от инфекций, травм и ультрафиолетового (УФ) излучения; регулировать
температура тела; и удалить отходы.
(2) Наука, как определено Национальной академией
Наук, это «использование свидетельств для построения проверяемых объяснений и
предсказания природных явлений, а также знания, полученные благодаря
этот процесс ». Это огромное количество изменяющихся и возрастающих знаний
описывается физическими, математическими и концептуальными моделями. Студенты должны
знайте, что некоторые вопросы выходят за рамки науки, потому что они касаются
с явлениями, которые не поддаются научной проверке.
(3) Научные гипотезы предварительные и проверяемые.
утверждения, которые должны поддерживаться или не поддерживаться
данные наблюдений. Гипотезы устойчивой объяснительной силы, которые были
Проверенные в самых разных условиях становятся теориями. Научные теории
основаны на природных и физических явлениях и могут быть проверены
несколько независимых исследователей. Студенты должны знать, что научные
теории, в отличие от гипотез, хорошо обоснованы и очень надежны, но они
все еще могут быть изменены, поскольку новая информация и технологии
развитый.Студенты должны уметь различать научные
методы принятия решений и этические / социальные решения, которые включают
применение научной информации.
(4) Заявления, содержащие слово «включая»
справочный контент, который необходимо освоить, а те, которые содержат фразу
«такие как» предназначены в качестве возможных иллюстративных примеров.
(b) Знания и навыки.
(1) Научные исследования и рассуждения.Студент,
не менее 40% учебного времени проводит лабораторные и полевые
расследования в соответствии с процедурами безопасности и экологически приемлемыми и
этические практики. Ожидается:
(A) продемонстрировать безопасные методы работы в лаборатории и
полевые исследования, как указано в утвержденной Техасским образовательным агентством безопасности
стандарты; и
(B) практиковать надлежащее использование и сохранение
ресурсы, включая утилизацию, повторное использование или переработку материалов.
(2) Научные исследования и рассуждения. Студент
использует научные методы при лабораторных и полевых исследованиях. В
ожидается:
(A) спланировать и реализовать сравнительный и описательный
расследования, делая наблюдения, задавая четко определенные вопросы и используя
соответствующее оборудование и технологии;
(B) разработать и провести экспериментальные исследования
делать наблюдения, задавать четко определенные вопросы, формулировать проверяемые
гипотезы и использование соответствующего оборудования и технологий;
(C) собирать и записывать данные с помощью Международного
Система единиц (СИ) и качественные средства, такие как маркированные чертежи, письменность,
и графические органайзеры;
(D) построить таблицы и графики, используя повторные испытания
и средства для организации данных и выявления закономерностей; и
(E) анализировать данные для формулирования разумных объяснений,
сообщать достоверные выводы, подкрепленные данными, и прогнозировать тенденции.
(3) Научные исследования и рассуждения. Студент
использует критическое мышление, научные рассуждения и решение проблем, чтобы
информированные решения и знает вклад соответствующих ученых. В
ожидается:
(A) анализировать, оценивать и критиковать научные
объяснения с использованием эмпирических данных, логических рассуждений и экспериментальных
и тестирование с наблюдением, чтобы стимулировать критическое мышление учащегося;
(B) использовать модели для представления аспектов естественного
мир, такой как системы человеческого тела и клетки растений и животных;
(C) идентифицируют преимущества и ограничения моделей, таких
как размер, масштаб, свойства и материалы; и
(D) относятся к влиянию исследований на научную мысль.
и общество, включая историю науки и вклад ученых
что касается содержания.
(4) Научные исследования и рассуждения. Студент знает
как использовать различные инструменты и оборудование для обеспечения безопасности для проведения научных исследований.
Ожидается:
(A) использовать соответствующие инструменты, в том числе науки о жизни
модели, ручные линзы, стереоскопы, микроскопы, мензурки, чашки Петри,
предметные стекла для микроскопов, градуированные цилиндры, пробирки, измерительные стержни, метрические
линейки, метрические рулетки, приборы для измерения времени, плиты, весы,
термометры, калькуляторы, наборы для проверки воды, компьютеры, температура и pH
зонды, сети для сбора насекомых, ловушки для насекомых, глобусы, цифровые фотоаппараты,
журналы / записные книжки и другое необходимое оборудование для сбора, записи и
анализировать информацию; и
(B) использовать средства профилактической безопасности, в том числе:
защитные очки, фартуки и перчатки, защищающие от брызг химикатов, и будьте готовы к чрезвычайным ситуациям.
защитное снаряжение, в том числе средство для мытья глаз / лица, противопожарное одеяло и огонь
огнетушитель.
(5) Материя и энергия. Студент знает, что взаимодействия
происходят между материей и энергией. Ожидается:
(A) признают, что лучистая энергия Солнца
превращается в химическую энергию в процессе фотосинтеза; и
(B) диаграмма потока энергии через живые системы,
включая пищевые цепи, пищевые сети и энергетические пирамиды.
(6) Материя и энергия. Студент знает, что дело
физические и химические свойства и могут претерпевать физические и химические изменения.Студент ожидается
различать физические и химические изменения в
иметь значение.
(7) Сила, движение и энергия. Студент знает, что
существует взаимосвязь между силой, движением и энергией. Студент
ожидается:
(A) иллюстрируют преобразование энергии в
организм, например, переход от химической энергии к тепловой энергии; и
(B) демонстрируют и иллюстрируют силы, влияющие на
движение в организмах, например, всходы всходов, тургорное давление,
геотропизм и кровообращение.
(8) Земля и космос. Студент знает, что природные явления
и деятельность человека может повлиять на системы Земли. Ожидается:
(A) предсказывать и описывать, как катастрофические события
как наводнения, ураганы или торнадо воздействуют на экосистемы;
(B) анализировать эффекты выветривания, эрозии и
осаждение на окружающую среду в экорегионах Техаса; и
(C) моделирование воздействия человеческой деятельности на грунтовые воды
и поверхностные воды в водоразделе.
(9) Земля и космос. Студент знает компоненты нашего
Солнечная система. Ожидается:
(A) анализирует характеристики объектов в нашей солнечной
система, которая позволяет жизни существовать, например, близость Солнца, присутствие
вода и состав атмосферы; и
(B) идентифицируют помещения с учетом
характеристики нашей Солнечной системы, позволившие осуществить пилотируемые исследования космоса.
(10) Организмы и окружающая среда.Студент знает, что
существует связь между организмами и окружающей средой. Студент
ожидается:
(A) наблюдать и описывать, как разные среды,
включая микробытовые среды на школьных дворах и в биомах, поддерживают различные сорта
организмов;
(B) описывают, как биоразнообразие способствует
устойчивость экосистемы; и
(C) наблюдать, записывать и описывать роль
экологическая сукцессия, например, в микрогороде сада с сорняками.
(11) Организмы и окружающая среда. Студент знает, что
популяции и виды демонстрируют изменчивость и наследуют многие из своих уникальных
черты характера через постепенные процессы на протяжении многих поколений. Ожидается студент
Кому:
(A) исследует организмы или их структуры, такие как
насекомые или листья и использовать дихотомические ключи для идентификации;
(B) объясняют вариации внутри популяции или вида
сравнение внешних характеристик, поведения или физиологии организмов, которые улучшают
их выживание, такое как миграция, спячка или хранение пищи в луковице;
и
(C) идентифицируют некоторые изменения генетических признаков,
происходили на протяжении нескольких поколений в результате естественного отбора и селективного отбора.
разведение, например, галапагосский средний наземный вьюрок ( Geospiza fortis ) или
домашние животные и гибридные растения.
(12) Организмы и окружающая среда. Студент знает, что
живые системы на всех уровнях организации демонстрируют дополнительные
характер структуры и функции. Ожидается:
(A) исследует и объясняет, как внутренние структуры
У организмов есть адаптации, которые позволяют выполнять определенные функции, такие как жабры у рыб,
полые кости у птиц или ксилема у растений;
(B) определить основные функции систем
человеческий организм, в том числе кровеносный, респираторный, скелетный, мышечный,
пищеварительный, выделительный, репродуктивный, покровный, нервный и эндокринный
системы;
(C) распознает уровни организации на заводах и
животные, включая клетки, ткани, органы, системы органов и организмы;
(D) различают структуру и функцию в
Органеллы клеток растений и животных, включая клеточную мембрану, клеточную стенку, ядро,
цитоплазма, митохондрия, хлоропласт и вакуоль;
(E) сравнить функции клеточных органелл с
функции системы органов; и
(F) распознают компоненты теории клетки.
(13) Организмы и окружающая среда. Студент знает, что
живой организм должен уметь поддерживать равновесие в стабильных внутренних условиях
в ответ на внешние и внутренние раздражители. Ожидается:
(A) исследовать, как организмы реагируют на внешние
раздражители, обнаруживаемые в окружающей среде, такие как фототропизм и борьба или бегство; и
(B) описывает и связывает реакции организмов, которые могут
результат внутренних раздражителей, таких как увядание растений и лихорадка или рвота
животные, которые позволяют им сохранять равновесие.
(14) Организмы и окружающая среда. Студент знает, что
размножение — это характеристика живых организмов, и инструкции
поскольку черты регулируются генетическим материалом. Ожидается:
(A) определяет наследственность как передачу генетических
инструкции от одного поколения к следующему поколению;
(B) сравнить результаты однообразного или разнообразного потомства
от бесполого или полового размножения; и
(C) признают, что унаследованные черты индивидуума
регулируется генетическим материалом, обнаруженным в генах в хромосомах в
ядро.
Источник: Положения настоящего §112.19 приняты в качестве
действует с 4 августа 2009 г., 34 TexReg 5063; с поправками, вступающими в силу 27 августа,
2018, 42 TexReg 5052.
112.20. Естественные науки, 8 класс, принято в 2017 г.
(а) Введение.
(1) Естественные науки в 8 классе имеют междисциплинарный характер;
однако большая часть контента посвящена науке о Земле и космосе. Национальный
стандарты по естественным наукам организованы в виде многоуровневых блоков, таких как 5-8 классы
а не отдельные классы.Чтобы следовать формату уровня обучения
используются в Техасе, различные национальные стандарты находятся среди классов 6, 7 и
8. Повторяющиеся темы широко используются в науках, математике и технологиях.
Эти идеи выходят за рамки дисциплинарных ограничений и включают изменение и постоянство,
паттерны, циклы, системы, модели и масштаб.
Пряди для 8-го класса включают следующее.
(A) Научное исследование и рассуждения.
(i) Развивать глубокие познания в науке и естественных
мира, студенты должны познакомиться с различными способами научного
запрос, правила доказательства, способы формулирования вопросов, способы предложения
объяснения и различные способы, которыми ученые изучают мир природы и
предлагать объяснения, основанные на доказательствах, полученных в результате их работы.
(ii) Научные исследования проводятся для различных
причины. Все исследования требуют исследовательского вопроса, внимательных наблюдений,
сбор данных и анализ данных для выявления закономерностей, которые будут
объясните результаты. Описательные исследования используются для изучения новых
такие явления, как обследование организмов или измерение абиотических
компоненты в данной среде обитания. Описательная статистика включает частоту, диапазон,
среднее, медиана и мода.Гипотеза не требуется в описательной
изучение. С другой стороны, когда условия можно контролировать, чтобы
сосредоточиться на одной переменной, экспериментальный план исследования используется для определения
причинно-следственная связь. Студенты должны пройти оба типа исследований и
понимать, что разные вопросы научных исследований требуют разных
исследовательские проекты.
(iii) Научные исследования используются для изучения
Натуральный мир.Студенты должны понимать, что некоторые типы вопросов могут
получить ответы на вопросы исследований, а также построенных методов, моделей и выводов.
результаты этих исследований меняются по мере появления новых наблюдений. Модели
объекты и события являются инструментами для понимания мира природы и могут показать, как
системы работают. Модели имеют ограничения и основаны на новых открытиях.
постоянно модифицируется, чтобы более точно отражать мир природы.
(B) Материя и энергия.Студенты осознают это
состоит из атомов. Студенты изучают информацию о Периодической таблице, чтобы
признать, что элементы сгруппированы в семейства. Кроме того, студенты
понять основную концепцию сохранения массы. Лабораторная деятельность позволит
студенты, чтобы продемонстрировать доказательства химических реакций. Они будут использовать химические
формулы для идентификации веществ.
(C) Сила, движение и энергия. Студенты экспериментируют с
отношения между силами и движением посредством изучения трех Ньютоновских
законы.Студенты узнают, как эти силы связаны с геологическими процессами и
астрономические явления. Кроме того, студенты признают, что эти законы
проявляется в повседневных предметах и деятельности. Математика используется для расчета
скорость с использованием измерений расстояния и времени.
(D) Земля и космос. Студенты определяют роль
природные явления в изменении земных систем. Циклы внутри Солнца, Земли и Луны
системы изучаются по мере того, как студенты узнают о сезонах, приливах и лунных фазах.Студенты узнают, что звезды и галактики являются частью Вселенной. Кроме того,
студенты используют данные для исследования научных теорий происхождения
Вселенная. Студенты продемонстрируют, как объекты Земли меняются со временем, на пластинах.
тектоника. Они будут интерпретировать особенности земли и эрозии на топографических картах.
и спутниковые снимки. Студенты узнают, как взаимодействуют солнечные, погодные и
океанские системы вызывают изменения в погодных условиях и климате.
(E) Организмы и окружающая среда.В исследованиях жизни
системы, студенты исследуют взаимозависимость между этими системами. Студенты
описать, как биотические и абиотические факторы влияют на количество организмов и
популяции, присутствующие в экосистеме. Кроме того, студенты изучают, как
организмы и их популяции реагируют на краткосрочные и долгосрочные экологические
изменения, в том числе вызванные деятельностью человека.
(2) Наука, как определено Национальной академией
Наук, это «использование свидетельств для построения проверяемых объяснений и
предсказания природных явлений, а также знания, полученные благодаря
этот процесс.»Это огромное количество изменяющихся и возрастающих знаний
описывается физическими, математическими и концептуальными моделями. Студенты должны
знайте, что некоторые вопросы выходят за рамки науки, потому что они касаются
с явлениями, которые не поддаются научной проверке.
(3) Научные гипотезы предварительные и проверяемые.
утверждения, которые должны поддерживаться или не поддерживаться
данные наблюдений. Гипотезы устойчивой объяснительной силы, которые были
Проверенные в самых разных условиях становятся теориями.Научные теории
основаны на природных и физических явлениях и могут быть проверены
несколько независимых исследователей. Студенты должны знать, что научные
теории, в отличие от гипотез, хорошо обоснованы и очень надежны, но они
все еще могут быть изменены, поскольку новая информация и технологии
развитый. Студенты должны уметь различать научные
методы принятия решений и этические / социальные решения, которые включают
применение научной информации.
(4) Заявления, содержащие слово «включая»
справочный контент, который необходимо освоить, а те, которые содержат фразу
«такие как» предназначены в качестве возможных иллюстративных примеров.
(b) Знания и навыки.
(1) Научные исследования и рассуждения. Студент,
не менее 40% учебного времени проводит лабораторные и полевые
расследования в соответствии с процедурами безопасности и экологически приемлемыми и
этические практики.Ожидается:
(A) продемонстрировать безопасные методы работы в лаборатории и
полевые исследования, как указано в утвержденной Техасским образовательным агентством безопасности
стандарты; и
(B) практиковать надлежащее использование и сохранение
ресурсы, включая утилизацию, повторное использование или переработку материалов.
(2) Научные исследования и рассуждения. Студент
использует научные методы при лабораторных и полевых исследованиях. В
ожидается:
(A) спланировать и реализовать сравнительный и описательный
расследования, делая наблюдения, задавая четко определенные вопросы и используя
соответствующее оборудование и технологии;
(B) разработать и провести экспериментальные исследования
делать наблюдения, задавать четко определенные вопросы, формулировать проверяемые
гипотезы и использование соответствующего оборудования и технологий;
(C) собирать и записывать данные с помощью Международного
Система единиц (СИ) и качественные средства, такие как маркированные чертежи, письменность,
и графические органайзеры;
(D) построить таблицы и графики, используя повторные испытания
и средства для организации данных и выявления закономерностей; и
(E) анализировать данные для формулирования разумных объяснений,
сообщать достоверные выводы, подкрепленные данными, и прогнозировать тенденции.
(3) Научные исследования и рассуждения. Студент
использует критическое мышление, научные рассуждения и решение проблем, чтобы
информированные решения и знает вклад соответствующих ученых. В
ожидается:
(A) анализировать, оценивать и критиковать научные
объяснения с использованием эмпирических данных, логических рассуждений и экспериментальных
и тестирование с наблюдением, чтобы стимулировать критическое мышление учащегося;
(B) использовать модели для представления аспектов естественного
мир, такой как атом, молекула, пространство или геологический объект;
(C) идентифицируют преимущества и ограничения моделей, таких
как размер, масштаб, свойства и материалы; и
(D) относятся к влиянию исследований на научную мысль.
и общество, включая историю науки и вклад ученых
что касается содержания.
(4) Научные исследования и рассуждения. Студент
знает, как использовать различные инструменты и оборудование для обеспечения безопасности для проведения научных исследований
расследование. Ожидается:
(A) используйте соответствующие инструменты, включая лабораторные журналы / записные книжки,
мензурки, измерительные стержни, градуированные цилиндры, анемометры, психрометры, горячие
тарелки, пробирки, пружинные весы, весы, микроскопы, термометры,
калькуляторы, компьютеры, спектроскопы, приборы для измерения времени и другое необходимое
оборудование для сбора, записи и анализа информации; и
(B) использовать средства профилактической безопасности, в том числе:
защитные очки, фартуки и перчатки, защищающие от брызг химикатов, и будьте готовы к чрезвычайным ситуациям.
защитное снаряжение, в том числе средство для мытья глаз / лица, противопожарное одеяло и огонь
огнетушитель.
(5) Материя и энергия. Студент знает, что дело в том,
состоит из атомов и обладает химическими и физическими свойствами. Студент
ожидается:
(A) описывают структуру атомов, включая
массы, электрические заряды и расположение протонов и нейтронов в
ядро и электроны в электронном облаке;
(B) идентифицируют, что протоны определяют
тождественные и валентные электроны определяют его химические свойства, в том числе
реактивность;
(C) интерпретировать расположение Периодической таблицы,
включая группы и точки, чтобы объяснить, как свойства используются для классификации
элементы;
(D) признают, что химические формулы используются для
идентифицировать вещества и определять количество атомов каждого элемента в
химические формулы, содержащие индексы; и
(E) исследовать, как доказательства химических реакций
указывает на то, что образуются новые вещества с другими свойствами и как это
относится к закону сохранения массы.
(6) Сила, движение и энергия. Студент знает, что
существует связь между силой, движением и энергией. Студент
ожидается:
(A) продемонстрируйте и рассчитайте, как неуравновешенные силы
изменить скорость или направление движения объекта;
(B) различают скорость, скорость и
ускорение; и
(C) исследовать и описывать приложения Ньютона
три закона движения, такие как автомобильные удерживающие устройства, спортивные мероприятия,
аттракционы, тектоническая активность Земли и запуски ракет.
(7) Земля и космос. Студент знает эффекты
в результате циклических движений Солнца, Земли и Луны. Студент
ожидается:
(A) и проиллюстрируйте, как наклоненная Земля вращается.
на своей оси, вызывая день и ночь, и вращается вокруг Солнца, вызывая
смены сезонов;
(B) продемонстрировать и спрогнозировать последовательность событий в
лунный цикл; и
(C) соотносят положения Луны и Солнца с их
влияние на океанские приливы.
(8) Земля и космос. Студент знает характеристики
Вселенная. Ожидается:
(A) описывает компоненты вселенной, в том числе
звезды, туманности и галактики, и используйте такие модели, как модель Герцшпрунга-Рассела.
схема для классификации;
(B) признать, что Солнце — звезда среднего размера
расположен в спиральном рукаве галактики Млечный Путь и что Солнце много
в тысячи раз ближе к Земле, чем любая другая звезда;
(C) определить, как разные длины волн
электромагнитный спектр, такой как видимый свет и радиоволны, используются для получения
информация о компонентах вселенной; и
(D) исследование того, как научные данные используются в качестве доказательства
разработать научные теории для описания происхождения Вселенной.
(9) Земля и космос. Студент знает, что природные явления
может повлиять на земные системы. Ожидается:
(A) описать историческое развитие свидетельств
что поддерживает теорию тектоники плит;
(B) связывает тектонику плит с формированием земной коры.
Особенности; и
(C) интерпретировать топографические карты и спутниковые снимки для
определить особенности земли и эрозии и спрогнозировать, как эти особенности могут быть
видоизменился под воздействием погодных условий.
(10) Земля и космос. Студент знает, что климатическая
существует взаимодействие между Землей, океаном и погодными системами. Студент
ожидается:
(A) признают, что Солнце обеспечивает энергию, которая
вызывает конвекцию в атмосфере и океанах, вызывая ветры;
(B) определить, как глобальные модели атмосферного
движение влияет на местную погоду, используя погодные карты, которые показывают высокие и низкие
давления и фронты; и
(C) определить роль океанов в формировании
погодные системы, такие как ураганы.
(11) Организмы и окружающая среда. Студент знает, что
взаимозависимость между живыми системами и окружающей средой, и человечество
деятельность может повлиять на эти системы. Ожидается:
(A) исследует, как организмы и популяции в
экосистема зависит от биотических факторов, таких как пищевые и абиотические, и может конкурировать за них.
такие факторы, как количество света, воды, диапазон температур или почва
состав;
(B) изучить, как краткосрочные и долгосрочные экологические
изменения влияют на организмы и признаки в последующих популяциях; и
(C) признают зависимость человека от океанических систем и
объясните, как деятельность человека, такая как сток, искусственные рифы или использование
ресурсы изменили эти системы.
Источник: Положения настоящего §112.20 приняты в
действует с 4 августа 2009 г., 34 TexReg 5063; с поправками, вступающими в силу 27 августа,
2018, 42 TexReg 5052.
Для
дополнительная информация, электронная почта [email protected].
.
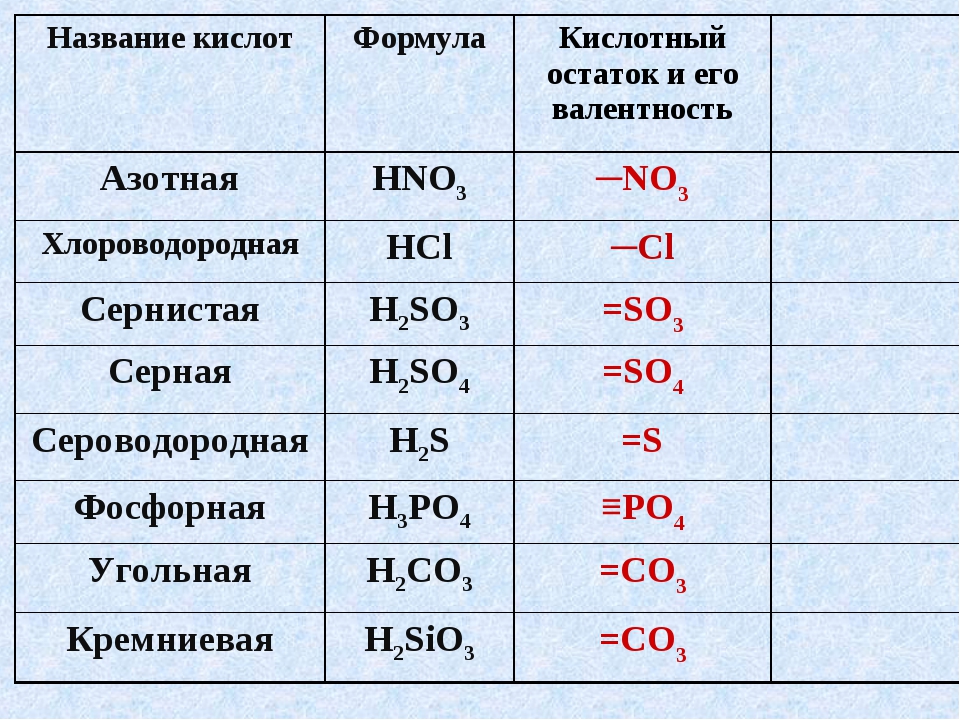

 )
)

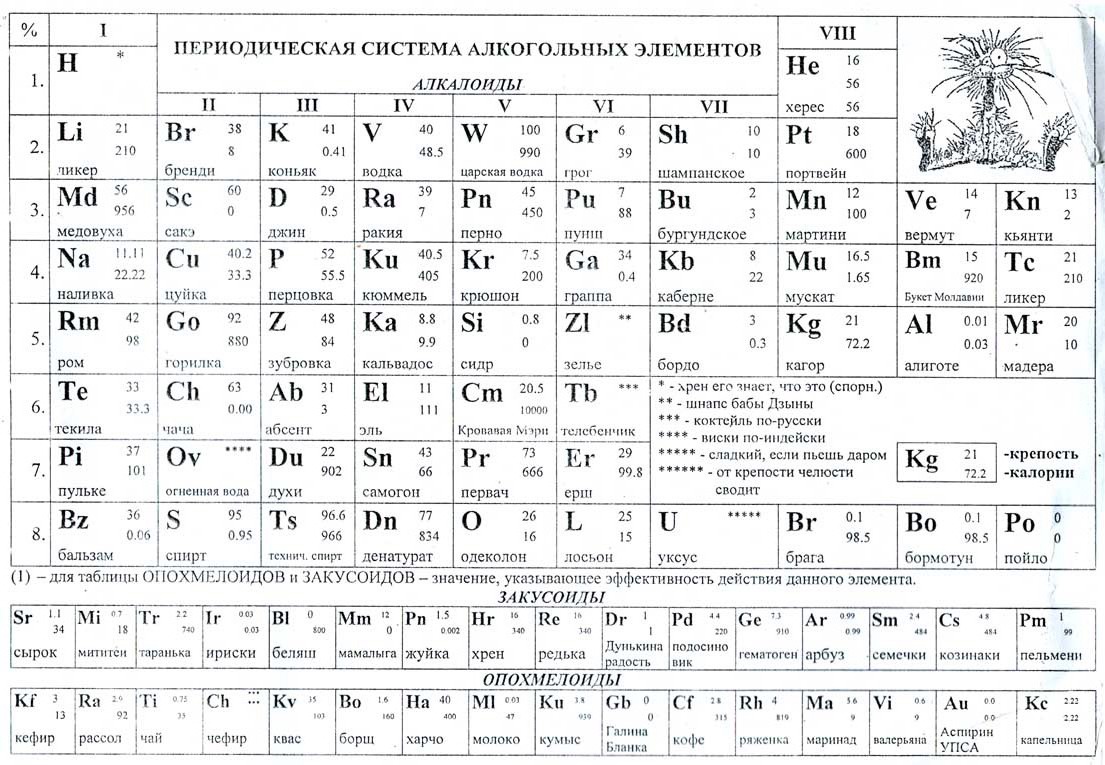

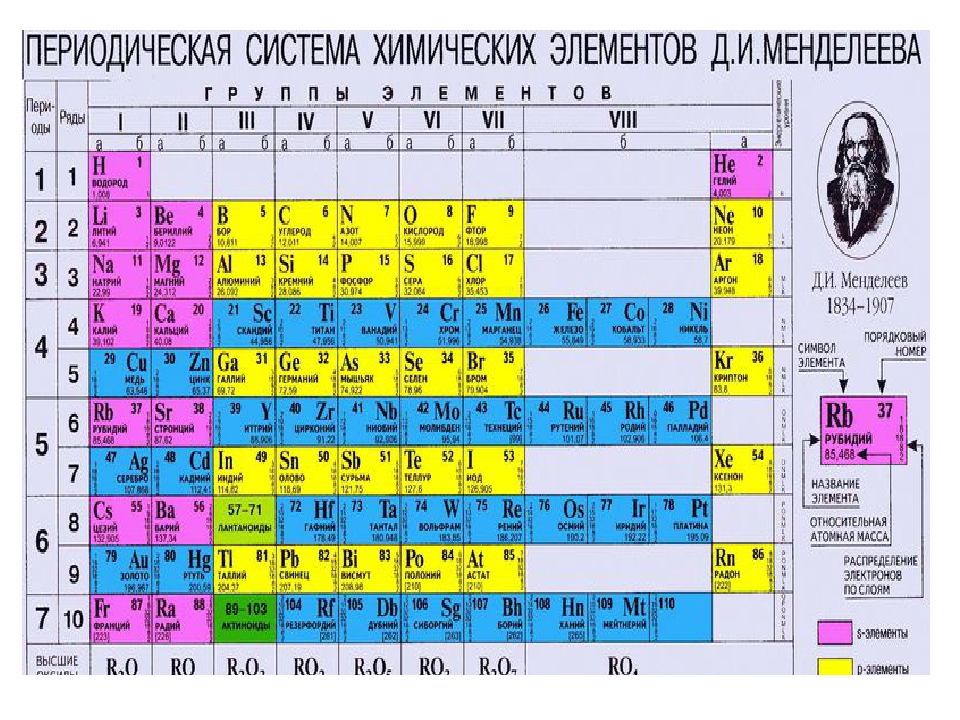
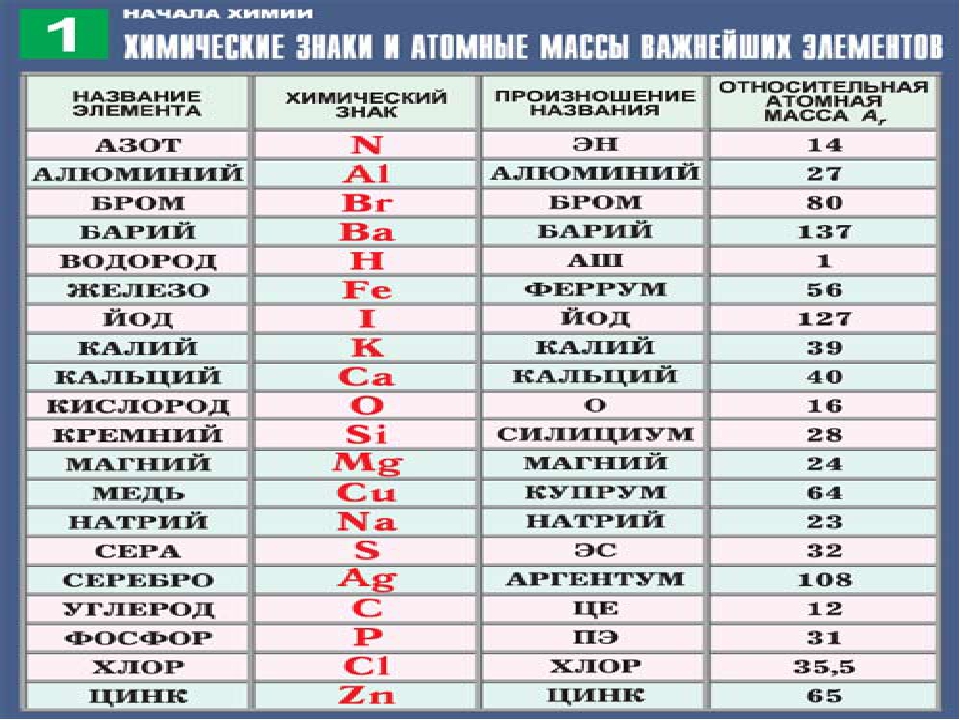
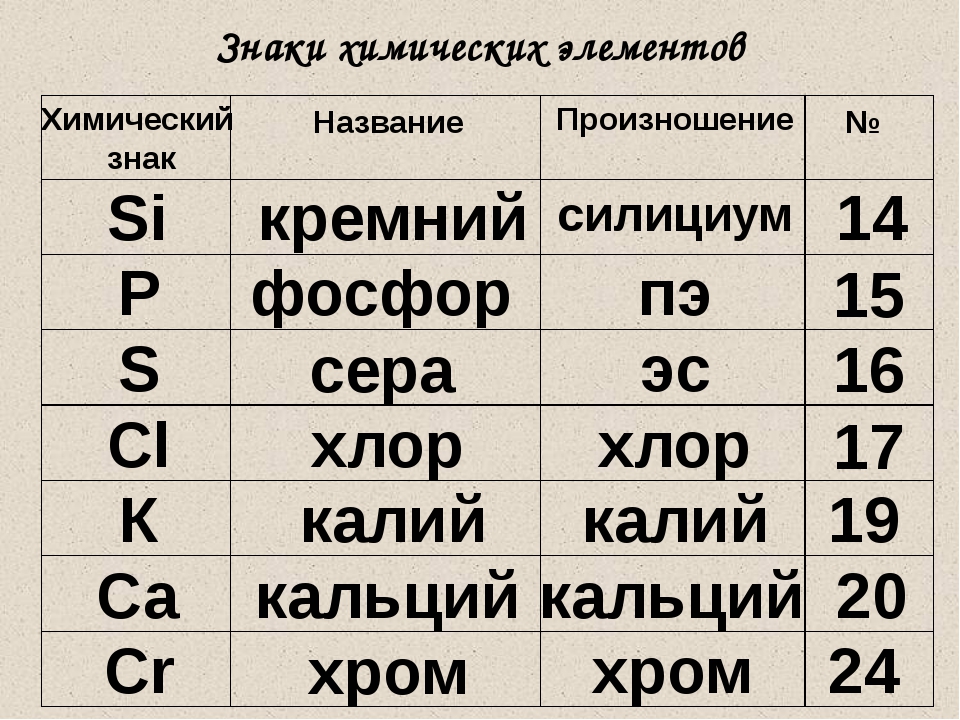 school-collection.edu.ru).
school-collection.edu.ru).  Ученику предлагается провести реакции, на примере соляной кислоты с металлами различной активности, с основными оксидами, с основаниями, с солями, сфотографировать результаты, записать результаты наблюдений и выводы в лабораторный журнал путём ввода с клавиатуры, а уравнения реакций в молекулярном, полном ионном и кратком ионном виде составить в редакторе уравнений.
Ученику предлагается провести реакции, на примере соляной кислоты с металлами различной активности, с основными оксидами, с основаниями, с солями, сфотографировать результаты, записать результаты наблюдений и выводы в лабораторный журнал путём ввода с клавиатуры, а уравнения реакций в молекулярном, полном ионном и кратком ионном виде составить в редакторе уравнений. edu.ru/card/10839/testy-po-teme-kisloty-v-svete-teorii-elektroliticheskoy-dissociacii.html
edu.ru/card/10839/testy-po-teme-kisloty-v-svete-teorii-elektroliticheskoy-dissociacii.html