Целлюлоза. Искусственные полимеры. Видеоурок. Химия 10 Класс
На уроке будет рассмотрена тема: «Целлюлоза. Искусственные полимеры». Самым распространенным полимером углевода глюкозы является целлюлоза. На этом уроке вы сможете познакомиться с ней подробнее. Узнаете о её физических и химических свойствах. Также изучите получение искусственных полимеров, например ацетатного шёлка, нитроваты, бездымного пороха.
Целлюлоза, или, как её еще называют, клетчатка, является основной частью оболочек клеток растений. В древесине содержится около 50% по массе целлюлозы. Всевозможные волокнистые растительные объекты, например волокна хлопчатника, содержат целлюлозу. Практически только из целлюлозы состоит аптечная вата, бинт. (Рис. 1.). Кроме того, из окружающих нас предметов, в основном из целлюлозы состоит обычная белая бумага.
Рис. 1. Вата, бинт
Целлюлоза является самым распространенным полимером глюкозы.
Крахмал и целлюлоза относятся к полисахаридам. Они являются природными полимерами. Их молекулы состоят из сотен и тысяч групп атомов (C6H10O5)n, остатков молекулы глюкозы.Значения n в них разные. Молекулы целлюлозы намного длиннее, чем крахмала. nцеллюлозы > nкрахмала .
Волокна целлюлозы состоят из остатков β-глюкозы. При этом, в отличие от крахмала, в целлюлозе практически нет ответвлений, и в результате полимер предствавляет собой сильно вытянутые нити. В одной полимерной цепи целлюлозы может содержаться от 1500 до 12 тыс. фрагментов глюкозы. Рис. 2.
Рис. 2. Строение цепи целлюлозы
- Химические свойства целлюлозыГидролиз
(С6Н10О5)n + (n-1) H2O nC6H12O6
- Однако гидролиз целлюлозы протекает в значительно более жестких условиях по сравнению с крахмалом.Сухая перегонка целлюлозы
При сухой перегонке происходит полное её разложение. В результате получается: древесный уголь, деготь, летучие продукты: метанол, уксусная кислота, ацетон (рис. 3).
Рис. 3. Сухая перегонка целлюлозы
- Образование сложных эфиров
В молекуле целлюлозы на каждый остаток глюкозы приходится три свободных гидроксильных группы. Как и положено спиртам, эти гидроксогруппы реагируют с кислотами, образуя сложные эфиры.
R1— OH + R-COOH ⇆ R-COOR1 + H2O
Растворы сложных эфиров целлюлозы можно продавливать сквозь узкие отверстия (фильеры). В результате можно получать волокна.
Например, обрабатывая, целлюлозу уксусным ангидридом, получают сложный эфир триацетат целлюлозы.
Из него получают волокно под названием ацетатный шелк.
[C6H7O2(OH)3] + 3n (CH3CO)2O → [C6H7O2(OCOCH3)3]n + 3n CH3COOH
Если подействовать на целлюлозу смесью концентрированных серной и азотной кислот, можно получить эфиры азотной кислоты.
[C6H7O2(OH)3] + 3n HNO3 → [C6H7O2(ONO2)3]n + 3n H2O
Если этот процесс доходит до конца, то получается тринитрат целлюлозы, который чаще называют пироксилином, или нитровата. Это вещество является основой для получения бездымного пороха.
Подведение итога урока
На уроке была рассмотрена тема: «Целлюлоза. Искусственные полимеры». Самым распространенным полимером углевода глюкозы является целлюлоза. На этом уроке вы смогли познакомиться с ней подробнее. Узнали о её физических и химических свойствах. Также изучили получение искусственных полимеров, например ацетатного шёлка, нитроваты, бездымного пороха.
Список литературы
- Рудзитис Г.Е., Фельдман Ф.Г. Химия: Органическая химия. 10 класс: учебник для общеобразовательных учреждений: базовый уровень/Г. Е. Рудзитис, Ф.Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
- Химия. 10 класс. Профильный уровень: учеб. для общеобразоват. учреждений/В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин, А.А. Дроздов, В.И. Теренин. – М.: Дрофа, 2008. – 463 с.
- Химия. 11 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин, А.А. Дроздов, В.И. Теренин. – М.: Дрофа, 2010. – 462 с.
- Хомченко Г.П., Хомченко И.Г. Сборник задач по химии для поступающих в вузы. – 4-е изд. – М.: РИА «Новая волна»: Издатель Умеренков, 2012. – 278 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Interneturok.ru (Источник).
- Chemistry.ssu.samara.ru (Источник).
- Химик.ру (Источник).
- Promobud.ua (Источник).
Домашнее задание
- №№ 14, 15 (с. 138) Рудзитис Г.Е., Фельдман Ф.Г. Химия: Органическая химия. 10 класс: учебник для общеобразовательных учреждений: базовый уровень/Г. Е. Рудзитис, Ф.Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
- Как получают волокна?
- Что такое бездымный порох?
interneturok.ru
Предмет органической химии. Роль органических веществ в жизни человека
К изучению предлагается тема «Предмет органической химии. Роль органических веществ в жизни человека». Преподаватель освещает вопрос, почему возникла необходимость разделить вещества на органические и неорганические. Далее он рассказывает учащимся о круговороте углерода в природе, дает определение органическим веществам, поясняет, что такое производные углеводородов, органогены. В конце урока преподаватель раскроет роль органической химии в нашей жизни.
Тема: Введение в органическую химию
Урок: Предмет органической химии. Роль органических веществ в жизни человека
К началу XXI века химики выделили в чистом виде миллионы веществ. При этом известно более 18 миллионов соединений углерода и меньше миллиона соединений всех остальных элементов.
Рост числа известных органических соединений
Соединения углерода в основном относят к органическим соединениям.
Вещества стали разделять на органические и неорганические с начала XIX века. Органическими называли тогда вещества, выделенные из животных и растений, а неорганическими – добытые из минералов. Именно через органический мир проходит основная часть круговорота углерода в природе.
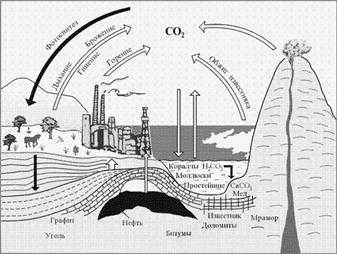
Круговорот углерода в природе
Из соединений, содержащих углерод, к неорганическим традиционно относят графит, алмаз, оксиды углерода (CO и CO2), угольную кислоту (H2CO3), карбонаты (например, карбонат натрия – сода Na2CO3), карбиды (карбид кальция CaC2), цианиды (цианистый калий KCN), роданиды (роданистый натрий NaSCN).
Более точное современное определение: органические соединения – это углеводороды и их производные.
Простейший углеводород – это метан. Атомы углерода способны соединяться друг с другом, образуя цепи любой длины. Если в таких цепях углерод связан еще и с водородом – соединения называются углеводородами. Известны десятки тысяч углеводородов.
Модели молекул метана СН4, этана С2Н6, пентана С5Н12
Производные углеводородов – это углеводороды, в которых один или несколько атомов водорода замещены атомом или группой атомов других элементов. Например, один из атомов водорода в метане можно заместить на хлор, или на группу ОН, или на группу NH2.
Метан CH4, хлорметан CH3Cl, метиловый спирт CH3OH, метиламин CH3NH2
В состав органических соединений, кроме атомов углерода и водорода, могут входить атомы кислорода, азота, серы, фосфора, реже галогенов.
Чтобы оценить значение органических соединений, которые нас окружают, представим себе, что они вдруг исчезли. Нет деревянных предметов, книг и тетрадей, нет сумок для книг и шариковых ручек. Исчезли пластмассовые корпуса компьютеров, телевизоров и других бытовых приборов, нет телефонов и калькуляторов. Без бензина и дизельного топлива встал транспорт, нет большинства лекарств и просто нечего есть. Нет моющих средств, одежды, да и нас с вами…

Органических веществ так много из-за особенностей образования химических связей атомами углерода. Эти небольшие атомы способны образовывать прочные ковалентные связи друг с другом и с неметаллами-органогенами.
В молекуле этана С2Н6 друг с другом связаны 2 атома углерода, в молекуле пентана С5Н12 – 5 атомов, а в молекуле всем известного полиэтилена сотни тысяч атомов углерода.
Строение, свойства и реакции органических веществ изучает органическая химия.
Рекомендуемые учебники
Химия. 10 класс. Профильный уровень: учеб. для общеобразоват. Учреждений / В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин. – М.: Дрофа, 2008. – 463 с.
ISBN 978-5-358-01584-5
Химия. 11 класс. Профильный уровень: учеб. для общеобразоват. Учреждений / В.В. Еремин, Н.Е. Кузьменко, В.В.Лунин. – М.: Дрофа, 2010. – 462 с.
ISBN 978-5-358-07020-2
Рекомендуемый задачник
Хомченко Г.П., Хомченко И.Г. Сборник задач по химии для поступающих в вузы. – 4-е изд. – М.: РИА «Новая волна»: Издатель Умеренков, 2012. – 278 с.
Учебник в Интернете
Самарский государственный университет.
Кафедра органической, биоорганической и медицинской химии
Г.И. Дерябина, Г.В. Кантария. Органическая химия: Web-учебник для средней школы: (Источник).
interneturok.ru
Основные принципы номенклатуры органических соединений. Видеоурок. Химия 10 Класс
Тема: Введение в органическую химию
Урок: Основные принципы номенклатуры органических соединений
Некоторые названия органических веществ, например, спирт и эфир, пришли к нам еще от алхимиков, очень многие вещества получили свои имена в девятнадцатом веке. Одни названия прямо указывают, из чего было впервые выделено данное вещество: винный спирт, гераниол, яблочная, щавелевая, муравьиная кислоты и т.д. Другие – отражают способ получения вещества: серный эфир, имя открывшего их ученого и т.п.
В настоящее время общепринятой считается номенклатура, разработанная союзом ИЮПАК, хотя до сих пор широко применяются как тривиальные названия (уксусная кислота, мочевина), так и названия, составленные по принципам устаревших номенклатур (изооктан, тетраметилэтилен и т.п.)
· Номенклатура ИЮПАК составлена по заместительному принципу. Считается, что структурная формула состоит из основной цепи – атомов углерода, соединенных между собой в неразветвленную цепочку – и присоединенных к ним заместителей. Заместитель – это любой атом или группа атомов, которые замещают атом водорода в неразветвленной структуре основой цепи.
· Функциональные группы, которые непосредственно связаны с основной цепью или входят в ее состав, в номенклатуре ИЮПАК называют характеристическими группами.
· Название в номенклатуре ИЮПАК состоит из корня, который обозначает длину основной цепи, а также приставок и суффиксов, отражающих наличие и расположение заместителей, кратных связей и функциональных групп.
· Название может содержать все блоки, а может – только два: корень и суффикс кратности связей.
· Корень названия вещества происходит из названий неразветвленных алканов с аналогичной длиной цепи.
Рис. 1. Принципы названий по номенклатуре ИЮПАК
Чтобы составить название вещества, необходимо знать названия неразветвленных алканов. Табл. 1.
Первые четыре названия: метан, этан, пропан и бутан возникли исторически, а остальные происходят от греческих корней, обозначающих число атомов углерода в молекуле.
Все названия неразветвленных алканов состоят из корня и суффикса кратности связи —ан. Этот суффикс обозначает то, что вещество предельно – не содержит двойных и тройных связей.
Двойную связь обозначает суффикс —ен, тройную – —ин.
Неразветвленную цепь можно выбрать разными способами. Для того, чтобы название было однозначным, в номенклатуре существует алгоритм выбора основной цепи.
1. В основную цепь входит «старшая» характеристическая группа.
2. В основную цепь максимально включены характеристические группы и кратные связи.
3. Основная цепь максимально длинная из всех возможных.
4. Основная цепь – самая разветвленная.
Например, в основную цепь необходимо включить кратные связи (правила 2), даже, если она при этом не будет самой длинной (правило 3).
В таблице 2 приведены примеры названий характеристических групп. Стрелочка справа показывает увеличение старшинства: в данной таблице, чем выше группа, тем она «старше». Название старшей характеристической группы определяет суффикс названия вещества. Остальные характеристические группы при этом обозначаются приставками, наравне с прочими заместителями.
Таб. 2. Названия характеристических групп
1. В структурной формуле выбирают основную цепь, используя алгоритм выбора основной цепи.
2. Основную цепь нумеруют так, чтобы старшая характеристическая группа получила наименьший номер. Если такая группа отсутствует, наименьший номер получает кратная связь, причем, принято, что двойная связь старше тройной. В случае отсутствия кратных связей нумерацию проводят так, чтобы заместители получили наименьшие номера.
3. Перечисляют заместители с их номерами в алфавитном порядке, затем записывают корень названия, отвечающий числу атомов углерода в основной цепи, добавляют суффикс кратных связей и суффикс старшей характеристической группы.
4. Если в молекуле присутствует несколько одинаковых заместителей или кратных связей, то употребляют приставку, обозначающую их число (ди-, три-, тетра-, пента-, гекса- и т.д.). Числа в названиях отделяют дефисами, между числами ставят запятые.
В ходе урока вы смогли изучить тему «Основные принципы номенклатуры органических соединений». Вы узнали названия веществ по номенклатуре IUPAC, которой придерживаются во всем мире. Рассмотрели алгоритм выбора основной цепи, порядок составления названия органических соединений. Научились составлять названия органических соединений по структурной формуле.
Список литературы
1. Рудзитис Г.Е. Химия. Основы общей химии. 10 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф.Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
2. Химия. 10 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. – М.: Дрофа, 2008. – 463 с.
3. Химия. 11 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. – М.: Дрофа, 2010. – 462 с.
4. Хомченко Г.П., Хомченко И.Г. Сборник задач по химии для поступающих в вузы. – 4-е изд. – М.: РИА «Новая волна»: Издатель Умеренков, 2012. – 278 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
1. Interneturok.ru (Источник).
2. Органическая химия (Источник).
3. Химик (Источник).
Домашнее задание
1. №№ 8, 9 (с. 22) Рудзитис Г.Е., Фельдман Ф.Г. Химия: Органическая химия. 10 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
2. Назовите по международной номенклатуре трехатомный спирт глицерин.
3. Напишите структурную формулу 2,5-диметил,3-этилоктана. К какому гомологическому ряду относится это вещество?
interneturok.ru
Решение задач на определение состава органических веществ
Тема: Введение в органическую химию
Урок: Решение задач на определение состава органических веществ
Суть анализа органических соединений основана на общем свойстве: все органические соединения горят и, сгорая, образуют углекислый газ, воду и некоторые другие продукты.
Рис. 1. Прибор для органического анализа
Суть анализа проста: надо взять известную массу органического соединения, сжечь его и определить, сколько получилось продуктов сгорания. Затем перейти к решению задачи на вывод формулы органического соединения. Прибор для органического анализа состоит из устройства для сжигания в воздухе обогащенным кислородом и системы ловушек для поглощения основных продуктов сгорания. Современные приборы действуют на том же самом принципе, хотя их чувствительность и скорость несравнимы с приборами Дюма и Либиха. Приборы, выпускаемые сейчас, позволяют взять для анализа буквально десятые доли милиграмма. При этом анализ выполняется очень быстро.
Рассмотрим примеры решения таких задач.
Условие задачи. При сжигании в избытке кислорода 0,22 г пропана, получено 0,66 г углекислого газа и 0,36 г воды. Определите состав газа.
Решение.
Согласно данным условия задачи, имеется только углекислый газ и вода, следовательно, в исходное вещество могут входить углерод, водород и кислород.
1. Напишем уравнение реакции в общем виде:
CxHyOz + O2 → xCO2 + y/2 H2O
2. Определим количества веществ углекислого газа и воды:
n = ; n(CO2) = = 0,015 моль.n(H2O) = = 0,02 моль.
3. Исходная проба 0,22 г пропана дает:
m(C) = 12 г/моль 0,015 моль = 0,18 г
m(H) = 1 г/моль·0,04 моль = 0,04 г
Сумма равна 0,18 г + 0,04 г = 0,22 г, что равно исходной массе пропана.
Вывод: Исходное вещество содержало только углерод и водород и не содержало кислорода.
Соотношение 0,015/0,04 = 3/8, следовательно, формула пропана С3Н8.
Простейшая формула газа: С3Н8.
4. Соответствует ли простейшая формула истинной формуле? Да, соответствует, потому что углеводорода С6Н16 не существует.
Ответ: Состав газа С3Н8.
Условие задачи. При сжигании 0,62 г этиленгликоля получено 0,88 г углекислого газа и 0,54 г воды. Определите состав этого вещества, если плотность его по воздуху равна 2,14.
Решение.
Согласно данным условия задачи, получается только углекислый газ и вода, следовательно, в исходное вещество могут входить углерод, водород и кислород.
1. Напишем уравнение реакции в общем виде:
CxHyOz + O2 → xCO2 + y/2 H2O
2. Определим количества веществ углекислого газа и воды:
n = ; n(CO2) = = 0,02 моль ; n(H2O) = = 0,03 моль.
3. Исходная проба дает:
m(C) = 12 г/моль ·0,02 моль = 0,24 г
m(H) = 1 г/моль ·0,06 моль = 0,06 г
В сумме 0,24 г+ 0,06 г =0,30 г, что существенно меньше сгоревшей массы этиленгликоля. Отсюда вывод, что в исходном веществе кроме углерода и водорода мог содержаться кислород.
4. Определяем массу кислорода и количество вещества.
m (O) = 0,62 – 0,30 = 0,32 г; n (O) = = 0,02 моль.
5. Находим соотношение атомов в сгоревшем веществе:
С: Н: О = 0,02: 0,06: 0,02 = 1:3:1.
6. Простейшая формула имеет состав СН3О. М (СН3О) = 31 г/моль.
7. Используя плотность по воздуху из условия задачи, находим молярную массу сгоревшего вещества, ; Мвоздух = 29 г/моль; М вещества = 29 г/моль ⋅ 2,14 = 62,06 г/моль. Это соответствует удвоенной его простейшей формуле.
Отсюда следует, что формула этиленгликоля: С2Н6О2.
Ответ: Формула этиленгликоля: С2Н6О2.
Подведение итога урока
В ходе урока вы получили общее представление о решении задач по теме «Решение задач на определение состава органических веществ». Вы узнали, что определение состава органических веществ происходит на основе способности всех органических веществ гореть. Рассмотрели алгоритм при решении подобного рода задач. Решили две разнотипные задачи на определение состава органических веществ с записью молекулярной формулы.
Список литературы
1. Рудзитис Г.Е. Химия. Основы общей химии. 10 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф.Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
2. Химия. 10 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. – М.: Дрофа, 2008. – 463 с.
3. Химия. 11 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. – М.: Дрофа, 2010. – 462 с.
4. Хомченко Г.П., Хомченко И.Г. Сборник задач по химии для поступающих в вузы. – 4-е изд. – М.: РИА «Новая волна»: Издатель Умеренков, 2012. – 278 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
1. Interneturok.ru (Источник).
2. Органическая химия (Источник).
3. Химик (Источник).
Домашнее задание
1. №№ 6, 7 (с. 23) Рудзитис Г.Е. Химия. Органическая химия. 10 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
2. В чем заключается суть анализа органических веществ?
3. Какие продукты реакции получаются при горении углеводородов?
interneturok.ru