Решебник по химии за 10 класс, ответы онлайн
-
ГДЗ
-
10 класс
- Химия
-
Химия 10 класс
рабочая тетрадь, тестовые задания ЕГЭАвторы:
Габриелян О.С. Яшукова А.В.
-
Химия 10-11 класс
дидактический материалАвтор: Радецкий А.М.
-
Химия 10-11 класс
Автор: Цветков Л.
 А.
А. -
Химия 10 класс
Авторы:
Гузей Л.С. Суровцева Р.П.
-
Химия 8-11 класс
задачникАвторы:
Гольдфарб Я.Л. Ходаков Ю.В.
-
Химия 10 класс
Авторы:
Рудзитис Г.Е. Фельдман Ф.Г.
-
Химия 10 класс
Авторы:
И.И. Новошинский Н.С. Новошинская
-
Химия 8-11 класс
сборник задач и упражненийАвтор: Хомченко И.
 Г.
Г. -
Химия 10 класс
Автор: О.С. Габриелян
-
Химия 10 класс
Авторы:
И.Е. Шиманович Е.И. Василевская
-
Химия 10 класс
сборник задачАвторы:
В.Н. Хвалюк В.И. Резяпкин
-
Химия 10 класс
лабораторные работыАвторы:
Шарапа Е.И. Ельницкий А.П.
-
Химия 10 класс
рабочая тетрадьАвторы:
Т.
 Н. Мякинник Н.В. Манкевич
Н. Мякинник Н.В. Манкевич -
Химия 10 класс
химический экспериментАвтор: И.И. Борушко
-
Химия 10 класс
Авторы:
Габриелян О.С. Остроумов И.Г.
-
Химия 10 класс
Авторы:
Ерёмин В.В. Кузьменко Н.Е.
-
Химия 10 класс
Авторы:
Кузнецова Н.Е. Гара Н.Н.
-
Химия 10 класс
Авторы:
Кузнецова Н.
 Е. Гара Н.Н.
Е. Гара Н.Н.
-
Химия 10 класс
Авторы:
Еремин В.В. Кузьменко Н.Е.
-
Химия 10 класс
Авторы:
Габриелян О.С. Остроумов И.Г.
-
Химия 10 класс
рабочая тетрадьАвтор: Ахметов М.А.
-
Химия 10 класс
Авторы:
Рудзитис Г.Е. Фельдман Ф.Г.
-
Химия 10-11 класс
сборник задачАвтор: Рябов М.
 А.
А. -
Химия 10 класс
контрольно-измерительные материалыАвтор: Стрельникова Е.Н.
-
Химия 10 класс
рабочая тетрадьАвторы:
Габриелян О.С. Сладков С.А.
-
Химия 10 класс
Авторы:
Габриелян О.С. Остроумов И.Г.
-
Химия 10 класс
контрольные и проверочные работыАвторы:
Габриелян О.С. Березкин П.Н.
-
Химия 10 класс
задачникАвторы:
Кузнецова Н.
 Е. Левкин А.Н.
Е. Левкин А.Н. -
Химия 10 класс
контрольные и проверочные работыАвторы:
Габриелян О.С. Сладков С.А.
-
Химия 10 класс
контрольные работыАвторы:
Габриелян О.С. Сладков С.А.
-
Химия 10 класс
тетрадь для практических работАвторы:
Матулис В.Э. Матулис В.Э.
-
Химия 10 класс
тетрадь для практических работАвторы:
Матулис В.
 Э. Матулис В.Э.
Э. Матулис В.Э. -
Химия 10 класс
Авторы:
Колевич Т.А. Матулис В.Э.
-
Химия 10-11 класс
сборник задач и упражненийАвторы:
Червина В.В. Варламова А.В.
-
Химия 10 класс
тематические тестыАвтор: Т.А. Боровских
-
Химия 10 класс
тетрадь для практических работАвтор: Борушко И.И.
Тесты по учебнику Габриеляна О.
 С. Химия. 10 класс. Профильный уровень — вопросы с ответами
С. Химия. 10 класс. Профильный уровень — вопросы с ответами
- Главная
- Тесты
- Учебные тесты
- Тесты для школы
- Тесты для школы по классам
- Тесты для 10 класса
- Тесты по химии для 10 класса
- Тесты по химии профильного уровня для 10 класса
Популярности
Новизне
Выбрать
сбросить выбранное
Тест: Насколько ты знаешь «Мой шумный дом»
Выводить по:
- 8
- 16
- 24
- 32
Тест по химии: Алкадиены (Габриелян, 10 класс, профильная)
Тест по химии: Алканы (Габриелян, 10 класс, профильная)
Тест по химии: Алкены (Габриелян, 10 класс, профильная)
Тест по химии: Алкины (Габриелян, 10 класс, профильная)
Тест по химии: Альдегиды и кетоны (Габриелян, 10 класс, профильная)
Тест по химии: Ароматические углеводороды (Габриелян, 10 класс, профильная)
Тест по химии: Валентные состояния атома углерода (Габриелян, 10 класс, профильная)
Тест по химии: Витамины (Габриелян, 10 класс, профильная)
Тест по химии: Дисахариды. Сахароза. Полисахариды. Крахмал и целлюлоза (Габриелян, 10 класс, профильная)
Сахароза. Полисахариды. Крахмал и целлюлоза (Габриелян, 10 класс, профильная)
Тест по химии: Изомерия и её виды (Габриелян, 10 класс, профильная)
Тест по химии: Карбоновые кислоты (Габриелян, 10 класс, профильная)
Тест по химии: Классификация органических соединений (Габриелян, 10 класс, профильная)
Тест по химии: Основы номенклатуры органических соединений (Габриелян, 10 класс, профильная)
Тест по химии: Предмет органической химии. Органические вещества (Габриелян, 10 класс, профильная)
Тест по химии: Природные источники углеводородов (Габриелян, 10 класс, профильная)
Тест по химии: Сложные эфиры. Жиры (Габриелян, 10 класс, профильная)
Жиры (Габриелян, 10 класс, профильная)
Тест по химии: Спирты (Габриелян, 10 класс, профильная)
Тест по химии: Строение атома углерода (Габриелян, 10 класс, профильная)
Тест по химии: Теория строения органических соединений А. М. Бутлерова (Габриелян, 10 класс, профильная)
Тест по химии: Типы реакционноспособных частиц и механизмы реакций в органической химии. Взаимное влияние атомов в молекулах органических соединений (Габриелян, 10 класс, профильная)
Тест по химии: Типы химических реакций в органической химии (Габриелян, 10 класс, профильная)
Тест по химии: Углеводы, их классификация и значение (Габриелян, 10 класс, профильная)
Тест по химии: Фенолы (Габриелян, 10 класс, профильная)
Тест по химии: Циклоалканы (Габриелян, 10 класс, профильная)
Рабочая программа по химии 10 класс
Рабочая программа составлена на основе ФГОС СОО, ООП СОО МКОУ «Новодугинская СШ», учебного плана МКОУ «Новодугинская СШ»,календарного учебного графика. Программа ориентирована на использование учебника О.С. Габриеляна Химия 10 класс: Дрофа,201? год. Рабочая программа соответствует углубленному уровню подготовки обучающихся. Программа рассчитана на 34 учебных недели. 102 часов в год (3 часа в неделю — уровень). Практических работ -11. Контрольных работ-8.
Программа ориентирована на использование учебника О.С. Габриеляна Химия 10 класс: Дрофа,201? год. Рабочая программа соответствует углубленному уровню подготовки обучающихся. Программа рассчитана на 34 учебных недели. 102 часов в год (3 часа в неделю — уровень). Практических работ -11. Контрольных работ-8.
Планируемые результаты освоения курса
Личностные результаты
осознание российской гражданской идентичности, патриотизма, чувства гордостиза российскую химическую науку;
-
в трудовой сфере:
готовность к осознанному выбору дальнейшей образовательной траектории в высшей школе, где химия является профилирующей дисциплиной;
умение управлять своей познавательной деятельностью,
-
готовность и способность к образованию, в том числе самообразованию, на протяжении всей жизни; сознательное отношение к непрерывному образованию как условию успешной профессиональной и общественной деятельности;
формирование навыков экспериментальной и исследовательской деятельности;
участие в публичном представлении результатов самостоятельной познавательной деятельности; участие в профильных олимпиадах различных уровней в соответствии с желаемыми результатами и адекватной самооценкой;
принятие и реализация ценностей здорового и безопасного образа жизни,
неприятие вредных привычек (курения, употребления алкоголя, наркотиков) на основе знаний о свойствах наркологических и наркотических веществ; соблюдение правил техники безопасности при
работе с веществами, материалами и процессами в учебной (научной) лаборатории и на производстве
Метапредметные результаты
-
использование умений и навыков различных видов познавательной деятельности, применение основных методов познания (системно-информационный анализ, наблюдение, измерение, проведение эксперимента, моделирование, исследовательская деятельность) для изучения различных сторон окружающей действительности;
-
владение основными интеллектуальными операциями: формулировка гипотезы, анализ и синтез, сравнение и систематизация, обобщение и конкретизация, выявление причинно-следственных связей и поиск аналогов;
-
познание объектов окружающего мира от общего через особенное к единичному;
-
умение генерировать идеи и определять средства, необходимые для их реализации;
-
умение определять цели и задачи деятельности, выбирать средства реализации цели и применять их на практике;
-
использование различных источников для получения химической информации, понимание зависимости содержания и формы представления информации от целей коммуникации и адресата;
-
умение продуктивно общаться и взаимодействовать в процессе совместной деятельности, учитывать позиции других участников деятельности, эффективно разрешать конфликты;
-
готовность и способность к самостоятельной информационно-познавательной деятельности, включая умение ориентироваться в различных источниках информации, критически оценивать и интерпретировать информацию, получаемую из различных источников;
-
умение использовать средства информационных и коммуникационных технологий (далее — ИКТ) в решении когнитивных ,коммуникативных и организационных задач с соблюдением требований эргономики, техники безопасности, гигиены, ресурсосбережения, правовых и этических норм, норм информационной безопасности;
-
владение языковыми средствами, в том числе и языком химии, умение ясно, логично и точно излагать свою точку зрения, использовать адекватные языковые средства, в том числе и символьные (химические знаки, формулы и уравнения).

Предметные результаты
Обучающийся научится
1) описывать признаки важнейших химических понятий: вещество, химический элемент, атом, молекула, относительные атомные и молекулярные массы, ион, изотопы, химическая связь (ковалентная полярная и неполярная, ионная, водородная), электроотрицательность, а валентность,углеродный скелет, функциональная группа, изомерия (структурная и пространственная) и гомология, основные типы (соединения, разложения, замещения, обмена), виды (гидрирования и дегидрирования, гидратации и дегидратации, полимеризации и деполимеризации, поликонденсации и изомеризации, каталитические и некаталитические, гомогенные и гетерогенные) и разновидности (ферментативные, горения, этерификации, крекинга, риформинга) реакций в органической химии, полимеры, биологически активные соединения;
2) выявлять взаимосвязи химических понятий для объяснения состава, строения, свойств отдельных химических объектов и явлений;
3) применять основных положений химических теорий: теории строения вещества
4) классифицировать органические вещества по различным основаниям;
5)установливать связь между составом, строением, свойствами, практическим применением и получением важнейших веществ;
6) знать основ химической номенклатуры (тривиальной и международной) и умение назвать органические соединения по формуле и наоборот;
7) определять валентности; видов химических связей в соединениях и типов кристаллических решеток; пространственного строения молекул; принадлежности веществ к различным классам органических соединений; гомологов и изомеров; типов, видов и разновидностей химических реакций в органической химии;
8) характеризовать: общие химические свойства основных классов органических соединений в плане общего, особенного и единичного;
9) объяснять зависимости свойств органических веществ от их состава и строения; механизмов протекания реакций между органическими и неорганическими веществами;
10)проводить расчеты по химическим формулам и уравнениям; проводить химический эксперимент (лабораторные и практические работы) с соблюдением требований к правилам техники безопасности при работе в химическом кабинете
Обучающийся получит возможность научиться
1. а )давать определения изученным понятиям; б) описывать демонстрационные и самостоятельно проведенные эксперименты, используя для этого естественный (русский, родной) язык и язык химии; в) объяснять строение и свойства изученных классов органических соединений; г) классифицировать изученные объекты и явления; д) наблюдать демонстрируемые и самостоятельно проводимые опыты, химические реакции, протекающие в природе и в быту; е) исследовать свойства органических веществ, определять их принадлежность к основным классам соединений; ж) обобщать знания и делать обоснованные выводы о закономерностях изменения свойств веществ; з) структурировать учебную информацию; и) интерпретировать информацию, полученную из других источников, оценивать ее научную достоверность; к) объяснять закономерности протекания химических реакций, прогнозировать возможность их протекания на основе знаний о строении вещества и законов термодинамики; м) моделировать строение простейших молекул органических веществ, кристаллов; н) проводить расчеты по химическим формулам и уравнениям; о) характеризовать изученные теории; п) самостоятельно добывать новое для себя химическое знание, используя для этого доступные источники информации;
а )давать определения изученным понятиям; б) описывать демонстрационные и самостоятельно проведенные эксперименты, используя для этого естественный (русский, родной) язык и язык химии; в) объяснять строение и свойства изученных классов органических соединений; г) классифицировать изученные объекты и явления; д) наблюдать демонстрируемые и самостоятельно проводимые опыты, химические реакции, протекающие в природе и в быту; е) исследовать свойства органических веществ, определять их принадлежность к основным классам соединений; ж) обобщать знания и делать обоснованные выводы о закономерностях изменения свойств веществ; з) структурировать учебную информацию; и) интерпретировать информацию, полученную из других источников, оценивать ее научную достоверность; к) объяснять закономерности протекания химических реакций, прогнозировать возможность их протекания на основе знаний о строении вещества и законов термодинамики; м) моделировать строение простейших молекул органических веществ, кристаллов; н) проводить расчеты по химическим формулам и уравнениям; о) характеризовать изученные теории; п) самостоятельно добывать новое для себя химическое знание, используя для этого доступные источники информации;
2) прогнозировать, анализировать и оценивать последствия для окружающей среды бытовой и производственной деятельности человека, связанной с переработкой веществ;
3) самостоятельно планировать и проводить химический эксперимент, соблюдая правила безопасной работы с веществами и лабораторным оборудованием;
4) оказывать первую помощь при отравлениях, ожогах и других травмах, связанных с веществами и лабораторным оборудованием.
Содержание тем учебного курса
Тема 1.Введение. (6 часов)
Введение. Предмет органической химии. Особенности строения и свойств органических соединений. Значение и роль органической химии в системе естественных наук и в жизни об-щества. Краткий очерк истории развития органической химии.Предпосылки создания теории строения: теория радикалов и теория типов, работы А. Кекуле, Э. Франкланда и А. М. Бутле-рова, съезд врачей и естествоиспытателей в г. Шпейере. Основ-ные положения теории строения органических соединений А. М. Бутлерова. Химическое строение и свойства органических веществ. Изомерия на примере н-бутана и изобутана.Электронное облако и орбиталь, их формы: s— и р-. Элек-тронные и электронно-графические формулы атома углерода в нормальном и возбужденном состояниях. Ковалентная химиче-ская связь и ее разновидности: s- и p-. Образование молекул Н2, Cl2, N2, HCl, H2O, NH3, CH4, C2H4, C2H2. Водородная связь. Образование ионов NH+4 и H3O+. Сравнение обменного и донор-но-акцепторного механизмов образования ковалентной связи.Первое валентное состояние — sp3-гибридизация — на при-мере молекулы метана и других алканов. Второе валентное со-стояние — sp2-гибридизация — на примере молекулы этилена. Третье валентное состояние — sp-гибридизация — на примере молекулы ацетилена. Геометрия молекул этих веществ и характе-ристика видов ковалентной связи в них. Модель Гиллеспи для объяснения взаимного отталкивания гибридных орбиталей и их расположения в пространстве с минимумом энергии.
Водородная связь. Образование ионов NH+4 и H3O+. Сравнение обменного и донор-но-акцепторного механизмов образования ковалентной связи.Первое валентное состояние — sp3-гибридизация — на при-мере молекулы метана и других алканов. Второе валентное со-стояние — sp2-гибридизация — на примере молекулы этилена. Третье валентное состояние — sp-гибридизация — на примере молекулы ацетилена. Геометрия молекул этих веществ и характе-ристика видов ковалентной связи в них. Модель Гиллеспи для объяснения взаимного отталкивания гибридных орбиталей и их расположения в пространстве с минимумом энергии.
Демонстрации. Коллекция органических веществ, материалов и изделий из них. Модели молекул Ch5 и СН3ОН; C2h3, C2h5и C6H6; н-бутана и изобутана. Взаимодействие натрия с этанолом и отсутствие взаимодействия с диэтиловым эфиром. Коллекция полимеров, природных и синтетических каучуков, лекарственных препаратов, красителей. Шаростержневые и объемные модели молекул Н2, Cl2, N2, h3O, Ch5. Шаростержневые и объемные модели Ch5, C2h5, C2h3. Модель отталкивания гибридных орбиталей, выполненная с помощью воздушных шаров.
Шаростержневые и объемные модели молекул Н2, Cl2, N2, h3O, Ch5. Шаростержневые и объемные модели Ch5, C2h5, C2h3. Модель отталкивания гибридных орбиталей, выполненная с помощью воздушных шаров.
Тема 2. Строение и классификация органических соединений, химические реакции в органической химии (14 часов)
Классификация органических соединений по строению углеродного скелета: ациклические (алканы, алкены, алкины,алкадиены), карбоциклические (циклоалканы и арены) и гетероциклические. Классификация органических соединений по функциональным группам: спирты, фенолы, простые эфиры,
альдегиды, кетоны, карбоновые кислоты, сложные эфиры.
Тривиальные названия веществ. Номенклатура рациональная и ИЮПАК (IUPAC). Принципы образования названий органических соединений по ИЮПАК: замещения, родоначальной структуры, старшинства характеристических групп.Структурная изомерия и ее виды: изомерия «углеродногоскелета», изомерия положения (кратной связи и функциональной группы), межклассовая изомерия. Пространственная изомерия и ее виды: геометрическая и оптическая. Биологическое значение оптической изомерии. Отражение особенностей строения молекул геометрических и оптических изомеров в их названиях.
Пространственная изомерия и ее виды: геометрическая и оптическая. Биологическое значение оптической изомерии. Отражение особенностей строения молекул геометрических и оптических изомеров в их названиях.
Демонстрации. Образцы представителей различных классов органических соединений и шаростержневые или объемные модели их молекул. Таблицы «Название алканов и алкильных заместителей» и «Основные классы органических соединений». Модели молекул изомеров разных видов изомерии.
Лабораторные опыты. Изготовление моделей молекул веществ — представителей различных классов.
Понятие о реакциях замещения. Галогенирование алканов и аренов, щелочной гидролиз галогеналканов.Понятие о реакциях присоединения. Гидрирование, гидро-галогенирование, галогенирование. Реакции полимеризации и поликонденсации.
Понятие о реакциях отщепления (элиминирования). Дегидрирование алканов. Дегидратация спиртов. Дегидрохлорирование на примере галогеналканов. Понятие о крекинге алканов
Дегидрохлорирование на примере галогеналканов. Понятие о крекинге алканов
и деполимеризации полимеров. Реакции изомеризации.Гомолитический и гетеролитический разрыв ковалентной химической связи; образование ковалентной связи по донорно-акцепторному механизму. Понятие о нуклеофиле и электрофиле. Классификация реакций по типу реагирующих частиц(нуклеофильные и электрофильные) и принципу изменения со-
става молекулы. Взаимное влияние атомов в молекулах органических веществ. Индуктивный и мезомерный эффекты. ПравилоМарковникова.
Расчетные задачи. Вычисление выхода продукта реакции оттеоретически возможного. Комбинированные задачи.
Демонстрации. Взрыв смеси метана с хлором. Обесцвечивание бромной воды этиленом и ацетиленом. Получение фенолформальдегидной смолы и полимера. Деполимеризация полиэтилена.Получение этилена из этанола. Крекинг керосина.Взрыв гремучего газа. Горение метана или пропан-бутановой смеси (из газовой зажигалки). Взрыв смеси метана или пропан-бутановой смеси с кислородом (воздухом).
Горение метана или пропан-бутановой смеси (из газовой зажигалки). Взрыв смеси метана или пропан-бутановой смеси с кислородом (воздухом).
Тема 3.Углеводороды (25 часов)
Понятие об углеводородах
А л к а н ы. Гомологический ряд и общая формула алканов. Строение молекулы метана и других алканов. Изомерия алканов. Физические свойства алканов. Алканы в природе. Промышленные способы получения: крекинг алканов, фракционная перегонка нефти. Лабораторные способы получения алканов: синтез Вюрца, декарбоксилирование солей карбоновых кислот,гидролиз карбида алюминия. Реакции замещения. Горение алканов в различных условиях. Термическое разложение алканов.Изомеризация алканов. Применение алканов. Механизм реакции радикального замещения, его стадии. Практическое использование знаний о механизме (свободнорадикальном) реакций в правилах техникибезопасности в быту и на производстве.
А л к е н ы. Гомологический ряд и общая формула алкенов. Строение молекулы этилена и других алкенов. Изомерия алкенов: структурная и пространственная. Номенклатура и физические свойства алкенов. Получение этиленовых углеводородов из алканов, галогеналканов, спиртов. Поляризация p-связи в молекулах алкенов на примере пропена. Понятие об индуктивном(+I) эффекте на примере молекулы пропена. Реакции присоединения (галогенирование, гидрогалогенирование, гидратация,гидрирование). Реакции окисления и полимеризации алкенов.Применение алкенов на основе их свойств. Механизм реакции электрофильного присоединения к алкенам. Окисление алкенов в «мягких» и «жестких» условиях.
Строение молекулы этилена и других алкенов. Изомерия алкенов: структурная и пространственная. Номенклатура и физические свойства алкенов. Получение этиленовых углеводородов из алканов, галогеналканов, спиртов. Поляризация p-связи в молекулах алкенов на примере пропена. Понятие об индуктивном(+I) эффекте на примере молекулы пропена. Реакции присоединения (галогенирование, гидрогалогенирование, гидратация,гидрирование). Реакции окисления и полимеризации алкенов.Применение алкенов на основе их свойств. Механизм реакции электрофильного присоединения к алкенам. Окисление алкенов в «мягких» и «жестких» условиях.
А л к и н ы. Гомологический ряд алкинов. Общая формула.Строение молекулы ацетилена и других алкинов. Изомерия алкинов. Номенклатура ацетиленовых углеводородов. Получение
алкинов: метановый и карбидный способы. Физические свойства алкинов. Реакции присоединения: галогенирование, гидрогалогенирование, гидратация (реакция Кучерова), гидрирование. Тримеризация ацетилена в бензол. Окисление алкинов. Особые свойства терминальных алкинов. Применение алкинов.
Тримеризация ацетилена в бензол. Окисление алкинов. Особые свойства терминальных алкинов. Применение алкинов.
А л к а д и е н ы. Общая формула алкадиенов. Строение молекул. Изомерия и номенклатура алкадиенов. Физические свойства. Взаимное расположение p-связей в молекулах алкадиенов:
кумулированное, сопряженное, изолированное. Особенности строения сопряженных алкадиенов, их получение. Аналогия в химических свойствах алкенов и алкадиенов. Полимеризация алкадиенов. Натуральный и синтетический каучуки. Вулканизация
каучука. Резина. Работы С. В. Лебедева. Особенности реакций присоединения к алкадиенам с сопряженными p-связями.
Ц и к л о а л к а н ы. Гомологический ряд и общая формула циклоалканов. Напряжение цикла в С3Н6, С4Н8 и С5Н10, конформации С6Н12. Изомерия циклоалканов (углеродного скелета, цис-, транс-, межклассовая). Получение и химические свойства циклоалканов: горение, разложение, радикальное замещение, изомеризация. Особые свойства циклопропана, циклобутана.
Особые свойства циклопропана, циклобутана.
А р е н ы. Бензол как представитель аренов. Строение молекулы бензола. Сопряжение p-связей. Изомерия и номенклатура аренов, их получение. Гомологи бензола. Влияние боковой цепи на электронную плотность сопряженного p-облака в молекулах гомологов бензола на примере толуола. Химические свойствабензола. Реакции замещения с участием бензола: галогенирование, нитрование и алкилирование. Применение бензола и его гомологов. Радикальное хлорирование бензола. Условия проведения реакции радикального хлорирования бензола. Каталитическое гидрирование бензола. Механизм реакций электрофильного замещения: галогенирования и нитрования бензола и его гомологов. Сравнение реакционной способности бензола и толуола в реакциях замещения. Ориентирующее действие метильной группы в реакциях замещения с участием толуола.Ориентанты I и II рода в реакциях замещения с участием аренов. Реакции по боковой цепи алкилбензолов.
П р и р од н ы е и с т оч н и к и у гл е в о д о р о д о в.
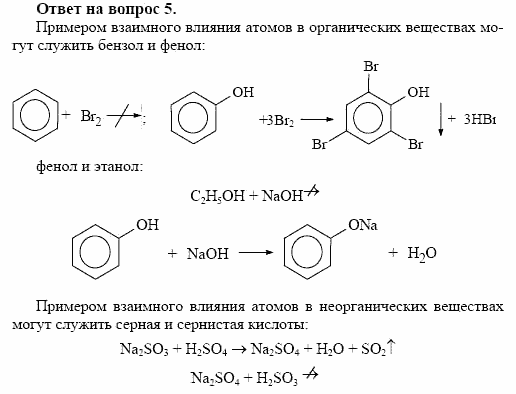
Нефть и ее промышленная переработка. Фракционная перегонка, термический и каталитический крекинг. Природный газ, егосостав и практическое использование. Каменный уголь. Коксование каменного угля. Происхождение природных источников
углеводородов. Риформинг, алкилирование и ароматизация нефтепродуктов. Экологические аспекты добычи, переработки и использования полезных ископаемых.
Расчетные задачи. Нахождение молекулярной формулы органического соединения по массе (объему) продуктов сгорания.Нахождение молекулярной формулы вещества по его относи-
тельной плотности и массовой доле элементов в соединениях.
Комбинированные задачи.
Демонстрации. Получение метана из ацетата натрия и гидроксида натрия. Модели молекул алканов — шаростержневые и объемные. Горение метана, пропан-бутановой смеси,парафина
в условиях избытка и недостатка кислорода. Взрыв смеси метана с воздухом. Отношение метана, пропан-бутановой смеси, бензина, парафина к бромной воде и раствору перманганата калия.Взрыв смеси метана и хлора, инициируемый освещением. Восстановление оксида меди (II) парафином.Шаростержневые и объемные модели молекул структурных и пространственных изомеров алкенов. Объемные модели молекул алкенов. Получение этена из этанола. Обесцвечивание этеном бромной воды. Обесцвечивание этеном раствора перманганата калия. Горение этена. Получение ацетилена из карбида кальция. Взаимодействие ацетилена с бромной водой. Взаимодействие ацетилена с раство-
Взрыв смеси метана с воздухом. Отношение метана, пропан-бутановой смеси, бензина, парафина к бромной воде и раствору перманганата калия.Взрыв смеси метана и хлора, инициируемый освещением. Восстановление оксида меди (II) парафином.Шаростержневые и объемные модели молекул структурных и пространственных изомеров алкенов. Объемные модели молекул алкенов. Получение этена из этанола. Обесцвечивание этеном бромной воды. Обесцвечивание этеном раствора перманганата калия. Горение этена. Получение ацетилена из карбида кальция. Взаимодействие ацетилена с бромной водой. Взаимодействие ацетилена с раство-
ром перманганата калия. Горение ацетилена. Взаимодействие ацетилена с раствором соли меди или серебра.Модели (шаростержневые и объемные) молекул алкадиенов с различным взаимным расположением p-связей. Деполимеризация каучука. Модели (шаростержневые и объемные) молекул алкадиенов с различным взаимным расположением p-связей.
Коагуляция млечного сока каучуконосов (молочая, одуванчиков
или фикуса). Шаростержневые модели молекул циклоалканов и алкенов.Отношение циклогексана к раствору перманганата калия и бромной воде. Шаростержневые и объемные модели молекул бензола и его гомологов. Разделение с помощью делительной воронки смеси
Шаростержневые модели молекул циклоалканов и алкенов.Отношение циклогексана к раствору перманганата калия и бромной воде. Шаростержневые и объемные модели молекул бензола и его гомологов. Разделение с помощью делительной воронки смеси
бензол—вода. Растворение в бензоле различных органических и неорганических (например, серы) веществ. Экстрагирование красителей и других веществ (например, иода) бензолом из водных растворов. Горение бензола. Отношение бензола к бромной воде и раствору перманганата калия. Получение нитробензола.Коллекция «Природные источники углеводородов». Сравнение процессов горения нефти и природного газа. Образованиенефтяной пленки на поверхности воды. Каталитический крекинг парафина. Растворение парафина в бензине и испарение растворителя из смеси. Плавление парафина и его отношение к воде (растворение, сравнение плотностей, смачивание). Разделение смеси бензин—вода с помощью делительной воронки.
Лабораторные опыты. Изготовление парафинированной бумаги, испытание ее свойств — отношение к воде и жирам. Обнаружение Н2О, сажи, СО2 в продуктах горения свечи. Изготовление моделей галогеналканов. Обнаружение непредельных соединений
Изготовление парафинированной бумаги, испытание ее свойств — отношение к воде и жирам. Обнаружение Н2О, сажи, СО2 в продуктах горения свечи. Изготовление моделей галогеналканов. Обнаружение непредельных соединений
в нефтепродуктах. Ознакомление с образцами полиэтилена и полипропилена. Распознавание образцов алканов и алкенов. Обнаружение воды, сажи и углекислого газа в продуктах горения углеводородов. Изготовление моделей алкинов и их изомеров. Ознакомление с коллекцией «Каучук и резина». Ознакомление с физическими свойствами бензола. Изготовление и использование простейшего прибора для хроматографии. Рас-
познавание органических веществ. Определение качественного состава парафина или бензола. Получение ацетилена и его окисление раствором KMnO4 или бромной водой.
Тема 4. Спирты и фенолы (8 часов)
С п и р т ы. Состав и классификация спиртов. Изомерия спиртов (положение гидроксильных групп, межклассовая, углеродного скелета). Физические свойства спиртов, их получение.
Физические свойства спиртов, их получение.
Межмолекулярная водородная связь. Особенности электронного строения молекул спиртов. Химические свойства спиртов,обусловленные наличием в молекулах гидроксильных групп: образование алкоголятов, взаимодействие с галогеноводородами,межмолекулярная и внутримолекулярная дегидратация, этерификация, окисление и дегидрирование спиртов. Особенности свойств многоатомных спиртов. Качественная реакция на многоатомные спирты. Важнейшие представители спиртов. Физиологическое действие метанола и этанола. Алкоголизм, его последствия. Профилактика алкоголизма.
Ф е н о л ы. Фенол, его физические свойства и получение.Химические свойства фенола как функция его строения. Кислотные свойства. Взаимное влияние атомов и групп в молекулах
органических веществ на примере фенола. Поликонденсация фенола с формальдегидом. Качественная реакция на фенол.Применение фенола. Классификация фенолов. Сравнение кислотных свойств веществ, содержащих гидроксильную группу:воды, одно- и многоатомных спиртов, фенола. Электрофильное замещение в бензольном кольце. Применение производных фенола.
Сравнение кислотных свойств веществ, содержащих гидроксильную группу:воды, одно- и многоатомных спиртов, фенола. Электрофильное замещение в бензольном кольце. Применение производных фенола.
Тема 5. Карбонильные соединения: альдегиды и кетоны (7 часов)
А л ь д е г и д ы и к е т о н ы. Строение молекул альдегидов и кетонов, их изомерия и номенклатура. Особенности строения карбонильной группы. Физические свойства формальдегида и его гомологов. Отдельные представители альдегидов и кетонов.Химические свойства альдегидов, обусловленные наличием в молекуле карбонильной группы атомов (гидрирование, окисление аммиачными растворами оксида серебра и гидроксида меди (II)). Качественные реакции на альдегиды. Реакция поликонденсации формальдегида с фенолом. Особенности строения и химических свойств кетонов. Нуклеофильное присоединение к карбонильным соединениям. Присоединение циановодорода и гидросульфита натрия. Способы получения. Взаимное влияние
Взаимное влияние
атомов в молекулах. Галогенирование альдегидов и кетонов по ионному механизму на свету. Качественная реакция на метилкетоны.
Тема 6. Карбоновые кислоты, сложные эфиры, жиры (10 часов)
К а р б о н о в ы е к и с л о т ы. Строение молекул карбоновых кислот и карбоксильной группы. Классификация и номенклатура карбоновых кислот. Физические свойства карбоно-
вых кислот и их зависимость от строения молекул. Способы получения. Карбоновые кислоты в природе. Биологическая роль карбоновых кислот. Общие свойства неорганических и органических кислот (взаимодействие с металлами, оксидами металлов,основаниями, солями). Влияние углеводородного радикала на силу карбоновой кислоты. Реакция этерификации, условия ее проведения. Химические свойства непредельных карбоновых
кислот, обусловленные наличием p-связи в молекуле. Реакцииэлектрофильного замещения с участием бензойной кислоты.
С л о ж н ы е э ф и р ы. Строение сложных эфиров. Изомерия сложных эфиров (углеродного скелета и межклассовая).Номенклатура сложных эфиров. Обратимость реакции этерифи-
кации, гидролиз сложных эфиров. Равновесие реакции этерификации — гидролиза; факторы, влияющие на него. Решение расчетных задач на определение выхода продукта реакции (в %)
от теоретически возможного, установление формулы и строения вещества по продуктам его сгорания (или гидролиза).
Жи р ы. Жиры как сложные эфиры глицерина и карбоновых кислот. Состав и строение жиров. Номенклатура и классификация жиров. Масла. Жиры в природе. Биологические функции жиров. Свойства жиров. Омыление жиров, получение мыла.Объяснение моющих свойств мыла. Гидрирование жидких жиров. Маргарин. Понятие о CMC. Объяснение моющих свойств мыла и CMC (в сравнении).
Расчетные задачи. Вычисления по термохимическим уравнениям.
Демонстрации. Физические свойства этанола, пропанола-1 и бутанола-1. Шаростержневые модели молекул изомеров с молекулярными формулами С3Н8О и С4Н10О. Количественное вытеснение водорода из спирта натрием. Сравнение реакций горения этилового и пропилового спиртов. Сравнение скоростей взаимодействия натрия с этанолом, пропанолом-2, глицерином. Получение простого эфира. Получение сложного эфира. Получение этена из этанола. Растворимость фенола в воде при обычной и повышенной температуре. Вытеснение фенола из фенолята натрия угольной кислотой. Реакция фенола с хлоридом железа (III). Реакция фенола с формальдегидом. Шаростержневые модели молекул альдегидов и изомерных им кетонов. Окисление бензальдегида на воздухе. Реакция «серебряного зеркала». Окисление альдегидов гидроксидом меди (II).Знакомство с физическими свойствами некоторых карбоновых кислот: муравьиной, уксусной, пропионовой, масляной, щавелевой, лимонной, олеиновой, стеариновой, бензойной. Возгонка бензойной кислоты. Отношение различных карбоновых кислот к воде. Сравнение кислотности среды водных растворов муравьиной и уксусной кислот одинаковой молярности. Получение приятно пахнущего сложного эфира. Отношение к бромной воде и раствору перманганата калия предельной и непредельной карбоновых кислот. Шаростержневые модели молекул сложных эфиров и изомерных им карбоновых кислот. Отношение сливочного, подсолнечного и машинного масла к водным растворам брома и перманганата калия.
Отношение различных карбоновых кислот к воде. Сравнение кислотности среды водных растворов муравьиной и уксусной кислот одинаковой молярности. Получение приятно пахнущего сложного эфира. Отношение к бромной воде и раствору перманганата калия предельной и непредельной карбоновых кислот. Шаростержневые модели молекул сложных эфиров и изомерных им карбоновых кислот. Отношение сливочного, подсолнечного и машинного масла к водным растворам брома и перманганата калия.
Лабораторные опыты. Растворение глицерина в воде. Взаимодействие глицерина с Cu(OH)2. Ректификация смеси вода—этанол (1—2 стадии). Взаимодействие фенола с раствором щелочи. Распознавание растворов фенолята натрия и карбоната натрия(барботаж выдыхаемого воздуха или действие сильной кислоты).Взаимодействие фенола с бромной водой. Распознавание водных растворов фенола и глицерина. Знакомство с физическими
свойствами отдельных представителей альдегидов и кетонов: ацетальдегида, ацетона, водного раствора формальдегида. Окисление этанола в этаналь. Реакция «серебряного зеркала». Окисление альдегидов гидроксидом меди (II). Получение фенолофор мальдегидного полимера. Взаимодействие раствора уксусной кислоты с магнием (цинком), оксидом меди (II), гидроксидом железа (III), раствором карбоната натрия, раствором стеарата
Окисление этанола в этаналь. Реакция «серебряного зеркала». Окисление альдегидов гидроксидом меди (II). Получение фенолофор мальдегидного полимера. Взаимодействие раствора уксусной кислоты с магнием (цинком), оксидом меди (II), гидроксидом железа (III), раствором карбоната натрия, раствором стеарата
калия (мыла). Ознакомление с образцами сложных эфиров. Отношение сложных эфиров к воде и органическим веществам (например, красителям). Выведение жирного пятна с помощью сложного эфира. Растворимость жиров в воде и органических растворителях. Распознавание сливочного масла и маргарина с помощью подкисленного теплого раствора KMnO4. Получение мыла. Сравнение моющих свойств хозяйственного мыла и СМС
в жесткой воде.
Экспериментальные задачи. Распознавание растворов ацетата натрия, карбоната натрия, силиката натрия и стеарата натрия. Распознавание образцов сливочного масла и маргарина. Получение карбоновой кислоты из мыла. Получение уксусной кислоты из ацетата натрия.
Получение уксусной кислоты из ацетата натрия.
Тема 7 . Углеводы (8 часов)
Моно-, ди- и полисахариды. Представители каждойгруппы. Биологическая роль углеводов. Их значение в жизни человека и общества.
Мо н о с а х а р и д ы. Глюкоза, ее физические свойства. Строение молекулы. Равновесия в растворе глюкозы. Зависимость химических свойств глюкозы от строения молекулы. Взаимодействие с гидроксидом меди (II) при комнатной температуре и нагревании этерификация, реакция «серебряного зеркала»,гидрирование. Реакции брожения глюкозы: спиртового, молочнокислого. Глюкоза в природе. Биологическая роль глюкозы. Применение глюкозы на основе ее свойств. Фруктоза как изомер глюкозы. Сравнение строения молекул и химических свойств глюкозы и фруктозы. Фруктоза в природе и ее биологическая
роль.
Д и с а х а р и д ы. Строение дисахаридов. Восстанавливающие и невосстанавливающиеся дисахариды. Сахароза, лактоза,мальтоза, их строение и биологическая роль. Гидролиз дисахаридов. Промышленное получение сахарозы из природного сырья.
Сахароза, лактоза,мальтоза, их строение и биологическая роль. Гидролиз дисахаридов. Промышленное получение сахарозы из природного сырья.
П о л и с а х а р и д ы. Крахмал и целлюлоза (сравнительная характеристика: строение, свойства, биологическая роль). Физические свойства полисахаридов. Химические свойства полисахаридов. Гидролиз полисахаридов. Качественная реакция на крахмал. Полисахариды в природе, их биологическая роль. Применение полисахаридов. Понятие об искусственных волокнах.Взаимодействие целлюлозы с неорганическими и карбоновыми кислотами — образование сложных эфиров.
Демонстрации. Образцы углеводов и изделий из них. Взаимодействие сахарозы с гидроксидом меди (II). Получение сахарата кальция и выделение сахарозы из раствора сахарата кальция. Реакция «серебряного зеркала» для глюкозы. Взаимодействие глюкозы с фуксинсернистой кислотой. Отношение растворов сахарозы и мальтозы (лактозы) к гидроксиду меди (II) при нагревании. Ознакомление с физическими свойствами целлюлозы и
Ознакомление с физическими свойствами целлюлозы и
крахмала. Набухание целлюлозы и крахмала в воде. Получениенитрата целлюлозы.
Лабораторные опыты. Ознакомление с физическими свойствами глюкозы (аптечная упаковка, таблетки). Взаимодействие с Cu(OH)2 при различной температуре. Кислотный гидролиз сахарозы. Знакомство с образцами полисахаридов. Обнаружение крахмала с помощью качественной реакции в меде, хлебе, клетчатке, бумаге, клейстере, йогурте, маргарине. Знакомство с коллекцией волокон.
Экспериментальные задачи. Распознавание растворов глюкозы и глицерина. Определение наличия крахмала в меде, хлебе,маргарине.
Тема 8. Азотсодержащие органические вещества (13 часов)
А м и н ы. Состав и строение аминов. Классификация,изомерия и номенклатура аминов. Алифатические амины. Анилин. Получение аминов: алкилирование аммиака, восстановление нитросоединений (реакция Зинина). Физические свойства аминов. Химические свойства аминов: взаимодействие с водой и кислотами. Гомологический ряд ароматических аминов. Алкилирование и ацилирование аминов. Взаимное влияние атомов
Физические свойства аминов. Химические свойства аминов: взаимодействие с водой и кислотами. Гомологический ряд ароматических аминов. Алкилирование и ацилирование аминов. Взаимное влияние атомов
в молекулах на примере аммиака, алифатических и ароматических аминов. Применение аминов.
А м и н о к и с л о т ы и б е л к и. Состав и строение молекул аминокислот. Изомерия аминокислот. Двойственность кислотноосновных свойств аминокислот и ее причины. Взаи-
модействие аминокислот с основаниями. Взаимодействие аминокислот с кислотами, образование сложных эфиров. Образование внутримолекулярных солей (биполярного иона). Реакция поликонденсации аминокислот. Синтетические волокна (капрон, энант и др.). Биологическая роль аминокислот. Применение аминокислот. Белки как природные биополимеры. Пептидная группа атомов и пептидная связь. Пептиды. Белки. Первичная, вторичная и третичная структуры белков. Химические свойства белков: горение, денатурация, гидролиз, качественные (цветные) реакции. Биологические функции белков. Значение белков. Четвертичная структура белков как агрегация белковых и небелковых
Биологические функции белков. Значение белков. Четвертичная структура белков как агрегация белковых и небелковых
молекул. Глобальная проблема белкового голодания и пути ее решения.
Н у к л е и н о в ы е к и с л о т ы. Общий план строения нуклеотидов. Понятие о пиримидиновых и пуриновых основаниях. Первичная, вторичная и третичная структуры молекулы ДНК. Биологическая роль ДНК и РНК. Генная инженерия и биотехнология. Трансгенные формы животных и растений.
Демонстрации. Физические свойства метиламина. Горение метиламина. Взаимодействие анилина и метиламина с водой и кислотами. Отношение бензола и анилина к бромной воде.
Окрашивание тканей анилиновыми красителями. Обнаружение функциональных групп в молекулах аминокислот. Нейтрализация щелочи аминокислотой. Нейтрализация кислоты аминокислотой. Растворение и осаждение белков. Денатурация белков.
Качественные реакции на белки. Модели молекулы ДНК и различных видов молекул РНК. Образцы продуктов питания из трансгенных форм растений и животных; лекарств и препаратов, изготовленных с помощью генной инженерии.
Модели молекулы ДНК и различных видов молекул РНК. Образцы продуктов питания из трансгенных форм растений и животных; лекарств и препаратов, изготовленных с помощью генной инженерии.
Лабораторные опыты. Изготовление шаростержневых моделей молекул изомерных аминов. Изготовление моделей изомерных молекул состава СзН7NO2. Растворение белков в воде и их коагуляция. Обнаружение белка в курином яйце и в молоке.
Тема 9. Биологически активные вещества (14 часов)
В и т а м и н ы. Понятие о витаминах. Их классификация и обозначение. Нормы потребления витаминов. Водорастворимые (на примере витамина С) и жирорастворимые (на примере витаминов А и D) витамины. Понятие об авитаминозах, гипер- и гиповитаминозах. Профилактика авитаминозов. Отдельные представители водорастворимых витаминов (С, РР,группы В) и жирорастворимых витаминов (А, D, Е), их биологическая роль.
Ф е р м е н т ы. Понятие о ферментах как о биологических катализаторах белковой природы. Значение в биологии и применение в промышленности. Классификация ферментов. Особенности строения и свойств ферментов: селективность и эффективность. Зависимость активности фермента от температуры и рН среды. Особенности строения и свойств в сравнении с неорганическими катализаторами.
Понятие о ферментах как о биологических катализаторах белковой природы. Значение в биологии и применение в промышленности. Классификация ферментов. Особенности строения и свойств ферментов: селективность и эффективность. Зависимость активности фермента от температуры и рН среды. Особенности строения и свойств в сравнении с неорганическими катализаторами.
Г о р м о н ы. Понятие о гормонах как биологически активных веществах, выполняющих эндокринную регуляцию жизнедеятельности организмов. Классификация гормонов: стероиды, производные аминокислот, полипептидные и белковые гормоны. Отдельные представители гормонов: эстрадиол, тестостерон, инсулин, адреналин.
Л е к а р с т в а. Понятие о лекарствах как химиотерапевтических препаратах. Группы лекарств: сульфамиды (стрептоцид),антибиотики (пенициллин), аспирин. Безопасные способы применения, лекарственные формы. Краткие исторические сведения о возникновении и развитии химиотерапии. Механизм действия некоторых лекарственных препаратов, строение молекул, прогнозирование свойств на основе анализа химического строения. Антибиотики, их классификация по строению, типу и спектру действия. Дисбактериоз. Наркотики, наркомания и ее профилактика.
Механизм действия некоторых лекарственных препаратов, строение молекул, прогнозирование свойств на основе анализа химического строения. Антибиотики, их классификация по строению, типу и спектру действия. Дисбактериоз. Наркотики, наркомания и ее профилактика.
Демонстрации. Образцы витаминных препаратов. Поливитамины. Иллюстрации фотографий животных с различными формами авитаминозов. Сравнение скорости разложения Н2О2 подействием фермента (каталазы) и неорганических катализаторов
(KI, FеCl3, MnO2). Плакат или кодограмма с изображением структурных формул эстрадиола, тестостерона, адреналина. Взаимодействие адреналина с раствором FeCl3. Белковая природа
инсулина (цветные реакции на белки). Плакаты или кодограммы с формулами амида сульфаниловой кислоты, дигидрофолиевой и ложной дигидрофолиевой кислот, бензилпенициллина, тетрациклина, цефотаксима, аспирина.
Лабораторные опыты. Обнаружение витамина А в растительном масле. Обнаружение витамина С в яблочном соке. Обнаружение витамина D в желтке куриного яйца. Ферментативный гидролиз крахмала под действием амилазы. Разложение пероксида водорода под действием каталазы. Действие дегидрогеназы на метиленовый синий. Испытание растворимости адреналина в воде и соляной кислоте. Обнаружение аспирина в готовой лекарственной форме (реакцией гидролиза или цветной реакцией с сульфатом бериллия).
Обнаружение витамина А в растительном масле. Обнаружение витамина С в яблочном соке. Обнаружение витамина D в желтке куриного яйца. Ферментативный гидролиз крахмала под действием амилазы. Разложение пероксида водорода под действием каталазы. Действие дегидрогеназы на метиленовый синий. Испытание растворимости адреналина в воде и соляной кислоте. Обнаружение аспирина в готовой лекарственной форме (реакцией гидролиза или цветной реакцией с сульфатом бериллия).
Химический практикум
Качественный анализ органических соединений. Углеводороды. Спирты и фенолы. Альдегиды и кетоны. Карбоновые кислоты. Углеводы. Амины, аминокислоты, белки. Идентификация органических соединений. Действие ферментов на различные вещества. Анализ некоторых лекарственных препаратов(аспирина, парацетамола).
Тематическое планирование по химии, 10 класс.
|
№ п/п |
Наименование темы |
Всего часов |
Из них |
|
|
Практические работы |
Контрольные работы |
|||
|
1. |
Тема 1. Введение |
6 |
СКР |
|
|
2. |
Тема 2. Строение и классификация органических соединений, химические реакции в органической химии |
14 |
№ 2 Строение и классификация органических соединений, химические реакции в органической химии |
|
|
3 |
Тема 3. Углеводороды |
25 |
Практическая работа №1: Качественный анализ органических соединений Практическая работа №2 Углеводороды |
№ 3 Углеводороды |
|
4. |
Тема 4. |
8 |
Практическая работа №3 Спирты. |
|
|
5 |
Тема 5. Карбонильные соединения: альдегиды и кетоны |
7 |
Практическая работа №4: Альдегиды и кетоны |
№ 4 Альдегиды и кетоны |
|
6 |
Тема 6. Карбоновые кислоты, сложные эфиры, жиры |
10 |
Практическая работа №5 Карбоновые кислоты |
№ 5 Карбоновые кислоты, сложные эфиры, жиры |
|
7 |
Тема 7. Углеводы |
8 |
Практическая работа №6 Углеводы |
№ 6 Углеводы |
|
8 |
Тема 8. |
13 |
Практическая работа № 7. Амины. Аминокислоты.Белки Практическая работа № 8. Идентификация органических веществ |
№ 7. Азотсодержащие органические соединения № 8 ИКР |
|
9 |
Тема 9. Биологически активные вещества |
11 |
Практическая работа № 9. Обнаружение витаминов Практическая работа №10 Действие ферментов на различные вещества |
|
|
Итого |
102 |
10 |
8 |
|
Приложение 1
Календарно-тематическое планирование
|
№ |
Тема урока |
Дата |
Примечания |
|
Тема 1. |
|||
|
1 |
Предмет органической химии. Место и роль органической химии в системе наук о природе |
||
|
2 |
Теория строения органических соединений А. М. Бутлерова |
||
|
3 |
Строение атома углерода. Ковалентная химическая связь |
||
|
4 |
Валентные состояния атома углерода |
||
|
5 |
Вид гибридизации и форма молекул |
||
|
6 |
Контрольная работа №1. |
||
|
Тема 2. Строение и классификация органических соединений, химические реакции в органической химии (14 часов) |
|||
|
7 |
Классификация органических соединений (по строению углеродного скелета) |
||
|
8 |
Классификация органических соединений (по функциональным группам) |
||
|
9 |
Номенклатура органических соединений |
||
|
10 |
Номенклатура органических соединений |
||
|
11-12 |
Изомерия органических соединений |
||
|
13-14 |
Решение задач на вывод формул органических веществ |
||
|
15-16 |
Типы химических реакций в органической химии |
||
|
17 |
Электронные эффекты в молекулах органических веществ |
||
|
18 |
Химические связи в органических веществах. |
||
|
19 |
Повторение и обобщение изученного материала |
||
|
20 |
Контрольная работа № 2. Строение и классификация органических соединений, химические реакции в органической химии |
||
|
Тема 3. Углеводороды (25 часов) |
|||
|
21 |
Алканы |
||
|
22 |
Химические свойства алканов |
||
|
23 |
Применение и способы получения алканов |
||
|
24 |
Решение задач и упражнений по теме «Алканы» |
||
|
25 |
Практическая работа № 1. |
||
|
26 |
Алкены |
||
|
27 |
Химические свойства алкенов |
||
|
28 |
Применение и способы получения алкенов |
||
|
29 |
Решение задач и упражнений по теме «Алкены» |
||
|
30 |
Алкадиены |
||
|
31 |
Свойства и получение алкадиенов |
||
|
32 |
Основные понятия химии высокомолекулярных соединений |
||
|
33 |
Алкины. |
||
|
34 |
Циклоалканы |
||
|
35 |
Решение задач на вывод формул органических веществ |
||
|
36 |
Решение задач на вывод формул органических веществ по продуктам их сгорания |
||
|
37 |
Ароматические углеводороды |
||
|
38 |
Изомерия и номенклатура гомологов бензола. Получение |
||
|
39 |
Химические свойства аренов |
||
|
40 |
Решение задач и упражнений по теме «Арены» |
||
|
41 |
Природные источники УВ |
||
|
42 |
Обобщение темы «Углеводороды» |
||
|
43 |
Генетическая связь между классами углеводородов |
||
|
44 |
Генетическая связь между классами углеводородов. |
||
|
45 |
Контрольная работа № 3. Углеводороды |
||
|
Тема 4. Спирты и фенолы (8 часов) |
|||
|
46 |
Спирты: состав, классификация, строение |
||
|
47 |
Предельные одноатомные спирты |
||
|
48 |
Химические свойства предельных одноатомных спиртов |
||
|
49 |
Получение предельных одноатомных спиртов |
||
|
50 |
Многоатомные спирты. |
||
|
51 |
Химические свойства фенола. Получение и применение |
||
|
52 |
Фенол. Решение упражнений |
||
|
53 |
Практическая работа № 3. Спирты |
||
|
Тема 5. Карбонильные соединения: альдегиды и кетоны (7 часов) |
|||
|
54 |
Альдегиды и кетоны |
||
|
55 |
Химические свойства альдегидов и кетонов |
||
|
56 |
Химические свойства альдегидов и кетонов |
||
|
57 |
Получение карбонильных соединений. |
||
|
58 |
Решение задач и упражнений |
||
|
60 |
Практическая работа № 4. Альдегиды и кетоны |
||
|
61 |
Контрольная работа № 4 Альдегиды и кетоны |
||
|
Тема 6. Карбоновые кислоты, сложные эфиры, жиры (10 часов) |
|||
|
62 |
Карбоновые кислоты |
||
|
63 |
Одноосновные карбоновые кислоты |
||
|
64 |
Химические свойства предельных одноосновных карбоновых кислот |
||
|
65 |
Практическая работа № 5. |
||
|
66 |
Химические свойства непредельных одноосновных карбоновых кислот |
||
|
67 |
Получение карбоновых кислот. Отдельные представители |
||
|
68 |
Сложные эфиры. Жиры |
||
|
69 |
Соли карбоновых кислот. Мыла |
||
|
70 |
Систематизация и обобщение знаний по теме: «Карбоновые кислоты, сложные эфиры, жиры» |
||
|
71 |
Контрольная работа № 5. |
||
|
Тема 7. Углеводы (8 часов) |
|||
|
72 |
Углеводы |
||
|
73 |
Моносахариды: глюкоза и фруктоза |
||
|
74 |
Моносахариды: рибоза и дезоксирибоза |
||
|
75 |
Дисахариды |
||
|
76 |
Полисахариды: крахмал и целлюлоза |
||
|
77 |
Систематизация и обобщение знаний по теме «Углеводы» |
||
|
78 |
Контрольная работа № 6. |
||
|
79 |
Практическая работа №6. Углеводы |
||
|
Тема 8. Азотсодержащие органические вещества (13 часов) |
|||
|
80 |
Амины |
||
|
81 |
Химические свойства аминов и способы получения |
||
|
82 |
Аминокислоты |
||
|
83 |
Белки |
||
|
84 |
Практическая работа № 7. |
||
|
85 |
|||
|
86 |
Шестичленные азотсодержащие гетероциклические соединения |
||
|
87 |
Пятичленные азотсодержащие гетероциклические соединения |
||
|
88 |
Нуклеиновые кислоты |
||
|
89 |
Обобщение и систематизация знаний по теме «Азотсодержащие органические соединения» |
||
|
90 |
Контрольная работа № 7. Азотсодержащие органические соединения |
||
|
91 |
Практическая работа № 8. |
||
|
92 |
Итоговая Контрольная работа |
||
|
Тема 9. Биологически активные вещества (11 часов) |
|||
|
93-94 |
Ферменты |
||
|
95-96 |
Витамины |
||
|
97-98 |
Гормоны |
||
|
96-99 |
Лекарства |
||
|
100 |
Практическая работа № 9. |
||
|
101 |
Практическая работа № 10. Действие ферментов на различные вещества. |
||
|
102 |
Обобщение по теме БАВ |
Система оценки по предмету:
-
Оценка устного ответа
Отметка «5»:
— ответ полный и правильный на основании изученных теорий;
— материал изложен в определенной логической последовательности, литературным языком;
— ответ самостоятельный.
Ответ «4»;
— ответ полный и правильный на сновании изученных теорий;
— материал изложен в определенной логической последовательности, при этом допущены две-три несущественные ошибки, исправленные по требованию учителя.
Отметка «З»:
— ответ полный, но при этом допущена существенная ошибка или ответ неполный, несвязный.
Отметка «2»:
— при ответе обнаружено непонимание учащимся основного содержания учебного материала или допущены существенные ошибки, которые учащийся не может исправить при наводящих вопросах учителя, отсутствие ответа.
2. Оценка экспериментальных умений
Оценка ставится на основании наблюдения за учащимися и письменного отчета за работу.
Отметка «5»:
— работа выполнена полностью и правильно, сделаны правильные наблюдения и выводы;
— эксперимент осуществлен по плану с учетом техники безопасности и правил работы с веществами и оборудованием;
— проявлены организационно — трудовые умения, поддерживаются чистота рабочего места и порядок (на столе, экономно используются реактивы).
Отметка «4»:
— работа выполнена правильно, сделаны правильные наблюдения и выводы, но при этом эксперимент проведен не полностью или допущены несущественные ошибки в работе с веществами и оборудованием.
Отметка «3»:
— работа выполнена правильно не менее чем наполовину или допущена существенная ошибка в ходе эксперимента в объяснении, в оформлении работы, в соблюдении правил техники безопасности на работе с веществами и оборудованием, которая исправляется по требованию учителя.
Отметка «2»:
— допущены две (и более) существенные ошибки в ходе: эксперимента, в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с веществами и оборудованием, которые учащийся не может исправить даже по требованию учителя;
— работа не выполнена, у учащегося отсутствует экспериментальные умения.
3. Оценка умений решать расчетные задачи
Отметка «5»:
— в логическом рассуждении и решении нет ошибок, задача решена рациональным способом;
Отметка «4»:
— в логическом рассуждении и решения нет существенных ошибок, но задача решена нерациональным способом, или допущено не более двух несущественных ошибок.
Отметка «3»:
— в логическом рассуждении нет существенных ошибок, но допущена существенная ошибка в математических расчетах.
Отметка «2»:
— имеется существенные ошибки в логическом рассуждении и в решении;
— отсутствие ответа на задание.
4. Оценка письменных контрольных работ
Отметка «5»:
— ответ полный и правильный, возможна несущественная ошибка.
Отметка «4»:
— ответ неполный или допущено не более двух несущественных ошибок.
Отметка «3»:
— работа выполнена не менее чем наполовину, допущена одна существенная ошибка и при этом две-три несущественные.
Отметка «2»:
— работа выполнена меньше чем наполовину или содержит несколько существенных ошибок;
— работа не выполнена.
При оценке выполнения письменной контрольной работы необходимо учитывать требования единого орфографического режима.
5. Оценка тестовых работ
Тесты, состоящие из пяти вопросов можно использовать после изучения каждого материала (урока). Тест из 10-15 вопросов используется для периодического контроля. Тест из 20-30 вопросов необходимо использовать для итогового контроля.
При оценивании используется следующая шкала:
Отметка «5»:
80% и более выполнено правильно
Отметка «4»:
70%-80% выполнено правильно
Отметка «3»:
60% -69% выполнено правильно
Отметка «2»:
выполнено правильно менее 60%
Список литературы
Литература, рекомендованная для учащихся:
-Химия. 10 класс. Базовый уровень: учебник для общеобразовательных учреждений /О.С.Габриелян. -М.: Дрофа, 2008
10 класс. Базовый уровень: учебник для общеобразовательных учреждений /О.С.Габриелян. -М.: Дрофа, 2008
— Химия. 10 класс. Профильный уровень: учебник для общеобразовательных учреждений / О.С. Габриелян, Ф.Н. Маскаев и др.– М.: Дрофа, 2009.
-Органическая химия в тестах, задачах, упражнениях. 10 кл. – Габриелян О.С., Остроумов И.Г., М.: Дрофа 2003-2005.
-Тесты по химии: 10-й кл.: к учебнику О.С.Габриеляна и др. «Химия. 10 класс» / М.А.Рябов, Р.В.Линько, Е.Ю.Невская. – М.: «Экзамен», 2006. – 158 с.
— Задачник по химии для учащихся 10 класса общеобразовательных учреждений: Профильный уровень, Кузнецова Н.Е., Лёвкин А.Н.- М.: Вентана-Граф, 2007
-Материалы для подготовки к ЕГЭ: ЕГЭ 2011. Химия. Тематические тренировочные задания / И.А.Соколова. –М.: Эксмо, 2011.
Литература для учителя
-Химия.10 класс. Базовый уровень: учебник для общеобразовательных учреждений /О. С.Габриелян. -М.: Дрофа, 2008
С.Габриелян. -М.: Дрофа, 2008
— Химия. 10 класс. Профильный уровень: учебник для общеобразовательных учреждений / О.С. Габриелян, Ф.Н. Маскаев и др.– М.: Дрофа, 2014
11
ГДЗ ЛОЛ по Химии за 10 класс, спиши ответ онлайн
Химия 10 класс Еремин В.В.
Авторы:
Еремин В.В. Кузьменко Н.Е.
Издательство:
Дрофа 2015
Уровень:
Профильный уровень
Химия 10 класс Рудзитис Г.Е.
Авторы:
Рудзитис Г.Е. Фельдман Ф.Г.
Издательство:
Просвещение
Уровень:
Базовый уровень
Химия 10-11 класс органическая химия Цветков Л.А.
Автор:
Цветков Л.А.
Издательство:
Владос
Химия 10 класс Кузнецова Н.Е.
Авторы:
Кузнецова Н. Е. Гара Н.Н.
Е. Гара Н.Н.
Издательство:
Вентана-граф 2012
Уровень:
Базовый уровень
Химия 10 класс рабочая тетрадь, тестовые задания ЕГЭ Габриелян О.С.
Авторы:
Габриелян О.С. Яшукова А.В.
Издательство:
Дрофа 2016
Уровень:
Базовый уровень
Химия 10 класс рабочая тетрадь Т.Н. Мякинник
Авторы:
Т.Н. Мякинник Н.В. Манкевич
Издательство:
Аверсэв 2015
Химия 10 класс Ерёмин В.В.
Авторы:
Ерёмин В.В. Кузьменко Н.Е.
Издательство:
Дрофа 2015
Уровень:
Базовый уровень
Химия 10 класс Кузнецова Н.Е.
Авторы:
Кузнецова Н.Е. Гара Н.Н.
Издательство:
Вентана-граф 2011
Уровень:
Профильный уровень
Химия 10 класс Гузей Л. С.
С.
Авторы:
Гузей Л.С. Суровцева Р.П.
Издательство:
Дрофа 2001
Химия 10-11 класс дидактический материал Радецкий А.М.
Автор:
Радецкий А.М.
Издательство:
Просвещение 2016
Химия 10 класс О.С. Габриелян
Автор:
О.С. Габриелян
Издательство:
Дрофа 2015
Уровень:
Базовый уровень
Химия 10 класс И.Е. Шиманович
Авторы:
И.Е. Шиманович Е.И. Василевская
Издательство:
Образование и воспитание 2013
Химия 10 класс И.И. Новошинский
Авторы:
И.И. Новошинский Н.С. Новошинская
Издательство:
Русское слово 2015
Химия 10 класс сборник задач В.Н. Хвалюк
Авторы:
В. Н. Хвалюк В.И. Резяпкин
Н. Хвалюк В.И. Резяпкин
Издательство:
Национальный институт образования 2015
Химия 10 класс химический эксперимент И.И. Борушко
Автор:
И.И. Борушко
Издательство:
Сэр-Вит 2015
Химия 8-11 класс сборник задач и упражнений Хомченко И.Г.
Автор:
Хомченко И.Г.
Издательство:
Новая волна 2009
Химия 10 класс Габриелян О.С.
Авторы:
Габриелян О.С. Остроумов И.Г.
Издательство:
Мнемозина 2015
Уровень:
Углубленный уровень
Химия 10 класс Габриелян О.С.
Авторы:
Габриелян О.С. Остроумов И.Г.
Издательство:
Дрофа 2014
Уровень:
Углубленный уровень
Химия 10 класс лабораторные работы Шарапа Е. И.
И.
Авторы:
Шарапа Е.И. Ельницкий А.П.
Издательство:
Аверсэв 2015
Химия 8-11 класс задачник Гольдфарб Я.Л.
Авторы:
Гольдфарб Я.Л. Ходаков Ю.В.
Издательство:
Дрофа 2004
Химия 10 класс рабочая тетрадь Ахметов М.А.
Автор:
Ахметов М.А.
Издательство:
Вентана-граф 2015
Уровень:
Базовый уровень
Химия 10 класс Рудзитис Г.Е.
Авторы:
Рудзитис Г.Е. Фельдман Ф.Г.
Издательство:
Просвещение 2018
Уровень:
Углубленный уровень
Химия 10-11 класс сборник задач Рябов М.А.
Автор:
Рябов М.А.
Издательство:
Экзамен 2017
Химия 10 класс контрольно-измерительные материалы Стрельникова Е. Н.
Н.
Автор:
Стрельникова Е.Н.
Издательство:
ВАКО 2017
Химия 10 класс рабочая тетрадь Габриелян О.С.
Авторы:
Габриелян О.С. Сладков С.А.
Издательство:
Дрофа 2017
Уровень:
Базовый уровень
Химия 10 класс Габриелян О.С.
Авторы:
Габриелян О.С. Остроумов И.Г.
Издательство:
Просвещение 2018
Уровень:
Базовый уровень
Химия 10 класс контрольные и проверочные работы Габриелян О.С.
Авторы:
Габриелян О.С. Березкин П.Н.
Издательство:
Дрофа 2018
Уровень:
Базовый уровень
Химия 10 класс задачник Кузнецова Н.Е.
Авторы:
Кузнецова Н.Е. Левкин А. Н.
Н.
Издательство:
Вентана-граф 2018
Химия 10 класс контрольные и проверочные работы Габриелян О.С.
Авторы:
Габриелян О.С. Сладков С.А.
Издательство:
Дрофа 2016
Уровень:
Углубленный уровень
Химия 10 класс контрольные работы Габриелян О.С.
Авторы:
Габриелян О.С. Сладков С.А.
Издательство:
Дрофа 2016
Химия 10 класс тетрадь для практических работ Матулис В.Э.
Авторы:
Матулис В.Э. Матулис В.Э.
Издательство:
Аверсэв 2020
Уровень:
Базовый уровень
Химия 10 класс тетрадь для практических работ Матулис В.Э.
Авторы:
Матулис В.Э. Матулис В.Э.
Издательство:
Аверсэв 2020
Уровень:
Повышенный уровень
Химия 10 класс Колевич Т. А.
А.
Авторы:
Колевич Т.А. Матулис В.Э.
Издательство:
Образование и воспитание 2019
Уровень:
Повышенный уровень
Химия 10-11 класс сборник задач и упражнений Червина В.В.
Авторы:
Червина В.В. Варламова А.В.
Издательство:
Просвещение 2019
Химия 10 класс тематические тесты Т.А. Боровских
Автор:
Т.А. Боровских
Издательство:
Экзамен 2013
Химия 10 класс тетрадь для практических работ Борушко И.И.
Автор:
Борушко И.И.
Издательство:
Сэр-Вит 2020
Уровень:
Повышенный уровень
Химия 10 класс тетрадь для практических работ Борушко И.И.
Автор:
Борушко И.И.
Издательство:
Сэр-Вит 2020
Уровень:
Базовый уровень
Химия 8-11 класс сборник авторских задач Маршанова Г. Л.
Л.
Автор:
Маршанова Г.Л.
Издательство:
ВАКО 2019
Химия 10 класс С.А. Пузаков
Авторы:
С.А. Пузаков Н.В. Машнина
Издательство:
Просвещение 2021
Уровень:
Углубленный уровень
ГДЗ БОТ по Химии для 10 класса
gdz-bot.ru
Химия О.С. Габриелян 10 класс
тип:
Учебник
автор: О.С. Габриелян
Химия Габриелян О.С. 10 класс
тип:
Учебник
авторы:
Габриелян О. С. Остроумов И.Г.
С. Остроумов И.Г.
Химия Габриелян О.С. 10 класс
тип:
Учебник
авторы:
Габриелян О.С. Остроумов И.Г.
Химия Т.Н. Мякинник 10 класс
тип:
рабочая тетрадь
авторы:
Т.Н. Мякинник Н.В. Манкевич
Химия Шарапа Е.И. 10 класс
тип:
лабораторные работы
авторы:
Шарапа Е. И. Ельницкий А.П.
И. Ельницкий А.П.
Химия Гузей Л.С. 10 класс
тип:
Учебник
авторы:
Гузей Л.С. Суровцева Р.П.
Химия Габриелян О.С. 10 класс
тип:
рабочая тетрадь, тестовые задания ЕГЭ
авторы:
Габриелян О.С. Яшукова А.В.
Химия Еремин В.В. 10 класс
тип:
Учебник
авторы:
Еремин В. В. Кузьменко Н.Е.
В. Кузьменко Н.Е.
Химия Ерёмин В.В. 10 класс
тип:
Учебник
авторы:
Ерёмин В.В. Кузьменко Н.Е.
Химия Хомченко И.Г. 8-11 класс
тип:
сборник задач и упражнений
автор: Хомченко И.Г.
Химия И.Е. Шиманович 10 класс
тип:
Учебник
авторы:
И. Е. Шиманович Е.И. Василевская
Е. Шиманович Е.И. Василевская
Химия Габриелян О.С. 10 класс
тип:
рабочая тетрадь
авторы:
Габриелян О.С. Сладков С.А.
Химия Цветков Л.А. 10-11 класс
тип:
органическая химия
автор: Цветков Л.А.
Химия Гольдфарб Я.Л. 8-11 класс
тип:
задачник
авторы:
Гольдфарб Я. Л. Ходаков Ю.В.
Л. Ходаков Ю.В.
Химия Рудзитис Г.Е. 10 класс
тип:
Учебник
авторы:
Рудзитис Г.Е. Фельдман Ф.Г.
Химия Радецкий А.М. 10-11 класс
тип:
дидактический материал
автор: Радецкий А.М.
Химия В.Н. Хвалюк 10 класс
тип:
сборник задач
авторы:
В. Н. Хвалюк В.И. Резяпкин
Н. Хвалюк В.И. Резяпкин
Химия И.И. Борушко 10 класс
тип:
химический эксперимент
автор: И.И. Борушко
[email protected]
gdz-bot.ru © 2022 при поддержке gdz.ru 💙
Учебники для школьников по химии
|
|
|
12.7 Mb |
|
|
|
djvu |
1.1 Mb |
|
|
|
|
4 Mb |
|
|
|
|
8.7 Mb |
|
|
|
|
10.1 Mb |
|
|
|
|
6.4 Mb |
|
|
|
|
5.4 Mb |
|
|
|
djvu |
1.4 Mb |
|
|
|
djvu |
5.1 Mb |
|
|
|
djvu |
4.7 Mb |
|
|
|
|
5.8 Mb |
|
|
|
djvu |
1.6 Mb |
|
|
|
djvu |
7.5 Mb |
|
|
|
djvu |
4 Mb |
|
|
|
djvu |
4.1 Mb |
|
|
|
djvu |
4. |
|
|
|
|
5.6 Mb |
|
|
|
|
1.3 Mb |
|
|
|
djvu |
8.5 Mb |
|
|
|
|
2.4 Mb |
|
|
|
|
1.1 Mb |
|
|
|
|
49 Mb |
|
|
|
|
60 Mb |
|
|
|
|
49 Mb |
|
|
|
|
48.5 Mb |
|
|
|
|
17.4 Mb |
|
|
|
djvu |
1.5 Mb |
|
|
|
djvu |
1.3 Mb |
|
|
|
|
57 Mb |
|
|
|
|
83 Mb |
|
|
|
|
24 Mb 22.5 Mb |
2007 |
|
|
|
88.6 Mb |
|
|
|
|
67 Mb |
|
|
|
|
28,4 Mb |
|
|
|
|
77 Mb |
|
|
|
djvu |
3.8 Mb |
|
|
|
djvu |
4.2 Mb |
|
|
|
|
40 Mb |
|
|
|
|
27 Mb |
|
|
|
|
29 Mb |
|
|
|
|
32 Mb |
|
|
|
djvu |
74.3 Mb 5.9 Mb |
2009 |
|
|
djvu |
14.8 Mb |
|
|
|
|
39 Mb 46 Mb |
2011 |
|
|
|
38 Mb |
|
|
|
djvu |
6.5 Mb |
|
|
|
|
11.9 Mb |
|
|
|
|
29.5 Mb |
|
|
|
|
35.3 Mb |
|
|
|
djvu |
51.2 Mb 6.9 Mb |
2010 |
|
|
|
51.5 Mb |
|
|
|
|
5 Mb |
|
|
|
djvu |
39.2 Mb 56.4 Mb 4 Mb |
2013 2001 |
|
|
|
44 Mb |
|
|
|
djvu |
5.1 Mb |
|
|
|
|
44.3 Mb |
|
|
|
|
29.1 Mb |
|
|
|
|
28 Mb |
|
|
|
|
5.4 Mb |
|
|
|
|
35.1 Mb |
|
|
|
|
40 Mb |
|
|
|
djvu |
4.5 Mb |
|
|
|
|
49 Mb 18.6 Mb |
2012 |
|
|
|
63 Mb |
|
|
|
djvu |
1.2 Mb |
|
|
|
|
2.8 Mb |
|
Анализ умк габриелян по химии. Химия
Линейка учебных комплектов (ТМК) «Химия» (авторы: Габриелян О. С. и др.) предназначена для 7-11 классов общеобразовательных учреждений. УМК выпускает издательство «Дрофа»
С. и др.) предназначена для 7-11 классов общеобразовательных учреждений. УМК выпускает издательство «Дрофа»
.
Курс химии Габриеляна основан на ключевом понятии «химический элемент» в виде трех форм его существования (атомы, простые вещества, соединения с другими элементами). Ведущая идея курса заключается в том, что знания не запоминаются, а выводятся на основе минимальной, но тщательно подобранной исходной информации, например, о строении атома. С первых же уроков учащиеся знакомятся с таблицей Д. И. Менделеева.
Учебники по химии Габриелян О.С. включены в федеральный перечень учебников, рекомендованных к использованию при реализации государственных образовательных программ начального общего, основного общего, среднего общего образования (Приказ Минобрнауки России от 31 марта 2014 г. N 253). Содержание учебников соответствует федеральному государственному образовательному стандарту основного общего образования (ООО ФГОС 2010).
Линия открывается пропедевтический курс
за изучение химии в 7 классе. Этот курс готовит учащихся к восприятию нового предмета и основан на изучении веществ и химических реакций, знакомых школьникам из повседневной жизни, с минимальным использованием химических формул, уравнений реакций и расчетных задач. Тема письма «Химия. Вводный курс. «7 класс» используется в рамках основной образовательной программы, формируемой участниками образовательных отношений.
Этот курс готовит учащихся к восприятию нового предмета и основан на изучении веществ и химических реакций, знакомых школьникам из повседневной жизни, с минимальным использованием химических формул, уравнений реакций и расчетных задач. Тема письма «Химия. Вводный курс. «7 класс» используется в рамках основной образовательной программы, формируемой участниками образовательных отношений.
Состав УМК «Химия. Вводный курс» для 7 класса:
— Учебник с электронным приложением (на сайте издательства). Авторы: Габриелян О.С., Остроумов И.Г., Ахлебинин А.К.
— Рабочая тетрадь. Авторы: Габриелян О.С., Шипарева Г.А.
— Практикум. Авторы: Габриелян О. С., Аксенова И. В.
— Методическое пособие Авторы: Габриелян О. С., Шипарева Г. А.
Сочинение УМК «Химия» Габриелян О. С. и др. для 8-9 классов:
— Учебник с электронным приложением (на сайте издательства). 8, 9 классы. Автор: Габриелян О.С.
— Рабочая тетрадь. 8, 9 классы. Авторы: Габриелян О. С., Сладков С.А.
С., Сладков С.А.
— Тетрадь для лабораторных опытов и практических работ. 8, 9 классы. Авторы: Габриелян О.С., Яшукова А.В.
— Контрольно-проверочные работы. 8, 9 классы. Авторы: Габриелян О.С. и др.
— Тетрадь для оценки качества знаний по химии. 8, 9 классы. Авторы: Габриелян О.С., Купцова А.В.
— Диагностические работы. 8 класс. Автор: Купцова А.В.
— Химия в тестах, задачах, упражнениях. Руководство. 8 класс. Авторы: Габриелян О.С., Смирнова Т.В., Сладков С.А.
— Мультимедийное приложение. 8, 9 классы. Автор: Габриелян О.С.
— Вода в нашей жизни. Инструментарий. 8-9 классы. Авторы: Габриелян О.С., Попкова Т.Н., Сивкова Г.А., Сладков С.А.
— Инструментарий. 8-9 классы. Авторы: Габриелян О.С., Купцова А.В.
— Рабочие программы. 7-9 классы.
учебники
Габриелян «Химия. 8 класс» и «Химия. 9 класс» составляют комплекс, который служит полным курсом химии для основной школы. Красочные иллюстрации, разнообразные вопросы и задания способствуют активному усвоению учебного материала. Основные правила и определения, ключевые слова и фразы выделены в тексте таким образом, что зрительная память учащегося также способствует их более прочному запоминанию. В конце каждого абзаца приводится список вопросов, направленных на демонстрацию связи химии с другими науками и повседневной жизнью. Электронные приложения к учебникам доступны на сайте издательства «Дрофа».
Основные правила и определения, ключевые слова и фразы выделены в тексте таким образом, что зрительная память учащегося также способствует их более прочному запоминанию. В конце каждого абзаца приводится список вопросов, направленных на демонстрацию связи химии с другими науками и повседневной жизнью. Электронные приложения к учебникам доступны на сайте издательства «Дрофа».
Рабочие тетради
содержат большое количество заданий, которые можно использовать для развития навыков и умений, для закрепления основных понятий, содержащихся в учебниках. Также тетради можно использовать с учебниками, соответствующими Федеральному компоненту ГОСО.
Тетради для лабораторных опытов и практических работ
содержит инструкции для лабораторных опытов и практических работ, предусмотренных программой.
Контрольно-проверочные работы
состоят из текстов контрольно-проверочных работ, соответствующих программе по химии для 8 и 9 классов О. С. Габриелян. Пособие предназначено для проведения текущего и итогового контроля по основным темам курса на уроках.
С. Габриелян. Пособие предназначено для проведения текущего и итогового контроля по основным темам курса на уроках.
Тетради для оценки качества знаний по химии
входят в состав учебно-методических материалов и включают проверочную работу по соответствующим разделам учебника. Тетради можно использовать как на уроках, так и в процессе самостоятельной работы.
Учебное пособие «Химия в тестах, задачах, упражнениях»
за 8 класс содержит разнообразные задания (тесты, задания со свободно построенным ответом, расчетные задания) двух уровней сложности, в том числе в форматах ГИА и ЕГЭ. Рассмотрены подходы к решению задач различного типа. В конце каждого раздела имеются контрольные работы по теме, состоящие из двух частей – обязательной и дополнительной (повышенной сложности). На все вопросы ответили.
Пособие «Диагностическая работа»
предназначена для организации тематического и итогового контроля предметных и метапредметных результатов изучения химии в 8 классе. Диагностическая работа поможет учителю объективно оценить результаты обучения, учащимся — подготовиться к итоговой аттестации (ГИА), прибегая к самопроверке, а родителям — организовать работу над ошибками при выполнении учащимися домашнего задания.
Диагностическая работа поможет учителю объективно оценить результаты обучения, учащимся — подготовиться к итоговой аттестации (ГИА), прибегая к самопроверке, а родителям — организовать работу над ошибками при выполнении учащимися домашнего задания.
мультимедийные средства
к учебникам О.С. Габриеляна включают информационные объекты различного типа: иллюстрации, анимационные фрагменты, видеоролики, интерактивы, трехмерные модели. Для удобства использования в учебном процессе все предметы структурированы в соответствии с оглавлением учебника. Электронные пособия включают в себя уроки, включающие анимации, помогающие усваивать новый материал, интерактивные модули управления, которые можно использовать как для обучения, так и для контроля знаний, виртуальные лаборатории.
Пособие «Вода в нашей жизни»
предназначен для учителей. Содержит дополнительные материалы для О.С. Габриеляна для 8-9 классов.
Набор инструментов
содержит примерное тематическое планирование программного материала для 8 и 9 классов и методические рекомендации по новым и наиболее сложным темам курса.
Сборник «Химия. Рабочие программы. 7-9 классы»
содержит: программу курса химии для 7 класса и программу основного общего образования по химии Габриелян О.С. и другие для 8-9 классов, программа основного общего образования по химии Еремина В.В. и другие для 8-9 классов.
Если вам понравился материал, нажмите кнопку вашей социальной сети:
«Разбор учебных материалов по химии»
Габриелян О.С. Химия 2014 Дрофа
II. Структура УМК:
2. Учебники;
3. Рабочие тетради;
4. Учебно-методические пособия для учителей;
5. Мультимедийные приложения.
III. Содержание компонентов УМК:
1. Автор программы О.С. Габриелян построили курс химии на основе концентрического подхода, где весь теоретический материал рассматривается на первом году обучения (8 класс). В 9 классе продолжается изучение химии элементов и преподается краткий курс органической химии. В 10 классе изучаются важнейшие органические соединения. В 11 классе происходит обобщение и углубление знаний по общей химии.
В 11 классе происходит обобщение и углубление знаний по общей химии.
Ведущая идея курса заключается в том, что знания не запоминаются, а выводятся
на основе минимальной, но тщательно отобранной исходной информации.
Курс химии Габриеляна основан на ключевом понятии «химический элемент» в виде трех форм его существования (атомы, простые вещества, соединения с другими элементами). Студентам предлагается не запоминать набор химических фактов, а формировать эти знания на основе общих принципов, теорий и законов химии. Например, учет особенностей строения органического вещества, электронных и пространственных эффектов, заключенных в его фрагментах, позволяет предсказывать (а не запоминать) химические свойства соединения.
2. Учебники по химии Габриелян О.С. включены в федеральный перечень учебников, рекомендованных к использованию при реализации государственных образовательных программ начального общего, основного общего, среднего общего образования (Приказ Минобрнауки России от 31 марта 2014 г. N 253). Содержание учебников соответствует федеральному государственному образовательному стандарту основного общего образования (ООО ФГОС 2010).
N 253). Содержание учебников соответствует федеральному государственному образовательному стандарту основного общего образования (ООО ФГОС 2010).
Учебники Габриеляна «Химия. 8 класс» и «Химия. 9 класс» составляют комплекс, служащий полным курсом химии для основной школы. Красочные иллюстрации, разнообразные вопросы и задания способствуют активному усвоению учебного материала. В тексте выделены основные правила и определения, ключевые слова и фразы таким образом, что зрительная память учащегося также способствует их более прочному запоминанию.В конце каждого параграфа приводится перечень вопросов, направленных на демонстрацию связи химии с другими науками и повседневной жизнью.Учебник построен с учетом осуществление межпредметных связей с курсом физики 7 класса, где изучаются основные сведения о строении молекул и атомов, и биологии 6-8 классов, где дается ознакомление с химической организацией клетки и обменными процессами. Методический аппарат учебников построен таким образом, чтобы способствовать более прочному усвоению материала. . Дифференцированные вопросы и задания, в том числе носящие творческий характер и требующие работы с различными источниками информации, в том числе интернет-ресурсами, и темы для обсуждения, приведенные в конце каждой главы учебника, способствуют мотивации учащихся к изучению предмета и помогают подготовиться к итоговая аттестация в форме ОГЭ.
. Дифференцированные вопросы и задания, в том числе носящие творческий характер и требующие работы с различными источниками информации, в том числе интернет-ресурсами, и темы для обсуждения, приведенные в конце каждой главы учебника, способствуют мотивации учащихся к изучению предмета и помогают подготовиться к итоговая аттестация в форме ОГЭ.
Учебное пособие по курсу «Химия. 10 класс. Продвинутый уровень» отличается от всех существующих своей глубокой практической направленностью. Материал дан в связи с экологическими, медицинскими, биологическими, культурологическими аспектами познания. Особо хотелось бы подчеркнуть актуальность изложенного впервые в отечественных школьных учебниках материала главы «Биологически активные соединения», в которой автор знакомит учащихся с такими жизненно важными веществами, как витамины, ферменты, гормоны и лекарственные средства. Глава очень интересная. Акцентируется внимание на острых социальных проблемах современного общества, таких как наркомания. Учебники рассчитаны на изучение химии 3/4 часа в неделю. Учебник «Химия. 11 класс. Продвинутый уровень» завершает и обобщает курс химии, представленный в учебниках для 8–10 классов. Ведущая идея учебника – способствовать формированию у выпускников школ единой химической картины мира через единство основных понятий, законов и теорий неорганической и органической химии.
Учебники рассчитаны на изучение химии 3/4 часа в неделю. Учебник «Химия. 11 класс. Продвинутый уровень» завершает и обобщает курс химии, представленный в учебниках для 8–10 классов. Ведущая идея учебника – способствовать формированию у выпускников школ единой химической картины мира через единство основных понятий, законов и теорий неорганической и органической химии.
Интересен химический эксперимент, представленный в учебниках. Отдельные работы сгруппированы в блоки.
3. Рабочие тетради содержат большое количество заданий, которые можно использовать для развития навыков и умений, для закрепления основных понятий, содержащихся в учебниках.
Первая часть из них представляет собой четкую, лаконичную и очень информативную справочную сводку учебного материала каждого параграфа. Конспект, который создается в сотворчестве и сотрудничестве учителя и учащихся, может быть оформлен не только на уроке, но и дома или на следующем уроке в ходе опроса (решает учитель). Вторая часть тетради также «работает» на результат: выполнение заданий, данных в ней по параграфам, позволяет не только усвоить материал, но и получить опыт применения знаний в ходе самостоятельной и контрольной работы, и впоследствии на экзаменах в виде ГИА и ЕГЭ, поэтому многие задания предлагаются в формате госиспытаний.
Специальными знаками отмечены задания, направленные на формирование метапредметных умений (планирование деятельности, выделение различных признаков, сравнение, классификация, установление причинно-следственных связей, преобразование информации и др.) и личностных качеств учащихся.
Тетради для лабораторных опытов и практических работ содержат указания по проведению лабораторных опытов и практических работ, предусмотренные программой.
Тетради для оценки качества знаний по химии входят в состав УМК и включают контрольные работы по соответствующим разделам учебника. Тетради можно использовать как на уроках, так и в процессе самостоятельной работы.
4. Учебно-методические пособия содержат примерное тематическое планирование программного материала и методические рекомендации по новым и наиболее сложным темам курса,
серия обобщающих таблиц и диаграмм по наиболее важным темам курса, методические рекомендации по их использованию в процессе обучения и, главное, при переходе на новые ФГОС, формируемые универсальные учебные действия различных типов. Для реализации идеи целеполагания в пособии, например, 11кл продвинутый уровень, даны рекомендации по изучению темы, часто отсутствующей в учебниках других авторов, — «Химия в жизни общества». Хочу отметить, что методические пособия для учителей постоянно совершенствуются, это огромное подспорье в их работе, так как мои ученики ежегодно сдают ОГЭ и ЕГЭ по химии.
Для реализации идеи целеполагания в пособии, например, 11кл продвинутый уровень, даны рекомендации по изучению темы, часто отсутствующей в учебниках других авторов, — «Химия в жизни общества». Хочу отметить, что методические пособия для учителей постоянно совершенствуются, это огромное подспорье в их работе, так как мои ученики ежегодно сдают ОГЭ и ЕГЭ по химии.
5.
Мультимедийные руководства для O.S. Габриеляна включают информационные объекты различного типа: иллюстрации, анимационные фрагменты, видеоролики, интерактивы, трехмерные модели. Для удобства использования в учебном процессе все предметы структурированы в соответствии с оглавлением учебника. Электронные пособия включают в себя уроки, включающие анимации, помогающие усваивать новый материал, интерактивные модули управления, которые можно использовать как для обучения, так и для контроля знаний, виртуальные лаборатории.
Использование электронного издания на уроках делает обучение более эффективным и информативным, использование во внеаудиторной работе или самоподготовке помогает лучше изучить, запомнить и усвоить материал учебника.
IV. Стандарты второго поколения ориентированы на замену знаниевой парадигмы в обучении на компетентностную, когда школьники не овладевают суммой знаний и умений, а учатся получать, анализировать, обрабатывать эти знания — осваивают универсальную учебную деятельность. которые позволяют достичь метапредметных, предметных и личностных результатов образования. И это эффективно с WMC O.S. Габриелян
Учебно-методический комплекс О.С. Габриеляна позволяет осуществить интеграцию химических знаний с гуманитарными науками: историей, литературой, мировой художественной культурой. Используя необычный прием художественного изображения при описании химического объекта, автор приводит многочисленные яркие, оригинальные примеры из литературы и истории. А это, в свою очередь, позволяет средствами предмета показать роль химии в нехимической сфере деятельности человека. Внутрипредметная интеграция охватывает однородный материал из программы разных лет обучения, что позволяет сформировать представление о химии как целостной науке, показать единство ее понятий, законов и теорий, их универсальность и применимость, как для неорганической, так и для органической химии.
Учебно-методические материалы Габриеляна постоянно развиваются и дополняются, остаются актуальными и соответствуют образовательным стандартам.
Библиография:
1. Кульневич С.В., Лакоценина Т.П. «Анализ современного урока» Практическое пособие ТУ «Учитель», 2002.
2. Подходова Н.С., Титова И.М. Метаметодология как новое научное направление // «Метаметодология: продуктивный диалог предметных методов обучения» Сборник научных трудов по непрерывному образованию . Проблема. 4. – СПб: «Культ-Информ-Пресс», 2004. – С. 5 – 17.
3. Бурая И.В. Интеграция знаний и умений как условие творческого саморазвития личности./ И.В. Бурая, О.С. Аран // Химия в школе. — 2001. — № 10. — С.23-32
В учебниках химии О.С. Габриелян максимально доступно излагает материал для учащихся, задания в конце параграфов направлены на формирование различных УУД.
Хотелось бы добавить направления проектно-изыскательской работы и справочник по химии для подготовки к вузам в СМС.
Пятых Татьяна Васильевна , учитель химии и биологии МАОУВ (С) Школа №13 города Тюмени
Многие из нас преподавали Габриелян О.С. на протяжении многих лет, и мне было очень приятно видеть его на вашем вебинаре! Как приятно, что автор таких заслуженных учебников может общаться с людьми из разных уголков нашей страны! Спасибо за вебинары по химии.
Керчинская Р.К. , учитель химии, Ейск
Просмотрел всю серию вебинаров Ахметова М.А. Иногда была плохая связь, но все равно большое спасибо за возможность проконсультировать по вопросам, которые волновали меня во время подготовки моих студентов к экзамену! С сентября снова начинаю смотреть ваши вебинары по химии!
Филимонова П.У. , учитель химии и биологии, г. Гусь-Хрустальный
Достоинства методических пособий Габриеляна О.С. по химии: наглядность изложения материала, красочность, примеры из жизни и истории. Очень хотелось бы иметь электронное приложение для учителей: планирование в ворде с датами по плану и собственно с домашними заданиями.
Шевченко Алла Вячеславрна , учитель химии МБОУ Лицей N4, г. Воронеж
Все учебники имеют продуманную, выверенную, научно и методически обоснованную структуру. УМК полностью соответствует ФГОС нового поколения, позволяет в полной мере реализовать системно-деятельностный подход к обучению и воспитанию, что способствует развитию ключевых компетенций, формированию универсальных учебных действий.
Наличие рабочих тетрадей и тетрадей для лабораторных и практических работ экономит время студентов, кроме того, рабочие тетради являются незаменимыми учебными пособиями при подготовке студентов к будущей сдаче ГИА (ОГЭ) и ЕГЭ.
Зубцова Е.Г. , учитель химии и биологии, СОШ №17, г. Подольск, Московская область
Логика построения курса, предполагающего совершенствование знаний по концентрическому принципу построения программ, понятна школьникам и, в то же время соответствует логике вузовских учебников.
Учет системно-деятельностного подхода, активное освоение учащимися универсальных учебных действий на основе содержания химических наук при сохранении знаниевой составляющей школьного курса химии — таковы основные характеристики учебно-методических материалов.
Учебники хорошо написаны и понятны.
Деглина Т.Е. , Учитель химии, Гимназия № 1, г. Воскресенск, Московская область
ВКМ содержит весь необходимый теоретический и практический материал, предусмотренный государственным образовательным стандартом по химии.
Стандарты второго поколения ориентированы на смену парадигмы знаний в обучении на компетентностную, когда школьники не овладевают суммой знаний и умений, а учатся получать, анализировать, обрабатывать эти знания — осваивают универсальные учебная деятельность, позволяющая достичь метапредметных, предметных и личностных результатов образования. Сегодня важно решить проблему стандартизации школьного химического образования. Это также связано с тем, что школы переходят на новые, более свободные формы организации учебного процесса. Федеральный государственный стандарт общего образования определяет нормы и требования к обязательному минимуму содержания основных образовательных программ общего образования, максимальный объем учебной нагрузки обучающихся, уровень подготовки выпускников образовательных учреждений, а также основные требования для обеспечения учебного процесса. Государственный стандарт общего образования служит основой для разработки учебных планов, примерных программ по учебным предметам; объективная оценка уровня подготовки выпускников образовательных учреждений; объективная оценка деятельности самих образовательных учреждений; установление федеральных требований к образовательным учреждениям в части оснащения учебного процесса, оснащения учебных помещений.
Государственный стандарт общего образования служит основой для разработки учебных планов, примерных программ по учебным предметам; объективная оценка уровня подготовки выпускников образовательных учреждений; объективная оценка деятельности самих образовательных учреждений; установление федеральных требований к образовательным учреждениям в части оснащения учебного процесса, оснащения учебных помещений.
В связи с изменениями, происходящими в обществе и системе образования, меняется структура и содержание школьного предмета химия. В настоящее время разработаны программы по химии и методическое обеспечение к ним для разных профилей обучения и разных типов школ, что обеспечивает вариативность. Однако реализация идеи развивающего и личностно-ориентированного школьного химического образования остается проблематичной, т.к. количество часов на изучение химии в 8-11 классах уменьшилось, а программы и учебники, которые преподаются, рассчитаны на большее учебное время, что приводит к повышению уровня абстрактности содержания уроков, сокращению время для химического эксперимента и объективная невозможность более широкого использования методов обучения для развития творческих и интеллектуальных способностей ребенка. Существует опасность формализма в знаниях учащихся. Необходимо найти пути и средства для предотвращения этого. Химическое образование является основой научного понимания мира, дает знания об основных методах изучения природы, научных теориях и закономерностях, формирует умение исследовать и объяснять явления природы и техники. Школьное химическое образование должно служить основой экологически грамотного поведения человека.
Существует опасность формализма в знаниях учащихся. Необходимо найти пути и средства для предотвращения этого. Химическое образование является основой научного понимания мира, дает знания об основных методах изучения природы, научных теориях и закономерностях, формирует умение исследовать и объяснять явления природы и техники. Школьное химическое образование должно служить основой экологически грамотного поведения человека.
Гдз химия 11 базовый уровень.
Рабочая программа по химии для 11 класса по учебнику автора Габриеляна С.С., несмотря на то, что она представляет собой базовый уровень знаний, непроста для освоения старшеклассниками. Поэтому для облегчения процесса обучения специалисты рекомендуют использовать решение, составленное на основе данной публикации.
Темы, изучаемые в одиннадцатом классе по химии
В соответствии с ФГОС темы, которые должны освоить учащиеся, представляют собой совокупность следующих разделов:
- строение атома и периодический закон Менделеева;
- связи и соединения веществ;
- химические реакции, их скорость и зависимость от природы реагирующих компонентов, концентрации и других параметров;
- основания органические и неорганические;
- способов защиты металлов от коррозии.

Как видно из набора, нужно уделить немало времени, чтобы все это отработать на достаточно высоком уровне. Но у одних не хватает времени, так как нужно готовиться к основным экзаменам ЕГЭ, а другим не хватает опыта и навыков, чтобы освоить все необходимое. В любом случае, вы можете обратиться к готовым домашним заданиям по решению этой задачи. Они также будут полезны подросткам, планирующим поступать в институты по этому профилю.
В чем особенности и преимущества использования ГДЗ для учебника химии за 11 класс от Габриеляна
Учащиеся, которые в своем обучении задействуют книгу-решение, имеют ряд преимуществ перед остальными. Они следующие:
- Вне зависимости от сложности домашнего задания, студент способен с ним справиться. И даже если у него не получится выполнить ее самостоятельно, он может проанализировать решения, предложенные специалистами, чтобы в дальнейшем осуществить все индивидуально;
- непонятные и сложные можно рассмотреть подробно, чтобы избежать проблем в будущем;
- если этот предмет нужен студенту для дальнейшего поступления в высшие учебные заведения, то он может, развивая однотипные, автоматизировать собственные навыки во всем, что предусмотрено рабочей программой;
- вы можете избежать репетиторства.
 Все числа представлены здесь последовательно, с разбором полного алгоритма решения, поэтому даже слабо владеющие дисциплиной студенты без труда разберутся в сути манипуляций;
Все числа представлены здесь последовательно, с разбором полного алгоритма решения, поэтому даже слабо владеющие дисциплиной студенты без труда разберутся в сути манипуляций; - при правильном подходе к этому справочно-информационному материалу можно значительно улучшить свои оценки по предмету. Все контрольные, проверочные работы и испытания будут выполняться проще, чем раньше.
Пользоваться ГДЗ можно как онлайн, так и в печатной версии. Ресурс предлагает не только запланированные упражнения, но и видеоуроки, которые делают информацию еще более доступной. Не упустите шанс укрепить свои знания в области химии, развивая определенный навык.
Учебник продолжает курс химии для средней школы, изложенный в учебнике О.С. Габриелян «Химия. Базовый уровень. 10 класс». Может использоваться в курсе основной общей химии.
Учебник соответствует ФГОС среднего (полного) общего образования.
Периодический закон и строение атома.
Периодический закон и Периодическая система химических элементов Д. И. Менделеева — величайшее открытие конца XIX в. в области химии, основа современной химии, динамичное и развивающееся учение, отражающее явления, реально существующие в природе, а потому никогда не потерявшие своей актуальности. значение
И. Менделеева — величайшее открытие конца XIX в. в области химии, основа современной химии, динамичное и развивающееся учение, отражающее явления, реально существующие в природе, а потому никогда не потерявшие своей актуальности. значение
Открытие Периодического закона и Периодической системы было подготовлено всем ходом истории развития химии, но понадобился гений Д. И. Менделеева, его дар научного предвидения, чтобы эти закономерности были сформулированы и графически представлены в виде таблицы.
Содержание
ГЛАВА ПЕРВАЯ. Строение вещества
§ 1. Основные сведения о строении атома.
§ 2. Периодический закон и строение атома.
§ 3. Ионная химическая связь.
§ 4. Ковалентная химическая связь.
§ 5. Химическая связь металлов.
§ 6. Водородная химическая связь.
§ 7. Полимеры.
§ 8. Газообразные вещества.
§ 9. Жидкие вещества.
§ 10. Твердые вещества.
§ 11. Дисперсные системы.
§ 12. Состав материи. Миксы.
Миксы.
ГЛАВА ВТОРАЯ. химические реакции
§ 13. Понятие о химической реакции. Реакции, протекающие без изменения состава веществ.
§ 14. Классификация химических реакций, протекающих с изменением состава веществ
§ 15. Скорость химической реакции.
§ 16. Обратимость химической реакции. Химическое равновесие и методы его смещения.
§ 17. Роль воды в химических реакциях.
§ 18. Гидролиз.
§ 19. Окислительно-восстановительные реакции.
Электролиз.
ГЛАВА ТРЕТЬЯ. Вещества и их свойства
§ 20. Металлы.
§ 21. Неметаллы.
§ 22. Кислоты.
§ 23. Основания.
§ 24. Соли.
§ 25. Генетическая связь между классами неорганического и органического вещества.
ЗАКЛЮЧЕНИЕ.
ЛАБОРАТОРНЫЕ ОПЫТЫ
1. Описание свойств некоторых веществ по типу кристаллической решетки
2. Ознакомление с коллекцией полимеров: пластмасс и волокон и изделий из них.
3. Жесткость воды. Устранение жесткости воды.
4. Знакомство с минеральными водами.
5. Знакомство с дисперсными системами.
6. Реакция замещения меди железом в растворе медного купороса.
7. Получение кислорода разложением пероксида водорода с использованием оксида марганца (IV) и каталазы сырого картофеля.
8. Получение водорода.
9. Различные случаи гидролиза солей.
10. Анализ растворов кислот, оснований и солей с индикаторами.
11. Получение и свойства нерастворимых оснований.
12. Гидролиз хлоридов и ацетатов щелочных металлов.
13. Ознакомление со сбором металлов.
14. Знакомство с коллекцией неметаллов.
15. Ознакомление со сбором кислот.
16. Ознакомление со сбором баз.
17. Ознакомление с коллекцией минералов, содержащих соли.
ПРАКТИЧЕСКАЯ РАБОТА
Практическая работа №1. Получение, сбор и распознавание газов.
Практикум № 2. Химические свойства кислот.
Практикум № 3. Распознавание веществ.
Проектная деятельность.
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ.
Бесплатно скачать электронную книгу в удобном формате, смотреть и читать:
Скачать книгу Химия, базовый уровень, 11 класс, учебник Габриелян О.С., 2014 — fileskachat.com, скачать быстро и бесплатно.
- Химия, 11 класс, рабочая тетрадь к учебнику Габриелян О.С. «Химия, 11 класс, базовый уровень», Габриелян О.С., Яшукова А.В., 2014
- Естествознание. Базовый уровень. 11 класс, Габриелян О.С., Остроумов И.Г., Пурышева Н.С., Сладков С.А., Сивоглазов В.И., 2014
- Спецификация контрольно-измерительных материалов к ЕГЭ по ХИМИИ в 2019 г. 11 класс 2019 г.
Рабочая программа по химии для 11 класса по учебнику автора Габриеляна С.С., несмотря на то, что она представляет собой базовый уровень знаний, непроста для освоения старшеклассниками. Поэтому для облегчения процесса обучения специалисты рекомендуют использовать решение, составленное на основе данной публикации.
Темы, изучаемые в одиннадцатом классе по химии
В соответствии с ФГОС темы, которые должны освоить обучающиеся, представляют собой комплекс следующих разделов:
- строение атома и периодический закон Менделеева;
- связи и соединения веществ;
- химические реакции, их скорость и зависимость от природы реагирующих компонентов, концентрации и других параметров;
- основания органические и неорганические;
- способов защиты металлов от коррозии.

Как видно по набору, нужно потратить немало времени, чтобы все это отработать на достаточно высоком уровне. Но у одних не хватает времени, так как нужно готовиться к основным экзаменам ЕГЭ, а другим не хватает опыта и навыков, чтобы освоить все необходимое. В любом случае, вы можете обратиться к готовым домашним заданиям по решению этой задачи. Они также будут полезны подросткам, планирующим поступать в институты по этому профилю.
В чем особенности и преимущества использования ГДЗ для учебника химии для 11 класса от Габриеляна
Учащиеся, которые в процессе обучения используют книгу с решениями, имеют ряд преимуществ перед остальными. Они следующие:
- вне зависимости от сложности домашнего задания, ученик способен с ним справиться. И даже если у него не получится выполнить ее самостоятельно, он может проанализировать решения, предложенные специалистами, чтобы в дальнейшем осуществить все индивидуально;
- непонятные и сложные можно рассмотреть подробно, чтобы избежать проблем в будущем;
- если этот предмет нужен студенту для дальнейшего поступления в высшие учебные заведения, то он может, развивая однотипные, автоматизировать собственные навыки во всем, что предусмотрено рабочей программой;
- вы можете избежать репетиторства.
 Все числа представлены здесь последовательно, с разбором полного алгоритма решения, поэтому даже слабо владеющие дисциплиной студенты без труда разберутся в сути манипуляций;
Все числа представлены здесь последовательно, с разбором полного алгоритма решения, поэтому даже слабо владеющие дисциплиной студенты без труда разберутся в сути манипуляций; - при правильном подходе к этому справочно-информационному материалу можно значительно улучшить свои оценки по предмету. Все контрольные, проверочные работы и испытания будут выполняться проще, чем раньше.
Пользоваться ГДЗ можно как онлайн, так и в печатной версии. Ресурс предлагает не только запланированные упражнения, но и видеоуроки, которые делают информацию еще более доступной. Не упустите шанс укрепить свои знания в области химии, развивая определенный навык.
Химия — наука, основанная на теориях, различных явлениях и закономерностях. В этом школьном предмете важную роль играет соответствие наблюдений, полученных в результате опытов, установленным нормам. Именно по этой причине учащиеся часто испытывают трудности с пониманием новых тем или упражнений, так как материал в одиннадцатом классе еще сложнее, а дефицит времени увеличивается. Преимущество ГДЗ к учебнику Химия для 11 класса автора О.С. Габриелян базовый уровень имеет множество схем таблиц, описаний формул, готовых практических работ, которые полностью соответствуют содержанию параграфов в учебнике. Используя книгу-решение в учебе, вы найдете любые ответы на вопросы, решение задач станет для старшеклассника легким и интересным, а самостоятельная подготовка к контрольной работе станет обыденностью.
Преимущество ГДЗ к учебнику Химия для 11 класса автора О.С. Габриелян базовый уровень имеет множество схем таблиц, описаний формул, готовых практических работ, которые полностью соответствуют содержанию параграфов в учебнике. Используя книгу-решение в учебе, вы найдете любые ответы на вопросы, решение задач станет для старшеклассника легким и интересным, а самостоятельная подготовка к контрольной работе станет обыденностью.
Приступая к выполнению лабораторных работ и проведению химических опытов, студент должен правильно решить все заданные работы, чтобы изучить все особенности новых правил и ни в коем случае не допускать ошибок в опытах.
Для старшеклассников очень важно получить высокие баллы, так как все оценки будут отображаться в итоговом аттестате. Самостоятельная практика решения домашних заданий с Учитель химии 11 класса Габриелян станет залогом сдачи контрольных испытаний на «отлично», что будет способствовать успешному поступлению в вузы.
ГДЗ к рабочей тетради по химии за 11 класс Габриелян О. С. (базовый уровень) можно скачать.
С. (базовый уровень) можно скачать.
ГДЗ за контрольно-проверочную работу по химии для 11 класса Габриелян О.С. (базовый уровень) можно скачать.
ГДЗ на рабочую тетрадь по химии для 11 класса Габриелян, Яшуков можно скачать.
ГДЗ на учебник по химии для 11 класса Габриелян Остроумов (продвинутый уровень) можно скачать
АП Химия – АП Студенты
Не ученик?
Посетите AP Central, чтобы получить ресурсы для учителей, администраторов и координаторов.
AP Химия
Перейти к моей точке доступа
О курсе
Узнайте об основных понятиях химии, включая структуру и состояние вещества, межмолекулярные силы и реакции. Вы будете проводить практические лабораторные исследования и использовать химические расчеты для решения проблем.
Примечание: Сохраняйте лабораторные журналы и отчеты; колледжи могут попросить вас увидеть их, прежде чем предоставить вам кредит.
Навыки, которым вы научитесь
Эквивалентность и предварительные условия
Эквивалент курса колледжа
Годовой вводный курс общей химии в колледже
Рекомендуемые предварительные условия
Курсы средней школы по химии и алгебре Ex1303 903 II 9002
Свидание
Об устройствах
Содержание курса, изложенное ниже, организовано в виде общеизучаемых единиц обучения, которые
предоставить одну возможную последовательность для курса. Ваш преподаватель может решить организовать курс
Ваш преподаватель может решить организовать курс
контента по-разному в зависимости от местных приоритетов и предпочтений.
Содержание курса
Блок 1: Атомная структура и свойства
Вы узнаете о составе атомов и о том, как ученые измеряют и классифицируют эти молекулярные строительные блоки.
Темы могут включать:
- Моль и молярная масса
- Масс-спектроскопия элементов
- Элементный состав чистых веществ
- Состав смесей
- Атомная структура и электронная конфигурация
- Фотоэлектронная спектроскопия
- Периодические тренды
- Валентные электроны и ионные соединения
7–9% от экзаменационного балла
Модуль 2: Молекулярная и ионная структура и свойства соединений
Вы узнаете о множестве химических связей и о том, как их структура может влиять на свойства создаваемых молекул.
Темы могут включать:
- Типы химических связей
- Внутримолекулярная сила и потенциальная энергия
- Структура ионных твердых тел
- Структура металлов и сплавов
- Диаграммы Льюиса
- Резонанс и официальное обвинение
- ВСЕПР и гибридизация связи
7–9% от экзаменационного балла
Блок 3: Межмолекулярные силы и свойства
Вы узнаете, как атомы собираются вместе, чтобы создавать твердые тела, жидкости и газы, и как субатомные силы управляют свойствами всего вокруг вас.
Темы могут включать:
- Межмолекулярные силы
- Твердые вещества, жидкости и газы
- Кинетическая молекулярная теория
- Растворы и смеси
- Фотоэлектрический эффект
18–22% от экзаменационного балла
Раздел 4: Химические реакции
Вы узнаете, как различать физические и химические процессы, а также как измерять и выражать химические реакции с помощью химических уравнений.
Темы могут включать:
- Введение для реакций
- Сводные ионные уравнения
- Представления реакций
- Физические и химические изменения
- Стехиометрия
- Типы химических реакций
7–9% от экзаменационного балла
Раздел 5: Кинетика
Вы изучите различные методы наблюдения за изменениями, происходящими во время химической реакции, и последствиями ряда реакций.
Темы могут включать:
- Скорость реакции
- Введение в закон о тарифах
- Элементарные реакции
- Модель столкновения
- Введение в механизмы реакции
- Энергетический профиль многоступенчатой реакции
- Катализ
7–9% от экзаменационного балла
Раздел 6: Термодинамика
Вы узнаете об изменениях энергии в химических реакциях и о том, как передача энергии может изменить физические свойства вещества.
Темы могут включать:
- Эндотермические и экзотермические процессы
- Теплопередача и тепловое равновесие
- Теплоемкость и калориметрия
- Энергия фазовых переходов
- Введение в энтальпию реакции
- Энтальпия образования
- Закон Гесса
7–9% от экзаменационного балла
Раздел 7: Равновесие
Вы наметите, как химические реакции меняются с течением времени, что заставляет вещества достигать равновесия и как системы реагируют, когда это равновесие нарушается.
Темы могут включать:
- Введение в равновесие
- Расчет константы равновесия
- Расчет равновесных концентраций
- Введение в принцип Ле Шателье
- Введение в равновесие растворимости
- рН и растворимость
- Свободная энергия растворения
7–9% от экзаменационного балла
Раздел 8: Кислоты и основания
Вы узнаете больше о рН, качествах и свойствах кислот и оснований, а также о том, как они взаимодействуют в химических реакциях.
Темы могут включать:
- Введение в кислоты и основания
- pH и pOH сильных кислот и оснований
- Кислотно-основные реакции и буферы
- Молекулярная структура кислот и оснований
- pH и pK a
- Свойства буферов
11–15% от экзаменационного балла
Модуль 9: Приложения термодинамики
Вы познакомитесь с концепцией «термодинамической благоприятности» реакций, что означает вероятность их возникновения с учетом изменений энергии и факторов окружающей среды.
Темы могут включать:
- Введение в энтропию
- Свободная энергия Гиббса и термодинамическая благоприятность
- Термодинамический и кинетический контроль
- Свободная энергия и равновесие
- Гальванические (гальванические) и электролитические элементы
- Электролиз и закон Фарадея
7–9% от экзаменационного балла
Химия – CLEP | College Board
Экзамен по химии охватывает материал, который обычно преподается на годичных курсах общей химии в колледже. Требуется понимание структуры и состояний вещества, типов реакций, уравнений и стехиометрии, равновесия, кинетики, термодинамики, описательной и экспериментальной химии, а также способность интерпретировать и применять этот материал к новым и незнакомым проблемам. Во время этого экзамена функция научного онлайн-калькулятора и таблица Менделеева доступны как часть программного обеспечения для тестирования.
Требуется понимание структуры и состояний вещества, типов реакций, уравнений и стехиометрии, равновесия, кинетики, термодинамики, описательной и экспериментальной химии, а также способность интерпретировать и применять этот материал к новым и незнакомым проблемам. Во время этого экзамена функция научного онлайн-калькулятора и таблица Менделеева доступны как часть программного обеспечения для тестирования.
Научный калькулятор
Научный (неграфический) калькулятор TI-30XS MultiView™ интегрирован в экзаменационное программное обеспечение и доступен учащимся в течение всего времени тестирования.
Чтобы использовать калькулятор во время экзамена, учащиеся должны выбрать значок Calculator . Информация о том, как использовать калькулятор, доступна на значке Help на вкладке Calculator . Ожидается, что учащиеся будут знать, как и когда правильно использовать калькулятор.
Посетите ETS, чтобы узнать больше и попрактиковаться в использовании научного калькулятора. Онлайновый инженерный калькулятор поможет учащимся выполнять вычисления (например, арифметические, экспоненты, корни и логарифмы).
Онлайновый инженерный калькулятор поможет учащимся выполнять вычисления (например, арифметические, экспоненты, корни и логарифмы).
Периодическая таблица
Чтобы использовать Периодическую таблицу элементов во время экзамена, выберите значок Справка в меню в верхней части экрана, а затем выберите вкладку Периодическая таблица .
Экзамен содержит примерно 75 вопросов, на которые нужно ответить в 90 минут. Некоторые из них являются предварительными вопросами, которые не будут оцениваться.
Вопросы на экзамене по химии требуют от кандидатов демонстрации одной или нескольких из следующих способностей:
- Вспомнить: запомнить определенные факты; продемонстрировать простое знание информации и знакомство с терминологией
- Применение: понимать концепции и переформулировать информацию в другие эквивалентные термины; применять знания в незнакомых и/или практических ситуациях; использовать математику для решения задач по химии
- Интерпретация: делать выводы и делать выводы из имеющихся данных и объединять информацию для формирования выводов; признавать невысказанные предположения
Предмет экзамена по химии состоит из следующих тем. Проценты рядом с основными темами указывают приблизительный процент экзаменационных вопросов по этой теме.
Проценты рядом с основными темами указывают приблизительный процент экзаменационных вопросов по этой теме.
Структура материи (20%)
Атомная теория и строение атома
- Доказательства атомной теории
- Атомные массы; определение химическими и физическими средствами
- Атомный номер и массовое число; изотопы и масс-спектроскопия
- Энергетические уровни электронов: атомные спектры и атомные орбитали
- Периодические зависимости, включая, например, атомные радиусы, энергии ионизации, сродство к электрону и степени окисления
- Ядерная химия: ядерные уравнения, периоды полураспада и радиоактивность; химическое применение
Химическая связь
- Связующие силы
- Типы: ковалентная, ионная, металлическая, макромолекулярная (или сетчатая), дисперсионная и с водородной связью
- Отношения к структуре и свойствам
- Полярность связей и электроотрицательность
- Теория VSEPR и электронно-точечные диаграммы Льюиса
- Гибридизация орбиталей
- Геометрия молекул, ионов и координационных комплексов
- Структурная изомерия
- Резонанс
- Сигма- и пи-облигации
- Дипольные моменты молекул
- Связь свойств со структурой
Состояния вещества (19%)
Газы
- Законы идеальных газов; уравнения состояния идеального газа
- Концепция крота; Номер Авогадро
- Кинетико-молекулярная теория
- Интерпретация законов идеального газа на основе этой теории
- Зависимость кинетической энергии молекул от температуры: распределение Больцмана
- Отклонения от законов идеальных газов
Жидкости и твердые тела
- Жидкости и твердые тела с кинетической молекулярной точки зрения
- Фазовые диаграммы однокомпонентных систем
- Изменения состояния и критические явления
Растворы
- Типы растворов и факторы, влияющие на растворимость
- Методы выражения концентрации
- Коллигативные свойства; например, закон Рауля
- Влияние межионного притяжения на коллигативные свойства и растворимость
Типы реакций (12%)
Кислотно-основные реакции; концепции Аррениуса, Бренстеда-Лоури и Льюиса; амфотеризм
Реакции с участием координационных комплексов
Реакции осаждения
Окислительно-восстановительные реакции
- Число окисления
- Роль электрона в окислительно-восстановительных процессах
- Электрохимия; электролитические ячейки, стандартные потенциалы полуячейки, предсказание направления окислительно-восстановительных реакций и влияние изменения концентрации
Уравнения и стехиометрия (10%)
Ионные и молекулярные частицы, присутствующие в химических системах; сетевые ионные уравнения
Стехиометрия: соотношения массы и объема с упором на понятие молей
Балансировка уравнений, в том числе для окислительно-восстановительных реакций
Равновесие (7%)
Концепция динамического равновесия физических и химических веществ; принцип ЛеШателье; константы равновесия
Количественная обработка
- Константы равновесия для газовых реакций с точки зрения как молярных концентраций, так и парциального давления (K c , K p )
- Константы равновесия для реакций в растворах
- Константы для кислот и оснований; рК; рН
- Константы произведения растворимости и их применение для осаждения и растворения малорастворимых соединений
- Константы для комплексных ионов
- Общий ионный эффект; буферы
Кинетика (4%)
Понятие скорости реакции
- Порядок реакции и константа скорости
- Определение порядка реакции и константы скорости по экспериментальным данным
- Влияние изменения температуры на скорость
Энергия активации и роль катализаторов
Связь между скоростью определяющей стадии и механизмом реакции
Термодинамика (5%)
Государственные функции
Первый закон:
- Теплота образования
- Теплота реакции, изменение энтальпии и закон Гесса
- Теплоемкость; теплоты парообразования и плавления
Второй закон:
- Свободная энергия образования
- Свободная энергия реакции
- Зависимость изменения свободной энергии от изменения энтальпии и энтропии
Связь изменения свободной энергии с константами равновесия и электродными потенциалами
Описательная химия (14%)
Накопление некоторых конкретных химических фактов необходимо для того, чтобы учащиеся:
- понимали развитие принципов и понятий
- продемонстрировать применение принципов
- связать факты с теорией и свойства со структурой
- развить понимание систематической номенклатуры, которая облегчает общение
В экзамен обычно включаются следующие разделы:
- Химическая активность и продукты химических реакций
- Отношения в периодической таблице: по горизонтали, вертикали и диагонали
- Химия основных групп и переходных элементов, включая типичные примеры каждой
- Органическая химия, включая такие темы, как функциональные группы и изомерия (может рассматриваться как отдельная единица или как примерный материал в других областях, таких как связывание)
Экспериментальная химия (9%)
Некоторые вопросы основаны на лабораторных экспериментах, широко проводимых в области общей химии, и касаются используемого оборудования, проведенных наблюдений, выполненных расчетов и интерпретации результатов. Вопросы предназначены для обеспечения понимания основных инструментов химии и их применения к простым химическим системам.
Вопросы предназначены для обеспечения понимания основных инструментов химии и их применения к простым химическим системам.
Рекомендации АСЕ по химии
| Выдача кредита Балл | 50 |
| Семестр Часы | 6 |
Примечание: Каждое учреждение оставляет за собой право устанавливать свою собственную политику предоставления кредитов, которая может отличаться от политики Американского совета по образованию (ACE). Свяжитесь с вашим колледжем, чтобы узнать количество баллов, необходимых для получения кредита, и количество предоставляемых кредитных часов.
Руководство по сдаче экзамена по химии CLEP
Экзамен по химии охватывает материал, который обычно преподается в рамках годового курса общей химии.
- 10,00 $
Официальное учебное пособие 2022 CLEP
В этом учебном пособии представлены практические вопросы для всех 34 экзаменов CLEP. Идеальный ресурс для сдачи более одного экзамена. Предлагается только College Board. Исправление: ключ к ответу на вопрос № 47 в Экзаменационном руководстве по принципам микроэкономики неверен. Правильный ответ: А.
Идеальный ресурс для сдачи более одного экзамена. Предлагается только College Board. Исправление: ключ к ответу на вопрос № 47 в Экзаменационном руководстве по принципам микроэкономики неверен. Правильный ответ: А.
- Книга
- $24,99
Зарегистрируйтесь за $90.00
Добавить в корзину
Товар добавлен в вашу корзину.
Химия
- Экзамен
- 90,00 $
Оформление заказа
Добавление учебных пособий
Руководство по сдаче экзамена по химии CLEP
Экзамен по химии охватывает материал, который обычно преподается в рамках годового курса общей химии.
- ПДФ
- 10,00 $
Официальное учебное пособие 2022 CLEP
В этом учебном пособии представлены практические вопросы для всех 34 экзаменов CLEP. Идеальный ресурс для сдачи более одного экзамена. Предлагается только College Board. Исправление: ключ к ответу на вопрос № 47 в Экзаменационном руководстве по принципам микроэкономики неверен. Правильный ответ: А.
Предлагается только College Board. Исправление: ключ к ответу на вопрос № 47 в Экзаменационном руководстве по принципам микроэкономики неверен. Правильный ответ: А.
- Книга
- 24,99 $
Товар добавлен в корзину.
Руководство по изучению химии CLEP
- 10,00 $
Касса
Товар добавлен в корзину.
Официальное учебное пособие 2022 CLEP
- Книга
- 24,99 $
Касса
Дмитрий Менделеев | Биография, периодическая таблица и факты
Дмитрий Менделеев
Смотреть все СМИ
- Дата рождения:
-
8 февраля 1834 г.
Тобольск
Россия
- Умер:
-
2 февраля 1907 г. (72 года)
Санкт-Петербург
Россия
- Награды и награды:
- Медаль Копли (1905)
- Известные работы:
- «Основы химии»
- Предметы изучения:
-
химический элемент
периодический закон
периодическая таблица
Просмотреть весь связанный контент →
Популярные вопросы
Что сделал Дмитрий Менделеев?
Дмитрий Менделеев разработал периодическую классификацию химических элементов, в которой элементы располагались в порядке возрастания атомного веса.
Какими были юные годы Дмитрия Менделеева?
Родителями Дмитрия Менделеева были учитель Иван Менделеев и Мария Корнилева. Иван ослеп в 1834 году, когда родился Дмитрий, и умер в 1847 году. Мария тогда управляла стекольным заводом. Однако в 1848 году фабрика сгорела, и Дмитрий переехал в Петербург, чтобы продолжить образование.
Чем занимался Дмитрий Менделеев?
В 1865 году Дмитрий Менделеев стал профессором химической технологии в Санкт-Петербургском университете. Он стал там профессором общей химии в 1867 г. и преподавал до 1890 г.
Резюме
Прочтите краткий обзор этой темы
Менделеев Дмитрий , русский полностью Менделеев Дмитрий Иванович , (род. 27 января (8 февраля по новому стилю) 1834, Тобольск, Сибирь, Российская империя — умер 20 января (2 февраля) 19 года.07, Санкт-Петербург, Россия), русский химик, разработавший периодическую классификацию элементов. Менделеев обнаружил, что, когда все известные химические элементы расположены в порядке возрастания атомного веса, в результирующей таблице обнаруживается повторяющийся образец или периодичность свойств внутри групп элементов. В своей версии периодической таблицы 1871 года он оставил пробелы в тех местах, где, по его мнению, могли найти свое место неизвестные элементы. Он даже предсказал вероятные свойства трех потенциальных элементов. Последующее подтверждение многих его предсказаний еще при жизни принесло Менделееву славу основоположника периодического закона.
Менделеев обнаружил, что, когда все известные химические элементы расположены в порядке возрастания атомного веса, в результирующей таблице обнаруживается повторяющийся образец или периодичность свойств внутри групп элементов. В своей версии периодической таблицы 1871 года он оставил пробелы в тех местах, где, по его мнению, могли найти свое место неизвестные элементы. Он даже предсказал вероятные свойства трех потенциальных элементов. Последующее подтверждение многих его предсказаний еще при жизни принесло Менделееву славу основоположника периодического закона.
Молодость и образование
Менделеев родился в маленьком сибирском городке Тобольске и был последним из 14 выживших детей (или 13, в зависимости от источника) Ивана Павловича Менделеева, учителя местной гимназии, и Марии Дмитриевны Корнилевой. . Отец Дмитрия ослеп в год его рождения и умер в 1847 году. Чтобы прокормить семью, его мать стала управлять небольшой стекольной фабрикой, принадлежавшей ее семье, в соседнем городе. Фабрика сгорела в декабре 1848 года, и мать Дмитрия увезла его в Петербург, где он поступил в Главный педагогический институт. Его мать вскоре умерла, и Менделеев получил высшее образование в 1855 году. Он получил свою первую преподавательскую должность в Симферополе в Крыму. Он пробыл там всего два месяца и, проучившись непродолжительное время в одесском лицее, решил вернуться в Петербург для продолжения образования. Он получил степень магистра в 1856 году и начал проводить исследования в области органической химии. Получив государственную стипендию, он на два года уехал учиться за границу в Гейдельбергский университет. Вместо того чтобы тесно сотрудничать с видными химиками университета, включая Роберта Бунзена, Эмиля Эрленмейера и Августа Кекуле, он устроил лабораторию в своей квартире. В сентябре 1860 года он посетил Международный химический конгресс в Карлсруэ, созванный для обсуждения таких важных вопросов, как атомный вес, химические символы и химические формулы. Там он познакомился и установил контакты со многими ведущими химиками Европы.
Фабрика сгорела в декабре 1848 года, и мать Дмитрия увезла его в Петербург, где он поступил в Главный педагогический институт. Его мать вскоре умерла, и Менделеев получил высшее образование в 1855 году. Он получил свою первую преподавательскую должность в Симферополе в Крыму. Он пробыл там всего два месяца и, проучившись непродолжительное время в одесском лицее, решил вернуться в Петербург для продолжения образования. Он получил степень магистра в 1856 году и начал проводить исследования в области органической химии. Получив государственную стипендию, он на два года уехал учиться за границу в Гейдельбергский университет. Вместо того чтобы тесно сотрудничать с видными химиками университета, включая Роберта Бунзена, Эмиля Эрленмейера и Августа Кекуле, он устроил лабораторию в своей квартире. В сентябре 1860 года он посетил Международный химический конгресс в Карлсруэ, созванный для обсуждения таких важных вопросов, как атомный вес, химические символы и химические формулы. Там он познакомился и установил контакты со многими ведущими химиками Европы. В последующие годы Менделееву особенно запомнилась статья итальянского химика Станислао Канниццаро, разъяснившая понятие атомного веса.
В последующие годы Менделееву особенно запомнилась статья итальянского химика Станислао Канниццаро, разъяснившая понятие атомного веса.
В 1861 году Менделеев вернулся в Петербург, где в 1864 году получил место профессора в Технологическом институте. После защиты докторской диссертации в 1865 году он был назначен профессором химической технологии в Петербургском университете (ныне Санкт-Петербургский университет). Петербургский государственный университет). Он стал профессором общей химии в 1867 г. и продолжал преподавать там до 1890 г.
Начав преподавать неорганическую химию, Менделеев не мог найти учебник, отвечающий его потребностям. Поскольку он уже издал в 1861 г. учебник по органической химии, удостоенный престижной Демидовской премии, он решил написать еще один. Результат был Основы химии (1868–71; Основы химии ), ставшей классической, выдержавшей множество изданий и множество переводов. Когда Менделеев начал составлять главу о галогенных элементах (хлоре и его аналогах) в конце первого тома, он сравнил свойства этой группы элементов со свойствами группы щелочных металлов, таких как натрий. Внутри этих двух групп непохожих элементов он обнаружил сходство в прогрессии атомных весов и задался вопросом, проявляют ли другие группы элементов аналогичные свойства. Изучив щелочные земли, Менделеев установил, что порядок атомных весов можно использовать не только для расположения элементов внутри каждой группы, но и для расположения самих групп. Таким образом, пытаясь осмыслить уже существовавшие обширные знания о химических и физических свойствах химических элементов и их соединений, Менделеев открыл периодический закон.
Внутри этих двух групп непохожих элементов он обнаружил сходство в прогрессии атомных весов и задался вопросом, проявляют ли другие группы элементов аналогичные свойства. Изучив щелочные земли, Менделеев установил, что порядок атомных весов можно использовать не только для расположения элементов внутри каждой группы, но и для расположения самих групп. Таким образом, пытаясь осмыслить уже существовавшие обширные знания о химических и физических свойствах химических элементов и их соединений, Менделеев открыл периодический закон.
Викторина «Британника»
Лица науки
Галилео Галилей. Андерс Цельсий. Вы можете узнать их имена, но знаете ли вы, кто они на самом деле? Соберите свои данные и проверьте свои знания об известных ученых в этой викторине.
Его вновь сформулированный закон был оглашен перед Русским химическим обществом в марте 1869 г. с утверждением, что «элементы, расположенные по значению их атомного веса, представляют четкую периодичность свойств».
 А.
А.
 Спирты и фенолы
Спирты и фенолы  Азотсодержащие органические вещества
Азотсодержащие органические вещества  Введение (6 часов)
Введение (6 часов) Вводный контроль
Вводный контроль Способы их разрыва
Способы их разрыва Качественный анализ органических соединений.
Качественный анализ органических соединений. Химические свойства алкинов
Химические свойства алкинов Практическая работа № 2. Углеводороды.
Практическая работа № 2. Углеводороды. Фенол
Фенол Отдельные представители
Отдельные представители Карбоновые кислоты
Карбоновые кислоты Карбоновые кислоты, сложные эфиры, жиры
Карбоновые кислоты, сложные эфиры, жиры Углеводы
Углеводы Амины. Аминокислоты.Белки
Амины. Аминокислоты.Белки Идентификация органических веществ
Идентификация органических веществ Обнаружение витаминов
Обнаружение витаминов Стахеев Ю. А.
Стахеев Ю. А.
 11 класс. Кузнецова Н.В., Лёвкин А.Н.
11 класс. Кузнецова Н.В., Лёвкин А.Н.
 10-11 класс. Гара Н.Н., Зуева М.В.
10-11 класс. Гара Н.Н., Зуева М.В.
 9 класс. Габриелян О.С.
9 класс. Габриелян О.С.
 11 класс. Базовый уровень. Новошинский И.И., Новошинская Н.С.
11 класс. Базовый уровень. Новошинский И.И., Новошинская Н.С.
 5 Mb
5 Mb Берман Н.И.
Берман Н.И.
 Кузнецова Н.Е., Титова И.М., Гара Н.Н., Жегин А.Ю.
Кузнецова Н.Е., Титова И.М., Гара Н.Н., Жегин А.Ю.
 Учебник. Кузнецова Н.Е., Титова И.М., Гара Н.Н.
Учебник. Кузнецова Н.Е., Титова И.М., Гара Н.Н.
 9 класс. Ковалевская Н.Б.
9 класс. Ковалевская Н.Б.
 10 класс. Базовый уровень. Габриелян О.С.
10 класс. Базовый уровень. Габриелян О.С.
 10 класс. Профильный уровень. Габриелян О.С.
10 класс. Профильный уровень. Габриелян О.С.
 10 класс. Учебник. Гузей Л.С., Суровцева Р.П.
10 класс. Учебник. Гузей Л.С., Суровцева Р.П.
 11 класс. Базовый уровень. Еремин В.В., Кузьменко Н.Е.
11 класс. Базовый уровень. Еремин В.В., Кузьменко Н.Е.
 11 класс. Профильный уровень. Еремин В.В., Кузьменко Н.Е.
11 класс. Профильный уровень. Еремин В.В., Кузьменко Н.Е.
 11 класс. Учебник. Габриелян О.С., Лысова Г.Г.
11 класс. Учебник. Габриелян О.С., Лысова Г.Г.
 8 класс. Новошинский И.И., Новошинская Н.С.
8 класс. Новошинский И.И., Новошинская Н.С.
 9 класс. Оржековский П.А., Мещерякова Л.М., Понтак Л.С.
9 класс. Оржековский П.А., Мещерякова Л.М., Понтак Л.С.
 9 класс. Учебник. Гузей Л.С.
9 класс. Учебник. Гузей Л.С.
 Дидактический материал. 10-11 классы. Радецкий А.М.
Дидактический материал. 10-11 классы. Радецкий А.М.
 Органическая химия. 10 класс. Базовый уровень. Рудзитис Г.Е., Фельдман Ф.Г.
Органическая химия. 10 класс. Базовый уровень. Рудзитис Г.Е., Фельдман Ф.Г.
 Учебник. 9 класс. Рудзитис Г.Е., Фельдман Ф.Г.
Учебник. 9 класс. Рудзитис Г.Е., Фельдман Ф.Г.