Лидин Р.А., Молочко В.А., Андреева Л.Л. Задачи по неорганической химии [DJVU]
Учебное пособие для хим.-технол. вузов / Под ред. Р.А. Лидина. — М.: Высшая школа, 1990. — 319 с. — ISBN 5-06-000664-6.Пособие включает более 3000 задач. Каждый раздел теоретических основ содержит математические указания по использованию физико-химических величин и единиц СИ в решении расчетных задач, методические формулы и примеры решения типовых задач. В разделах химии элементов расчетные задачи сформулированы применительно к практикуму, имеются задачи по экологическим аспектам химической технологии.СодержаниеПредисловие
Принятые сокращения и обозначения
Типы и номенклатура неорганических веществ
Кислотные и основные гидроксиды. Соли
Кислотные и основные оксиды
Амфотерные гидроксиды и оксиды
Бинарные соединения
Составление уравнений химических реакций
Обменные реакции
Окислительно-восстановительные реакции
Стехиометрические расчеты в химии
Расчеты по уравнениям реакций
Расчеты по закону эквивалентов
Энергетика и направление химических реакций
Энтальпия химических реакций
Направление химических реакций в изолированной системе. Энтропия
Направление химических реакций в неизолированной системе. Энергия Гиббса
Энергия Гиббса и химические свойства веществ
Направление окислительно-восстановительных реакций в водном растворе
Химическое равновесие
Состояние химического равновесия
Смещение химического равновесия
Общие свойства растворов
Состав и приготовление растворов
Насыщенные растворы. Растворимость веществ
Водные растворы протолитов
Вода. Нейтральная, кислая и щелочная среда. Сильные протолиты
Слабые протолиты. Амфолиты
Смещение протолитических равновесий
Произведение растворимости. Условие выпадения осадка
Периодический закон и строение атома
Химическая связь и строение молекул
Метод валентных связей
Метод молекулярных орбиталей
Комплексные соединения
Номенклатура комплексных соединений
Строение комплексных соединений
Типы и устойчивость комплексных соединений
Химические свойства р-элементов
Элементы VI1A группы
Элементы VIA группы
Элементы VA группы
Элементы IVA группы
Элементы ША группы
Химические свойства s-элементов
Элементы НА группы
Элементы IA группы
Химические свойства d- и f-элементов
Элементы IIБ группы
Элементы 1Б группы
Элементы VIIIE группы
Элементы VIIБ группы
Элементы VIE группы
Элементы VB группы
Элементы IVB группы
Элементы ШБ группы
Приложение
Ответы
www.twirpx.com
Решение задач по общей химии
Как вы думаете, что чаще всего слышит человек, выбравший своей специальностью химию и сообщающий об этом своим новым или старым знакомым? Правильно, вариации на тему: «Химия? Серьезно? А я в школе ее совсем не понимал!». К сожалению,
этот интереснейший предмет предстает в школьной программе совершенно оторванным от реальной жизни – непонятные реакции, абстрактные формулы… Неудивительно, что поступив в высшее или среднее учебное заведение (где химия не является
профилирующим предметом, однако присутствует в учебной программе), студенты начинают испытывать серьезные трудности. И трудности эти начинаются с заданий по общей химии. Около четверти заказов на нашем сайте представляют собой задачи или контрольные по этой дисциплине.
Что же такое общая химия?
Это основа химических знаний, которая включает в себя несколько разделов:
- Основные понятия и законы химии
- Строение атома
- Химическая связь
- Химические системы (свойства веществ в различных агрегатных состояниях)
- Основы термодинамики
- Основы кинетики
- Основы электрохимии
- Растворы
- Окислительно-восстановительные процессы
- Координационная химия
- Периодический закон и химия элементов
Какая литература популярна?
Количество и последовательность изложения разделов может быть разной для каждого конкретного учебника. Например, раньше на химическом факультете СПбГУ использовали учебник «Химия» Никольского А.Б. и Суворова А.В., а также трехтомник Коттона Ф., Уилкинсона Дж. «Современная неорганическая химия», который, хотя и издан в 1969 году, является одним из лучших учебников по общей и неорганической химии. Популярностью также пользуется двухтомник «Основы общей химии» Некрасова Б.В.. Несколько раз в списке рекомендованной литературы у наших заказчиков нам попадался весьма достойный учебник общей химии Коровина Н.В., там есть даже разделы органической химии и химии полимеров. Для студентов заочников часто составляются собственные методические указания с кратким изложением теории и примерами решения задач по изучаемым разделам. Такие пособия крайне полезны, поскольку позволяют выбрать правильную для данного учебного заведения систему обозначения физико-химических величин (в разных учебниках и пособиях для величин скорости, потенциала, работы и др. могут использоваться разные буквы, на химический смысл это никак не влияет, но непривычный вид обозначений может вызвать дополнительные вопросы преподавателя).
Примеры заданий по общей химии
Много сложностей вызывают у студентов окислительно-восстановительные процессы, включая составление и расстановку коэффициентов в уравнениях окислительно-восстановительных реакций, электрохимические задачи и, несомненно, все вопросы,
связанные с коррозией. При составлении уравнений окислительно-восстановительных реакций очень помогают таблицы полуреакций с соответствующими потенциалами. Зная, в какой среде происходит реакция, можно подобрать подходящую пару полуреакций и закончить любое уравнение. А для проверки результата можно воспользоваться книгой «Химические свойства неорганических веществ» Лидина Р.А, Молочко В.А. и Андреевой Л.Л., в которой собраны практически все важнейшие реакции неорганических соединений. В случае с коррозией все также сводится к рассмотрению электродных полуреакций и правильному выбору катода и анода.
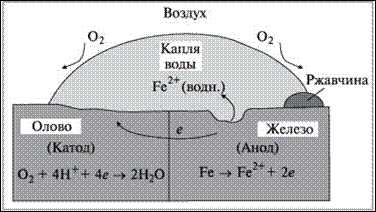 Коррозия железа, покрытого оловом во влажном воздухе
Коррозия железа, покрытого оловом во влажном воздухе
Что нужно для успешного решения задач по общей химии?
Прежде всего, знание основных физико-химических законов и умение их адекватно использовать в каждом конкретном случае. Многие законы и эмпирические правила имеют определенные области применения, например, правило Вант-Гоффа выполняется для реакций с небольшой энергией активации в температурном диапазоне 10-400°C, и использование его при других условиях приведет к неправильному результату.
Решение общей химии на заказ
Мы занимаемся решением задач на заказ уже много лет, и для нас работа с заказчиком – это очень высокий уровень личной ответственности. Свои задания в студенческие годы мы оформляли весьма лаконично, даже можно сказать, что небрежно, поскольку все вопросы можно было разобрать непосредственно с преподавателем. Но выполняя задания на заказ, мы стараемся передать максимум известной нам информации: формулы для расчетов выводятся из классических формулировок законов с подробным пояснением каждого шага, производится проверка размерностей итоговых величин, делаются выводы по задаче. Наше непосредственное участие заканчивается в момент передачи работы заказчику, но цель – не только выполнить задания, но и облегчить процесс сдачи или защиты работы. К счастью, прошли времена, когда приходилось сканировать или фотографировать 10 – 15 листов A4, чтобы передать готовое решение, так как для нас оформлять работы в электронном виде (в MS Word) стало уже правилом хорошего тона.
|
|
| Раньше | Сейчас |
Так что, если у Вас есть проблемы с решением задач по общей химии, на нашем сайте Вы всегда получите квалифицированную и оперативную помощь.
reshatel.org
Решение типовых задач по общей и неорганической химии
Решение типовых задач
Проект «Решение типовых задач» представляет собой сборник примеров и задач по общей и неорганической химии с решениями.
Авторы постарались включить в него задачи, формулировка и содержание которых, согласно статистике, наиболее часто встречаются в ходе учнебного процесса. Сборник
ориентирован именно на решение задач и в силу этого содержит минимальный объем теоретического материала.
ОГЛАВЛЕНИЕ
1. Электрохимия.
1.1.Составление гальванических элементов, расчет ЭДС
1.2.Определение возможности коррозии, составление коррозионных пар
1.3.Электролиз с растворимыми и инертными анодами, расчет количества продуктов
1.4.Составление концентрационных элементов, расчет ЭДС
1.5.Коррозия железа, пары дифференциальной аэрации
1.6.Хлорный и хлорсеребряный электроды
1.7.Электролиз водных растворов и расплавов
1.8.Газовые электроды: водородный и кислородный
1.9.Определение концентрации катионов металла
1.10.Определение продуктов электролиза
1.11.Протекторная защита, определение необходимости защиты
1.12.Хромирование и выход по току
2. Окислительно-Восстановительные реакции.
2.1. Расстановка коэффициентов. 2.2. Электронно-ионный баланс. 2.3. Направление процесса.
2.4. Направление, ЭДС и константа равновесия реакции, энергия Гиббса. 2.5. Уравнение Нернста для ОВР.
3. Растворы. Изотонический коэффициент, давление насыщенного пара, температуры кипения и замерзания.
3.1. Давление насыщенного пара. 3.1.1. Температуры кипения, замерзания. 3.2. Изотонический коэффициент.
3.3. Давление насыщенного пара, температуры кипения, замерзания электролита. 3.4. Определение молярной массы по температуре кипения.
3.5. Определение степени диссоциации по температуре замерзания.
4. Растворы. Осмотическое давление.
4.1., 4.1.1. Осмотическое давление неэлектролита и электролита.
4.2.Определение молярной массы по осмотическому давлению.
4.3.Определение степени диссоциации по осмотическому давлению.
4.4.Изотонические растворы.
5. Растворы. Гидролиз солей.
5.1.Определение солей, подвергающихся гидролизу.
5.2.Уравнения гидролиза.
5.3.Совместный гидролиз.
5.4.Сравнительная степень гидролиза.
5.5.Константа гидролиза.
5.6.Константа и степень гидролиза, рН.
5.7.Степень гидролиза, смещение равновесия.
6. Растворы. Произведение растворимости (ПР).
6.1.Выражение для ПР.
6.2.Расчет растворимости через ПР.
6.3.Определение молярной и массовой растворимости по ПР.
6.4.Определение ПР по растворимости.
6.5.Влияние одноименных ионов.
6.6.Возможность выпадения осадка.
7. Растворы. Ионная сила. Коэффициент активности. Активность.
7.1.Ионная сила. Формула и пример.
7.2.Ионная сила. Вычисление ионной силы.
7.3.Коэффициент активности, активность.
7.4.Водородный показатель с учетом активности.
7.5.Влияние растворенных электролитов. Солевой эффект.
8. Растворы. Слабые электролиты, степень диссоциации, рН, буферные растворы.
8.1.Степень диссоциации.
8.2.Влияние разбавления на степень диссоциации.
8.3.Степень диссоциации и рН.
8.4.рН буферной смеси.
8.5.Изменение рН буферного раствора.
9. Равновесие химических процессов. Константа равновесия, принцип Ле-Шателье.
9.1.Смещение равновесия.
9.2.Контанта равновесия и концентрации.
9.3.Определение константы равновесия.
9.4.Равновесные концентрации.
9.5.Константа равновесия, равновесные концентрации.
9.6.Константа равновесия, энергия Гиббса.
10. Скорость химических реакций. Правило Вант-Гоффа. Закон действия масс.
10.1. Зависимость скорости реакции от температуры. 10.2., 10.2.1. Скорость и температурный коэффициент.
10.3.Скорость и давление.
10.4.Скорость и концентрация.
11. Энергетика химических процессов. Закон Гесса, расчет теплового эффекта,
энтропия, энергия Гиббса.
11.1.Определение энтальпии реакции.
11.2.Определение теплоты сгорания.
11.3.Температура наступления равновесия.
11.4.Знак изменения энтропии.
11.5.Возможность процесса.
1.1. Составление гальванических элементов, расчет ЭДС
Задание: требуется составить схемы гальванических элементов, в одном из которых медь была бы катодом, а в другом анодом, записать уравнения катодных и анодных процессов, рассчитать ЭДС при концентрациях катионов меди и второго металла 0,1 моль/л и 0,2 моль/л соответственно, указать направление движения электронов и электрического тока.
Решение: рассмотрим расположение меди в электрохимическом ряду напряжений металлов:
|
Li |
K |
Na |
Mg |
Al |
Ti |
Mn |
Zn |
Cr |
Fe |
Cd |
Co |
Ni |
Sn |
|
|
Pb |
h3 |
Sb |
Cu |
Ag |
Pd |
Pt |
Au |
-0,74 |
-0,44 |
-0,40 |
-0,28 |
-0,25 |
-0,14 |
-0,13 0,00 0,24 0,34 0,80 0,99 1,20 |
|
-3,04 |
-2,93 |
-2,71 -2,36 -1,66 -1,63 -1,18 |
-0,76 |
|||||||||||
1,50
В первом случае медь должна иметь по сравнению с другим металлом больший потенциал, во втором – меньший. Данным условиям удовлетворяют, например, железо (- 0,44 В < 0,34 В) и серебро (0,34 В < 0,80 В) соответственно.
Схемы гальванических элементов и электродные реакции:
анод ( — ) Fe | Fe2+ (0,2 М) || Cu2+ (0,1 М) | Cu ( + ) катод Анодная реакция: Fe = Fe2+ + 2e
Катодная реакция: Cu2+ + 2e = Cu Суммарная реакция: Fe + Cu2+ = Cu + Fe2+
анод ( — ) Cu | Cu2+ (0,1 М) || Ag+ (0,2 М) | Ag ( + ) катод Анодная реакция: Cu = Cu2+ + 2e
Катодная реакция: Ag+ + e = Ag
Суммарная реакция: Cu + 2Ag+ = 2Ag + Cu2+
Для расчета ЭДС необходимо рассчитать потенциалы катода и анода по уравнению Нернста E = E0Me + (R • T / z • F) • ln [Mez+] = E0Me + (0,059 / z) • lg [Mez+],
где E0Me – стандартный потенциал металла, В
R – универсальная газовая постоянная, Дж/моль•К T – температура, К
z – число электронов, принимающих участие в электродной реакции F – число Фарадея, Кл/моль
Mez+ – концентрация катионов металла, моль/л
ЭДС = Екатода – Еанода.
Для первого случая:
Екатода = 0,34 + (8,31 • 298 / 2 • 96500) • ln [0,1] = 0,34 + (0,059 / 2) • lg [0,1] = 0,31 В Еанода = -0,44 + (8,31 • 298 / 2 • 96500) • ln [0,2] = -0,44 + (0,059 / 2) • lg [0,2] = -0,46 В ЭДС = 0,77 В
Для второго случая:
Екатода = 0,80 + (8,31 • 298 / 1 • 96500) • ln [0,2] = 0,80 + (0,059 / 1) • lg [0,2] = 0,76 В Еанода = 0,34 + (8,31 • 298 / 2 • 96500) • ln [0,1] = 0,34 + (0,059/ 2) • lg [0,1] = 0,31 В ЭДС = 0,45 В
Движение электронов во внешней цепи – от анода к катоду, направление электрического тока – противоположное.
1.2. Определение возможности коррозии, составление коррозионных пар
Задание: определить возможность коррозии, составить схему коррозионного элемента, указать полярность электродов, указать вид деполяризации и записать уравнения катодного и анодного процессов для гальванопары алюминий-железо, находящейся в кислоте (pH -> 0), в условиях влажной атмосферы (pH = 7) и в щелочи (pH -> 14) при нормальных условиях.
Решение: рассмотрим расположение алюминия и железа в электрохимическом ряду напряжений металлов (ряд приведен не полностью, указаны стандартные потенциалы в вольтах)
|
Li |
K |
Na |
Mg |
Al |
Ti |
Mn |
Zn |
Cr |
Fe |
Cd |
Co |
Ni |
Sn |
|
|
Pb |
h3 |
Sb |
Cu |
Ag |
Pd |
Pt |
Au |
-0,74 |
-0,44 |
-0,40 |
-0,28 |
-0,25 |
-0,14 |
-0,13 0,00 0,24 0,34 0,80 0,99 1,20 |
|
-3,04 |
-2,93 |
-2,71 -2,36 -1,66 -1,63 -1,18 |
-0,76 |
|||||||||||
1,50
Номинально железо имеет по сравнению с алюминием больший потенциал (-1,66 В < -0,44 В), следовательно, в гальванопаре с алюминием номинально железо должно быть катодом, а алюминий – анодом.
Вид деполяризации определяют по наличию в коррозионной системе деполяризатора – катионов водорода (воды) или кислорода. В кислой среде (доступ кислорода не указан) деполяризация – водородная, в атмосферных условиях – кислородная, в щелочной среде (доступ кислорода не указан) – водородная.
Термодинамическую возможность коррозии оценивают путем сравнения стандартных потенциалов каждого из металлов с потенциалами водородного и кислородного электродов, рассчитанных по формулам Eh3 = -0,059 * pH и EO2 = 1,23 -0,059 * pH (с учетом вида деполяризации). Если потенциал металла меньше потенциала водородного или кислородного электрода, то коррозия термодинамически возможна, если потенциал металла больше – соответственно, наоборот. Для определения фактической возможности
коррозии следует учитывать склонность металлов к пассивации в той или иной коррозионной среде.
Ниже приведены значения потенциалов водородного и кислородного электродов и указаны катодные реакции восстановления деполяризатора.
В кислой среде:
Eh3 = -0,059 • pH = -0,059 • 0 = 0,00 В, 2H+ + 2e = h3
EO2 = 1,23 -0,059 • pH = 1,23 -0,059 • 0 = 1,23 В, O2 + 4H+ + 4e = 2h3O
В нейтральной среде:
Eh3 = -0,059 • pH = -0,059 • 7 = -0,41 В, 2h3O + 2e = h3 + 2OH-
EO2 = 1,23 -0,059 • pH = 1,23 -0,059 • 7 = 0,82 В, O2 + 2h3O + 4e = 4OH-
В щелочной среде:
Eh3 = -0,059 • pH = -0,059 • 14 = -0,83 В, 2h3O + 2e = h3 + 2OH-
EO2 = 1,23 -0,059 • pH = 1,23 -0,059 • 14 = 0,40 В, O2 + 2h3O + 4e = 4OH-
Схемы коррозионных элементов и электродные реакции для каждой из коррозионных
сред представлены ниже.
Eh3 = -0,059 * 0 = 0,00 В.
Термодинамически возможна коррозия обоих металлов с водородной деполяризацией (- 1,66 В < -0,44 В < 0,00 В).
Фактически возможна коррозия обоих металлов (оба металла неустойчивы в кислотах).
анод ( — ) Al | h3O, H+ | Fe ( + ) катод Анодная реакция: Al = Al3+ + 3e
Катодная реакция: 2H+ + 2e = h3 Суммарная реакция: 2Al + 6H+ = 2Al3+ + 3h3
EO2 = 1,23 -0,059 * 7 = 0,82 В.
Термодинамически возможна коррозия обоих металлов с кислородной деполяризацией (- 1,66 В < -0,44 В < 0,82 В).
Фактически возможна коррозия только железа (алюминий устойчив в подобных условиях).
анод ( — ) Fe | h3O, O2 | Al ( + ) катод Анодная реакция: Fe = Fe2+ + 2e
Катодная реакция: O2 + 2h3O + 4e = 4OH-
Суммарная реакция: 2Fe + O2 + 2h3O = 2Fe(OH)2
Eh3 = -0,059 * 14 = -0,83 В.
Термодинамически возможна коррозия только алюминия (-1,66 В < -0,83 В < -0,44 В). Фактически возможна коррозия только алюминия (железо пассивируется в щелочах).
анод ( — ) Al | h3O, OH- | Fe ( + ) катод Анодная реакция: Al = Al3+ + 3e
Катодная реакция: 2h3O + 2e = h3 + 2OH-
Суммарная реакция: 2Al + 6h3O = 2Al(OH)3 + 3h3
1.3. Электролиз с растворимыми и инертными анодами, расчет количества продуктов
Задание: определить какие вещества и в каких количествах выделяются на электродах при электролизе водных растворов CuSO4 и CuCl2 с растворимыми и инертными анодами при пропускании через электроды тока силой в 5 А в течение получаса.
Решение: рассмотрим расположение металла в электрохимическом ряду напряжений:
|
Li |
K |
Na |
Mg |
Al |
Ti |
Mn |
Zn |
Cr |
Fe |
Cd |
Co |
Ni |
Sn |
|
|
Pb |
h3 |
Sb |
Cu |
Ag |
Pd |
Pt |
Au |
-0,74 |
-0,44 |
-0,40 |
-0,28 |
-0,25 |
-0,14 |
-0,13 0,00 0,24 0,34 0,80 0,99 1,20 |
|
-3,04 |
-2,93 |
-2,71 -2,36 -1,66 -1,63 -1,18 |
-0,76 |
|||||||||||
1,50
Металлы с потенциалами отрицательнее марганца – не выделяются на катоде из водных растворов своих солей, на катоде выделяется в таких случаях только водород — по реакции 2h3O + 2e = h3 + 2OH-. Марганец и металлы с большими потенциалами – выделяются из водных растворов на катоде по реакции Mez+ + z • e = Me (z – валентность металла).
Анионы кислородосодержащих кислот SO42-, NO3-, PO43-, ClO4- и гидроксид-анионы OH- обычно не окисляются на инертном аноде, на аноде в таких случаях происходит окисление воды с выделением кислорода по реакции 2h3O = O2 + 4H+ + 4e. Галоген-
анионы кроме фторид-анионов F- окисляются на инертных анодах по реакции 2Hal- = Hal2
+ 2e.
Реакция растворения металлического анода выглядит как обратная катодному процессу восстановления металла: Me = Mez+ + z • e.
Медь – выделяется из водных растворов, медный анод – растворяется. На инертном аноде в первом случае (сульфат-анион) – выделение кислорода, во втором (хлорид-анион) – выделение хлора.
Электролиз сульфата меди с растворимыми анодами: на катоде Cu2+ + 2e = Cu
на аноде Cu = Cu2+ + 2e
Электролиз сульфата меди с инертными анодами: на катоде Cu2+ + 2e = Cu
на аноде 2h3O = O2 + 4H+ + 4e
Электролиз хлорида меди с растворимыми анодами: на катоде Cu2+ + 2e = Cu
на аноде Cu = Cu2+ + 2e
Электролиз хлорида меди с инертными анодами: на катоде Cu2+ + 2e = Cu
на аноде 2Сl- = Cl2 + 2e
Количества выделяющихся веществ в граммах или литрах определяют по закону Фарадея:
m = I • M • t • Вт / (z • F) или V = I • Vm • t • Вт / (z • F),
где I – ток, А
M – молярная масса выделяющегося вещества, г/моль Vm – молярный объем газа, л/моль
t – время, с
Вт – выход по току (обычно принимают равным 1)
z – число электронов, принимающих участие в электродной реакции F – число Фарадея, Кл/моль
Масса выделившейся на катоде меди (убыль массы медного анода): m = 5 • 63,55 • (0,5 • 3600) • 1 / (2 • 96500) = 2,96 г.
Объем выделившегося на инертном аноде кислорода: V = 5 • 22,4 • (0,5 • 3600) • 1 / (4 • 96500) = 0,52 л.
Объем выделившегося на инертном аноде хлора: V = 5 • 22,4 • (0,5 • 3600) • 1 / (2 • 96500) = 1,04 л.
1.4. Составление концентрационных элементов, расчет ЭДС
Задание: требуется записать схему концентрационного гальванического элемента (металл
– цинк), записать уравнения катодного и анодного процессов, рассчитать ЭДС при концентрациях катионов цинка 0,1 моль/л и 0,2 моль/л соответственно.
Решение: катодный и анодный процессы в концентрационном гальваническом элементе можно представить в виде уравнений реакций: Mez+ + z • e = Me и Me = Mez+ + z • e, где z
– валентность металла. В данном случае: на катоде Zn2+ + 2e = Zn
на аноде Zn = Zn2+ + 2e
Для расчета ЭДС и составления схемы элемента необходимо рассчитать потенциалы
катода и анода по уравнению Нернста E = E0Me + (R • T / z • F) • ln [Mez+] = E0Me + (0,059 / z) • lg [Mez+],
где E0Me – стандартный потенциал металла, В
R – универсальная газовая постоянная, Дж/моль•К T – температура, К
z – число электронов, принимающих участие в электродной реакции F – число Фарадея, Кл/моль
Mez+ – концентрация катионов металла, моль/л и определить полярность электродов:
Е1 = -0,76 + (8,31 • 298 / 2 • 96500) • ln [0,1] = -0,76 + (0,059 / 2) • lg [0,1] = -0,79 В Е2 = -0,76 + (8,31 • 298 / 2 • 96500) • ln [0,2] = -0,76 + (0,059 / 2) • lg [0,2] = -0,78 В
Электрод с меньшим равновесным потенциалом – анод, с большим равновесным потенциалом – катод.
ЭДС = Екатода – Еанода = -0,78 – (-0,79) = 0,01 В
Поскольку электрод в растворе с минимальной (максимальной) концентрацией является
анодом (катодом), расчет ЭДС можно реализовать через следующую формулу: E = (R • T / z • F) • ln [Mez+max / Mez+min] = (0,059 / z) • lg [Mez+max / Mez+min]
Схема:
анод ( — ) Zn | Zn2+ (0,1 М) || Zn2+ (0,2 М) | Zn ( + ) катод
1.5. Коррозия железа, пары дифференциальной аэрации
Задание: записать уравнения катодного и анодного процессов для железа, находящегося в кислоте (pH < 7), в воде (pH = 7) и в щелочи (pH > 7) при стандартных условиях, но при различном доступе кислорода воздуха к разным участкам поверхности железа (пары дифференциальной аэрации).
Решение: характерный пример — образование ржавчины на железе, например, под каплей воды, но не по всей площади капли, а строго в центре.
В парах дифференциальной аэрации деполяризатором является кислород воздуха, растворенный в коррозионной среде. Соответственно катодами являются участки с наибольшей аэрацией — те, к которым доступ кислорода наибольший. Поскольку сечение капли имеет условно полусферическую форму, то наименьший доступ кислорода — по центру капли.
анод ( — ) Fe | h3O, H+, O2 | Fe (O2) ( + ) катод Анодная реакция: Fe = Fe2+ + 2e
Катодная реакция: 4H+ + O2 + 4e = 2h3O
Суммарная реакция: 2Fe + 4H+ + O2 = 2Fe2+ + 2h3O
анод ( — ) Fe | h3O, O2 | Fe (O2) ( + ) катод Анодная реакция: Fe = Fe2+ + 2e
Катодная реакция: 2h3O + O2 + 4e = 4OH-
Суммарная реакция: 2Fe + 2h3O + O2 = 2Fe(OH)2
анод ( — ) Fe | h3O, OH-, O2 | Fe (O2) ( + ) катод Анодная реакция: Fe = Fe2+ + 2e
Катодная реакция: 2h3O + O2 + 4e = 4OH-
Суммарная реакция: 2Fe + 2h3O + O2 = 2Fe(OH)2
Образование ржавчины: 4Fe(OH)2 + 2h3O + O2 = 4Fe(OH)3
1.6. Хлорный и хлорсеребряный электроды
Задание: рассчитать ЭДС гальванического элемента, составленного хлорного и хлорсеребряного электродов, погруженных в раствор соляной кислоты с концентрацией 0,1 М (среднеионный коэффициент активности принять равным 1) при нормальных условиях, составить схему и записать уравнения электродных процессов.
Решение: хлорному электроду соответствует обратимая электродная реакция Cl2 + 2e =
2Cl-, потенциал хлорного электрода может быть рассчитан по формуле ECl2/Cl- = E0Cl2/Cl- + R • T / ( z • F ) • ln ( pCl2 / a2Cl- ). Активность a связана с концентрацией c через
среднеионный коэффициент активности γ соотношением a = γ • c, соответственно, при γ = 1 вместо значения активности для расчета можно воспользоваться значением концентрации, то есть a = c. Поскольку степень диссоциации α соляной кислоты практически равна 100%, то cCl- = cHCl = 0,1 моль/л.
ECl2/Cl- = 1,35 + 8,31 • 298 / ( 2 • 96500 ) • ln ( 1 / 0,12) = 1,41 В.
Хлорсеребряному электроду соответствует обратимая электродная реакция AgCl + e = Ag
+ Cl-, потенциал хлорсеребряного электрода может быть рассчитан по формуле EAgCl/Ag, Cl-
= E0AgCl/Ag, Cl- + R • T / ( z • F ) • ln ( 1 / aCl- ) = E0Ag+/Ag + R • T / ( n • F ) • ln (ПРAgCl) + R • T / ( z • F ) • ln ( 1 / aCl- ), где n — число электронов, принимающих участие в обратимой
электродной реакции Ag+ + e = Ag.
z = n = 1, ПРAgCl = 1,78 • 10-10.
EAgCl/Ag, Cl- = 0,80 + 8,31 • 298 / ( 1 • 96500 ) • ln ( 1,78 • 10-10 / 0,1 ) = 0,28 В.
Анодом в данном случае является ХСЭ, поскольку его потенциал — наименьший.
ЭДС = Екатода — Еанода = 1,41 — 0,28 = 1,13 В.
Схема гальванического элемента:
анод ( — ) Ag, AgCl | HCl (0,1 M) | Pt, Cl2 ( + ) катод
1.7. Электролиз водных растворов и расплавов
Задание: определить какие вещества выделяются на электродах при электролизе водных растворов и расплавов гидроксида натрия, сульфата натрия и хлорида натрия.
Решение: рассмотрим расположение натрия в электрохимическом ряду напряжений (ряд приведен не полностью, указаны стандартные потенциалы в вольтах)
|
Li |
K |
Na |
Mg |
Al |
Ti |
Mn |
Zn |
Cr |
Fe |
Cd |
Co |
Ni |
Sn |
|
|
Pb |
h3 |
Sb |
Cu |
Ag |
Pd |
Pt |
Au |
-0,74 |
-0,44 |
-0,40 |
-0,28 |
-0,25 |
-0,14 |
-0,13 0,00 0,24 0,34 0,80 0,99 1,20 |
|
-3,04 |
-2,93 |
-2,71 -2,36 -1,66 -1,63 -1,18 |
-0,76 |
|||||||||||
1,50
Металлы с потенциалами отрицательнее марганца – не выделяются на катоде из водных растворов своих солей, на катоде выделяется в таких случаях только водород — по реакции 2h3O + 2e = h3 + 2OH-. Выделение на катоде возможно из расплавов соответствующих солей по реакции Mez+ + z • e = Me (z – валентность металла).
Анионы кислородосодержащих кислот, например, SO42- и гидроксид-анионы OH- обычно
не окисляются аноде в водных растворах, на аноде в таких случаях происходит окисление воды с выделением кислорода по реакции 2h3O = O2 + 4H+ + 4e или гидроксид-анионов по реакции 4OH- = O2 + 2h3O + 4e. Галоген-анионы кроме фторид-анионов F- окисляются на аноде по реакции 2Hal- = Hal2 + 2e. В расплавах происходит анодное окисление анионов кислородосодержащих кислот и галоген-анионов.
Натрий – не выделяется на катоде из водных растворов, но выделяется из расплавов.
Электролиз водного раствора гидроксида натрия:
на катоде 2h3O + 2e = h3 + 2OH- на аноде 4OH- = O2 + 2h3O + 4e в сумме 2h3O = O2 + 2h3
Электролиз расплава гидроксида натрия: на катоде Na+ + e = Na
на аноде 4OH- = O2 + 2h3O + 4e
в сумме 4Na+ + 4OH- = O2 + 2h3O + 4Na или 4NaOH = O2 + 2h3O + 4Na
Электролиз водного раствора сульфата натрия:
на катоде 2h3O + 2e = h3 + 2OH- на аноде 2h3O = O2 + 4H+ + 4e в сумме 2h3O = 2h3 + O2
Электролиз расплава сульфата натрия: на катоде Na+ + e = Na
на аноде 2SO42- = O2 + 2SO3 + 4e
в сумме 4Na+ + 2SO42- = 4Na + O2 + 2SO3 или 2Na2SO4 = 4Na + O2 + 2SO3
Электролиз водного раствора хлорида натрия:
на катоде 2h3O + 2e = h3 + 2OH- на аноде 2Cl- = Cl2 + 2e
в сумме 2h3O + 2Cl- = h3 + 2OH- + Cl2 или 2h3O + 2NaCl = h3 + 2NaOH + Cl2
Электролиз расплава хлорида натрия: на катоде Na+ + e = Na
на аноде 2Cl- = Cl2 + 2e
в сумме 2Na+ + 2Cl- = 2Na + Cl2 или 2NaCl = 2Na + Cl2
1.8. Газовые электроды: водородный и кислородный
Задание: рассчитать ЭДС гальванического элемента, составленного из водородного и кислородного электродов, погруженных в раствор соляной кислоты с концентрацией 0,1 М (среднеионный коэффициент активности принять равным 1) при нормальных условиях, составить схему и записать уравнения электродных процессов.
Решение: водородному электроду соответствует обратимая электродная реакция 2H+ + 2e = h3, потенциал водородного электрода может быть рассчитан по формуле E2H+/h3 =
E02H+/h3 + R • T / ( z • F ) • ln ( a2H+ / ph3 ). Активность a связана с концентрацией c через среднеионный коэффициент активности γ соотношением a = γ • c, соответственно, при γ =
1 вместо значения активности для расчета можно воспользоваться значением концентрации, то есть a = c. Поскольку степень диссоциации α соляной кислоты
[Cu2+] = 10-E0Cu2+/Cu • z / 0,059
практически равна 100%, то cH+ = cHCl = 0,1 моль/л. При стандартных условиях давление водорода ph3 принимают равным 1 атм. С другой стороны показатель рН – функция активности или концентрации катионов водорода: pH = -lg (ah3) = -lg ( ah3 • γ ) = -lg [ H+ ].
Потенциал водородного электрода может быть рассчитан через pH: E2H+/h3 = E02H+/h3 + R • T / ( z • F ) • ln (a2 H+ / ph3 ) = 0,00 + 2, 3 • R • T / ( z • F ) • lg ( a2H+ ) = ( 0,059 / z ) • lg ( a2H+ )
= 0,059 • lg ( aH+ ) = -0,059 • pH.
E2H+/h3 = -0,059 • lg ( 0,1 ) = 0,059 В.
Кислородному электроду соответствует электродная реакция O2 + 4H+ + 4e = 2h3O, потенциал кислородного электрода может быть рассчитан по формуле EO2/h3O = E0O2/h3O +
R • T / ( z • F ) • ln ( pO2 • a4H+ / a2h3O ). При стандартных условиях давление кислорода pO2 принимают равным 1 атм. Активность воды принимают равной 1.
Потенциал кислородного электрода также может быть рассчитан через pH: EO2/h3O = E0O2/h3O + R • T / ( z • F ) • ln ( pO2 • a4H+ / a2h3O ) = 1,23 + 2, 3 • R • T / ( z • F ) • lg ( a4H+ ) =
1,23 — 0,059 • lg ( aH+ ) = 1,23 — 0,059 • pH.
EO2/h3O = 1,23 — 0,059 • lg ( 0,1 ) = 1,17 В.
Анодом в данном случае является водородный электрод, поскольку его потенциал — наименьший.
ЭДС = Екатода — Еанода = 1,17 — 0,06 = 1,11 В.
Схема гальванического элемента:
анод ( — ) Pt, h3 | HCl (0,1 M) | Ni, O2 ( + ) катод
1.9. Определение концентрации катионов металла
Задание: определить при какой концентрации Cu2+ медный электрод в растворе CuSO4 будет иметь равновесный потенциал, равный потенциалу стандартного водородного электрода. Условия – стандартные.
Решение: медному электроду соответствует обратимая электродная реакция Cu2+ + 2e = Cu.
E02H+/h3 = 0,00 В.
ECu2+/Cu = E0Cu2+/Cu + R • T / ( z • F ) • ln [Cu2+] = E0Cu2+/Cu + 2,3 • R • T / ( z • F ) • lg [ Cu2+ ] = E0Cu2+/Cu + ( 0,059 / z ) • lg [ Cu2+ ] = 0,00.
lg [Cu2+] = -E0Cu2+/Cu • z / 0,059, где z – число электронов, принимающих участие в
электродной реакции.
= 10-0,34 • 2 / 0,059 = 10-11,53 = 3 • 10-12 = 0,000000000003 моль/л.
1.10. Определение продуктов электролиза
Задание: определить трехвалентный металл, если при пропускании тока силой 5 А через раствор фторида данного металла в течение 53 минут 6 секунд он выделился на катоде в количестве 6,70 г, определить какой газ и в каком объеме выделился на аноде, записать уравнения электродных процессов.
Решение: количества выделяющихся веществ в граммах или литрах определяют по закону Фарадея:
studfiles.net
Задачи по неорганической химии | Лидин Р.А., Молочко В.А., Андреева Л.Л.
On July 20, we had the largest server crash in the last 2 years. Mostly the data of the books and covers were damaged so many books are not available for download now. Also, some services may be unstable (for example, Online reader, File Conversion). Full recovery of all data can take up to 2 weeks! So we came to the decision at this time to double the download limits for all users until the problem is completely resolved. Thanks for your understanding!
Progress: 53.6% restored
Main
Задачи по неорганической химии

Лидин Р.А., Молочко В.А., Андреева Л.Л.
Учебное пособие для хим.-технол. вузов / Под ред. Р.А. Лидина. — М.: Высшая школа, 1990. — 319 с. — ISBN 5-06-000664-6.Пособие включает более 3000 задач. Каждый раздел теоретических основ содержит математические указания по использованию физико-химических величин и единиц СИ в решении расчетных задач, методические формулы и примеры решения типовых задач. В разделах химии элементов расчетные задачи сформулированы применительно к практикуму, имеются задачи по экологическим аспектам химической технологии.СодержаниеПредисловие
Принятые сокращения и обозначения
Типы и номенклатура неорганических веществ
Кислотные и основные гидроксиды. Соли
Кислотные и основные оксиды
Амфотерные гидроксиды и оксиды
Бинарные соединения
Составление уравнений химических реакций
Обменные реакции
Окислительно-восстановительные реакции
Стехиометрические расчеты в химии
Расчеты по уравнениям реакций
Расчеты по закону эквивалентов
Энергетика и направление химических реакций
Энтальпия химических реакций
Направление химических реакций в изолированной системе. Энтропия
Направление химических реакций в неизолированной системе. Энергия Гиббса
Энергия Гиббса и химические свойства веществ
Направление окислительно-восстановительных реакций в водном растворе
Химическое равновесие
Состояние химического равновесия
Смещение химического равновесия
Общие свойства растворов
Состав и приготовление растворов
Насыщенные растворы. Растворимость веществ
Водные растворы протолитов
Вода. Нейтральная, кислая и щелочная среда. Сильные протолиты
Слабые протолиты. Амфолиты
Смещение протолитических равновесий
Произведение растворимости. Условие выпадения осадка
Периодический закон и строение атома
Химическая связь и строение молекул
Метод валентных связей
Метод молекулярных орбиталей
Комплексные соединения
Номенклатура комплексных соединений
Строение комплексных соединений
Типы и устойчивость комплексных соединений
Химические свойства р-элементов
Элементы VI1A группы
Элементы VIA группы
Элементы VA группы
Элементы IVA группы
Элементы ША группы
Химические свойства s-элементов
Элементы НА группы
Элементы IA группы
Химические свойства d- и f-элементов
Элементы IIБ группы
Элементы 1Б группы
Элементы VIIIE группы
Элементы VIIБ группы
Элементы VIE группы
Элементы VB группы
Элементы IVB группы
Элементы ШБ группы
Приложение
Ответы
Language:
russian
File:
DJVU, 3.94 MB
The file will be sent to selected email address. It may takes up to 1-5 minutes before you received it.
The file will be sent to your Kindle account. It may takes up to 1-5 minutes before you received it.
Please note you’ve to add our email [email protected] to approved e-mail addresses.
Read more.
b-ok.org
Глинка Н. Л. Задачи и упражнения по общей химии
Глинка Н. Л. Задачи и упражнения по общей химии. Учебное пособие для вузов / Под ред. В. А. Рабиновича и Х. М. Рубиной. – 23-е изд., исправленное – Л.: Химия, 1985. – 264 с., ил.
Глава I. ПРОСТЕЙШИЕ СТЕХИОМЕТРИЧЕСКИЕ РАСЧЕТЫ
1. Эквивалент. Закон эквивалентов
Задачи 1-27
2. Основные газовые законы
Задачи 28-40
3. Парциальное давление газа
Задачи 41-52
4. Моль. Закон Авогадро. Мольный объем газа
Задачи 53-79
5. Определение молекулярных масс веществ в газообразном состоянии
Задачи 80-98
6. Вывод химических формул. Расчеты по химическим формулам и уравнениям
Задачи 99-139
Глава II. ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Задачи 140-160
Задачи 161-174
Глава III. СТРОЕНИЕ АТОМА. РАДИОАКТИВНОСТЬ
1. Электронная структура атомов. Зависимость свойств элементов от строения их атомов
Задачи 175-205
2. Строение атомных ядер. Радиоактивность. Ядерные реакции
Задачи 206-227
Глава IV. ХИМИЧЕСКАЯ СВЯЗЬ
1. Типы химической связи. Способы образования ковалентной связи
Задачи 228-253
2. Полярность молекул. Геометрическая структура молекул
Задачи 254-267
3. Ионная связь. Поляризация ионов
Задачи 268-278
4. Водородная связь. Межмолекулярное взаимодействие
Задачи 279-282
Глава V. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
1. Энергетика химических реакций. Химико-термодинамические расчеты
Задачи 283-300
Задачи 301-314
Задачи 315-324
2. Скорость химической реакции. Химическое равновесие
Задачи 325-360
Задачи 361-390
Глава VI. РАСТВОРЫ
1. Способы выражения содержания растворенного вещества в растворе. Растворимость
Задачи 391-457
2. Энергетические эффекты при образовании растворов
Задачи 458-462
3. Физико-химические свойства разбавленных растворов неэлектролитов
Задачи 463-501
Глава VII. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
1. Слабые электролиты. Константа и степень диссоциации
Задачи 502-528
2. Сильные электролиты. Активность ионов
Задачи 529-535
3. Ионное произведение воды. Водородный показатель
Задачи 536-558
4. Произведение растворимости
Задачи 559-579
5. Обменные реакции в растворах электролитов. Гидролиз солей
Задачи 580-607
Глава VIII. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. ОСНОВЫ ЭЛЕКТРОХИМИИ
1. Степень окисленности. Окисление и восстановление
Задачи 608-618
2. Окислители и восстановители
Задачи 619-623
3. Составление уравнений окислительно-восстановительных реакций
Задачи 624-631
Задачи 632-640
4. Эквиваленты окислителей и восстановителей
Задачи 641-649
5. Химические источники электрической энергии. Электродные потенциалы
Задачи 650-671
6. Направление протекания окислительно-восстановительных реакций
Задачи 672-685
7. Электролиз
Задачи 686-715
Глава IX. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
1. Определение состава комплексного иона
Задачи 716-722
2. Номенклатура комплексных соединений
Задачи 723-728
3. Равновесия в растворах комплексных соединений
Задачи 729-738
4. Магнитные и оптические свойства комплексных соединений. Пространственная структура комплексных соединений
Задачи 739-756
Глава X. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ. СПЛАВЫ
Задачи 757-768
Глава XI. ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ. СВОЙСТВА ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
1. Общие закономерности
Задачи 769-780
2. Водород
Задачи 781-807
3. Галогены
Задачи 808-833
4. Элементы подгруппы кислорода
Задачи 834-877
5. Элементы подгруппы азота
Задачи 878-911
Задачи 912-942
6. Углерод и кремний
Задачи 943-967
7. Металлы первой группы периодической системы
Задачи 968-1003
8. Металлы второй группы периодической системы. Жесткость воды
Задачи 1004-1043
9. Элементы третьей группы периодической системы
Задачи 1044-1067
10. Металлы четвертой, пятой, шестой и седьмой групп периодической системы
Задачи 1068-1088
Задачи 1089-1108
11. Благородные газы. Металлы восьмой группы
Задачи 1109-1139
reshchem.ucoz.ru
Задачники по химии — Все для студента
В подразделе Задачники по химии размещаются книги, представляющие собой только типографские сборники задач и их решений.
При наличии в сборнике задач в виде приложения к курсу науки, он размещается в соответствующем подразделе по своей основной тематике.Мелкие брошюрки, изданные учебными заведениями для внутреннего применения, а также «самодельные» решебники размещаются в соответствующем подразделе с указанием типа файла «Контрольные работы, РГР, решения задач».
Hodder Education Group, 2008. — 152 p. Chemical calculations account for 25% of available examination maks in Advanced Higher Chemistry (as offered by the Scottish Qualifications Authority) and the first part of this book explains background theory as well as worked examples and problems (with answers provided), to give valuable practice in this area of the examination. The second…
- №1
- 15,20 МБ
- добавлен
- изменен
Really Useful Resources Limited. 2005.
ISBN 1-877389-02-1
Задания по химии третьего уровня New Zealand Certificate of Educational Achievemets (аналог нашего ЕГЭ). С решениями.
This book is intended for students preparing for NCEA Level 3 Chemistry. I hope that it serves as a useful revision guide throughout the year and in preparation for the final assessments. It is…
- №2
- 15,14 МБ
- добавлен
- изменен
Really Useful Resources Limited. 2005.
ISBN 1-877389-18-8
Задания по химии второго уровня New Zealand Certificate of Educational Achievemets (аналог нашего ЕГЭ). С решениями.
This book is intended for students preparing for NCEA Level Two Chemistry. It includes a large number of appropriate assessments with suggested answers. There are useful hints included in both the…
- №3
- 10,40 МБ
- добавлен
- изменен
21.11.1998. — 6 с. Олимпиада республиканского уровня на польском языке (с решением).
- №4
- 360,72 КБ
- добавлен
- изменен
www.twirpx.com