Практические работы по химии 8 класс
Просмотр содержимого документа
«Практическая работа №2-8 класс»
Практическая работа №2
Анализ почвы и воды
Цель: определить состав почвы, научиться фильтровать и выпаривать жидкость.
Оборудование: две пробирки, воронка, бумажный фильтр, стеклянная палочка, предметное стекло, спиртовка, стеклянный цилиндр с водой, пробка, универсальная индикаторная бумага.
Инструкция по технике безопасности:
Если зажечь спиртовку сразу же после снятия колпачка, загорается плёнка спирта на горлышке спиртовки как раз на том месте, где колпачок прилегает к горлышку. Пламя проникает под диск с трубкой, и пары спирта внутри резервуара загораются. Может произойти взрыв и выброс диска вместе с фитилём. Чтобы избежать этого, приподнимите на несколько секунд диск с фитилём для удаления паров. Если случится воспламенение паров, быстро отставьте в сторону предметы (тетрадь для практических работ) и позовите учителя.
Зажжённую спиртовку нельзя переносить с места на место, нельзя также зажигать одну спиртовку непосредственно от другой. Для зажигания спиртовки пользуйтесь спичками.
Гасить спиртовку можно только одним способом – накрыть пламя фитиля колпачком. Колпачок должен находиться всегда под рукой.
Предметное стекло закрепляется в держателе у одного из его краёв аккуратно. При этом учитывается, что стекло – хрупкий материал и может треснуть, если на него сильно надавить.
В процессе выпаривания воды из почвенной вытяжки вначале прогревается всё предметное стекло, а затем капля жидкости на нём.
Опыт №1. Механический анализ почвы.
В пробирку помещена почва. Прилейте к ней воду, объём которой должен быть в 3 раза больше объёма почвы. Закройте пробирку пробкой и тщательно встряхивайте 1 – 2 минуты. Наблюдайте за осадком частиц почвы и структурой осадков. Опишите и объясните свои наблюдения.
Опыт №2. Получение почвенного раствора и опыты с ним.
Приготовьте бумажный фильтр, вставьте его в чистую пробирку и профильтруйте полученную в первом опыте смесь почвы и воды. Перед фильтрованием смесь не следует встряхивать. Почва останется на фильтре, а собранный в пробирке фильтрат представляет собой почвенную вытяжку (почвенный раствор).
Несколько капель этого раствора с помощью стеклянной палочки поместите на предметное стекло и подержите его над пламенем спиртовки до выпаривания воды. Что наблюдаете? Объясните.
Возьмите универсальную индикаторную бумагу, нанесите на неё стеклянной палочкой почвенный раствор. Сделайте вывод по результатам своих наблюдений.
Заполните таблицу:
|
№п/п |
Что делали |
Что наблюдали |
Вывод |
Просмотр содержимого документа
«Практическая работа №6 — 8 кл»
Практическая работа №6
«Ионные реакции и условия их протекания»
Цель: выяснить условия протекания химических реакций между растворами электролитов до конца.
Оборудование и реактивы: пробирки, растворы сульфата меди (II), гидроксида натрия, хлорида бария, карбоната натрия, азотной кислоты, серной и соляной кислот, фенолфталеин.
Выполнение работы
Инструктаж по технике безопасности (подпись)
Опыт №1. Условие первое – выпадение осадка.
В одну пробирку налили 1 мл раствора сульфата меди (II) и добавили немного раствора щелочи. Наблюдаем образование ______________
CuSO4 + NaOH = ? + ?
(уравнение написать в молекулярной и ионной формах)
Во вторую пробирку налили раствор хлорида бария и прилили раствор серной кислоты. Наблюдаем образование ______________
BaCl2 + H2SO4 = ? + ?
(уравнение написать в молекулярной и ионной формах)
Опыт №2. Условие второе – выделение газа.
В две пробирки налили по 1 мл раствора карбоната натрия и добавили в одну пробирку несколько капель азотной кислоты, а в другую – несколько капель соляной кислоты. В обеих пробирках наблюдаем выделение ___________________________.
Na2CO3 + HNO3 = ? + ?
Na2CO3 + HCl = ? + ?
(уравнения написать в молекулярной и ионной формах)
Опыт №3. Условие третье – образование воды как побочного продукта.
В две пробирки налили по 1 мл раствора гидроксида натрия и добавили несколько капель фенолфталеина. Раствор приобрел ________________ окраску. В одну пробирку добавили раствор серной кислоты, а в другую – раствор азотной кислоты до исчезновения окраски.
NaOH + H2SO4 = ? + ?
NaOH + HNO3 = ? + ?
(уравнения написать в молекулярной и ионной формах)
Работу оформить в виде таблицы
|
№п/п |
Реактивы |
Наблюдаемый эффект |
Уравнения реакций в молекулярном и ионном виде |
|
1 |
|||
|
2 |
|||
|
3 |
Вывод: Реакции между растворами электролитов протекают до конца в случае выпадения __________, выделения ___________, образования _____________.
Просмотр содержимого документа
«Практические работы 8 класс оборудование и реактивы»
multiurok.ru
Опыты и эксперименты по химии (8 класс) на тему: Практические работы по химии 8 классе
Практическая работа № 4
Признаки химических реакций
Цель работы: научиться распознавать признаки химических реакций, соблюдать осторожность при работе с химическими реактивами, закрепить правила оказания первой помощи при попадании кислоты на кожу человека.
Продолжить отработку навыков составления уравнений химических реакций.
Оборудование: спиртовка, тигельные щипцы, пробирка, лучинка.
Реактивы: кусочки мрамора, медная проволока, разбавленная серная кислота; растворы хлорида железа (III), роданида калия, карбоната натрия, хлорида кальция.
Ход работы
1. Инструктаж по технике безопасности при работе с нагревательными приборами, реактивами и стеклянной посудой. Оказание первой помощи при попадании щелочи или кислоты на кожу, глаза.
2. Выполните опыты, предложенные в учебнике.
3. Оформите таблицу
|
Что делали |
Наблюдения |
Выводы и ответы на вопросы, уравнение и тип реакции |
|
Опыт 1. Прокалили медную спираль, держа её тигельными щипцами, в пламени до почернения. Прокалённую спираль опустили в пробирку с серной кислотой. Пробирку подогрели. |
||
|
Опыт 2. В пробирку положили кусочек мрамора. Прилили разбавленную соляную кислоту. Зажгли лучинку и внесли её в пробирку. |
||
|
Опыт 3. В пробирку налили 2 мл хлорида железа (III), затем несколько капель раствора роданида калия. |
||
|
Опыт 4. В пробирку налили 2 мл раствора карбоната натрия, затем несколько капель раствора хлорида кальция. |
4. Приведите в порядок своё рабочее место.
nsportal.ru
Практические работы по химии 8 класс
МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
«СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА №25»
г.Мытищи М.о.
Методические рекомендации
к выполнению практических работ по химии
8 класс
Составитель: Т.Г. Ожерелкова
учитель химии
2015 год
Правила техники безопасности при проведении практических работ по химии
-
Выполняйте лишь те опыты, которые описаны в инструкции или предложены учителем. Запрещается проводить посторонние опыты.
-
Химические вещества для опытов берите в количествах, указанных в инструкции. Твёрдые вещества отбирайте с помощью ложечки или шпателя, а жидкость – пипетками или стеклянными трубочками.
-
Правильно обращайтесь со спиртовкой. Помните, как зажигать и гасить пламя спиртовки. Экономьте горючее.
-
Нагревание веществ и смесей начинайте со слабого прогревания всей пробирки (3-4 движения пламени), а затем пламя переместите в то место, где находится вещество. Такой приём уменьшает возможность растрескивания пробирки или выброса жидкости.
-
При нагревании жидкости направляйте отверстие пробирки в сторону от себя и соседей, так как жидкость может выплеснуться из пробирки.
-
Не заглядывайте в нагреваемый сосуд или пробирку, так как возможен выброс горячей массы.
-
Не берите вещества руками, пользуйтесь только ложечкой или шпателем.
-
Не меняйте крышки от различных склянок. Не набирайте одной и той же пипеткой растворы различных веществ.
-
Не выливайте излишек реактива в склянку, из которой он был взят.
-
Не пробуйте вещества на вкус. Помните: многие вещества ядовиты.
-
При определении вещества по запаху не наклоняйтесь над горлом сосуда, не вдыхайте пары и газы полной грудью.
-
Запрещается выливать в раковину отходы соединений серебра, свинца, бария, растворы органических веществ (фенола, анилина и др.). Сливайте их только в специальные банки-сливы.
-
Осторожно обращайтесь с растворами кислот и щелочей: они могут вызвать ожоги, порчу одежды. В случае попадания капель этих веществ на стол, одежду или руки немедленно смойте их водой и сообщите учителю.
-
Во время работы соблюдайте осторожность, чистоту рабочего места и тишину. Помните, что невнимательность, поспешность, небрежность могут привести к нарушению правил техники безопасности и несчастным случаям.
-
В случае порезов, ожогов или других повреждений немедленно сообщите учителю.
Правила обращения со спиртовкой
-
Сняв колпачок, обратите внимание на то, чтобы диск с трубкой плотно прикрывал отверстие резервуара спиртовки: иначе во время работы может воспламениться спирт.
-
Зажигайте спиртовку только спичкой.
-
Нагревание проводите в верхней части пламени, так как оно самое горячее.
-
Пламя спиртовки гасите колпачком.
-
Если не пользуетесь спиртовкой, закройте её колпачком во избежание испарения спирта через фитиль.
Практическая работа №1
Тема: Знакомство с лабораторным оборудованием. Правила техники безопасности при проведении практических работ по химии
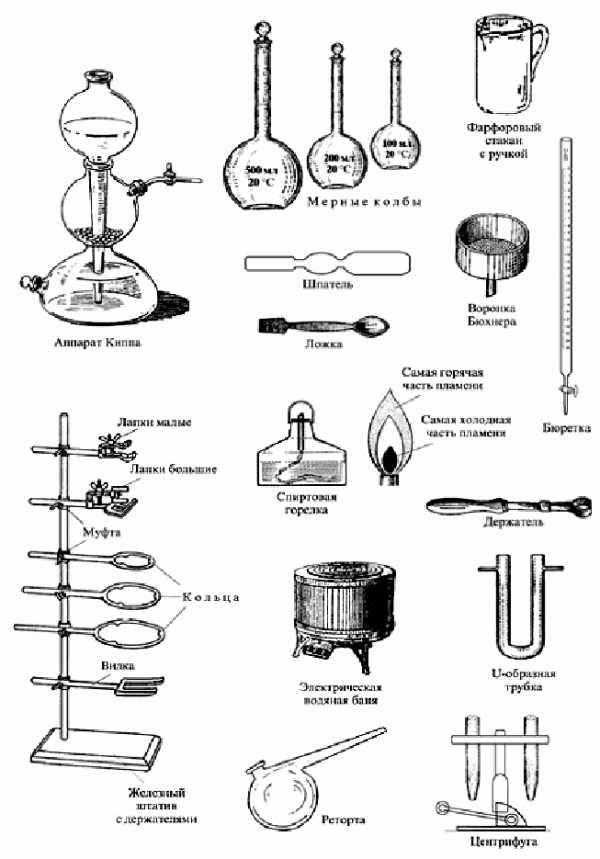
Цель: ознакомиться с основным оборудованием и химической посудой, изучить приёмы правильного обращения с ними, изучить строение пламени.
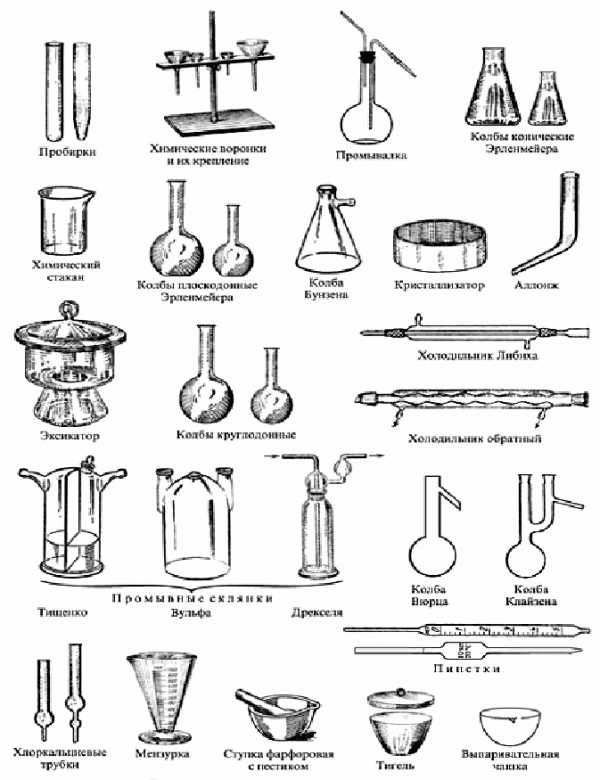
Оборудование: лабораторный штатив с кольцом и лапкой, спиртовка, пробиркодержатель, пробирка, химические стаканы, колбы, воронки, мерная посуда (цилиндр, мензурка, градуированная пробирка), фарфоровые чашки, ступки с пестиками, тигли, тигельные щипцы, шпатели, микроложечки, стеклянные палочки и трубочки, пипетки.
Ход работы:
Задание 1. Изучите устройство штатива и приёмы его использования.
Составные части штатива:
-
Чугунная подставка
-
Стержень
-
Муфты
-
Лапка
-
Кольцо
Сделайте рисунок штатива и подпишите на рисунке части штатива.
Поменяйте высоту, на которой укреплены лапка и кольцо. Для этого ослабьте винты муфт, переместите их по стержню до нужного уровня и закрепите.
Поверните лапку и кольцо в креплении муфты. Для этого ослабьте другие винты муфт, поверните лапку или кольцо и закрепите винты вновь.
Задание 2. Изучите устройство спиртовки и правила обращения с ней.
Составные части спиртовки:
-
Резервуар со спиртом
-
Фитиль
-
Трубка с диском
-
Колпачок
Сделайте рисунок спиртовки, указав её части.
Задание 3. Изучите строение пламени.
Проверьте, плотно ли прилегает диск к отверстию резервуара. Зажгите спиртовку спичкой, рассмотрите строение пламени. Погасите спиртовку колпачком.
Сделайте рисунок пламени, подпишите его части.
Части пламени:
-
Нижняя часть (тёмная зона)
-
Средняя часть (яркая зона)
-
Верхняя часть
Подпишите, какая из частей пламени самая горячая? Какая самая холодная?
После окончания работы приведите в порядок рабочее место.
Практическая работа №2
Тема: Очистка загрязнённой поваренной соли
Цель: ознакомиться со способами разделения смесей: фильтрованием, выпариванием.
Оборудование и реактивы: штатив с малым кольцом, 2 стакана, микроложечка, воронка, фильтровальная бумага, выпарительная чашка, стеклянная палочка, спиртовка, спички, загрязнённая поваренная соль.
Ход работы:
-
Растворение загрязнённой соли. В стакан налейте 5-6 мл воды, добавьте ложечку соли и перемешайте стеклянной палочкой до полного растворения соли.
-
Фильтрование. Приготовьте фильтр, вставьте его в воронку, смочите фильтр водой, чтобы он плотно прилегал к стенкам воронки. Вставьте воронку в кольцо штатива, подставьте стакан так, чтобы конец воронки соприкасался с внутренней стенкой стакана. Загрязнённый раствор наливайте небольшими порциями на фильтр по стеклянной палочке, направленной к стенке воронки.
-
Выпаривание очищенного раствора соли (фильтрата). В выпарительную чашку налейте 1 мл фильтрата и выпарьте его.
Отчёт: оформите в виде таблицы
Что делали?
Что наблюдали?
Рисунок
Выводы.
1.
1.В каком случае смесь разделяют фильтрованием?
2.Какие вещества выделяют из раствора выпариванием?
2.
После окончания работы приведите в порядок рабочее место. J
Практическая работа №3
Тема: Приготовление раствора соли с определённой массовой долей растворённого вещества.
Цель: научиться готовить растворы определённой концентрации, закрепить умение отмеривать объём жидкости, взвешивать твёрдые вещества, растворять.
Оборудование и реактивы: стакан химический, стеклянная палочка с резиновым наконечником, весы с разновесами, шпатель или лопаточка, мерный цилиндр, соли, холодная кипячёная вода.
Задание:
Вариант 1.
Приготовьте 20 г водного раствора поваренной соли (хлорида натрия) с массовой доли соли 5%.
Вариант 2.
Приготовьте 25 г водного раствора сульфата меди с массовой долей соли 4%.
Вариант 3.
Приготовьте 25 г водного раствора соды (карбоната натрия) с массовой долей соли 8%.
Ход работы:
-
Произведите расчёты: определите, какую массу соли и воды потребуется взять для приготовления раствора, указанного в условии задачи.
-
Отвесьте соль и поместите её в стакан. Отмерьте мерным цилиндром необходимый объём воды и вылейте в стакан. Содержимое перемешайте палочкой до полного растворения соли.
-
В отчёте приведите расчёты, последовательность действий и сделайте рисунок сосуда, в котором вы приготовили раствор. На рисунке обозначьте массовую долю соли и её химическую формулу.
-
КСl
р-р 3%
Приведите в порядок рабочее место J
Практическая работа №4
Тема: Признаки химических реакций
Цель: изучить признаки химических реакций, доказывающие образование новых веществ.
Оборудование и реактивы: кусочки мела, соляная кислота, растворы роданита аммония, хлорида железа(III), сульфата меди, гидроксида натрия, железный гвоздь, четыре пробирки.
Ход работы:
Опыт 1. Взаимодействие раствора сульфата меди с железом
В пробирку налейте 1,5 мл раствора сульфата меди. Отметьте его цвет. Опустите в раствор очищенный железный гвоздь. Окончательный вывод о продуктах реакции сделайте через 5 минут.
Какие признаки химических реакций вы наблюдаете? Запишите её уравнение и укажите тип реакции по признаку числа и состава исходных веществ и продуктов реакции.
Опыт 2. Взаимодействие хлорида железа (III) с роданитом аммония
В пробирку налейте 1 мл раствора хлорида железа(III) и добавьте по каплям раствор роданита аммония.
Какие признаки химических реакций вы наблюдаете? Запишите её уравнение и укажите тип реакции по признаку числа и состава исходных веществ и продуктов реакции.
Опыт 3. Взаимодействие сульфата меди со щёлочью
В пробирку налейте 1 мл раствора сульфата меди и добавьте несколько капель раствора гидроксида натрия.
Какие признаки химических реакций вы наблюдаете? Запишите её уравнение и укажите тип реакции по признаку числа и состава исходных веществ и продуктов реакции.
Опыт 4. Взаимодействие мела с кислотой
В пробирку положите 1-2 кусочка мела и прилейте соляной кислоты столько, чтобы она покрыла кусочки мела.
Какие признаки химических реакций вы наблюдаете? Запишите её уравнение и укажите тип реакции по признаку числа и состава исходных веществ и продуктов реакции.
Отчёт:
Что делали?
Что наблюдали?
Уравнения реакций. Выводы.
1.
2.
Приведите в порядок рабочее место
Практическая работа №5
Тема: Реакция обмена между оксидом меди (II)) и серной кислотой. (Получение медного купороса)
Цель: закрепить знания о свойствах кислот и способах получения солей путём реакций обмена между основным оксидом и кислотой.
Оборудование и реактивы: порошок оксида меди, раствор серной кислоты, спиртовка, пробиркодержатель, 2 пробирки, штатив с кольцом, выпарительная чашка, воронка, фильтровальная бумага, спички.
Ход работы:
-
Получение раствора сульфата меди (медного купороса). На дне выданной пробирки находится порошок оксида меди. Прилейте к нему 1 мл раствора серной кислоты и нагрейте смесь, не доводя до кипения.
-
Кристаллизация сульфата меди. Горячую смесь профильтруйте в выпарительную чашку и нагрейте её до появления первых кристаллов. Дальше нагревать не следует. При остывании раствора наблюдается кристаллизация.
Отчёт:
Что делали?
Что наблюдали?
Рисунок
Уравнения реакций. Выводы.
1.
2.
Приведите в порядок рабочее место J
Практическая работа №6
Тема: Ионные реакции. Свойства кислот, оснований, солей
Цель: исследовать вопрос необратимости реакций ионного обмена, закрепить умение составлять молекулярные, полные и краткие ионные уравнения.
Оборудование и реактивы: растворы сульфата меди, карбоната натрия, гидроксида натрия, серной кислоты, фенолфталеина, 3 пробирки; таблица растворимости.
Задание: провести опыты в соответствии с инструкцией, соблюдая меры предосторожности; составить уравнения реакций в молекулярном, полном и кратком ионном виде.
Опыт №1. Взаимодействие соли и щёлочи.
В пробирку налить 1 мл раствора сульфата меди и добавить по каплям раствор гидроксида натрия до образования осадка.
Опыт №2. Взаимодействие соли и кислоты.
К 1 мл раствора карбоната натрия добавить по каплям раствор серной кислоты. Содержимое пробирки взболтать.
Вывод: образование газа – условие необратимости реакций ионного обмена.
Опыт №3. Взаимодействие щёлочи и кислоты – реакция нейтрализации.
К 1 мл раствора щёлочи добавить 1 каплю раствора фенолфталеина, отметить окраску индикатора. Затем добавить по каплям раствор серной кислоты до обесцвечивания.
Вывод: индикатор показывает щелочную среду, затем при добавлении кислоты среда становится нейтральной, образуется соль и малодиссоциирующее вещество – вода. Образование малодиссоциирующего вещества – условие необратимости РИО.
Отчёт: результаты работы оформить в виде таблицы.
Что делали?
Что наблюдали?
Рисунок.
Уравнения реакций. Выводы.
После окончания работы приведите рабочее место в порядок.
Практическая работа №7
Тема: Решение экспериментальных задач по теме «Основные классы неорганических соединений»
Цель: закрепить знания о свойствах кислот, оснований, солей, об условиях необратимости реакций ионного обмена, закрепить умение составлять уравнения реакций ионного обмена, уравнения ОВР методом электронного баланса.
Оборудования и реактивы: растворы серной кислоты, хлорида бария, нитрата серебра, карбоната натрия, сульфата натрия, хлорида натрия, гранулы цинка; 3 пронумерованные пробирки с испытуемыми растворами, 7 чистых пробирок.
Ход работы:
Опыт 1. Реакция серной кислоты с цинком
Налейте в пробирку1 мл раствора серной кислоты и опустите в неё гранулу цинка. Что наблюдаете? Какой газ выделяется? Составьте уравнение реакции в молекулярном и ионном виде и рассмотрите его как окислительно-восстановительное.
Опыт 2. Распознавание карбоната натрия, сульфата натрия, хлорида натрия.
Распознавание карбоната натрия: из 3-х пронумерованных пробирок взять пробы и испытать их раствором серной кислоты.
Распознавание сульфата натрия: из 2-х оставшихся пробирок взять пробы и испытать их раствором хлорида бария.
Распознавание хлорида натрия: из 1-й оставшейся пробирки взять пробу и испытать её раствором нитрата серебра.
Напишите уравнение реакций в молекулярном и ионном виде.
Вывод: распознавание проводится при помощи качественных реакций на анионы.. Реактивом для карбонат-аниона является катион водорода; реактивом для сульфат-аниона является катион бария; реактивом для хлорид-аниона является катион серебра.
Отчёт: результаты работы оформить в виде таблицы.
Что делали?
Что наблюдали?
Уравнения реакций. Выводы.
После окончания работы приведите рабочее место в порядок.
infourok.ru
Практическая работа по химии 8 класс
 Учитель химии и биологии Павлодарской области,
Учитель химии и биологии Павлодарской области,
Щербактинского района,
с.Хмельницкое, ГУ «Хмельницкая СОШ»
Омербаева Жангуль Артуровна
Методическое пособие
Практические работы по химии для 8 класса
Практическая работа № 1 по химии 8 класс
Правила безопасности в химическом кабинете. Приёмы обращения с лабораторным оборудованием. Изучение строения пламени. Правила горения жидкости. Первичный инструктаж по ТБ.
Цель урока: Ознакомиться с правилами техники безопасности при работе в кабинете химии; научиться закреплять штатив к основанию, пробирку на штативе; ознакомиться с химической посудой, фарфоровыми чашками, устройством спиртовки; приёмами обращения с лабораторным штативом; изучить строение пламени; правилами горения пламени; первичным инструктажем на рабочем месте.
Оборудование.
Лабораторный штатив, пробирки, колбы, фарфоровая посуда, стакан с водой, спички, стеклянная посуда, спиртовка, инструкции по ТБ.
Ход урока.
1. Вводная беседа о необходимости соблюдения правил техники безопасности при работе в химическом кабинете. Работа с учебником стр. 194-195 «Основные правила техники безопасности» (приложение № 1). Сделайте конспект.
2. Ознакомление с лабораторным оборудованием (приложение № 2). Зарисуйте виды колб, фарфоровую ступку, дайте им названия.
3. Рассмотрите и ознакомьтесь со строением железного штатива с держателями. Ознакомиться со сборкой штатива, установить пробирку в держателе. Зарисуйте штатив и обозначьте его составные части.
4. Рассмотрите строение спиртовки, зарисуйте и укажите его устройство.
5. Исследуйте строение пламени и выясните, какой его частью следует пользоваться при нагревании. Ознакомьтесь с устройством и правилами работы спиртовки по инструкции (приложение № 3).
Зажгите спиртовку или свечу и внимательно рассмотрите пламя. Сколько зон можно выделить в пламени? Отметьте цвет пламени (яркое, прозрачное, тёмное) и по времени загорания спички отметьте характеристику его зон по температуре (самая горячая, менее горячая, не горячая). Зарисуйте пламя, отметьте зоны, оформите отчёт. Уберите рабочее место.
Сделайте общий вывод, с чем вы сегодня ознакомились.
Приложение 1
Инструкция
по охране труда для учащихся в кабинете химии
1. Общие положения инструкции для учащихся в кабинете химии
Данная инструкция разработана для всех учащихся школы, посещающих уроки химии, проводимые в кабинете химии.
Кабинет химии оборудован:
А)учебными местами учащихся: столы и стулья;
Б) столом учителя;
В) классной доской.
Каждый учащийся проходит вводный инструктаж в начале каждого полугодия и первичный (целевой) согласно инструкции по охране труда для учащихся в кабинете химии, перед каждой практической или лабораторной работой, о чём делается запись с соответствующих журналах регистрации инструктажей по охране труда.
Каждый учащийся соблюдает правила личной гигиены (поддерживает своё рабочее место в чистоте) и требования санитарных норм.
Согласно расписанию уроков, учащиеся приходят в кабинет со звонком на урок и входят в кабинет химии только с разрешения учителя.
Покидают кабинет с разрешения учителя.
Учащиеся не заходят в лабораторию, т.к. там находятся реактивы.
Опасности в работе:
Уколы и порезы рук при небрежном обращении с лабораторной посудой и оборудованием;
Ожоги кислотами, щелочами, термические ожоги при неаккуратном обращении со спиртовкой, горячей водой;
Отравления вредными газами (аммиак, сероводород, оксиды азота и серы).
2. Требования безопасности перед началом работы учащихся в кабинете химии.
2.1 Дежурный учащийся проверяет санитарное состояние кабинета химии перед уроком. Каждый учащийся проверяет санитарное состояние своего рабочего места, проверяет, нет ли посторонних вещей.
2.2 Учащийся изучает содержание и порядок выполнения практической работы, а также безопасные приёмы её выполнения.
2.3 Не загромождают проходы портфелями и сумками.
3. Требования безопасности во время занятий учащихся в кабинете химии:
3.1 Точно выполнять указания учителя химии, без его разрешения не проводить опыты, не вставать с места.
3.2 Осторожно обращаться с лабораторным оборудованием.
3.3Без разрешения учителя не брать приборы и другое оборудование с других рабочих мест.
3.4 Не выносить из кабинета и не вносить в кабинет химии любые приборы и оборудование.
3.5 Немедленно сообщить учителю об обнаружении неисправности прибора.
3.6 Не принимать пищу и напитки в кабинете химии.
3.7 При получении травм и плохом самочувствии сообщить учителю.
3.8 При возникновении в кабинете, во время работы, аварийной ситуации, не допускать паники, и действовать по указанию учителя.
4. Требования безопасности для учащихся по окончании занятий в кабинете химии.
4.1 По окончании урока учащиеся приводят в порядок рабочее место.
4.2 Учащиеся собирают тетради, учебники, письменные принадлежности и с разрешения учителя покидают кабинет химии.
4.3 Дежурный учащийся проверяет санитарное состояние кабинета и передаёт кабинет дежурному другого класса или учителю.
5. Требование безопасности для учащихся в аварийных ситуациях в кабинете химии:
5.1 При возникновении аварийной ситуации срочно сообщить учителю, действовать по указанию учителя
5.2 При получении травмы учащимся, сообщить учителю и при необходимости помочь ему вызвать медицинского работника для оказания первой медицинской помощи пострадавшему.
Приложение № 2
Химическая посуда
Приложение 3
Правила работы со спиртовкой
-
Рассмотрите устройство спиртовки: резервуар, трубка с диском, фитиль, колпачок.
-
Изучите правила работы со спиртовкой:
-
резервуар спиртовки должен быть заполнен спиртом на 2/3 его объёма;
-
фитиль должен быть ровно подрезан, его длина не должна превышать 1,5 см;
-
фитиль должен не плотно прилегать, но и не выпадать из трубки;
-
диск должен плотно прикрывать отверстие резервуара спиртовки.
Перед зажиганием спиртовки следует произвести внешний осмотр и удовлетвориться, что корпус её исправлен, фитиль вытащен на требуемую высоту и достаточно распущен, а горловина и держатель фитиля совершенно сухие, если спиртом смочены держатель фитиля и горловина спиртовки, почти неизбежно произойдёт разрыв паров внутри, следствием чего может быть нарушение целостности корпуса, выброс держателя, растекание спирта и пожар. Поэтому ни в коем случае нельзя зажигать спиртовку с остатками жидкости, а следует держать некоторое время и дать ей обсохнуть.
Пользуясь спиртовкой, помните:
-
в нерабочем состоянии спиртовка всегда должна быть плотно закрыта; пред началом не забудьте приподнять колпачок и диск с фитилем, чтобы избежать высокой вспышки пламени;
-
не зажигайте спиртовку от другой горящей спиртовки;
-
в горящую спиртовку не подливайте спирт;
-
не допускайте сильного нагревания резервуара;
-
не переносите горящую спиртовку, это очень опасно;
-
обращайтесь с прибором очень осторожно, чтобы не уронить, не опрокинуть и не разбить его;
-
не дуйте в горящую спиртовку, гасить её только колпачком: поднесите колпачок сбоку и быстро накройте пламя;
-
если авария произошла, и горящий спирт разлился по столу, прикройте пламя накидкой, залейте водой или пеной.
Практическая работа по химии №2 8 класс.
Тема: Очистка загрязненной поваренной соли.
Цель: очистить поваренную соль, загрязненную речным песком.
Оборудование: Фарфоровая чашка, фильтр, воронка, мерный стакан, тигельные щипцы, спиртовка, стеклянная палочка.
Техника безопасности:
-
Не пробовать соль на вкус;
-
При перемешивании раствора стеклянной палочкой, делать это осторожно, что бы не разбить стакан;
-
Соблюдать особое внимание и осторожность, при работе со спиртовкой, при неисправности, поставить учителя в известность.
Ход работы
-
Растворение загрязнённой поваренной соли.
В химический стакан поместите выданную учителем загрязненную соль и налейте 50–70 мл дистиллированной воды.
Перемешивая содержимое стеклянной палочкой, добейтесь полного растворения соли в воде. Посмотрите рисунок № 1 и растворите выданную соль. Занесите действия и наблюдения в таблицу.
№
Что сделали
Наблюдения
Выводы
1.
Растворили загрязнённую поваренную соль в воде при помешивании.
рисунок № 1
-
Очистка полученного раствора с помощью фильтрования.
Раствор соли от песка можно отделить фильтрованием.
С помощью стеклянной палочки осторожно перелейте содержимое стакана на фильтр.
Прозрачный фильтрат будет стекать в чистый стакан, нерастворимые компоненты исходной смеси останутся на фильтре. Посмотрите рисунок № 2 и выполните задание. Продолжите заполнение таблицы, занесите свои действия и наблюдения в таблицу.
рис. № 2
-
Выпаривание раствора.
Жидкость в стакане – это водный раствор поваренной соли. Выделить из него чистую соль можно выпариванием. Для этого 5–7 мл фильтрата налейте в фарфоровую чашку, закрепите тигельные щипцы, как показано на рис. 3 и осторожно нагревайте на пламени спиртовки, постоянно перемешивая содержимое стеклянной палочкой. Продолжите занесение своих действий и наблюдений в таблицу.
рис. № 3
№
Что сделали
Наблюдения
Выводы
1.
2.
3.
Закройте таблицу, сделайте общий вывод:
Сравните кристаллы соли, полученные после выпаривания раствора, с исходной загрязненной солью. Перечислите, какие приёмы и операции вы использовали для очистки загрязненной соли.
______________________________________________________________________________________________________________________________________________________________________________________________________
Приведите в порядок рабочее место.
Практическая работа по химии № 3 8 класс
Тема: Очистка загрязнённой воды
Цель: овладеть простейшими способами очистки воды от примесей: путем фильтрования, кипячения и перегонки (дистилляции).
Оборудование: Лабораторный штатив с кольцом, два химических стакана, воронка, фарфоровая чашка, готовый фильтр, стеклянная палочка с резиновым наконечником, шпатель, спиртовка, спички, загрязненная речным песком и илом вода.
Техника безопасности:
-
Не пробовать выданные вещества на вкус;
-
Нюхать вещества только веерообразными движениями руки в сторону носа;
-
Осторожно пользоваться стеклянной посудой, чтобы не разбить и не порезаться;
-
Соблюдать осторожность при работе со спиртовкой, при неисправности, поставить в известность учителя.
Ход работы
1.Изучение загрязненной воды.
Рассмотрите выданный вам образец загрязненной воды, какая это смесь (однородная или неоднородная)? Свои действия и наблюдения занесите в таблицу. Визуально определите показатели степени загрязнения воды (прозрачность, мутность, содержание частиц, цвет, запах).
№
Что сделали
Наблюдения
Выводы
1.
Рассмотрели выданный образец воды.
2. Фильтрование образца воды.
1) Определите оборудование для этого этапа, соберите прибор для фильтрования. Приготовьте фильтр для воронки.
2) Проведите фильтрование загрязненной воды, для этого воду по стеклянной палочке наливайте на фильтр. Что остается на фильтре, а что проходит сквозь него? Рассмотрите частицы, оставшиеся на фильтре. Затем налейте в пробирку отфильтрованной воды. Рисунок № 1. Отметьте ее внешние показатели (прозрачность, цвет, запах), свои действия и наблюдения запишите в таблицу. Составьте выводы о степени очистки воды на данном этапе.
рис. 1
3. Смягчение воды путем кипячения.
Затем, взятую в пробирке, пробу воды переливаем в фарфоровую чашку и кипятите над пламенем спиртовки, оставьте для охлаждения в штативе рис. №2. Путём наблюдения, определите, есть ли легкое помутнение или выпадение незначительного осадка. Что происходит при кипячении воды? Если наблюдается легкое помутнение и выпадение осадка, то какой вывод вы сделаете? Наблюдения и выводы запишите в таблицу.
рис. №2
4. Получение дистиллированной воды.
1. Определите оборудование для этого этапа, соберите простейший прибор для перегонки воды.
2. В пробирку налейте очищенную фильтрованием воду и выпаривайте до тех пор, пока в приемнике не соберется около 2 мл воды.
3. Сравните дистиллированную воду с фильтратом и прокипяченной пробой воды. Свои действия и наблюдения занесите в таблицу.
№
Что сделали
Наблюдения
Выводы
1.
2.
3.
4.
Опишите полученные образцы воды и составьте выводы по проведенным опытам и сделайте общий вывод.
Вывод: ___________________________________________________________
____________________________________________________________________________________________________________________________________
Приведите в порядок рабочее место.
Практическая работа по химии № 4 8 класс
Тема: Приготовление раствора сахара с заданной массовой долей растворённого вещества
Цель: Научиться готовить растворы с определенной массовой долей растворенного вещества, используя следующие операции: взвешивание, отмеривание определенного объема жидкости, растворение; производить необходимые расчеты; знать расчетную формулу для определения массовой доли растворенного вещества, правила пользования химической посудой и реактивами.
Оборудование и реактивы: весы с разновесами, мерный цилиндр, химический стакан (100 мл), стеклянная палочка, вода, сахар (1 чайная ложка).
Техника безопасности:
-
Соблюдать осторожность при работе со стеклянной посудой;
-
Не пробовать выданные вещества на вкус;
-
Работу проводить только над столом.
Ход работы
-
Рассчитайте, какую массу сахара и какой объём воды надо взять для приготовления 50г 5% раствора сахара.
Порядок выполнения:
-
Рассчитайте массовую долю сахара в растворе, используя известные вам формулы:
W(сахар)= m(сахара)/ m(раствора)
Но прежде чем найти массовую долю сахара в растворе, вы рассчитайте массу сахара и массу воды. Плотность воды примите равной 1г/мл.
m(раствора)=m(сахара)+m(воды)
m(воды)=V(воды)*р (воды)
Необходимые данные для расчётов вы рассчитали: объём воды, масса сахара.
-
Рассчитанную массу сахара взвесьте на лабораторных весах. Рис. 1
-
Технохимические весы:
1 – стойка; 2 – стремена; 3 – коромысло;
4 – чашка; 5 – стрелка; 6 – ручка арретира
Рис.№ 1
Для этого взвешиваемое вещество кладите на левую чашку весов, разновесы на правую. (Для левшей – на правую чашку кладут вещество, на левую – разновесы.). Разновесы брать только пинцетом и при снятии с весов класть сразу в те гнезда футляра, из которых они были взяты. После взвешивания чашка весов должна оставаться чистой.
3)Поместите сахар в стакан. Отмерьте мерным цилиндром рассчитанный объем жидкости и вылейте в стакан с сахаром рис. 2. Перемешайте стеклянной палочкой смесь до полного растворения вещества. Раствор готов!
рис.2
4)Напишите вывод о приготовлении раствора, опишите последовательность ваших действий. Сделайте рисунок сосуда, в котором вы приготовили раствор, какую вы взяли массу сахара и массу воды?
5)Склянку с раствором сдайте учителю или лаборанту.
-
Рассчитайте, сколько молекул сахара, содержится в растворе, используя известные вам формулы:
N=Na *Ѵ
Ѵ=m/M
Поскольку сахар на 99,9% состоит из сахарозы, формула которой C12H22O11, вы легко рассчитаете молярную массу сахарозы и затем найдете число молекул сахара в приготовленном вами растворе.
Приведите в порядок рабочее место.
Задача. Определите массу воды, которую нужно добавить к 50 г раствора с массовой долей соли 5%, чтобы получить раствор с массовой долей соли 2%.
Практическая работа по химии № 5 8 класс
Тема: Генетическая связь классов неорганических веществ.
Цель: закрепить знания и умения учащихся о генетической связи классов неорганических веществ.
Оборудование: раствор соляной кислоты, серной кислоты, гидроксид натрия, лакмус, оксид кальция, оксид магния, магний, пробирки.
Техника безопасности:
-
Соблюдать осторожность при работе со стеклянной посудой;
-
Не пробовать выданные вещества на вкус;
-
Работу проводить только над столом.
Ход работы
Задача 1. В двух пробирках даны раствор соляной кислоты и гидроксид натрия. С помощью какого реактива можно определить в какой пробирке кислота, а в какой щёлочь? Запишите проделанные реакции в тетрадь.
Задача 2. Используя выданные реактивы, осуществите практически последовательное превращение веществ:
а) оксид кальция →гидроксид кальция→ соль;
Напишите уравнения реакций, дайте названия солей.
Задача 3. Получите с помощью реакции нейтрализации сульфат кальция.
Задача 4. Даны: магний, оксид магния, серная кислота. Используя их, получите сульфат магния двумя способами. Запишите выполненные превращения в виде уравнений реакций.
Приведите в порядок рабочее место.
Домашнее задание: Сколько граммов гидроксида кальция можно получить из оксида кальция массой 5,6г?
infourok.ru
Практические работы по химии 8 класс
Практическая работа №2
Наблюдение за горящей свечой
Цель работы: анализ физических и химических процессов, происходящих при горении свечи и определение скорости расходования кислорода во время горения.
Оборудование: банки объемом 0,5л, 0,8л, 1л, 2л, секундомер, свеча, спички, рулетка,
Ход работы:
1. Вспомните правила поведения и техники безопасности при работе с веществами и оборудованием.
2. Внимательно слушай указания учителя.
1. Явления, происходящие при горении свечи.
Опыт №1. Физические явления при горении свечи.
Зажгите свечу. Вы увидите, как начинает таять парафин около фитиля, образуя круглую лужицу. Какой процесс здесь имеет место?
Опыт №2. Обнаружение продуктов горения в пламени.
А) Обнаружение углерода Закрепите предметное стекло в держателе и внесите в темную зону пламени, подержите 3 – 5 с. Объясните что там появилось.
Б) Обнаружение водорода Зафиксируйте перевернутую вверх дном сухую пробирку и подержите над пламенем свечи до запотевания, объясните наблюдаемое явление.
Запишите в виде таблицы, какие физические и химические процессы происходят при горении свечи.
Явления, происходящие при горении свечи
|
Физические явления |
Химические явления |
2. Изучение скорости горения свечи
1. Подготовить таблицу для записи данных опыта.
Результаты изучения скорости горения свечи
| V (банки) , л |
Время (t) , с |
2. Зажечь свечу и накрыть банкой объемом 0,5л.
3. Определить время (t), в течение которого горит свеча.
4. Провести подобные действия, используя банки других объемов.
5. Выразить зависимость продолжительности горения свечи от объема банки в виде графика (построение произвести на миллиметровой бумаге или компьютере).
6. Определить объем классной комнаты.
7. Рассчитать, сколько времени будет гореть свеча, если в комнату не поступает воздух и весь кислород расходуется на горение свечи. Скорость расходования кислорода определить по графику из пункта 5.
8. Вывод: (Сделайте общий вывод по проделанной работе, исходя из цели урока)
Практическая работа №3.
«Анализ качества питьевой воды»
Цель: научиться простым способам определения качества питьевой воды.
Оборудование: образцы воды: водопроводная вода (из разных скважин), химические стаканы, кольцо из проволоки, индикаторная бумага, цилиндр, белый лист бумаги.
Ход работы:
1. Вспомните правила поведения и техники безопасности при работе с веществами и оборудованием.
2. Внимательно слушай указания учителя.
Задание1. Исследование органолептических показателей воды.
Налейте в стаканы воду из различных источников и проведите
органолептические исследования на окраску, прозрачность, запах:
Цвет (окраска). Для определения цветности воды возьмите стеклянный сосуд и лист белой бумаги. В сосуд наберите воду и на белом фоне бумаги определите цвет воды (голубой, зеленый, желтый, серый, коричневый) – показатель определенного вида загрязнения.
Прозрачность зависит от количества взвешенных частиц органического и неорганического происхождения. Для определения прозрачности воды используйте прозрачный мерный цилиндр с плоским дном, в который наливаем воду, подкладываем под цилиндр на расстоянии 4 см от его дна шрифт, высота букв которого 2 мм, а толщина линий букв – 0.5мм, и сливаем воду до тех пор, пока сверху через слой воды не будет виден этот шрифт. Измерим высоту столба воды в цилиндре линейкой и выразим степень прозрачности в см. При прозрачности воды менее 3 см водопотребление ограничивается. Уменьшение прозрачности природных вод свидетельствует об их загрязненности.
Запах зависит от биологических и химических загрязнителей. его оценивают по шкале
Оценка запаха воды
|
Интенсивность запаха |
Описательное определение |
Балл |
|
Нет |
Отсутствие ощутимого запаха |
0 |
|
Очень слабый |
Запах ощущается опытным наблюдателем, не ощущается потребителем |
1 |
|
Слабый |
Обнаруживается, если обратить внимание |
2 |
|
Заметный |
Ощущается легко |
3 |
|
Отчетливый |
Запах обращает на себя внимание, делает воду неприятной для питья |
4 |
|
Очень сильный |
Настолько сильный, что вода совершенно непригодна для питья |
5 |
Характер и род запаха воды естественного происхождения
|
Характер запаха |
Примерочный род запаха |
|
Ароматический |
Огуречный, цветочный |
|
Болотный |
Илистый, тинистый |
|
Гнилостный |
Фекальный, сточной воды |
|
Древесный |
Мокрой щепы, древесной коры |
|
Землистый |
Прелый, свежевспаханой земли |
|
Плесневый |
Затхлый, застойный |
|
Сероводородный |
Тухлых яйц |
|
Травянистый |
Скошенной травы |
|
Неопределенный |
Не подходящий под предыдущие определения |
По результатам исследования заполните таблицу:
|
№ пробы |
Природа исследуемого вещества |
Цвет |
Прозрачность |
Запах |
|
1. |
Вода из колодца |
|||
|
2. |
Водопроводная вода (с. Большая Арать) |
|||
|
3. |
Водопроводная вода (с. Сыченки) |
Задание 2. Водородный показатель воды (pH)
Питьевая вода должна иметь нейтральную реакцию (pH около 7). Значение pH воды водоемов хозяйственного, питьевого, культурно-бытового назначения регламентируется в пределах 6,5-8,5.
Определить значение рН можно с помощью универсальной индикаторной бумаги, сравнивая ее окраску со шкалой.
|
№ пробирки |
Природа исследуемого вещества |
Окраска индикатора |
рН среда |
Задание 3. Сравнение жесткости различных образцов воды
В жесткой воде мыло образует хлопья (нерастворимые соединения кальция).
Повышенная концентрация солей в воде ухудшает вкус питьевой воды.
Для хозяйственно-бытовых нужд требуется мягкая вода или вода с очень незначительной жесткостью, т.к. при кипячении жесткой воды образуется накипь. При стирке тканей в жесткой воде образуются нерастворимые соединения (стеараты кальция), которые осаждаются на поверхности тканей и постепенно разрушают волокна. В жесткой воде плохо развариваются продукты. Употребление жесткой воды увеличивает опасность мочекаменной болезни, неблагоприятно влияет на состояние сосудов, приводит к отложению солей.
В три пробирки наливают воду из различных источников по 10-15 мл:
В каждую пробирку бросают кусочек мыла и сильно встряхивают пробирку (около 5 минут). Дают, отстоятся и описывают внешний вид полученных растворов: есть ли осадок в виде хлопьев, много осадка или мало, раствор почти прозрачный и т. д. результаты заносят в таблицу.
|
Образец воды |
Характеристика полученного раствора |
Вывод: (Сделайте общий вывод по проделанной работе, исходя из цели урока)
Практическая работа № 4.
Приготовление растворов с заданной массовой долей растворенного вещества.
Цель работы: научиться готовить растворы с определенной массовой долей растворенного вещества, производить теоретические расчеты, которые можно применить на практике.
Оборудование: весы, мерный цилиндр, ложечка, химический стакан, стеклянная палочка, вода, соли (карбонат натрия, сульфат меди 2, хлорид бария)
1. Вспомните правила поведения и техники безопасности при работе с веществами и оборудованием.
2. Внимательно слушай указания учителя.
Ход работы:
1. этап работы: Расчетная часть.
1. Получив задание от учителя, произведи расчет для выполнения практической работы.
1 вариант. Для проведения лабораторных и практических работ приготовьте 30 г раствора медного купороса (сульфат меди 2) с массовой долей соли 3%.
2 вариант. Для школьной аптечки приготовьте 100 г 2%-го водного раствора питьевой соды (гидрокарбонат натрия), который используют для обработки кожи после ожога кислотой.
3 вариант. Для школьной аптечки приготовьте 100 г 2%-го водного раствора борной кислоты для обработки глаз и кожи после попадания щелочи.
4 вариант. Для проведения лабораторных и практических работ приготовьте 25 г раствора хлорида бария с массовой долей соли 2%.
2. этап работы: Взвешивание навески вещества.
1. На весах взвесьте требуемую навеску вещества, и высыпьте ее в стаканчик.
3. этап работы: Измерение объема воды.
1. Мерным цилиндром отмерьте рассчитанный объем воды и вылейте ее в стакан с сахаром.
4. этап работы: Приготовление раствора с заданной массовой долей вещества.
1. Перемешайте стеклянной палочкой вещество с водой до полного его растворения.
5. Приготовьте этикетку с указанием формулы вещества, его массовой доли и кто приготовил.
Вывод: (Сделайте общий вывод по проделанной работе, исходя из цели урока)
Литература:
-Габриелян О.С. химия. 8 класс.-М.: Дрофа, 2008
-Исаев Д.С. Практические работы исследовательского характера по неорганической химии: Учебное пособие для учащихся 8-х классов. Тверь: Твер. гос. ун-т, 2001.- 56 с.: ил.
kopilkaurokov.ru
Опыты и эксперименты по химии (8 класс) на тему: Практические работы по химии, 8 класс
8 класс
Практическая работа №1
«Правила техники безопасности при работе в химическом кабинете. Приемы обращения с лабораторным оборудованием и нагревательными приборами»
Цель работы: ознакомиться с правилами техники безопасности при работе в кабинете химии, лабораторным оборудованием и приемами обращения с ним.
Оборудование: Лабораторный штатив с кольцом и лапкой, спиртовка, пробиркодержатель, колбы, стаканы, воронка, фарфоровая посуда, спички.
Примечание:
Правила по технике безопасности изучи, используя стр.105.
2. Внимательно слушай указания учителя.
Алгоритм проведения работы:
1. этап работы: Изучение техники безопасности при работе в кабинете химии.
2. этап работы: Строение и обращение с лабораторным штативом.
Изучи строение лабораторного штатива, используя стр.106.
Собери штатив для работы и разбери.
Зарисуй строение штатива, отметь его назначение в тетради.
3. этап работы: Строение спиртовки, приемы работы с ней.
1. Изучи строение спиртовки, используя стр. 107.
2. Изучите приемы обращения со спиртовкой, используя инструкцию, выданную учителем.
3. Изучи строение пламени спиртовки, выясни, в какой зоне пламени следует производить нагревание и почему.
4. Нагрейте в пробирке воду, соблюдая приемы работы со спиртовкой.
5. В тетради зарисуйте спиртовку и укажите ее части, отметь назначение спиртовки и правила нагревания.
4. этап работы: Знакомство и обращение с лабораторным оборудованием и посудой.
Внимательно следи за рассказом учителя, в тетради сделай вывод о том, как следует обращаться с оборудованием и посудой.
Заключение:
Обратите внимание на оформление таблицы в тетради, записи рисунки делай аккуратно.
Практическая работа №2
«Очистка загрязненной поваренной соли»
Цель работы: овладеть способами очистки веществ от примесей: путем фильтрования и выпаривания.
Оборудование: Лабораторный штатив с кольцом, два химических стакана, воронка, фарфоровая чашка, готовый фильтр, стеклянная палочка с резиновым наконечником, шпатель, спиртовка, спички, загрязненная речным песком поваренная соль.
Примечание:
1. Вспомните правила поведения и техники безопасности, процессы растворения, фильтрования, нагревания, выпаривания.
2. Внимательно слушай указания учителя.
Алгоритм проведения работы:
1. этап работы: Изучение загрязненной поваренной соли.
1. Рассмотрите загрязненную соль, какая это смесь. (однородная или неоднородная).
2. этап работы: Растворение загрязненной поваренной соли.
1. Возьмите в стакан треть воды и шпателем добавьте загрязненную соль, перемешайте, пока соль перестанет растворяться.
3. этап работы: Фильтрование раствора загрязненной соли.
1. Определите оборудование для этого этапа, соберите прибор для фильтрования.
2. Приготовьте фильтр для воронки.
3. Проведите фильтрование загрязненной соли, для этого раствор по стеклянной палочке наливайте
на фильтр, что остается на фильтре, а что проходит сквозь его.
4. . этап работы: Выпаривание очищенного раствора соли.
1. Осуществите выпаривание, для этого определите оборудование для этого этапа, соберите прибор.
3. В фарфоровую чашку налейте очищенного раствора соли и выпарьте его.
3. Сравните полученную соль с той, которая вам была выдана.
Заключение:
1.Обратите внимание на оформление таблицы в тетради, записи рисунки делай аккуратно.
2. Сделайте правильные рисунки и выводы по работе.
Практическая работа №3
«Приготовление раствора сахара, с определенной массовой долей».
Цель работы: научиться готовить растворы с определенной массовой долей растворенного вещества, производить теоретические расчеты, которые можно применить на практике.
Оборудование: весы, мерный цилиндр, ложечка, химический стакан, стеклянная палочка, вода, сахар.
Примечание:
1. Вспомните правила поведения и техники безопасности, процессы растворения, формулы для расчета.
2. Внимательно слушай указания учителя.
Алгоритм проведения работы:
1. этап работы: Расчетная часть.
1. Получив задание от учителя, произведи расчет для выполнения практической работы.
2. этап работы: Взвешивание навески сахара.
1. На весах взвесьте требуемую навеску сахара, и высыпьте ее в стаканчик.
3. этап работы: Измерение объема воды.
1. Мерным цилиндром отмерьте рассчитанный объем воды и вылейте ее в стакан с сахаром.
4. . этап работы: Приготовление раствора сахара с заданной массовой долей сахара.
1. Перемешайте стеклянной палочкой сахар с водой до полного его растворения.
Заключение:
1.Обратите внимание на оформление таблицы в тетради, расчеты, рисунки делай аккуратно.
2. Сделайте правильные выводы по работе.
3. Уберите свое рабочее место.
Практическая работа №4
«Наблюдения за изменениями, происходящие с горящей свечой, и их описание».
Цель работы: изучить явления, происходящие при горении свечи.
Оборудование: свеча, спички, изогнутая стеклянная трубка, предметное стекло, держатель, пробирка, стеклянная трубка с оттянутым концом в резиновой груше, два химических стакана разной емкости.
Примечание: 1. Вспомните правила поведения и техники безопасности, явления физические и химические их отличие, внимательно слушай указания учителя.
Алгоритм проведения работы:
1. этап работы: Исследование формы пламени.
1. Зажгите свечу и определите форму пламени, вспомните какие зоны имеет пламя, почему свечу используют как источник света?
2. этап работы: Явления, происходящие при горении свечи.
1. Изучите ход выполнения этапа, использую стр.110.
2. Осуществите этап на практике.
3. Какое явление происходит при таянии парафина свечи?
3. этап работы: Обнаружение продуктов горения в пламени.
А) Обнаружение углерода
1. Закрепите предметное стекло в держателе и внесите в темную зону пламени, объясните что там появилось.
Б) Обнаружение водорода
1. Зафиксируйте перевернутую вверх дном сухую пробирку и подержите над пламенем свечи до запотевания, объясните наблюдаемое явление.
4. этап работы: Влияние воздуха на горение свечи.
1. Изучите ход выполнения этапа, используя стр. 111.
2. Осуществите этап на практике.
3. Объясните, как влияет воздух на горение свечи?
Заключение:
1.Обратите внимание на оформление таблицы в тетради, выводы рисунки делай аккуратно, убери рабочее место после себя.
Практическая работа №5
«Признаки химических реакций».
Цель работы: Закрепить знания о признаках химических реакций; продолжить развивать умения: работы с веществами и химическим оборудованием, наблюдать и описывать проведенные реакции.
Оборудование: Спиртовка, пробирки в штативе, щипцы, медная проволока, соляная кислота, мрамор, серная кислота,, сульфат натрия, хлорид бария, оксид меди (2), ложечка, фенолфталеин.
Примечание:
1. Вспомните правила поведения и техники безопасности, признаки химических реакций.
2. Реактивы используем согласно требованиям и экономно.
Алгоритм проведения работы:
1. этап работы: Прокаливание медной проволоки в пламени спиртовки.
1. В щипцы возьмите медную проволоку и внесите в пламя спиртовки, нагрейте, обратите внимание на изменения, которые произошли с проволокой.
2. этап работы: Взаимодействие оксида меди (2) с серной кислотой.
2. Возьмите ложечкой оксид меди (2) , поместите его в пробирку, добавьте серную кислоту и нагрейте. Что происходит?
3. этап работы: Взаимодействие мрамора с соляной кислотой.
1. Поместите в пробирку кусочек мрамора и добавьте соляную кислоту, что происходит?
4. этап работы: Взаимодействие гидроксида натрия и соляной кислотой.
1. Поместите в пробирку раствор гидроксида натрия и по каплям добавьте фенолфталеин, что произошло, затем добавьте раствор соляной кислоты, что происходит?
5. . этап работы: Взаимодействие сульфата натрия с хлоридом бария.
1. Поместите в пробирку 2мл раствора сульфата натрия и добавьте несколько капель хлорида бария, что происходит?
Заключение:
1. Какие признаки химических реакций вы наблюдали во всех этапах работы.
2. Сделайте правильные уравнения реакции, определив их тип и выводы по работе.
Практическая работа №6
«Получение водорода и изучение его свойств».
Цель работы: Получить, собрать и доказать наличие водорода, изучить некоторые его физические и химические свойства, развивать умения и навыки работы с химическим оборудованием.
Оборудование: пробирки в штативе, пробка с газоотводной трубкой, спички, гранулы цинка, соляная кислота.
Примечание:
1. Вспомните правила поведения и техники безопасности.
2. Следуй указаниям учителя.
Алгоритм проведения работы:
1. этап работы: Получение, собирание и распознавание водорода.
1. В пробирку поместите гранулы цинка, добавьте раствор соляной кислоты, закройте пробирку пробкой с газоотводной трубкой, на конец газоотводной трубки поместите пробирку — приемник, взяв ее отверстием вниз. Что происходит в пробирке со смесью цинка и кислоты?
2. Определите, какой способ вы использовали для собирания водорода, почему?
3. Пробирку – приемник закройте пробкой, предварительно собрав в неё водород, распознайте его, для этого внесите в пробирку горящую спичку, что происходит? Как распознать наличие чистого водорода и водорода с примесями?
2. этап работы: Изучение физических свойств водорода.
1. Охарактеризуйте свойства водорода, цвет, запах, состояние, отношение к воде.
3. этап работы: Изучение химических свойств водорода.
1. Поднесите к концу газоотводной трубки горящую спичку, что происходит?
Заключение:
1. Какие типы химических реакций вы наблюдали в 1 и 3 этапах работы.
2. Обратите внимание на оформление таблицы в тетради.
3. Сделайте правильные уравнения реакции, определив их тип и выводы по работе.
Практическая работа №7
«Получение кислорода и изучение его свойств».
Цель работы: Получить, собрать и доказать наличие кислорода, изучить некоторые его физические и химические свойства, развивать умения и навыки работы с химическим оборудованием.
Оборудование: Штатив с лапкой, пробирка с газоотводной трубкой, пробирки, стеклянная палочка, вата, спиртовка, пинцет, перманганат калия, древесный уголь, лучинка.
Примечание: 1. Вспомните правила поведения и техники безопасности, Следуй указаниям учителя.
Алгоритм проведения работы:
1. этап работы: Получение, собирание и распознавание кислорода.
1. Соберите прибор для получения кислорода; для этого в пробирку поместите ¼ объема перманганата калия, вставьте ее в лапку штатива, отверстие пробирки закройте пробкой с газоотводной трубкой.
2. Конец газоотводной трубки поместите в пробирку – приемник, взяв ее отверстием вверх.
3. Определите, какой способ вы использовали для собирания кислорода, почему?
2. этап работы: Обнаружение кислорода.
1.Пробирку – приемник закройте пробкой, предварительно собрав в неё кислород, распознайте его, для этого внесите в пробирку тлеющую лучинку, что происходит? Как распознать наличие кислорода?
3. этап работы: Изучение физических свойств кислорода.
1. Охарактеризуйте свойства кислорода, цвет, запах, состояние, отношение к воде.
4. этап работы: Изучение химических свойств кислорода.
1. Внесите в пробирку с кислородом тлеющий уголек, что происходит с угольком? Почему?
Заключение:
1. Какие типы химических реакций вы наблюдали в 1 и 4 этапах работы.
2. Обратите внимание на оформление таблицы в тетради.
3. Сделайте правильные уравнения реакции, определив их тип и выводы по работе.
4. Уберите свое рабочее место.
Практическая работа №8
«Ионные реакции»
Цель работы: Провести качественные реакции на ионы, научиться определять анионы и катионы, познакомиться с характером проведения реакций ионного обмена.
Оборудование: Штатив с пробирками, стеклянная палочка, синий лакмус, серная кислота, хлорид бария, хлорид натрия, нитрат серебра, карбонат натрия, соляная кислота, сульфат меди (2), гидроксид натрия.
Примечание: 1. Вспомните и соблюдайте правила поведения и техники безопасности.
Алгоритм проведения работы:
1. этап работы: Обнаружение в растворе катионов водорода (H+) и сульфат анионов (SO4 2-).
1. Налейте в первую пробирку 1мл раствора серной кислоты и добавьте синий лакмус, во вторую пробирку 1мл серной кислоты и добавьте раствор хлорида бария, что происходит, объясните наблюдаемое.
2. Составьте уравнение диссоциации кислоты и реакции ионного обмена между взятыми растворами веществ, что служит реактивом на катион H+ и анион SO4 2-?
2. этап работы: Обнаружение хлорид ( Cl -) аниона в растворе.
1. Налейте в пробирку 1мл раствора хлорида натрия и добавьте нитрат серебра, что происходит, объясните наблюдаемое.
3. Составьте уравнение реакции ионного обмена между взятыми растворами веществ, что служит реактивом на анион Cl -?
3. этап работы: Обнаружение карбонат (СО3 2-) аниона в растворе.
1. Налейте в пробирку 1мл раствора карбоната натрия и добавьте раствор соляной кислоты, что происходит, объясните наблюдаемое.
2. Составьте уравнение реакции ионного обмена между взятыми растворами веществ, что служит реактивом анион СО3 2-?
4. этап работы: Поделайте реакции, подтверждающие качественный состав CuSO4 .
1. Налейте в первую пробирку раствор сульфата меди (2) и добавьте раствор гидроксида натрия, во вторую пробирку раствор сульфат меди (2) и добавьте раствор хлорид бария, что происходит, объясните наблюдаемое?
2.Составьте уравнения реакции ионного обмена между взятыми растворами веществ, что служит реактивом на катион Cu2+ и анион SO4 2-?
Заключение: 1. Сделайте правильные уравнения реакции, выводы по работе, уберите свое рабочее место.
Практическая работа №9
«Условия течения химических реакций между растворами электролитов до конца»
Цель работы: Подтвердить и закрепить знания об условиях, при которых химические реакции между растворами электролитов идут до конца, формировать умение подбирать пары электролитов.
Оборудование: Штатив с пробирками, спиртовка, держатель, спички, предметное стекло, CuSO4, KCl, NaOH, Na2SO4 , Na2CO3, HCl, HNO3 , фенолфталеин.
Примечание: 1. Вспомните и соблюдайте правила поведения и техники безопасности.
Алгоритм проведения работы:
Проведение реакций между растворами электролитов:
А) .Сульфатом меди (2) и гидроксидом натрия.
1. Налейте в пробирку 1мл раствора сульфата меди (2) и добавьте по каплям гидроксид натрия.
Б) .Хлоридом калия и гидроксидом натрия.
1. Налейте в пробирку 1мл раствора хлорида калия и добавьте по каплям гидроксид натрия.
В) .Сульфатом натрия и соляной кислотой.
1. Налейте в пробирку 1мл раствора сульфатом натрия и добавьте по каплям соляной кислоты.
Г) .Карбонатом натрия и соляной кислотой.
1. Налейте в пробирку 1мл раствора карбоната натрия и добавьте по каплям соляной кислоты.
Д) .Гидроксидом натрия и соляной кислотой.
1. Налейте в пробирку 1мл раствора гидроксида натрия прилейте фенолфталеин и добавьте по каплям соляной кислоты.
Е) .Сульфатом натрия и азотной кислотой.
1. Налейте в пробирку 1мл раствора сульфата натрия и добавьте по каплям азотной кислоты.
Заключение: 1. Что происходит в каждом этапе, объясните наблюдаемое, сделайте правильные уравнения реакции, выводы по работе, уберите рабочее место.
Практическая работа № 10
«Свойства кислот, оснований, оксидов, солей». Вариант 1
Цель работы: Провести химические реакции, характеризующие свойства кислот, оснований, оксидов, солей, Формировать умение грамотно оформлять эксперимент, писать уравнения реакции в свете ТЭД.
Оборудование: Штатив с пробирками, стеклянная палочка, Н2SO4 , Mg, CaO, BaCl2, CuSO4
NaOH, FeCl3, синий лакмус, спиртовка, держатель.
Примечание: 1. Вспомните и соблюдайте правила поведения и техники безопасности, реактивы используйте экономно, эксперимент проводите согласно инструкции.
Алгоритм проведения работы:
1. этап: Осуществите реакции, характеризующие свойства Н2SO4 , имея Mg, CaO, KOH, BaCl2 .
1. Налейте в пробирку 1мл серной кислоты и поочередно добавьте предложенные вещества (не забудьте опыт проводите в одной пробирке, промывайте), что происходит, объясните наблюдаемое.
2. Составьте уравнение диссоциации кислоты и реакции ионного обмена между взятыми веществами.
2. этап: Получите Cu (OH)2, проделайте реакции, характеризующие его свойства.
1. Налейте в пробирку 1мл раствора сульфата меди (2) и добавьте по каплям раствор гидроксид натрия, что происходит?
2. Полученный осадок голубого цвета разделите на две пробирки, в одну добавьте серную кислоту, другую нагрейте, что происходит, объясните наблюдаемое.
3. Составьте уравнение реакции ионного обмена между взятыми веществами.
3. этап работы: Проделайте реакции, характеризующие свойства FeCl3 и CuSO4 .
1. Налейте в пробирку раствор хлорида железа (3) и добавьте по каплям раствор гидроксида натрия, что происходит?
2. Налейте в пробирку раствор сульфат меди(2) и отпустите железную скрепку, что происходит?
3. Составьте уравнение реакции ионного обмена между взятыми веществами.
Заключение: Сделайте правильные уравнения реакции, выводы по работе, уберите свое рабочее место.
Практическая работа № 10
«Свойства кислот, оснований, оксидов, солей». Вариант 2
Цель работы: Провести химические реакции, характеризующие свойства кислот, оснований, оксидов, солей, Формировать умение грамотно оформлять эксперимент, писать уравнения реакции в свете ТЭД.
Оборудование: Штатив с пробирками, стеклянная палочка, HCl, Mg, CaO, AgNO3, CuSO4
NaOH, FeCl3, синий лакмус, спиртовка, держатель.
Примечание: 1. Вспомните и соблюдайте правила поведения и техники безопасности, реактивы используйте экономно, эксперимент проводите согласно инструкции.
Алгоритм проведения работы:
1. этап: Осуществите реакции, характеризующие свойства HCl, имея Mg, CaO, KOH, AgNO3
1. Налейте в пробирку 1мл соляной кислоты и поочередно добавьте предложенные вещества (не забудьте опыт проводите в одной пробирке, промывайте), что происходит, объясните наблюдаемое.
2. Составьте уравнение диссоциации кислоты и реакции ионного обмена между взятыми веществами.
2. этап: Получите Fe (OH)3, проделайте реакции, характеризующие его свойства.
1. Налейте в пробирку 1мл раствора хлорид железа (3) и добавьте по каплям раствор гидроксид натрия, что происходит?
2. Полученный осадок бурого цвета разделите на две пробирки, в одну добавьте соляную кислоту, другую нагрейте, что происходит, объясните наблюдаемое.
3. Составьте уравнение реакции ионного обмена между взятыми веществами.
3. этап работы: Проделайте реакции, характеризующие свойства CuSO4 .
1. Налейте в пробирку раствор сульфат меди (2) и добавьте по каплям раствор гидроксида натрия, что происходит?
2. Налейте в пробирку раствор сульфат меди(2) и отпустите железную скрепку, что происходит?
3. Составьте уравнение реакции ионного обмена между взятыми веществами.
Заключение: Сделайте правильные уравнения реакции, выводы по работе, уберите свое рабочее место.
Практическая работа № 11
«Решение экспериментальных задач». Вариант 1
Цель работы: Формировать умение решать экспериментальные задачи по теме: «Классы неорганических соединений», формировать умение грамотно оформлять эксперимент, писать уравнения реакции в свете ТЭД.
Оборудование: Штатив с пробирками, стеклянная палочка, MgCl2, Н2SO4, AgNO3, CuO,
NaOH, FeCl3, спиртовка, держатель.
Примечание: 1. Вспомните и соблюдайте правила поведения и техники безопасности, реактивы используйте экономно 2. Не забудьте: сначала выполняется теоретическая часть задачи, затем практическая часть.
Алгоритм проведения работы:
1. этап: Проведение химических реакций между следующими парами веществ:
А) хлорид магния и гидроксид натрия
1. Налейте в пробирку 1мл хлорида магния и добавьте гидроксид натрия, что происходит, объясните наблюдаемое.
2. Составьте уравнение диссоциации кислоты и реакции ионного обмена между взятыми веществами.
Б) хлорид магния и серная кислота
1. Налейте в пробирку 1мл хлорида магния и добавьте серной кислоты, что происходит, объясните наблюдаемое.
2. Составьте уравнение диссоциации кислоты и реакции ионного обмена между взятыми веществами.
nsportal.ru
Методическая разработка по химии (8 класс) на тему: Практические работы по химии 8 класс
Практическая работа № 1
Правила поведения в кабинете химии, приемы безопасной работы с оборудованием и веществами. Строение пламени
Цель:
Изучить приемы обращения с простейшим лабораторным оборудованием: лабораторным штативом, спиртовкой, пробирками, колбами и т. д. Изучить строение пламени. Изучить правила техники безопасности, которые требуется соблюдать при работе в школьном химическом кабинете.
Оборудование: спиртовка, лабораторный штатив, спички, пробирки, стаканчик с водой, баночка для отработанных реактивов, посуда химическая ( разная)
ход работы
- Правила по технике безопасности при работе в кабинете химии. ( работа с текстом учебника с. 9-10)
- Приемы обращения с лабораторным штативом. Зарисовать лабораторный штатив, подписать основные части, сделать вывод.
- Приемы обращения со спиртовкой. 9 сделать рисунок, сформулировать вывод)
- Изучение строения пламени. ( сделать рисунок, определить основные части пламени, сделать вывод.
- Сделать общий вывод
Практическая работа 2
Очистка загрязненной поваренной соли.
Цель:
Научиться простейшим способам очистки веществ: фильтрованию и выпариванию. Научить выполнять практическую работу по инструкции и оформлять отчет о химическом эксперименте.
Оборудование и реактивы: пробирки, чаша для выпаривания растворов, спиртовка, спички, фильтровальная бумага, стакан с водой, загрязненная поваренная соль
Ход работы
- Инструктаж по ТБ при проведении практической работы.
- Растворение загрязненной поваренной соли.
- Очистка полученного раствора при помощи фильрования.
- Выпаривание раствора.
Учащиеся должны ответить на следующие вопросы:
1. Какими физическими свойствами (агрегатное состояние при обычных условиях, запах, цвет, растворимость в воде) обладают поваренная соль и речной песок?
2. Как разделить компоненты смеси, используя различия в их физических свойствах? Составьте план действий.
3. Какое оборудование вам потребуется для очистки поваренной соли?
Затем учащиеся приступают к выполнению практической работы (с. 52 учебника).
Отчет о работе учащиеся оформляют в тетрадях для практических занятий в виде таблицы.
|
Что сделали |
Что наблюдали |
Выводы |
|
|
|
|
Сформулировать общий вывод.
Практическая работа № 3
Получение и свойства кислорода
Цель: закрепить полученные знания о свойствах кислорода; продолжить формирование умений написания химических уравнений; повторить правила ТБ при проведении практических работ
Оборудование: штатив лабораторный, пробирки, газоотводные трубки, колбы, горелка, спички
Реактивы: перманганат калия, сера, уголь.
Ход работы:
- Правила ТБ
- Получение и собирание кислорода
- Горение угля и серы в кислороде
- Отчет о работе
|
Что делали |
Что наблюдали |
Выводы |
Практическая работа № 5
Приготовление растворов с определенной массовой долей растворенного вещества
Цель: закрепить полученные знания о массовой доле растворенного вещества, отработать навыки приготовления растворов с заданной концентрацией.
Оборудование урока: учебник, химическая посуда, весы лабораторные
Реактивы: вода, хлорид натрия, сульфат меди, карбонат кальция
Ход работы:
- Инструктаж по ТБ при проведении практической работы
- Произведение расчетов
- Взвешивание
- Приготовление раствора
- Отчет о выполнении работы выполняется в произвольной форме
Задания для практической работы:
Вариант 1
- Приготовьте 100 г раствора NaCl массовой долей 5 %
- Приготовьте 100 г раствора CuSO4 массовой долей 7 %
- Приготовьте 100 г раствора Ca CO3 массовой долей 10, 5%
Вариант 2.
1. Приготовьте 100 г раствора NaCl массовой долей 9 %
2. Приготовьте 70 г раствора CuSO4 массовой долей 3 %
3. Приготовьте 20 г раствора Ca CO3 массовой долей 12, 3%
Вариант 3
1. Приготовьте 35 г раствора NaCl массовой долей 4 %
2. Приготовьте 100 г раствора CuSO4 массовой долей 2,5 %
3. Приготовьте 48 г раствора Ca CO3 массовой долей 13, 5%
Вариант 4
1. Приготовьте 115 г раствора NaCl массовой долей 3,2 %
2. Приготовьте 79 г раствора CuSO4 массовой долей 8 %
3. Приготовьте 108 г раствора Ca CO3 массовой долей 15%
Вариант 5
1. Приготовьте 50 г раствора NaCl массовой долей 3,2 %
2. Приготовьте 60 г раствора CuSO4 массовой долей 8 %
3. Приготовьте 30 г раствора Ca CO3 массовой долей 15%
Практическая работа № 6.
Решение экспериментальных задач по теме «Важнейшие классы неорганических соединений».
Цель: закрепить полученные знания об основных классах неорганических веществ отработать навыки написания уравнений реакций, умения делать выводы.
Оборудование: учебник, ПСХЭ, химическая посуда
Реактивы: соляная кислота гидроксид натрия, гидроксид меди, магний, оксид магния, хлорид меди
Ход работы:
- Инструктаж по ТБ при проведении практической работы
- Выполнение практической части.
- Решение задач № 1-5 вариант II
Оформить таблицу
|
Что делали |
Что наблюдали |
Выводы |
|
Задача№1 Определение соляной кислоты и гидроксида натрия, |
Изменение окраски индикатора |
Сформулировать вывод о изменении окраски используемых индикаторов |
|
Задача №2 Взаимодействие кислот и нерастворимых оснований |
Растворение осадка |
Написать уравнение реакции, сделать вывод |
|
Задача № 3 Определение раствора фенолфталеина |
Изменение окраски индикатора |
Сделать вывод |
|
Задача № 4 Получение хлорида магния используя имеющиеся реактивы |
Написать уравнения реакций, сделать вывод |
nsportal.ru