Дидактический материал по химии 8 класс
Автор: Чистофорова Елена Анатольевна
учитель биологии и химии
Образовательное учреждение: ГC(К)ОУ для обучающихся, воспитанников
с ограниченными возможностями здоровья «Петровск — Забайкальская специальная (коррекционная) общеобразовательная школа-интернат»
Предмет: химия
Тема: Обобщающий урок по темам «Кислород. Горение. Водород».
Класс: 8
УМК: Химия 8 класс: учебник для общеобразовательных учреждений/ Г.Е.Рудзитис, Ф.Г.Фельдман.
Проведение уроков с использованием интерактивной доски в учебном процессе способствует повышению уровня применения наглядности на уроке и производительности урока, установлению межпредметных связей, воспитанию интереса учащихся к учебному предмету, позволяет сделать процесс обучения интересным, насыщенным.
Работа с интерактивной доской помогает эффективно закрепить и проверить знания учащихся. Важно отметить, что ученики, которые раньше не проявляли особого интереса к учебе, теперь с энтузиазмом выходят отвечать к интерактивной доске.
Описание разработки.
Разработка учебных занятий по химии в 8 классе. Методический материал разработан с помощью программного обеспечения Elite Panaboard book для интерактивной доски Elite Panaboard.
Комментарии: Цифровой образовательный ресурс можно использовать для
проведения обобщающего урока химии в 8 классе, при изучении темы «Кислород. Горение. Водород».
Урок химии в 8 классе.
Обобщающий урок по темам «Кислород. Горение. Водород».
Задачи урока:
Образовательные: обобщение, углубление и систематизация знаний по теме «Кислород. Горение. Водород». Активизировать знания учащихся о процессах горения и медленного окисления.
Коррекционно—развивающие: развитие мышления учащихся, в том числе умения анализировать, активизировать познавательный интерес. Развивать эмоциональную сферу учащихся.
Воспитательные: воспитание потребности в знаниях, целеустремленность, наблюдательность, умение работать в коллективе. Экологическое воспитание — напомнить о значении кислорода для жизни на Земле, необходимости его сбережения, охраны окружающей среды.
Формы организации учебной деятельности: коллективная, групповая, индивидуальная
Методы работы: самостоятельная и под руководством учителя.
Оснащение урока: компьютер + интерактивная доска, учебник 8 класс Химия .
Скриншоты страниц и методические рекомендации по использованию дидактического материала
№ страниц
Страница
Пояснения
1

Титульная страница разработки
2

Вступительная беседа.
Тему сегодняшнего урока вы назовете сами, если отгадаете загадки.
Проверка: два щелчка по тексту.
Назовите химические формулы кислорода и водорода.
Проверка: открываем шторку и проверяем
Называем тему урока
3
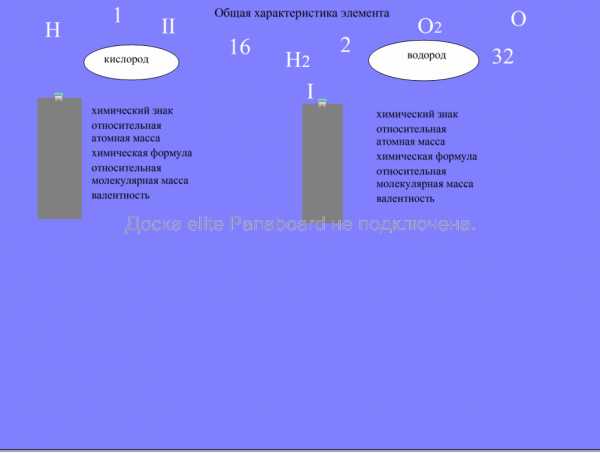
Общая характеристика химического элемента. Работа у доски. Учащиеся перемещают химические значки на соответствующие строчки.
Проверка: открываем шторку и проверяем
4
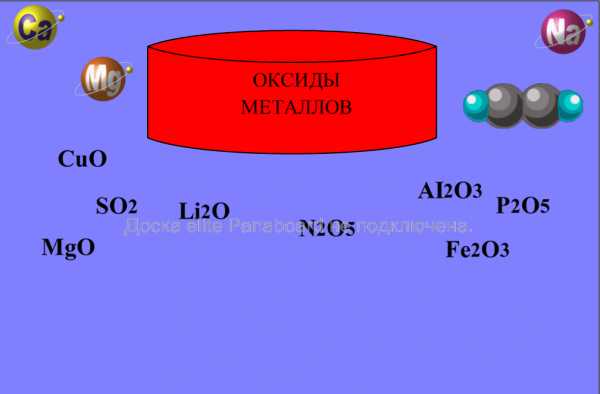
Какие вещества называются оксидами? Ученик работает у доски. Нужно выбрать оксиды металлов и поместить их в цилиндр. Проверка: правильные ответы скроются за цилиндр, а неправильные останутся на поверхности
5

Условия возникновения горения. Ученик работает у доски. При перемещении текста в прямоугольник высвечивается слово верно или неверно. Текст со словом верно скрывается за прямоугольником, а со словом неверно остаётся на поверхности.
6

Найдите в тексте оксиды. Самостоятельная работа учащихся в тетради. После выполнения работы дети обмениваются своими тетрадями и проводят взаимопроверку.
Проверка: Правильные ответы за пределами страницы. Можно проверить правильность выполнения, вытянув прямоугольник с ответами за проверку.
7

Решить уравнения реакций и расставить коэффициенты. Учащиеся самостоятельно решают уравнения в тетради, затем проверяют друг у друга.
Проверка: Открываем шторку и проверяем.
8
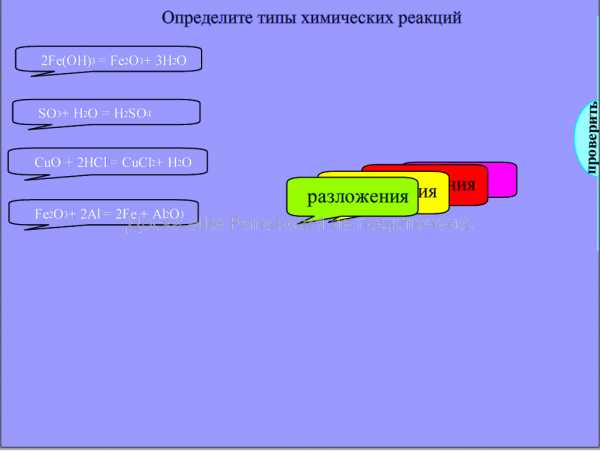
Типы химических реакций.
Учащиеся работают у доски. Перемещают прямоугольники, размещая их напротив соответствующей реакции. Правильные ответы за пределами страницы.
Проверка: Потянув за слово проверить вытягиваем правильные ответы.
9

Составление химических формул веществ. Используя инструмент клонирования, учащиеся по очереди выходят к доске и составляют формулы, все вместе проверяем.
10

Рефлексия. Используя инструмент клонирования, подарить капельке цветок с улыбкой, если урок был интересным и у вас хорошее настроение, а если у вас плохое настроение, то цветок, который плачет.
Изображения взяты из галереи программного обеспечения Elite Panaboard book для интерактивной доски Elite Panaboard.
infourok.ru
ГДЗ Радецкий 8 класс Химия
Авторы: А.М. Радецкий.
Выберите задание:
Работа 1
1
2
3
4
8 класс
Работа 2
1
2
3
4
Тема 1
Работа 3
1
2
3
4
Работа 4
1
2
3
4
Тема 2
Работа 5
1
2
3
4
Тема 3
Работа 6
1
2
3
4
Тема 4
Дополнительные задания
1
2
3
4
5
6
7
8
9
10
11
12
klassgdz.ru
Учебно-методический материал по химии (8 класс) на тему: Химия, дидактический материал
Тема: «Химические формулы. Относительная молекулярная масса. Вычисления по химическим формулам» 8 класс
В 1
1. Вычислить относительные молекулярные массы веществ: С 3 H 8 , Cu 2 S , Nh4 , MgO
2. Какую информацию можно узнать по химической формуле Nh4 ?
3. Рассчитать массовую долю каждого элемента и массовые отношения в Cu 2 S и MgO
4. Вычислить массу меди, которую можно выделить из Cu 2 S массой 700г.
В 2
1.Вычислить относительные молекулярные массы веществ: С О 2 , SО 3, Fe2 O3 , h3O
2. Какую информацию можно узнать по химической формуле 3 С 3 H 8 ?
3. Рассчитать массовую долю каждого элемента и массовые отношения в Fe2 O3 и SО 3
4. Вычислить массу С О 2, содержащего 48 г углерода.
В 3
1.Вычислить относительные молекулярные массы веществ: HCl , CH 4, Al2 O3 , CuO
2. Какую информацию можно узнать по химической формуле 7 Al2 O3?
3. Рассчитать массовую долю каждого элемента и массовые отношения в Al2 O3 и CuO
4. Вычислить массу кальция, которая содержится в 250г CaCO 3
В 4
1.Вычислить относительные молекулярные массы веществ:K2 O , C2H 4, Ph4 , SО 2
2. Какую информацию можно узнать по химической формуле С 3 H 8?
3. Рассчитать массовую долю каждого элемента и массовые отношения в С 3 H 8 и SО 3
4. Вычислить массу Fe2 O3, в которой содержится 2,4 г железа
В 5
1.Вычислить относительные молекулярные массы веществ: С 4 H 10 , Cu S , HNО3 , Mg3Р2
2. Какую информацию можно узнать по химической формуле 2 Mg3Р2?
3. Рассчитать массовую долю каждого элемента и массовые отношения в Cu S и Nh4
4. Вычислить массу серы, которую можно выделить из Cu 2 S массой 800г.
В 6
1.Вычислить относительные молекулярные массы веществ: С О , SО 2, Fe O , h3 SO3
2. Какую информацию можно узнать по химической формуле С O 2 ?
3. Рассчитать массовую долю каждого элемента и массовые отношения в Fe O и SО 2
4. Вычислить массу S О 2, содержащего 36 г серы.
В 7
1.Вычислить относительные молекулярные массы веществ: HClO4 , C2H 2, Al2 S3 , CuCl2
2. Какую информацию можно узнать по химической формуле 3 Al2 S3 ?
3. Рассчитать массовую долю каждого элемента и массовые отношения в Al2 S3 и Cu 2O
4. Вычислить массу углерода, которая содержится в 400г CaCO 3
В 8
1.Вычислить относительные молекулярные массы веществ: K2 SО 3 , C5H 10, P 2 О 5 , SО 3
2. Какую информацию можно узнать по химической формуле 4 H 2?
3. Рассчитать массовую долю каждого элемента и массовые отношения в С 5 H 10 и P 2 О 5
4. Вычислить массу Al2 S3, в которой содержится 10,2 г алюминия
В 9
1.Вычислить относительные молекулярные массы веществ: K2 O , P 2 О 5 , Al2 S3 , SО 2
2. Какую информацию можно узнать по химической формуле 2 СаО?
3. Рассчитать массовую долю каждого элемента и массовые отношения в СаО и Fe2 O3
4. Вычислить массу Fe 3О4, в которой содержится 12 г железа
В 10
1.Вычислить относительные молекулярные массы веществ: С 3 H 8 , Cu 2 S , Nh4 , MgO
2. Какую информацию можно узнать по химической формуле 5Nh4 ?
3. Рассчитать массовую долю каждого элемента и массовые отношения в Al2 O3 и CuO
4. Вычислить массу Fe2 O3, в которой содержится 68 г железа
В 11
1.Вычислить относительные молекулярные массы веществ: С О 2 , SО 3, Fe2 O3 , h3O
2. Какую информацию можно узнать по химической формуле С O 2 ?
3. Рассчитать массовую долю каждого элемента и массовые отношения в С 3 H 8 и SО 3
4. Вычислить массу серы, которую можно выделить из Cu 2 S массой 800г.
В 12
1.Вычислить относительные молекулярные массы веществ: С 4 H 10 , Cu S , HNО3 , Mg3Р2
2. Какую информацию можно узнать по химической формуле 2 С 3 H 8 ?
3. Рассчитать массовую долю каждого элемента и массовые отношения в Cu S и Nh4
4. Вычислить массу S О 2, содержащего 36 г серы.
В 13
1.Вычислить относительные молекулярные массы веществ: С О , SО 3, Fe O , h3 SO4
2. Какую информацию можно узнать по химической формуле 3 Al2 S3 ?
3. Рассчитать массовую долю каждого элемента и массовые отношения в С 5 H 10 и P 2 О 5
4. Вычислить массу меди, которую можно выделить из Cu S массой 70г.
В 14
1.Вычислить относительные молекулярные массы веществ: HClO4 , C2H 2, Al2 S3 , CuCl2
2. Какую информацию можно узнать по химической формуле 9 N 2?
3. Рассчитать массовую долю каждого элемента и массовые отношения в СаО и Fe O
4. Вычислить массу Fe2 O3, в которой содержится 56 г железа
В 15
1.Вычислить относительные молекулярные массы веществ:K2 O , P 2 О 5 , Al2 S3 , SО 2
2. Какую информацию можно узнать по химической формуле Nh4 ?
3. Рассчитать массовую долю каждого элемента и массовые отношения в С 3 H 8 и SО 3
4. Вычислить массу S О 3, содержащего 72 г серы.
В 16
1.Вычислить относительные молекулярные массы веществ: С 4 H 10 , Cu S , HNО3 , Mg3Р2
2. Какую информацию можно узнать по химической формуле 3 СаО?
3. Рассчитать массовую долю каждого элемента и массовые отношения в Cu S и Nh4
4. Вычислить массу меди, которую можно выделить из Cu S массой 400г.
В 17
1.Вычислить относительные молекулярные массы веществ: С О 2 , SО 3, Fe2 O3 , h3O
2. Какую информацию можно узнать по химической формуле 10 Al2 S3 ?
3. Рассчитать массовую долю каждого элемента и массовые отношения в Cu S и Nh4
4. Вычислить массу Al2 S3, в которой содержится 104 г алюминия
В 18
1.Вычислить относительные молекулярные массы веществ: HClO3 , C6H 12, Al2 S3 , CuCl
2. Какую информацию можно узнать по химической формуле Al2 O3?
3. Рассчитать массовую долю каждого элемента и массовые отношения в Fe O и SО 2
4. Вычислить массу углерода, которая содержится в 200г CaCO 3
В 19
1.Вычислить относительные молекулярные массы веществ: HCl , CH 4, Al2 O3 , CuO
2. Какую информацию можно узнать по химической формуле С 3 H 8 ?
3. Рассчитать массовую долю каждого элемента и массовые отношения в СаО и Fe2 O3
4. Вычислить массу меди, которую можно выделить из Cu S массой 70г.
В 20
1.Вычислить относительные молекулярные массы веществ: С 3 H 8 , Cu 2 S , Nh4 , MgO
2. Какую информацию можно узнать по химической формуле 2 Mg3Р2?
3. Рассчитать массовую долю каждого элемента и массовые отношения в Al2 O3 и CuO
4. Вычислить массу S О 2, содержащего 36 г серы.
В 21
1.Вычислить относительные молекулярные массы веществ: HBr , H 2CO3, Al N , CuI2
2. Какую информацию можно узнать по химической формуле CaCO 3?
3. Рассчитать массовую долю каждого элемента и массовые отношения в С 3 H 8 и SО 3
4. Вычислить массу Fe 3О4, в которой содержится 12 г железа
В 22
1.Вычислить относительные молекулярные массы веществ: С 4 H 10 , Cu S , HNО3 , Mg3Р2
2. Какую информацию можно узнать по химической формуле 3 O 2?
3. Рассчитать массовую долю каждого элемента и массовые отношения в С 5 H 10 и P 2 О 5
4. Вычислить массу Fe2 O3, в которой содержится 68 г железа
В 23
1.Вычислить относительные молекулярные массы веществ: С О , SО 2, Fe O , h3 SO3
2. Какую информацию можно узнать по химической формуле 2Nh4 ?
3. Рассчитать массовую долю каждого элемента и массовые отношения в СаО и Fe O
4. Вычислить массу серы, которую можно выделить из Cu 2 S массой 800г.
В 24
1.Вычислить относительные молекулярные массы веществ: HClO4 , C2H 2, Al2 S3 , CuCl2
2. Какую информацию можно узнать по химической формуле СаО?
3. Рассчитать массовую долю каждого элемента и массовые отношения в Cu S и Nh4
4. Вычислить массу Fe2 O3, в которой содержится 56 г железа
В 25
1.Вычислить относительные молекулярные массы веществ: С 3 H 6 , Cu 2S , HNО2 , Mg3N2
2. Какую информацию можно узнать по химической формуле Al2 S3 ?
3. Рассчитать массовую долю каждого элемента и массовые отношения в С 3 H 8 и SО 3
4. Вычислить массу меди, которую можно выделить из Cu S массой 400г.
В 26
1.Вычислить относительные молекулярные массы веществ: С О 2 , SО 2, Fe O , h3S
2. Какую информацию можно узнать по химической формуле 2 Al2 O3?
3. Рассчитать массовую долю каждого элемента и массовые отношения в Cu S и Nh4
4. Вычислить массу S О 3, содержащего 72 г серы.
Литература:
- Боровских Т.А. дидактические карточки-задания по химии. 8 класс. – М: «Экзамен», 2004
- Радецкий А.М. Задания для текущего и итогового контроля знаний учащихся по химии 8-8 классы. — М:Гуманитарный издательский центр «Владос», 2003
nsportal.ru
ГДЗ по Химии за 8‐9 класс дидактический материал А.М. Радецкий
Решебники, ГДЗ
-
1 Класс
-
Математика
-
Русский язык
-
Английский язык
-
Информатика
-
Немецкий язык
-
Литература
-
Человек и мир
-
Природоведение
-
Основы здоровья
-
Музыка
-
Окружающий мир
-
-
2 Класс
-
Математика
-
Русский язык
-
Белорусский язык
-
Английский язык
-
Информатика
-
Украинский язык
-
Немецкий язык
-
Литература
-
Человек и мир
-
Природоведение
-
Основы здоровья
-
Музыка
-
Окружающий мир
-
Технология
-
-
3 Класс
-
Математика
-
Русский язык
-
Белорусский язык
-
Английский язык
-
Информатика
-
Украинский язык
-
Немецкий язык
-
Литература
-
Человек и мир
-
Музыка
-
Окружающий мир
-
Испанский язык
-
-
4 Класс
-
Математика
-
Русский язык
-
Белорусский язык
-
Английский язык
-
Информатика
-
Украинский язык
-
Немецкий язык
-
Литература
-
Человек и мир
-
Основы здоровья
-
megaresheba.ru
ГДЗ по химии для 8‐9 класса дидактический материал А.М. Радецкий
ГДЗ от Путина
Найти
-
-
1 класс
- Математика
- Английский язык
- Русский язык
- Немецкий язык
- Информатика
- Природоведение
- Основы здоровья
- Музыка
- Литература
- Окружающий мир
- Человек и мир
-
2 класс
- Математика
- Английский язык
- Русский язык
- Немецкий язык
- Белорусский язык
- Украинский язык
- Информатика
- Природоведение
- Основы здоровья
- Музыка
- Литература
- Окружающий мир
- Человек и мир
- Технология
-
3 класс
- Математика
-
1 класс
gdzputina.ru
Дидактический материал по химии ( УМК О.С. Габриеляна) 8 класс
I.
8 класс Многовариантная проверочная работа
Тема: « Кислоты, их классификация и свойства».
-
Напишите химические формулы и названия солей, образованных соляной, азотной, серной и ортофосфорной кислотами и металлом……
-
Охарактеризуйте химические свойства кислоты……
-
Даны вещества. С какими из них реагирует серная кислота. Напишите молекулярные и ионные уравнения реакций.
-
Составьте формулы солей по названиям.
№ варианта
1 вопрос
2 вопрос
3 вопрос
4 вопрос.
1
цинком
азотная кислота
медь, магний,
оксид меди( II),
оксид серы( VI)
сульфат меди( II),
нитрат кальция,
хлорид цинка.
2
алюминием
серная кислота
оксид магния, серебро,
натрий, гидроксид калия
фосфат калия,
хлорид натрия,
карбонат кальция.
3
барием
фосфорная кислота
оксид натрия, магний, соляная кислота, оксид фосфора( V).
сульфид свинца,
нитрат железа( II),
силикат натрия.
4
железом ( II)
соляная кислота
оксид алюминия, оксид азота(V), цинк,
гидроксид бария.
фосфата калия, бромида серебра,
карбоната натрия.
5
железом (III)
угольная кислота
серебро, оксид меди( II), гидроксид калия, магний.
хлорид аммония,
карбонат магния,
нитрит натрия.
6
магнием
азотная кислота
оксид кремния, барий, соляная кислота, гидроксид цинка.
хлорид лития,
сульфит натрия,
сульфат хрома (III).
7
калием
соляная кислота
оксид лития,
железо,
оксид серы(IV),
угольная кислота.
иодида натрия,
нитрата серебра,
фосфата кальция.
II. 8 класс К теме: «Решение задач по уравнениям».
-
Сколько граммов магния можно сжечь в Х л кислорода?
-
Сколько литров водорода ( при н.у) выделится при взаимодействии У граммов цинка с соляной кислотой?
-
Сколько литров водорода потребуется для восстановления металла из B граммов оксида меди(II)?
-
Сколько граммов оксида фосфора ( V) получится, если в реакцию вступает Z моль фосфора?
-
Сколько литров оксида углерода ( IV) получится при разложении D граммов карбоната кальция?
№ варианта
Значение переменных
Задание №1
X л.
Задание №2
У г.
Задание №3
В г.
Задание №4
Z моль
Задание №5
D г.
I
1,12
13
8
0,5
20
II
5,6
39
24
2
0,4
III
224
2,6
20
0,25
100
IV
8,96
3,25
3.2
3
50
V
28
6,5
40
0,1
400
III 8 класс Задание к теме: « Степени окисления». Для частицы укажите:
Вариант I
C+4
C0
C+2
C — 4
Общее число электронов
Формулу вещества с соответствующей степенью окисления
Вариант II
S+4
S0
S—2
S+6
Общее число электронов
Формулу вещества с соответствующей степенью окисления
Вариант III
Si+4
Si0
Si+2
Si — 4
Общее число электронов
Формулу вещества с соответствующей степенью окисления
Вариант IV
N+4
N0
N+2
N — 3
Общее число электронов
Формулу вещества с соответствующей степенью окисления
IV. 8 класс Проверочная работа к теме: « Вычисления по формулам».
Фамилия, имя ученика: ___________________________________ Вариант: _____________
Заполните таблицу, вычислив для вещества недостающие величины.
Напоминание М (вещества) вычисляем по ПСХЭ Д.И. Менделеева М = Мr ( на 1 моль).
№ варианта
Формула вещества
М (г/моль)
n ( моль)
m (г)
V ( л)
N (молекул, атомов)
1
SO2
3 * 10 23
2
H2
11,2
3
CH4
0,5
4
NO
3
5
HCl
8,96
6
Cl2
0,6 * 10 23
7
H2S
2
8
O2
128
V. 8 класс Проверочная работа
Фамилия, имя ученика: ___________________________________ Вариант: _____________
Вариант
А
Б
В
Г
Д
Е
1
HCl
CO2
NaOH
Cu
Na2SO4
HNO3
2
Na2O
Fe(OH)3
P
HI
CaCO3
SiO2
3
H2
Al2 (SO4)3
CuO
KOH
MgS
H3PO4
4
FeO
H2S
LiCl
Al2O3
F2
NaHCO3
5
Mg(NO3)2
ZnO
H2SO4
C
Al(OH)3
Cl2O7
Задания по теме: « Классы неорганических веществ».
-
Запишите названия веществ: А, Д.
-
Укажите класс соединения: Б.
-
Выпишите формулу бинарного соединения.
-
Определите степени окисления элементов в формулах: Е
-
Для простого вещества вашего варианта составьте формулы: оксида, гидроксида.
Задания по теме: « Вычисления по химическим формулам».
-
Вычислите массу 2 моль вещества Г
-
Вычислите количество моль вещества В, если N = 12 * 10 22 молекул.
-
Вычислите Mr вещества Б и массовые доли элементов в веществе.
VI.Проверочная работа по темам: « Электролитическая диссоциация веществ. Реакции в растворах» 8 класс
-
Напишите уравнения диссоциации следующих веществ.
-
I вариант
II вариант
III вариант
IV вариант
А
H3PO4
Al2 (SO4)3
Ba(OH)2
CaS
В
Ca(OH)2
HNO3
CuI2
Cu(OH)2
С
FeCl3
Fe(OH)2
K3PO4
HBr
D
NaCl
AgNO3
H2SiO3
Na2SO4
-
Напишите уравнения реакций ( в молекулярной, полной и сокращенной ионной формах).
-
I вариант
II вариант
III вариант
IV вариант
А
CaO + HNO3 =
Al2 (SO4)3 +Ba(OH)2 =
Ba + HBr =
Fe( NO3)3 +Na3PO4=
В
Ca(OH)2 + CO2 =
CuSO4+ Fe =
Na2O + H3PO4 =
Zn + HCl =
С
FeCl3 + NaOH =
Na2CO3 +CaCl2 =
K2SiO3+ H2SO4 =
SO3 + NaOH =
D
AgNO3 + LiCl =
N2O5 + KOH =
MgCl2 + Ba(OH)2 =
BeO + HNO3 =
VII ХИМИЯ 8 класс СХЕМА — алгоритм (к теме: « Решение задач по уравнениям).
( использую данную схему на начальном этапе обучения учащихся решению химических задач)
ИСХОДНЫЕ ВЕЩЕСТВА
У
Р
А
В
Н
Е
Н
И
Е
ПРОДУКТЫ РЕАКЦИИ
m(раствора) m р. в
m (смеси) mч. в
m (вещества)
V (раствора) V (вещества)
V (смеси) V(компонента смеси)
V (вещества)
N
n
←→
←→
n
m р.в m(р-ра)
mч.в.mсмеси
m (вещества)
V (вещества) V (раствора)
V(компонента смеси) V( смеси)
V(вещества)
Задача № 1. Какая масса оксида магния получится при сжигании 6 г магния. Учитель: 1. Прочтите внимательно задачу. 2.Определите, что дано в условии задачи, что необходимо определить. 3.Запишите в тетрадях условие задачи.
Дано:
m(Mg)= 6 г.
Решение:
Составим алгоритм решения задачи ( используя схему- алгоритмов)
m(Mg) 1n(Mg) 2 УР 3n(MgО) 4m(MgО)
-
Количество вещества магния находим по формуле: n =
n( Mg) = =0,25 моль
Найти:
m(MgО)=?
2. Запишем уравнение химической реакции:
0,25 моль х моль
2 Mg + O2 = 2 MgO
2 моль2 моль
3. Найдем количество вещества оксида магния, полученного в результате реакции.
n ( Mg) =n( MgO) ( по уравнению реакции), следовательно n ( MgO) = 0,25 моль.
4. Находим массу оксида магния по формуле: m = M*n
M ( MgO) = 40 г/моль m ( MgO) = 40*0,25 = 10 г.
Ответ: m ( MgO) = 10 г.
Задача № 2 Какой объем углекислого газа (н.у.) образуется при взаимодействии с избытком азотной кислоты 250 г известняка (карбоната кальция), содержащего 20% примесей? Каково количество углекислого газа?
Дано:
m(CaCO3)= 250 г.
ᴡприм= 20%
М(СаСО3) = 100 г/моль
Решение:
Составим алгоритм решения задачи ( используя схему- алгоритмов)
m (смеси) 1mч.в. 2n( CaCO3 ) 3 УР 4n(CO2) 5V( СО2)
1.Вычислим mч.в. по формуле: mч.в.= ᴡчист* m(CaCO3)/100% = (100 -20)* 250/100 = 200 г.
2.Находим n( CaCO3) = = = 2 моль
Составим уравнение химической реакции:
2моль х моль
СаСО3+ 2НNO3 = Ca( NO3)2 + H2O + CO2↑
1 моль 1моль
3. Находим n( CO2)
Из уравнения следует, что n(CaCO3) = n (CO2), n (CO2) = 2 моль.
4. Находим V(СО2) по формуле: V = Vm*n
V( CO2) = 22,4*2 = 44,8 л.
Ответ: V(СО2)= 44,8 л, n(CO2)=2 моль.
Найти: V(СО2)=?
n(CO2)=?
Задача № 3 Вычислите массу соли, образующейся при взаимодействии 200 г 15%-ного раствора HNO3 с достаточным количеством оксида меди (II).
Дано:
mраствора(НNO3)= 200 г.
ᴡр.в.= 15%
М(НNO3) = 63 г/моль
M(Cu(NO3)2) =188 г/ моль
Решение: Составим алгоритм решения задачи ( используя схему- алгоритмов)
m (раствора) 1mр.в. 2n( НNO3 ) 3 УР 4n(соли) 5m( соли)
1. Вычислим mр.в. по формуле: mр.в.= mраствора(НNO3) * ᴡр.в./100 = 200 * 15/100 = 30 г.
Находим n( НNO3) = = = 0,476 моль ( можно округлить до 0,5 моль)
3. Составляем уравнение химической реакции:
0,5моль х моль
СuO+ 2НNO3 = Cu( NO3)2 + H2O
2моль 1моль
4. Находим n( Cu( NO3)2)
Из уравнения следует, что n( НNO3) = n ( Cu( NO3)2), следовательно
n ( Cu( NO3)2)= = 0,25 моль
5. Находим m(соли)
m(соли) = M*n = 188*0,25 = 47 г.
Ответ: m( Cu( NO3)2)= 47 г.
Найти: m(соли) =?
Задача № 4
Составьте уравнение реакции взаимодействия железа с хлором (Cl2) и вычислите массу железа и объем хлора, которые необходимы для получения 42,6 г хлорида железа (III) FeCl3.
Дано:
m (FeCl3.)= 42,6 г.
М ( FeCl3) = 162,5 г/моль
Решение: Составим алгоритм решения задачи ( используя схему- алгоритмов).
Обращаем внимание на то, что в условии задачи известна масса продукта
реакции, поэтому составлять алгоритм решения начинаем с колонки – масса
продукта реакции.
3n(Fe) 4m( Fe)
m ( FeCl3) 1 n( FeCl3 ) 2 УР
3
n(Cl2) 5 V( Сl2)
Находим n( FeCl3) = = = 0,26 моль
2. Составляем уравнение химической реакции:
х моль х моль 0 ,26 моль
2 Fe + 3 Cl2 = 2 FeCl3
2моль 3моль 2моль
3. Находим n( Fe ) и n(Сl2)
Из уравнения следует:
а) что n( FeCl3) = n ( Cl2), следовательно n ( Cl2)= = 0,39 моль,
б) что n( FeCl3) = n (Fe), следовательно n (Fe) = 0,26 моль.
4. Находим m(Fe)
m(Fe) = M*n = 56*0,26 = 14,56г.
5. Находим V( Сl2) по формуле: V = Vm*n
V( Сl2) = 22,4*0,39 = 8,74 л.
Ответ: m(Fe) = 14,56 г, V( Сl2) =8,74 л.
Найти: m(Fe) =?
V( Сl2) = ?
infourok.ru
ГДЗ за 8‐9 класс по Химии А.М. Радецкий дидактический материал
gdz.im
Найти
Навигация по гдз
1 класс
Русский язык
Математика
Английский язык
Окружающий мир
Литература
Информатика
Музыка
Человек и мир
2 класс
Русский язык
Математика
Английский язык
Немецкий язык
Окружающий мир
Литература
Информатика
Музыка
Технология
Человек и мир
Белорусский язык
3 класс
Русский язык
Математика
Английский язык
Немецкий язык
Окружающий мир
Литература
Информатика
Музыка
Человек и мир
Белорусский язык
Испанский язык
4 класс
Русский язык
Математика
Английский язык
Немецкий язык
Окружающий мир
Литература
Информатика
Музыка
Человек и мир
Белорусский язык
Испанский язык
5 класс
Русский язык
Математика
Английский язык
Немецкий язык
История
География
Биология
Обществознание
Физика
Литература
Информатика
Музыка
Технология
ОБЖ
Природоведение
Естествознание
Человек и мир
Белорусский язык
Украинский язык
Французский язык
gdz.im