Классификация органических соединений. Видеоурок. Химия 10 Класс
Данный урок познакомит вас с темой «Классификация органических соединений». Будут систематизированы знания учащихся об органических веществах, определены критерии классификации органических соединений. Вы узнаете о составлении схемы классификации органических веществ, что такое скелет молекул, как классифицируют вещества по классам и функциональным группам.
Тема: Введение в органическую химию
Урок: Классификация органических соединений
Классификация по составу
Органические соединения подразделяют по составу на:
ü углеводороды – вещества, состоящие только из углерода и водорода;
ü кислородсодержащие органические соединения, в состав которых входят атомы углерода, водорода и кислорода;
ü азотсодержащие органические соединения – содержат, кроме атомов углерода, водорода (и иногда кислорода) еще и атом азота.
Однако при этом в одну группу кислородсодержащих соединений попадают вещества с очень разными свойствами, такие, например, как уксусная кислота, сахар и целлюлоза.
Классификация по строению
Рис. 1. Классификация по строению
Наиболее полезна для химиков классификация органических веществ по их строению. Рис. 1. Внутри этой классификации существуют признаки, позволяющие наиболее полно охарактеризовать вещества.
Первый признак классификации органического соединения по строению – тип скелета молекулы.
Скелет – это последовательность связанных атомов углерода в молекуле, основа структуры органического соединения.
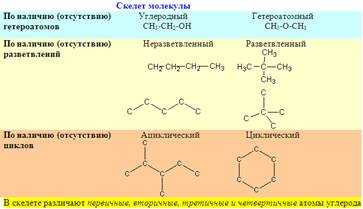
Рис. 2. Разновидности углеродного скелета
Кроме атомов углерода, в состав скелета могут входить и другие атомы, например, O, S, N, если они связаны, по меньшей мере, с двумя атомами углерода.
Например, в диметиловом эфире СН3-О-СН3 атом кислорода включен в скелет молекулы, а в этаноле CH3-CH2-OH – нет. Молекулы, в скелет которых, кроме атомов углерода, входят атомы других элементов, называются гетероатомными(«гетеро-» – лат. «разный»).
Скелет молекулы может быть неразветвленным – все атомы углерода соединены последовательно – и разветвленным. Цепь из атомов углерода может быть замкнутой. Такую замкнутую группу атомов называют циклом. Поэтому скелет молекулы бывает или ациклическим, (т.е. не циклическим) или циклическим. В скелете различают первичный, вторичный, третичный, четвертичный атомы углерода.
Первичным называют атом углерода, связанный только с одним другим атомом углерода, вторичным – с двумя, третичным – с тремя, а четвертичным – с четырьмя другими атомами углерода.
Рис. 3. Наличие кратных связей и бензольных колец
Второй признак классификации – наличие (или отсутствие) в молекуле кратных связей и бензольных колец. Органические вещества, содержащие только простые (одинарные) связи, называют предельными или насыщенными. Вещества, которые содержат не только простые, но и кратные (двойные или тройные) связи между атомами углерода, называют непредельными или ненасыщенными. На один атом углерода в их молекулах приходится меньшее число атомов водорода, чем у предельных соединений. Если вещество содержит бензольное кольцо, то его принято называть ароматическим соединением. Вещества, в состав которых не входят ароматические группировки, называют алифатическими. Иногда можно встретить уста
interneturok.ru
Материал для подготовки к ЕГЭ (ГИА) по химии (10 класс) по теме: Разделы органической химии.
ИМЕННЫЕ РЕАКЦИИ
1. Реакция Вагнера Е.Е.
Окисление алкенов в цис — α — гликоли действием разбавленного раствора перманганата калия в щелочной среде (гидроксилирование):
2. Реакция Вюрца
Получение углеводородов конденсацией алкилгалогенидов при действии металлического натрия:
3. Реакция Вюрца — Гриньяра
Образование углеводородов при взаимодействии алкил (арил) галогенидов с реактивом Гриньяра:
4. Реакция Вюрца — Фиттига
Получение жирноароматических углеводородов конденсацией ароматических галогенопроизводных с алкилгалогенидами в присутствии натрия:
5. Реакция Гарриеса
Окислительное расщепление алкенов путем озонирования и последующего гидролиза (озонолиз):
6. Реакция Гаттермана — Коха
Реакция формилирования ароматических углеводородов действием окиси углерода и хлористого водорода в присутствии AlCl3:
7. Реакция Гелля — Фольгарда — Зелинского
Получение α — галогензамещенных кислот действием хлора или брома в присутствии фосфора:
8. Реакция Гофмана (перегруппировка)
Перегруппировка амидов кислот в первичные амины с потерей одного атома углерода в растворе гипохлоритов:
9. Реакции Гриньяра (магнийорганический синтез)
Реакции синтеза органических соединений на основе присоединения реактива Гриньяра к связи >С = О:
10. Реакция Дильса — Альдера (диеновый синтез)
Присоединение соединений с активированной двойной связью (диенофилов) к сопряженным диенам с образованием циклических структур. Присоединение идет по типу 1,4:
11. Реакция Зандмейера
Замена диазогруппы в ароматических соединениях на галоген или другую группу действием солей одновалентной меди:
12. Реакция Зелинского
Получение α — аминокислот из альдегидов или кетонов при действии смеси цианида калия и хлорида аммония (цианида аммония):
13. Реакция Зинина
Восстановление ароматических нитросоединений в амины:
Зинин использовал для восстановления сульфид аммония, в промышленности для восстановления нитросоединений применяют чугунные стружки в кислой среде.
14. Реакция Канниццаро
Окислительно-восстановительное диспропорционирование двух молекул ароматического альдегида в соответствующие спирт и кислоту под действием щелочей. В эту реакцию вступают также алифатические и гетероциклические альдегиды, не содержащие в α — положении подвижного водорода:
Перекрестная реакция Канниццаро
15. Реакция Кольбе
Получение углеводородов электролизом растворов щелочных солей алифатических карбоновых кислот:
На аноде анион кислоты разряжается в неустойчивый радикал кислоты, который распадается с выделением диоксида углерода, и образующиеся алкильные радикалы спариваются в углеводород:
16. Реакция Кольбе-Шмитта
Получение ароматических оксикислот термическим карбоксилированием фенолятов щелочных металлов двуокисью углерода:
17. Реакция Коновалова
Нитрование алифатических, алициклических и жирноароматических соединений азотной кислотой (12-20%):
18. Реакция Кучерова
Каталитическая гидратация ацетилена, его гомологов и производных с образованием альдегидов и кетонов:
а) при гидратации ацетилена получается ацетальдегид:
б) при гидратации гомологов ацетилена получаются кетоны:
19. Реакция Лебедева
Получение бутадиена каталитическим пиролизом (450˚C) этилового спирта:
20. Реакция Тищенко
Конденсация альдегидов с образованием сложных эфиров под действием алкоголятов алюминия:
21. Реакция Фаворского
Взаимодействие алкинов с альдегидами и кетонами:
22. Реакция Фриделя-Крафтса
Алкилирование или ацилирование ароматических соединений алкил- или ацилгалогенидами в присутствии хлористого алюминия:
а) алкилирование:
б) ацилирование:
nsportal.ru
Методическая разработка по химии (10 класс) на тему: Интеллектуальная игра по органической химии в 10 классе
Интеллектуальная игра по органической химии в 10 классе
Игра с мультимедийным сопровождением
Цели: углубить знания учащихся по органической химии, повысить интерес к предмету; развивать навыки работы с дополнительной литературой.
Примечание: участвуют 5 команд по 5-6 человек.
Ход игры
1 конкурс. Занимательная викторина
Вопросы задает ведущий игры, каждый правильный ответ оценивается 1 баллом.
- Почему мороженый картофель имеет сладкий вкус?
(На морозе крахмал, образовавшийся в картофеле в результате фотосинтеза, превращается в сахар.)
- Какой спирт вызывает гибель зрительного нерва и повреждает сетчатку глаза? (Метанол.)
- Как называется гексоза, содержащаяся в молоке? (Лактоза.)
- Как называется природный полимер, содержащийся в рисе, картофеле, кукурузе? (Крахмал.)
- Почему крапива жжется? (В листьях и стеблях крапивы содержится муравьиная кислота, которая и вызывает ожог.)
- Какой углеводород называется так же, как и одно из государств? (Бутан.)
- Как называется физический процесс разделения нефти на фракции? (Перегонка.)
- Назовите заменитель сахара для диабетиков, полученный из глюкозы. (Сорбит.)
- Какой спирт хорошо смягчает кожу рук? (Глицерин.)
- Назовите фамилию ученого, впервые получившего циклическую формулу бензола. (Кекуле.)
- Назовите фамилию русского химика-органика и по совместительству композитора. (Бородин.)
- Его изобрели как дорогой упаковочный материал, а сегодня он стал чуть ли не главным мусором планеты. (Целлофан.)
2 конкурс. «Головоломка»
Каждой команде предлагается «головоломка». Среди буквенной неразберихи нужно найти (сверху вниз, слева направо и по диагонали) за 5 минут как можно больше слов, относящихся к теме «Предельные углеводороды». За каждое найденное слово выставляется по 0,5 балла.
Ответы: алканы, радикал, метил, фреон, разложение, сажа, хлорметан, замещение, метан, одинарная, парафины, горение, бутан, гомология.
3 конкурс. Викторина «Закончи фразу»
Командам дается по 1 баллу за каждую законченную фразу. Задания даются командам поочередно.
- Углерод в органических соединениях имеет валентность, равную …(4)
- Углеводороды, в молекулах которых две двойные связи, называются …(алкадиены)
- сигма-связь, по сравнению с л-связью, более …(прочная)
- Для непредельных углеводородов наиболее характерны реакции …(Присоединения)
- Многократно повторяющаяся в структуре полимера группировка атомов называется …(Мономер)
- Число структурных звеньев в молекуле полимера называют … (Степень полимеризации)
- Реакция, в результате которой происходит отщепление воды, — это …Дегидратация)
- Реакция отщепления водорода называется …(Дегидрирование)
- Для большинства органических веществ характерны реакции …(Горения)
- Для ароматических углеводородов характерны реакции …(Замещения и присоединения)
4 конкурс. Ваятели
Участвуют 2 человека от каждой команды. Им выдаются пластилин и спички. Задание: слепить модели органических веществ, которые предложены членами соревнующихся команд. Жюри оценивает каждую модель по 3-бальной системе.
5 конкурс. Органические шарады
По 1 баллу за каждую разгаданную шараду.
- Возьми ты греческое «два»
И добавляй к нему слова.
Два газа ты соедини
И растворитель получи. (Дихлорэтан.)
- То, что в облаке сгустится,
Да балканская столица,
Меж собой соединясь,
Образуют целый класс. (Парафины.)
- Слог мой первый метлой выметают,
Слогом вторым информатор считает.
В целом, скажу, дорогие друзья,
Для многих больных вместо сахара я. (Сорбит.)
- Нота плюс женское имя,
В целом напишем … (Резина.)
- Первый мой слог означает крушение.
Крохотен слог мой второй.
Рождаюсь лишь только в зеленых растеньях.
Подумайте, кто я такой. (Крахмал.)
- Напиши, как зовут великана из сказки,
А рядом — названье реки.
Букву поставь между ними для связки — Диена названье прочти. (Дивинил.)
6 конкурс. «Органический чайнворд»
На выполнение данного задания дается 5 минут. За каждое угаданное слово — 1 балл. Если же чайнворд будет отгадан весь, то 20 баллов.
1.Одноатомный спирт. 2. Нефтепродукт. 3. Производное бензола. 4. Полиэфирное волокно. 5. Функциональная группу. 6. Соединение, содержащее карбонильную группу. 7. Галогенопроизводное одного из простейших углеводородов. 8. Система названий органических веществ. 9. Ископаемый уголь высшего качества.
10. Геометрический образ метана. 11. Неустойчивая частица вещества с неспаренными электронами. 12. Молочный сахар. 13. Радикал. 14. Диаминомокапроновая кислота. 15. Сок, выделяемый цветками. 16. Ароматизация нефтепродуктов с целью повышения качества их октанового числа. 17. Реакция присоединения водорода.
Ключ: 1. Этанол. 2. Лигроин. 3. Нитробензол. 4. Лавсан. 5. Нитрогруппа. 6. Альдегид. 7. Дихлорэтан. 8. Номенклатура. 9. Антрацит. 10. Тетраэдр. 11. Радикал. 12. Лактоза. 13. Амил. 14. Лизин. 15. Нектар. 16. Риформинг. 17. Гидрирование.
7 конкурс. «Заморочки из бочки»
Заранее готовим несколько интересных заданий, которые написаны на листах бумаги и заклеены так, чтобы невозможно было прочитать. Весь материал ведущий прячет в «бочку» (какую-нибудь коробку). Поочередно достаем по «заморочке», зачитываем вслух. Отвечает тот, кто первым догадался, о чем идет речь.
Первая заморочка : «Чем обуславливается запах вещества?»
Ответ: Под «душистыми» обычно понимают приятно пахнущие органические вещества. Вещества, которые просто пахнут, называют пахучими. С химической точки зрения, разницы между ними нет. Душистые вещества, как правило, содержат одну из так называемых функциональных групп: карбинольную, карбонильную, сложноэфирную. Сильный запах обусловливают альдегиды и спирты, содержащие 4-8 атомов углерода в молекуле. Согласно химической теории запаха, существует семь первичных основных запахов. Каждый их этих запахов может вызываться химическими веществами, чьи молекулы имеют строго определенную для каждой группы структуру.
Вторая заморочка : «Одна народная легенда рассказывает, как старый больной человек надел волшебную рубашку и стал молодым и здоровым. Эта легенда стала, в какой степени, былью в наши дни. Как называется такая ткань и в чем секрет ее лечебного действия?»
Ответ: Ткань сделана из хлорина. Исходное сырье — ацетилен. Из него получают хлористый винил, затем смолу поливинилхлорид. А уже из смолы формуют нить из ацетонового раствора. От трения трикотажа из хлоринового волокна о кожу возникает статическое электричество. Становясь источником отрицательно заряженных ионов, белье действует на нервные окончания и снимает болевые ощущения.
Третья заморочка : «Какова перспектива использования нефти в качестве основы для получения белка?»
Ответ: Это происходит с помощью микроорганизмов. Так получают кормовые дрожжи, витамины и кормовые белки. Впервые в 1952 г. немецкий биолог Феликс Жуст получил новую культуру дрожжевых грибков, под действием которых углеводы нефти превращались в белки. Это вдохновило ученых на синтез белковых молекул, содержащих незаменимые аминокислоты. Наилучшим питанием для микроорганизмов являются фракции нефти между керосином и смазочным маслом. Белки, полученные таким путем, почти не отличаются от белков, синтезированных животными и растениями.
Четвертая заморочка : «Одним из достижений прошлого века называют кремнийорганические соединения. Как они называются и где применяются?»
Ответ: Это полиорганосилоксаны или силиконы. Их отличительной особенностью является стойкость при высоких и низких температурах, диэлектрические свойства и большая эластичность. Они не подвергаются действию даже самых агрессивных реагентов, микроорганизмов, атмосферным влияниям, плесени грибков. Их используют для приготовления медицинских приборов, трубок, пробок; на их основе делают лаки, краски, смазки, эмали, клей. Применяют в области электроники, радио и приборостроения.
Пока жюри подводит окончательный итог, можно посмотреть опыт.
Опыт «Несгораемый платок». Платок сначала смочить в воде, а потом в спирте. Поджечь. Будет гореть спирт, а не платок.
Литература и Интернет-ресурсы
- Байкова В.М. Химия после уроков. — Петрозаводск: Карелия, 2000.
- Бочарова С.В. Занимательные материалы по химии. 10 класс. — Волгоград: Корифей, 2010.
- Гаврусейко Н.П., Дебалтовская Р.И. Химические викторины. — Минск: Народная асвета, 1997.
- Ольгин О. Опыты без взрывов. — М.: Химия, 2000.
- Рогожников С.И. Все о химических элементах. — СПб.: Химия, 1996.
- www.encyclopedia.ru
- www.school-sector.relarm.ru
nsportal.ru
Тесты по курсу «Органическая химия» (10 класс)
Медицинский колледж № 1
Тестирование за курс органической химии
(базового уровня)
Подготовила: преподаватель химии
Папикян С.Х.
Тестирование за курс органической химии в 10 классе.
Часть А. (1 вариант)
-
К какому гомологическому ряду относится вещество состава С7Н8 ?
а) алканы б) алкены в) алкины г) арены
2. Какая общая формула соответствует классу алканов?
а) СпН2п+2 б) СпН2п в) СпН2п-2 г) СпН2п-6
3. Реакции какого типа характерны для алканов?
а) присоединения б) замещения в) полимеризации г) гидратации
4. Какое название соответствует веществу СН3 – СН – СН2 – СН3
СН3
а) бутан б) 2-метилбутан в) 2-метилпропан г) 3-метилбутан
5. Какой газ составляет основу природного газа?
а) метан б) этан в) пропан г) бутан
6. Сколько σ -связей в молекуле этена?
а) 2 б) 3 в) 4 г) 5
7. Сколько π-связей в молекуле бутадиена-1,3
а) 1 б) 2 в) 3 г) 4
8. Гомологами являются
а) пентен и 2-метилбутан б) хлорэтен и дихлорэтан
в) пропанол и пропаналь г) 2,2-диметилпропан и 2,2-диметилбутан
9. Тип реакции взаимодействия этена с бромом
а) присоединения б) замещения в) гидрирования г) гидратации
10. Только σ – связи имеются в молекуле
а) этанола б) этаналя в) этена г) этина
11. Вещество СН3 – СН – СН = СН2 называется
СН3
а)2-метилбутан б) 3-метилбутен-2
в) 3-метилбутин-1 г) 3-метилбутен-1
12. Несколько функциональных групп -ОН содержат молекулы
а) глицерина и глюкозы б) фенола и пропанола
в) сахарозы и формальдегида г) фенола и формальдегида
13. Следующие признаки: sp-гибридизация, длина С-С связи 0,120 нм,
угол 1800 характерны для молекулы
а) бензола б) этана в) этина г) этена
14. Функциональная группа -ОН характерна для класса
а) альдегидов б) аминов в) карбоновых кислот г) спиртов
15. Карбоксильная группа содержится в молекуле
а) метанола б) ацетальдегида в) уксусной кислоты г) глицерина
16. Реактивом для распознавания многоатомных спиртов является
а) бромная вода б) оксид меди (+2)
в) гидроксид меди (+2) г) хлорид железа (+3)
17. Продуктами окисления предельных одноатомных спиртов являются
а) альдегиды б) кетоны в) простые эфиры г) сложные эфиры
18. Сложный эфир можно получить реакцией
а) гидрирования б) гидратации в) этерификации г) дегидратации
19. В реакцию «серебряного зеркала» вступают
а) альдегиды б) фенолы в) спирты г) одноатомные спирты
20. Из остатков молекул α – глюкозы состоят молекулы
а) фруктозы б) крахмала в) сахарозы г) целлюлозы
21. Установите тип реакции: n C6H12O6 → (C6H10O5)n + n H2O
а) полимеризация б) присоединения
в) поликонденсации г) изомеризации
22. Для аминов характерны свойства
а) кислот б) оснований в) амфотерных соединений
23. Какое название у вещества СН3 – СН – СН2 – СООН
NH2
а) 3-аминобутановая кислота б) 2-аминобутановая кислота
в) α-аминомасляная кислота в) 4- аминомасляная кислота
24. В состав белков входят остатки
а) α-аминокислот б) β-аминокислот
в) γ-аминокислот г) δ-аминокислот
25. Химическая связь, образующая первичную структуру белков:
а) водородная б) ионная в) пептидная г) ковалентная неполярная
часть Б.
-
Установите формулу органического вещества, в котором С — 53,5%,
Н – 15,6%, N – 31,1% и относительная плотность по водороду 22,5
-
Для вещества СН2= СН-СН=СН2 составьте структурные формулы одного изомера и одного ближайшего гомолога, назовите все вещества.
-
Напишите уравнения для осуществления превращений:
СаС2 → С2Н2 → С6Н6 → С6Н5NO2 Укажите условия реакций, назовите продукты.
-
Выберите, с какими из перечисленных веществ может взаимодействовать этанол, и напишите соответствующие уравнения реакций:
натрий, гидроксид натрия, хлорид натрия, хлороводород, уксусная кислота
-
При полном сгорании 3 г. углеводорода получилось 4,48 л. (н.у.) углекислого газа и 5,4 г. воды. Относительная плотность по воздуху равна 1,03. Выведите формулу углеводорода.
Тестирование за курс органической химии в 10 классе.
Часть А. ( 2 вариант)
-
К какому гомологическому ряду относится вещество состава С5Н8 ?
а) алканы б) алкены в) алкины г) арены
2. Какая общая формула соответствует классу алкенов?
а) СпН2п+2 б) СпН2п в) СпН2п-2 г) СпН2п-6
3. Реакции какого типа характерны для алканов?
а) полимеризации б) гидратации в) замещения г) присоединения
4. Какое название соответствует веществу СН3 – СН – СН = СН2
СН3
а) бутан б) 2-метилбутен-3 в) 3-метилбутен-1 г) 3-метилбутан
5. Какое вещество является природным полимером?
а) глюкоза б) фруктоза в) сахароза г) целлюлоза
6. Сколько σ -связей в молекуле этина?
а) 2 б) 3 в) 4 г) 5
7. Сколько π-связей в молекуле бутена-1
а) 1 б) 2 в) 3 г) 4
8. Гомологами являются
а) пентен-2 и бутен-2 б) хлорэтан и дихлорэтен
в) пропанол и пропаналь г) 2-метилпропан и 2-метилбутен
9. Тип реакции взаимодействия этена с бромоводородом
а) присоединения б) замещения в) гидрирования г) изомеризации
10. Только σ – связи имеются в молекуле
а) этаналя б) этанола в) бензола г) уксусной кислоты
11. Вещество СН3 – СН2 – С = СН2 называется
СН3
а)2-метилбутен-1 б) 2-метилбутен-2
в) 3-метилбутин-1 г) 3-метилбутен-1
12. Несколько функциональных групп -ОН содержат молекулы
а) этанола и глюкозы б) фенола и формальдегида
в) сахарозы и формальдегида г) глюкозы и глицерина
13. Следующие признаки: sp2-гибридизация, длина С-С связи 0,134 нм,
угол 1200 характерны для молекулы
а) циклобутана б) этана в) этина г) этена
14. Функциональная группа -СООН характерна для класса
а) альдегидов б) аминов в) карбоновых кислот г) спиртов
15. Карбонильная группа содержится в молекуле
а) метанола б) ацетальдегида в) фенола г) глицерина
16. Реактивом для распознавания фенолов является
а) бромная вода б) оксид меди (+2)
в) гидроксид меди (+2) г) хлорид железа (+3)
17. Продуктами межмолекулярной дегидратации предельных
одноатомных спиртов являются
а) альдегиды б) кетоны в) простые эфиры г) сложные эфиры
18. Жир можно получить реакцией
а) гидрирования б) гидратации в) этерификации г) дегидратации
19. В реакцию «серебряного зеркала» вступают
а) спирты б) фенолы в) альдегиды г) одноатомные спирты
20. Из остатков молекул β– глюкозы состоят молекулы
а) глюкозы б) крахмала в) сахарозы г) целлюлозы
21. Установите тип реакции: n CH2 = CH2 → ( — CH2 — CH2-)n
а) полимеризация б) замещения
в) поликонденсации г) изомеризации
22. Для аминокислот характерны свойства
а) кислот б) оснований в) амфотерных соединений
23. Какое название у вещества СН3 – СН – СН2 – СООН
NH2
а) 3-аминопропановая кислота б) 2-аминобутановая кислота
в) α-аминомасляная кислота г) β- аминомасляная кислота
24. В состав белков входят остатки
а) δ-аминокислот б) β-аминокислот
в) γ-аминокислот г) α- аминокислот
25. Химическая связь, образующая вторичную структуру белков:
а) водородная б) ионная в) пептидная г) ковалентная неполярная
часть Б.
-
Установите формулу органического вещества, в котором С – 52,18%,
Н – 13,04%, О – 34,78% и относительная плотность по водороду 23
-
Для вещества СН2= СН- СН2— СН-СН3 составьте структурные формулы
СН3
одного изомера и одного ближайшего гомолога, назовите все вещества.
-
Напишите уравнения для осуществления превращений:
С2Н5ОН → С2Н4 → С2Н5Сl → С4Н10 Укажите условия реакций, назовите продукты.
-
Выберите, с какими из перечисленных веществ может взаимодействовать этановая кислота, и напишите соответствующие уравнения реакций:
магний, гидроксид натрия, хлорид натрия, хлороводород, этанол
-
При полном сгорании 4,4 г. углеводорода получилось 6,72 л. (н.у.) углекислого газа и 7,2 г. воды. Относительная плотность по воздуху равна 1,517. Выведите формулу углеводорода.
Инструкция по выполнению работы.
Тест состоит из частей А и Б. На его выполнение отводится 120 минут. Задания рекомендуется выполнять по порядку. Часть А содержит тестовые задания с выбором одного правильного ответа. Ответы на вопросы части А вносятся вами в таблицу бланка ответов.
Часть Б содержит задания со свободным ответом, предусматривающие произведение расчётов, написание уравнений реакций, составление структурных формул веществ.
Каждое задание части А оценивается в 1 балл, задание Б1 – 3 балла, Б2 – 5 баллов, Б3 -3 балла, Б4 – 3 балла, Б5 – 5 баллов. Общее количество баллов равно 44.
Шкала перевода баллов в отметки:
0 -15 баллов — «2» ( 0-34 %)
16 – 26 баллов — «3» (35-60%)
27 – 37 баллов -«4» (61-85 %)
38 – 44 балла — «5» (86-100%)
Желаю успехов!
Ответы на задания 1 варианта. Часть А
1
2
3
4
5
г
а
б
б
а
6
7
8
9
10
г
б
г
а
а
11
12
13
14
15
г
а
в
г
в
16
17
18
19
20
в
а
в
а
б
21
22
23
24
25
в
б
а
а
в
Б1 ответ С2Н7N
Б2 изомер СН2=С=СН-СН3 бутадиен-1,2
гомолог СН2=СН-СН=СН-СН3 пентадиен-1,3
Б3 СаС2+2Н2О → Са(ОН)2+С2Н2 (этин и гидроксид кальция)
3 С2Н2 → С6Н6 С активир., t ̊ (бензол)
С6Н6 + НNO3 → С6Н5NO2 + Н2О Н2SO4 конц. (нитробензол)
Б4 2С2Н5ОН + 2Na → 2С2Н5ОNa + H2
С2Н5ОН + HCl → С2Н5Cl + Н2О
С2Н5ОН + СН3COОН → СН3COО С2Н5 + Н2О
Б5 ответ С2Н6
Ответы на задания 2 варианта. Часть А
1
2
3
4
5
в
б
в
в
г
6
7
8
9
10
б
а
а
а
б
11
12
13
14
15
а
г
г
в
б
16
17
18
19
20
г
в
в
в
г
21
22
23
24
25
а
в
г
г
а
Б1 ответ С2Н6О
Б2 изомер СН2=СН-СН-СН2-СН3 или СН2=СН-СН2-СН2-СН2-СН3 и др.
3-метилпентен-1 СН3 гексен-1
гомолог СН2=СН-СН-СН3 или СН2=СН-СН-СН2-СН2-СН3
СН3 3-метилбутен-1 СН3
3-метилгексен-1
Б3 С2Н5ОН → С2Н4 + Н2О t ̊> 140 ̊, Н2SO4 конц. (этен и вода)
С2Н4 + НСl → С2Н5Сl (хлорэтан)
2 С2Н5Сl + 2Na → С4Н10 + 2NaСl (бутан и хлорид натрия)
Б4 СН3COОН + С2Н5ОН → СН3COОС2Н5 + Н2О
2 СН3COОН + Мg → (СН3COО)2Mg + Н2
2 СН3COОН + 2Na →2 СН3COОNa + Н2
Б5 ответ С3Н8
infourok.ru
«Классификация органических соединений». 10-й класс
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Класс: 10.
Базовый учебник: химия 10 класс О.С.Габриелян.
Цель урока: познакомить учащихся с общей классификацией органических соединений. Рассмотреть классификацию органических веществ по характеру углеродного скелета и классификацию по функциональной группе.
Оборудование: компьютер, мультимедийный проектор, презентация.
Тип урока: комбинированный
Ход урока
I. Организационный момент.
II. Классификация органических соединений.
В природе существуют несколько миллионов органических соединений. Каждый год создаются все новые и новые органические вещества. Чтобы разобраться в огромном количестве органических соединений, необходимо их классифицировать. Существуют разные способы классификации органических соединений. Мы будем рассматривать два способа классификации: первый — по характеру углеродной цепи, второй – по функциональной группе. Слайд 2
Последовательность химически связанных атомов углерода в молекуле составляет ее углеродный скелет. Это основа органического соединения. Поэтому первым признаком классификации органического соединения служит классификация по строению углеродного скелета. Слайд 3
По характеру углеродного скелета органического соединения вещества можно разделить на открытые или ациклические (приставка а- обозначает отрицание, т.е. это незамкнутые цепи) и циклические в них углеродная цепь замкнута в цикл. Слайд 4
Углеродный скелет может быть также неразветвленным или разветвленным. Слайд 5
Органические соединения можно подразделять также по кратности связи. Соединения, содержащие только одинарные связи С-С, называются насыщенными или предельными. Соединения со связями С=С или СС называются ненасыщенными или непредельными. Слайд 6
Циклические соединения – это соединения, в которых углеродные атомы образуют цикл или замкнутую цепь. Циклические соединения делятся на две большие группы: карбоциклические и гетероциклические. Карбоциклические содержат в циклах только атомы углерода и подразделяются на алициклические и ароматические. Гетероциклические соединения содержат циклы, в составе которых кроме атомов С входят один или несколько других атомов, так называемых гетероатомов ( греч. heteros — другой) – O, S, N. Слайд 7
Закрепляем новый материал выполнением следующего задания: используя схему классификации, определить к какому классу относятся представленные соединения.
CH2=CH–CH3 CH3–CH3 CH2= CH–CH=CH2Слайд 8
Рассматриваем второй способ классификации органических соединений, по наличию функциональных групп. Формулируем определение функциональной группы, как группы атомов, определяющей химические свойства соединения и принадлежность его к определенному классу органических соединений. Функциональная группа является основным признаком, по которому органические соединения относят к определенному классу. Слайд 9,10
Ставим перед учениками задачу: рассмотреть основные классы органических соединений с точки зрения наличия кратных связей. Рассматриваем более подробно классы органических соединений, относящихся к группе ациклических соединений это классы алканов, алкенов, алкинов и алкадиенов. Слайд 11
К ациклическим соединениям кроме углеводородов, относятся вещества содержащие разнообразные функциональные группы. Главный критерий, по которому вещества относят к ациклическим соединениям – это наличие незамкнутой цепи углеродных атомов. Рассматриваем более подробно классы кислородосодержащих органических соединений. Слайд 12
Закрепляем изученный материал. Определить к какому классу относятся соединения? Слайд 13
III. Рефлексия.
Список использованной литературы:
- Учебник Химия 10 класс О.С. Габриелян
- Поурочные разработки по химии М.Ю. Горковенко
- festival.1september.ru/articles/586588/
- www.xumuk.ru/rhf/
- festival.1september.ru/articles/630735
urok.1sept.ru
|
Название класса |
Общая формула |
Способы получения |
Химические свойства |
|
Алканы |
СпН2n+2 |
Из оксида углерода(II), карбида алюминия, солей карбоновых кислот, гидрирование алкенов и алкинов, реакция Вюрца, крекинг |
Горение, замещение, крекинг, изомеризация, дегидрирование |
|
Циклоалканы |
СпН2п |
Гидрирование аренов, из дигалогенопроизводных |
Горение, замещение (для высших), присоединение (для низших) |
|
Алкены |
СпН2п |
Крекинг, дегидрирование алканов, гидрирование алкинов, дегидратация спиртов, дегидрогалогенирование моногалогеналканов, дегалогениро- вание дигалогеналканов |
Горение, присоединение (водорода, галогенов, галогеноводородов, воды), полимеризация, окисление |
|
Алкадиены |
СпН2п-2 |
Дегидрирование и дегидратация этанола (реакция Лебедева), дегидрирование алканов и алкенов |
Горение, присоединение (водорода, галогенов, галогеноводородов), полимеризация |
|
Алкины |
СпН2п-2 |
Дегидрогалогенирование дигалогеналканов. Гидролиз карбида кальция и термическое разложение метана (ацетилен) |
Горение, замещение, присоединение (водорода, галогенов, галогеноводородов, воды), окисление, полимеризация |
|
Арены (бензол, толуол) |
СпН2п-6 |
Дегидрирование циклоалканов, дегидроциклизация алканов, алкилирование по Фриделю-Крафтсу, реакция Вюрца-Фитинга, из солей бензойной кислоты |
Горение, замещение (взаимодействие с галогенами, азотной кислотой), присоединение (водорода, галогенов) |
|
Предельные одноатомные спирты |
СпН2п+1ОН или СпН2п+2О |
Гидратация алкенов, гидрирование альдегидов и кетонов, гидролиз галогеналканов, гидролиз (и омыление) сложных эфиров. Из оксида углерода(П) и водорода (метанол). Брожение глюкозы (этанол) |
Горение, взаимодействие со щелочными металлами, галогеноводородами, окисление, межмолекулярная и внутримолекулярная дегидратация, этерификация |
|
Многоатомные спирты |
R(OH)n |
Гидролиз жиров, из пропилена |
Горение, этерификация, взаимодействие со щелочными металлами, галогеноводородами, азотной кислотой, гидроксидом меди(П) |
|
Фенолы |
С6Н5(ОН)n |
Из фенолята натрия,сплавление солей сульфокислот, из галогенопро- изводных аренов, кумольный способ (из бензола и пропилена) |
Горение, замещение, поликонденсация, взаимодействие с галогенами, азотной кислотой, щелочными металлами, щелочами |
|
Альдегиды |
СпН2пО |
Окисление первичных спиртов, гидролиз дигалогеналканов, гидратация ацетилена, окисление алкенов и метана |
Горение, окисление (гидроксидом меди(Н), аммиачным раствором оксида серебра), присоединение (воды, водорода), замещение (взаимодействие с галогенами), поликонденсация, полимеризация |
|
Кетоны |
СпН2пО |
Из солей карбоновых кислот, окисление вторичных спиртов |
Горение, присоединение водорода |
|
Одноосновные предельные карбоновые кислоты |
СпН2пО2 |
Окисление первичных спиртов, альдегидов, алканов, гидролиз сложных эфиров. Из щавелевой кислоты и оксида углерода(Н) (муравьиная кислота) |
Диссоциация, взаимодействие с металлами, основными оксидами, гидроксидами, солями более слабых и летучих кислот, спиртами (этерификация), замещение в радикале (взаимодействие с галогенами), присоединение водорода. Для муравьиной кислоты взаимодействие с гидроксидом меди(Н), аммиачным раствором оксида серебра |
|
Простые эфиры |
r,—0—r2 СпН2п+2О |
Из предельных одноатомных спиртов |
Горение |
|
Сложные эфиры |
СпН2пО2 |
Из спиртов и кислот |
Горение, гидролиз (в том числе омыление) |
|
Углеводы (глюкоза) |
С6Н12О6 |
Гидролиз полисахаридов, фотосинтез |
Взаимодействие с гидроксидом меди(П), аммиачным раствором оксида серебра, азотной кислотой, ангидридами кислот, галогеналканами, спиртами, горение, восстановление, этерификация, брожение |
|
Углеводы (полисахариды) |
(С6н10О5)п |
Из моносахаридов |
Горение, гидролиз, этерификация, взаимодействие с азотной и органическими кислотами |
|
Амины |
R2-N- R3 |
Из галогеналканов, нитросоединений |
Горение, основные свойства (взаимодействие с водой и кислотами) |
|
Анилин |
R-Nh3 или C6H5Nh3 |
Из галогеналканов, нитробензола |
Основные свойства (взаимодействие с кислотами), взаимодействие с галогенами, водородом, азотной кислотой |
|
Аминокислоты |
Nh3СпН2п-1О2 |
Гидролиз белков, из галогенопроизводных кислот |
Горение, амфотерные свойства (взаимодействие с кислотами и щелочами), взаимодействие с металлами, основными оксидами, солями, спиртами,поликонденсация, образование биполярного иона |
nsportal.ru
Тест по химии (10 класс) по теме: Итоговая контрольная работа по органической химии (10 класс профиль)
Итоговая контрольная работа по органической химии 10 класс
Вариант 1
А 1. Общая формула алкинов:
1) Сn h3n 3) Cnh3n-2
2) Cnh3n+2 4) Cnh3n-6
А 2. Название вещества, формула которого
СН3 ─ СН2 ─ СН (СН3)─ С ≡ СН
1) гексин -1 3) 3-метилгексин-1
2) 3-метилпентин-1 4) 3-метилпентин-4
А 3. Вид гибридизации электронных орбиталей атома углерода, обозначенного
звёздочкой в веществе, формула которого СН2═ С∗═ СН2
1) sp3 3) sp
2) sp2 4) не гибридизирован
А 4. В молекулах какого вещества отсутствуют π-связи?
1) этина 3) этена
2) изобутана 4) циклопентана
А 5. Гомологами являются:
1) метанол и фенол 3) глицерин и этиленгликоль
2) бутин-2 и бутен-2 4) 2-метилпропен и 2-метилпентан
А 6. Изомерами являются:
1) бензол и толуол 3) уксусная кислота и этилформиат
2) этанол и диметиловый эфир 4) этанол и фенол
А 7. Окраска смеси глицерина с гидроксидом меди (ΙΙ):
1) голубая 3) красная
2) ярко синяя 4) фиолетовая
А 8. Анилин из нитробензола можно получить при помощи реакции:
1) Вюрца 3) Кучерова
2) Зинина 4) Лебедева
А 9. Какие вещества можно использовать для последовательного
осуществления следующих превращений
С2H5Cl → С2Н5ОН → С2Н5ОNa
1) KOH, NaCl 3) KOH, Na
2) HOH, NaOH 4) O2, Na
А 10. Объём углекислого газа, образовавшийся при горении 2 л бутана
1) 2 л 3) 5 л
2) 8 л 4) 4 л
Б 1. Установите соответствие между молекулярной формулой органического
вещества и классом, к которому оно относится
А) С5Н10О5 1) алкины
Б) С5Н8 2) арены
В) С8Н10 3) углеводы
Г) С4Н10О 4) простые эфиры
5) многоатомные спирты
Б 2. Фенол реагирует с
1) кислородом
2) бензолом
3) гидроксидом натрия
4) хлороводородом
5) натрием
6) оксидом кремния (ΙV)
Б 3. И для этилена, и для бензола характерны
1) реакция гидрирования
2) наличие только π-связей в молекулах
3) sp2-гибридизация атомов углерода в молекулах
4) высокая растворимость в воде
5) взаимодействие с аммиачным раствором оксида серебра (Ι)
6) горение на воздухе
Б 4. Молекулярная формула углеводорода, массовая доля углерода в котором
83,3%, а относительная плотность паров по водороду 36 ________
С 1. Напишите уравнения реакций, с помощью которых можно осуществить
превращения по схеме
СаС2 → С2Н2 → С6Н6 → С6Н5NO2 → С6Н5NН2
↓
С2Н4 → С2Н5ОН
С 2. Рассчитайте массу сложного эфира, полученного при взаимодействии 46 г
50% раствора муравьиной кислоты и этилового спирта, если выход
продукта реакции составляет 80% от теоретически возможного.
Итоговая контрольная работа по органической химии 10 класс
Вариант 2
А 1. Общая формула алкадиенов:
1) Сn h3n 3) Cnh3n-2
2) Cnh3n+2 4) Cnh3n-6
А 2. Название вещества, формула которого
СН3─СН(СН3)─СН═СН─СН3
1) гексен-2 3) 4-мнтилпентен-2
2) 2-метилпентен-3 4) 4-метилпентин-2
А 3. Вид гибридизации электронных орбиталей атомов углерода в молекуле
бензола
1) sp3 3) sp
2) sp2 4) не гибридизирован
А 4. Только σ-связи присутствуют в молекуле
1) метилбензола 3) 2-мтилбутена-2
2) изобутана 4) ацетилена
А 5. Гомологами являются
1) этен и метан 3) циклобутан и бутан
2) пропан и бутан 4) этин и этен
А 6. Изомерами являются
1) метилпропан и метилпропен 3) метан и этан
2) бутен-1 и пентен-1 4) метилпропан и бутан
А 7. Окраска смеси альдегида с гидроксидом меди (ΙΙ) (при нагревании):
1) голубая 3) красная
2) синяя 4) фиолетовая
А 8. Уксусный альдегид из ацетилена можно получить при помощи реакции:
1) Вюрца 3) Кучерова
2) Зинина 4) Лебедева
А 9. Какие вещества можно использовать для последовательного
осуществления следующих превращений
С2Н5ОН → С2Н5Сl → С4Н10
1)NaCl, Na 3) O2, Na
2) HСl, Na 4) HСl, NaОН
А 10. Объём кислорода, необходимый для сжигания 2 л метана
1) 2л 3) 10 л
2) 4 л 4) 6 л
Б 1. Установите соответствие между молекулярной формулой органического
вещества и классом, к которому оно относится
А) С6Н6О 1) одноатомные спирты
Б) С6Н12О6 2) многоатомные спирты
В) С3Н8О 3) углеводы
Г) С2Н6О2 4) фенолы
5) карбоновые кислоты
Б 2. Метаналь может реагировать с
1) азотом
2) аммиачным раствором оксида серебра (Ι)
3) фенолом
4) толуолом
5) натрием
6) водородом
Б 3. И для метана, и для пропена характерны
1) реакции бромирования
2) sp-гибридизация атомов углерода в молекулах
3) наличие π-связей в молекулах
4) реакция гидрирования
5) горение на воздухе
6) малая растворимость в воде
Б 4. Молекулярная формула органического вещества, с массовой долей
углерода 51,89%, водорода 9,73% и хлора 38,38%, относительная плотность
его паров по воздуху 3, 19 ______
С 1. Напишите уравнения реакций, с помощью которых можно осуществить
превращения по схеме
С2Н6 → С2Н5Сl → С2Н5ОН → СН3СОН → СН3СООН
↓
С2Н4 → С2Н5Вr
С 2. Какая масса этилацетата образуется при взаимодействии 60 г 80% раствора
уксусной кислоты с этиловым спиртом, если доля выхода эфира составляет
90% ?
Итоговая контрольная работа по органической химии 10 класс
Вариант 3
А 1. Общая формула алкенов:
1) Сn h3n 3) Cnh3n-2
2) Cnh3n+2 4) Cnh3n-6
А 2. Название вещества, формула которого
СН3─СН2─СН(СН3)─СН(СН3)─СОН
1) 2,3-диметилбутаналь 3) пентаналь
2) 2,3-диметилпентаналь 4) 3,4-диметилпентаналь
А 3. Вид гибридизации электронных орбиталей атома углерода, обозначенного
звёздочкой в веществе, формула которого СН3─С∗Н2ОН
1) sp3 3) sp
2) sp2 4) не гибридизирован
А 4. Число π-связей в молекуле пропина равно
1) 1 3) 3
2) 2 4) 4
А 5. Гомологом уксусной кислоты является кислота
1) хлоруксусная 3) олеиновая
2) муравьиная 4) бензойная
А 6. Изомерами являются:
1) пентан и пентадиен 3) этан и ацетилен
2) уксусная кислота и метилформиат 4) этанол и этаналь
А 7. Окраска смеси глюкозы с гидроксидом меди (ΙΙ) (при нагревании):
1) голубая 3) красная
2) синяя 4) фиолетовая
А 8. Бутадиен-1,3 из этанола можно получить при помощи реакции
1) Вюрца 3) Кучерова
2) Зинина 4) Лебедева
А 9. Какие вещества можно использовать для последовательного
осуществления следующих превращений
СН3СОН → СН3СООН → СН3СООК
1) O2, К 3) HСl, КОН
2) Сu и t , КОН 4) HСl, КОН
А 10. Объём этана, необходимый для получения 4 л углекислого газа
1) 2л 3) 10 л
2) 4 л 4) 6 л
Б 1. Установите соответствие между молекулярной формулой органического
вещества и классом, к которому оно относится
А) С 12Н22О11 1) альдегиды
Б) С3Н8О3 2) карбоновые кислоты
В) С4Н8О 3) многоатомные спирты
Г) С18Н36О2 4) углеводы
5) одноатомные спирты
Б 2. С аминоуксусной кислотой может реагировать
1) сульфат натрия
2) хлороводород
3) метан
4) этанол
5) анилин
6) гидроксид калия
Б 3. И для этилена, и для ацетилена характерны
1) взаимодействие с оксидом меди (ΙΙ)
2) наличие σ- и π-связей в молекулах
3) sp2-гибридизация атомов углерода в молекулах
4) реакция гидрирования
5) горение на воздухе
6) реакции замещения
Б 4. Молекулярная формула углеводорода, массовая доля водорода в котором
15,79 %, а относительная плотность паров по воздуху 3, 93 ________
С 1. Напишите уравнения реакций, с помощью которых можно осуществить
превращения по схеме
СН4→ С2Н2 → СН3СОН → С2Н5ОН → С2Н5Сl→ С4Н10
↓
СН3СООС2Н5
С 2. Рассчитайте массу сложного эфира, полученного при взаимодействии 64 г
60% раствора уксусной кислоты и метилового спирта, если выход
продукта реакции составляет 80% от теоретически возможного.
Итоговая контрольная работа по органической химии 10 класс
Вариант 4
А 1. Общая формула алканов:
1) Сn h3n 3) Cnh3n-2
2) Cnh3n+2 4) Cnh3n-6
А 2. Название вещества, формула которого
СН3─СН(СН3)─СН(ОН)─СН3
1) бутанол-2 3) 2-метилбутанол-3
2) пентанол-2 4) 3-метилбутанол-2
А 3. Вид гибридизации электронных орбиталей атома углерода, обозначенного
звёздочкой в веществе, формула которого СН3─С∗≡СН
1) sp3 3) sp
2) sp2 4) не гибридизирован
А 4. Число σ-связей в молекуле этилена равно:
1) 6 3) 5
2) 2 4) 4
А 5. Гомологами являются
1) бензол и циклогексан 3) фенол и этанол
2) этен и пропен 4) толуол и метилбензол
А 6. Изомером пропановой кислоты является
1) диэтиловый эфир 3) бутаналь
2) пропилацетат 4) этилормиат
А 7. Окраска смеси глицерина с гидроксидом меди (ΙΙ)
1) голубая 3) красная
2) синяя 4) фиолетовая
А 8. Этан из хлорметана можно получить при помощи реакции
1) Вюрца 3) Кучерова
2) Зинина 4) Лебедева
А 9. Какие вещества можно использовать для последовательного
осуществления следующих превращений
С2Н5Сl → С2Н4 → С2Н5ОН
1) КОН (спирт. р-р), Н2О 3) КОН (водн. р-р), Н2О
2) Na, Н2О 4) КСl, Н2О
А 10. Объём углекислого газа, образовавшийся при горении 3 л пропана
1) 2 л 3) 6 л
2) 3 л 4) 9 л
Б 1. Установите соответствие между молекулярной формулой органического
вещества и классом, к которому оно относится
А) С4Н6 1) углеводы
Б) С4Н8О2 2) арены
В) С7Н8 3) алкины
Г) С5Н10О5 4) сложные эфиры
5) альдегиды
Б 2. Этиламин взаимодействует
1) метаном
2) водой
3) бромоводородом
4) бензолом
5) кислородом
6) пропаном
Б 3. И для ацетилена, и для пропина характерны
1) тетраэдрическая форма молекулы
2) sp-гибридизация атомов углерода в молекулах
3) реакция гидрирования
4) наличие только σ-связей в молекулах
5) горение на воздухе
6) реакция с хлоридом натрия
Б 4. Молекулярная формула циклоалкана, массовая доля углерода в котором
85,71 %, а относительная плотность паров по воздуху 1, 931 ________
С 1. Напишите уравнения реакций, с помощью которых можно осуществить
превращения по схеме
СН4 → СН3Сl → С2Н6 → С2Н4 → С2Н5ОН → НСООС2Н5
↓
СО2
С 2. Какая масса метилацетата образуется при взаимодействии 80 г 60%
раствора уксусной кислоты с метиловым спиртом, если доля выхода эфира
составляет 90% ?
Итоговая контрольная работа по органической химии 10 класс
Вариант 5
А 1. Общая формула алкадиенов:
1) Сn h3n 3) Cnh3n-2
2) Cnh3n+2 4) Cnh3n-6
А 2. Название вещества, формула которого
СН3─СН2─СН2─СН(СН3)─СОН
1) 2-метилпентаналь 3) 4-метилпентаналь
2) 2-метилпентанол 4) пентаналь
А 3. Вид гибридизации электронных орбиталей атома углерода, обозначенного
звёздочкой в веществе, формула которого СН3─С∗≡СН
1) sp3 3) sp
2) sp2 4) не гибридизирован
А 4. Только σ-связи присутствуют в молекуле
1) ацетилена 3) 2-мтилбутена-2
2) изобутана 4) метилбензола
А 5. Гомологами являются
1) этин и этен 3) циклобутан и бутан
2) пропан и бутан 4) этен и метан
А 6. Изомерами являются:
1) пентан и пентадиен 3) этанол и этаналь
2) уксусная кислота и метилформиат 4) этан и ацетилен
А 7. Окраска смеси белка с гидроксидом меди (ΙΙ)
1) голубая 3) красная
2) синяя 4) фиолетовая
А 8. Анилин из нитробензола можно получить при помощи реакции:
1) Вюрца 3) Кучерова
2) Зинина 4) Лебедева
А 9. Какие вещества можно использовать для последовательного
осуществления следующих превращений
С2Н5ОН → С2Н5Сl → С4Н10
1) O2, Na 3) HСl, NaОН
2) HСl, Na 4) NaCl, Na
А 10. Объём этана, необходимый для получения 4 л углекислого газа
1) 2л 3) 10 л
2) 4 л 4) 6 л
Б 1. Установите соответствие между молекулярной формулой органического
вещества и классом, к которому оно относится
А) С4Н6 1) арены
Б) С4Н8О2 2) углеводы
В) С7Н8 3) альдегиды
Г) С5Н10О5 4) сложные эфиры
5) алкины
Б 2. Фенол реагирует с
1) натрием
2) кислородом
3) гидроксидом натрия
4) оксидом кремния (ΙV)
5) бензолом
6) хлороводородом
Б 3. И для метана, и для пропена характерны
1) реакции бромирования
2) sp-гибридизация атомов углерода в молекулах
3) наличие π-связей в молекулах
4) реакция гидрирования
5) горение на воздухе
6) малая растворимость в воде
Б 4. Молекулярная формула углеводорода, массовая доля водорода в котором
15,79 %, а относительная плотность паров по воздуху 3, 93 ________
С 1. Напишите уравнения реакций, с помощью которых можно осуществить
превращения по схеме
СН4 → СН3Сl → С2Н6 → С2Н4 → С2Н5ОН → НСООС2Н5
↓
СО2
С 2. Рассчитайте массу сложного эфира, полученного при взаимодействии 46 г
50% раствора муравьиной кислоты и этилового спирта, если выход
продукта реакции составляет 80% от теоретически возможного.
Итоговая контрольная работа по органической химии 10 класс
Вариант 6
А 1. Общая формула алкенов:
1) Сn h3n 3) Cnh3n-2
2) Cnh3n+2 4) Cnh3n-6
А 2. Название вещества, формула которого
СН3─СН(ОН)─СН(СН3)─СН3
1) бутанол-2 3) 2-метилбутанол-3
2) пентанол-2 4) 3-метилбутанол-2
А 3. Вид гибридизации электронных орбиталей атома углерода, обозначенного
звёздочкой в веществе, формула которого СН2═ С∗═ СН2
1) sp3 3) sp
2) sp2 4) не гибридизирован
А 4. Только σ-связи присутствуют в молекуле
1) метилбензола 3) 2-мтилбутена-2
2) ацетилена 4) изобутана
А 5. Гомологом уксусной кислоты является кислота
1) хлоруксусная 3) олеиновая
2) бензойная 4) муравьиная
А 6. Изомером пропановой кислоты является
1) диэтиловый эфир 3) бутаналь
2) этилформиат 4) пропилацетат
А 7. Окраска смеси глицерина с гидроксидом меди (ΙΙ):
1) голубая 3) красная
2) синяя 4) фиолетовая
А 8. Уксусный альдегид из ацетилена можно получить при помощи реакции:
1) Вюрца 3) Кучерова
2) Зинина 4) Лебедева
А 9. Какие вещества можно использовать для последовательного
осуществления следующих превращений
СН3СОН → СН3СООН → СН3СООК
1) O2, К 3) HСl, КОН
2) Сu и t , КОН 4) HСl, К
А 10. Объём углекислого газа, образовавшийся при горении 3 л пропана
1) 2 л 3) 5 л
2) 9 л 4) 3 л
Б 1. Установите соответствие между молекулярной формулой органического
вещества и классом, к которому оно относится
А) С5Н8 1) арены
Б) С8Н10 2) алкины
В) С5Н10О5 3) углеводы
Г) С4Н10О 4) простые эфиры
5) многоатомные спирты
Б 2. Метаналь может реагировать с
1) натрием
2) аммиачным раствором оксида серебра (Ι)
3) фенолом
4) водородом
5) азотом
6) толуолом
Б 3. И для этилена, и для ацетилена характерны
1) наличие σ- и π-связей в молекулах
2) взаимодействие с оксидом меди (ΙΙ)
3) sp2-гибридизация атомов углерода в молекулах
4) реакция гидрирования
5) реакции замещения
6) горение на воздухе
Б 4. Молекулярная формула циклоалкана, массовая доля углерода в котором
85,71 %, а относительная плотность паров по воздуху 1, 931 ________
С 1. Напишите уравнения реакций, с помощью которых можно осуществить
превращения по схеме
СаС2 → С2Н2 → С6Н6 → С6Н5NO2 → С6Н5NН2
↓
С2Н4 → С2Н5ОН
С 2. Какая масса этилацетата образуется при взаимодействии 60 г 80% раствора
уксусной кислоты с этиловым спиртом, если доля выхода эфира составляет
90% от теоретически возможного?
Итоговая контрольная работа по органической химии 10 класс
Вариант 7
А 1. Общая формула алканов:
1) Сn h3n 3) Cnh3n-2
2) Cnh3n+2 4) Cnh3n-6
А 2. Название вещества, формула которого
СН3 ─ СН(СН3) ─ СН2─ С ≡ СН
1) 4-метилпентин-1 3) 2,3-диметилбутин-1
2) 3-метилпентин-1 4) 2-метилпентин-4
А 3. Вид гибридизации электронных орбиталей атомов углерода в молекуле
бензола
1) sp3 3) sp
2) sp2 4) не гибридизирован
А 4. Число π-связей в молекуле пропина равно
1) 1 3) 3
2) 2 4) 4
А 5. Гомологами являются
1) фенол и этанол 3) бензол и циклогексан
2) этен и пропен 4) толуол и метилбензол
А 6. Изомерами являются:
1) этанол и фенол 3) уксусная кислота и метилформиат
2) этанол и диэтиловый эфир 4) бензол и толуол
А 7. Окраска смеси альдегида с гидроксидом меди (ΙΙ) (при нагревании):
1) голубая 3) красная
2) синяя 4) фиолетовая
А 8. Бутадиен-1,3 из этанола можно получить при помощи реакции
1) Вюрца 3) Кучерова
2) Зинина 4) Лебедева
А 9. Какие вещества можно использовать для последовательного
осуществления следующих превращений
С2Н5Сl → С2Н4 → С2Н5ОН
1) КОН (спирт. р-р), Н2О 3) КОН (водн. р-р), Н2О
2) КСl, Н2О 4) Na, Н2О
А 10. Объём углекислого газа, образовавшийся при горении 2 л бутана
1) 2 л 3) 4 л
2) 5 л 4) 8 л
Б 1. Установите соответствие между молекулярной формулой органического
вещества и классом, к которому оно относится
А) С6Н6О 1) карбоновые кислоты
Б) С6Н12О6 2) многоатомные спирты
В) С3Н8О 3) фенолы
Г) С2Н6О2 4) углеводы
5) одноатомные спирты
Б 2. С аминоуксусной кислотой может реагировать
1) сульфат натрия
2) хлороводород
3) этанол
4) метан
5) гидроксид калия
6) анилин
Б 3. И для ацетилена, и для пропина характерны
1) тетраэдрическая форма молекулы
2) sp-гибридизация атомов углерода в молекулах
3) реакция гидрирования
4) наличие только σ-связей в молекулах
5) горение на воздухе
6) реакция с хлоридом натрия
Б 4. Молекулярная формула углеводорода, массовая доля углерода в котором
83,3%, а относительная плотность паров по водороду 36 ________
С 1. Напишите уравнения реакций, с помощью которых можно осуществить
превращения по схеме
С2Н6 → С2Н5Сl → С2Н5ОН → СН3СОН → СН3СООН
↓
С2Н4 → С2Н5Вr
С 2. Рассчитайте массу сложного эфира, полученного при взаимодействии 64 г
60% раствора уксусной кислоты и метилового спирта, если выход
продукта реакции составляет 80% от теоретически возможного.
Итоговая контрольная работа по органической химии 10 класс
Вариант 8
А 1. Общая формула алкинов:
1) Сn h3n 3) Cnh3n-2
2) Cnh3n+2 4) Cnh3n-6
А 2. Название вещества, формула которого
СН3─СН(СН3)─СН═СН─СН3
1) гексен-2 3) 4-мнтилпентен-2
2) 2-метилпентен-3 4) 4-метилпентин-2
А 3. Вид гибридизации электронных орбиталей атома углерода, обозначенного
звёздочкой в веществе, формула которого СН3─С∗Н2ОН
1) sp3 3) sp
2) sp2 4) не гибридизирован
А 4. Число σ-связей в молекуле этилена равно:
1) 6 3) 5
2) 2 4) 4
А 5. Гомологами являются:
1) метанол и фенол 3) глицерин и этиленгликоль
2) бутин-2 и бутен-2 4) 2-метилпропен и 2-метилпентан
А 6. Изомерами являются
1) метилпропан и метилпропен 3) метан и этан
2) бутен-1 и пентен-1 4) метилпропан и бутан
А 7. Окраска смеси глюкозы с гидроксидом меди (ΙΙ) (без нагревания):
1) голубая 3) красная
2) синяя 4) фиолетовая
А 8. Этан из хлорметана можно получить при помощи реакции
1) Вюрца 3) Кучерова
2) Зинина 4) Лебедева
А 9. Какие вещества можно использовать для последовательного
осуществления следующих превращений
С2H5Cl → С2Н5ОН → С2Н5ОNa
1) O2, Na 3) KOH, Na
2) HOH, NaOH 4) KOH, NaCl
А 10. Объём кислорода, необходимый для сжигания 2 л метана
1) 10 л 3) 2 л
2) 4 л 4) 6 л
Б 1. Установите соответствие между молекулярной формулой органического
вещества и классом, к которому оно относится
А) С 12Н22О11 1) углеводы
Б) С3Н8О3 2) карбоновые кислоты
В) С18Н36О2 3) многоатомные спирты
Г) С4Н8О 4) альдегиды
5) одноатомные спирты
Б 2. Диметиламин взаимодействует
1) водой
2) метаном
3) бромоводородом
4) кислородом
5) бензолом
6) пропаном
Б 3. И для этилена, и для бензола характерны
1) реакция гидрирования
2) наличие только π-связей в молекулах
3) sp2-гибридизация атомов углерода в молекулах
4) высокая растворимость в воде
5) взаимодействие с аммиачным раствором оксида серебра (Ι)
6) горение на воздухе
Б 4. Молекулярная формула органического вещества, с массовой долей
углерода 51,89%, водорода 9,73% и хлора 38,38%, относительная плотность
его паров по воздуху 3, 19 ______
С 1. Напишите уравнения реакций, с помощью которых можно осуществить
превращения по схеме
СН4→ С2Н2 → СН3СОН → С2Н5ОН → С2Н5Сl→ С4Н10
↓
СН3СООС2Н5
С 2. Какая масса метилацетата образуется при взаимодействии 80 г 60%
раствора уксусной кислоты с метиловым спиртом, если доля выхода эфира
составляет 90% ?
nsportal.ru